Rhumatologie
Congrès de 2019 de l’EULAR
Les données d’un essai de phase III : un nouvel inhibiteur des JAK indiqué pour la PR laissent présager l’évolution des traitements
Madrid – Les données d’un essai de phase III sur un nouvel inhibiteur des JAK dont le développement clinique tire à sa fin laissent présager une modification de la séquence des traitements opposés à la polyarthrite rhumatoïde (PR). Un des essais réalisés dans le cadre d’un programme clinique déterminant présenté lors du congrès de 2019 de l’EULAR a établi que ce nouvel agent à prise orale était plus efficace que l’inhibiteur du facteur de nécrose tumoral (TNF) injecté par voie intraveineuse auquel il était comparé, avantage qui a persisté jusqu’à la 48e semaine. Dans le volet de cet essai mené avec permutation, les deux groupes de sujets ayant répondu de façon insatisfaisante à leur traitement ont eu de très bons résultats en le remplaçant par l’autre. Or les grands gagnants de la permutation ont été les sujets qui sont passés de l’inhibiteur du TNF à l’inhibiteur des JAK.
Le ciblage de la voie pro-inflammatoire JAK/STAT a fait ses preuves dans le traitement de la PR depuis l’homologation du tofacitinib, le premier agent de sa classe à avoir reçu cette indication. De nouveaux agents dotés d’une plus grande sélectivité pour les enzymes Jak d’intérêt ont enrichi cette classe de médicaments, dont le baricitinib, qui a été homologué par la FDA des É.-U., et l’upadacitinib qui fait actuellement l’objet d’un vaste programme d’essais de phase III. Un des essais sur l’upadacitinib présenté lors du congrès visait à comparer directement cet agent à l’adalimumab, un inhibiteur du TNF. L’autre reposait sur une comparaison indirecte ajustée par appariement avec le premier inhibiteur des JAK qui ait été homologué, le tofacitinib.
L’essai SELECT-COMPARE : les tout derniers résultats des 48 semaines
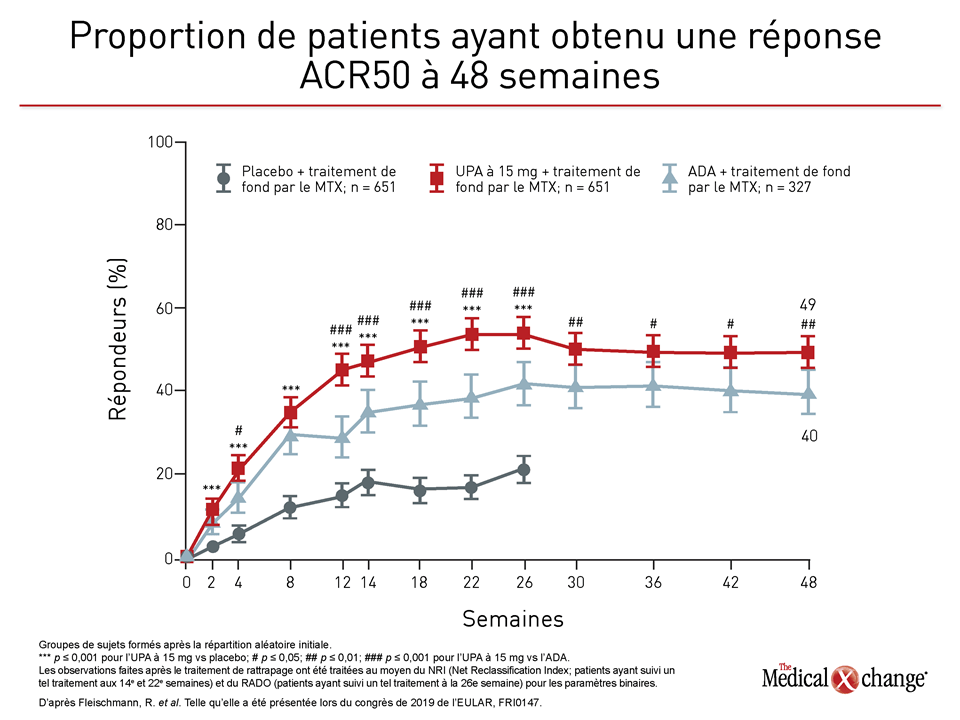
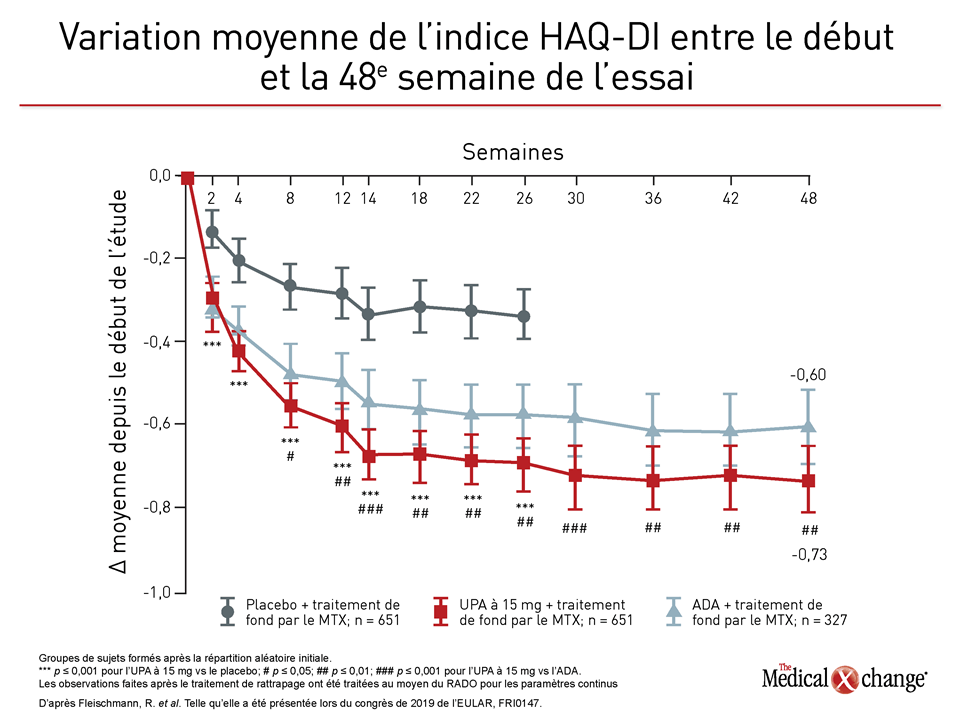
Lors des deux essais, les différences d’efficacité objectivées étaient à l’avantage de l’upadacitinib. Dans l’essai SELECT-COMPARE où ont été comparés l’upadacitinib et l’adalimumab, les nouvelles données recueillies à 48 semaines ont fait ressortir un avantage relatif identique à celui qui avait été rapporté à 26 semaines, et ce pour de nombreux paramètres normalisés dont une meilleure maîtrise de la maladie comme en faisaient foi la réponse ACR50 et l’indice HAQ-DI (Health Assessment Questionnaire Disability Index) (Figure 1), (Figure 2).
« L’avantage relatif de l’upadacitinib sur l’adalimumab s’est notamment manifesté par des réponses cliniques et fonctionnelles rapides qui ont persisté pendant toute la période de suivi. »
Le Dr Roy M. Fleischmann, professeur clinicien de médecine, au Centre médical de l’Université du Texas du Sud-ouest, à Dallas a affirmé : « L’avantage relatif de l’upadacitinib sur l’adalimumab s’est notamment manifesté par des réponses cliniques et fonctionnelles rapides qui ont persisté pendant toute la période de suivi ».
Lors de l’essai SELECT-COMPARE, 1629 patients ayant répondu de façon insatisfaisante au méthotrexate ont été affectés selon un ratio de 2:1 au placebo et à l’upadacitinib comparativement à l’adalimumab. Tous les patients ont continué de recevoir du méthotrexate comme traitement de fond. Au moment de la sélection, plus de la moitié des patients prenaient un glucocorticoïde par voie orale, mais seulement 10 % avaient déjà pris un antirhumatismal de fond biologique. Tous les patients recrutés étaient très exposés à l’évolution de leur maladie, puisque leur taux de protéine C-réactive mesurée par des techniques très sensibles se chiffrait à 5 mg/L ou plus et que trois de leurs articulations au moins montraient une érosion osseuse.
Médicament de rattrapage autorisé aux 14e, 18e et 22e semaines
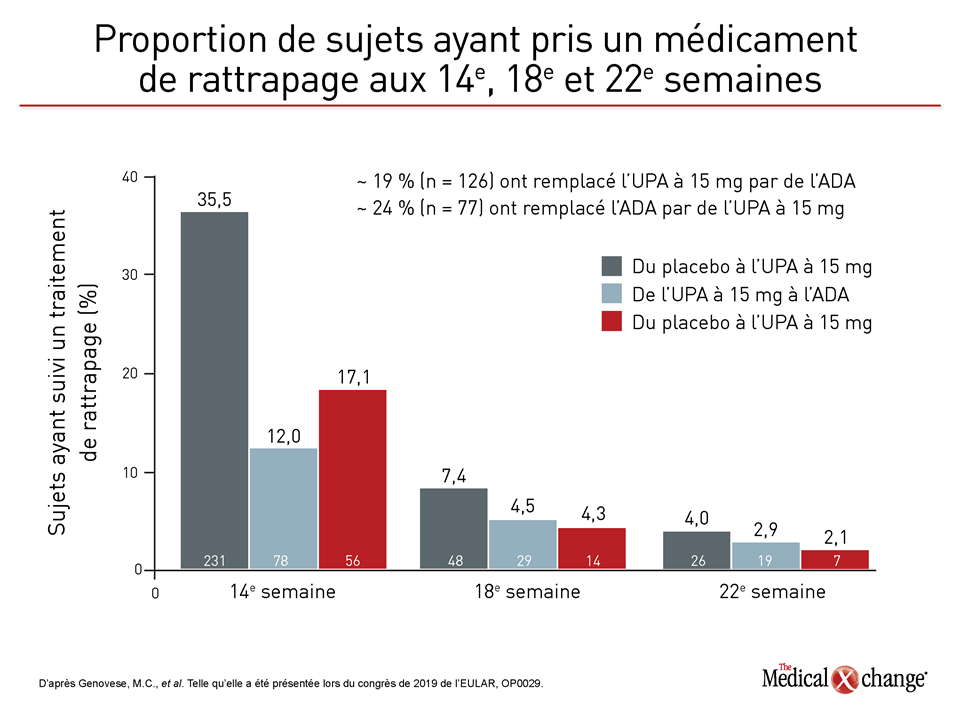
L’upadacitinib a été administré par voie orale en doses quotidiennes de 15 mg, tandis que l’adalimumab a été injecté à des doses de 40 mg par voie intraveineuse, une semaine sur deux. Faute de respecter les critères établis, notamment une diminution de 20 % du nombre d’articulations enflées ou sensibles, les sujets étaient autorisés à prendre un médicament de rattrapage aux 14e, 18e et 22e semaines indépendamment du traitement qui leur avait été attribué. L’upadacitinib faisait office d’agent de rattrapage pour les sujets recevant le placebo ou de l’adalimumab. Pour les sujets traités par l’upadacitinib, c’était l’adalimumab. À la 26e semaine, tous les sujets prenant le placebo l’ont remplacé par de l’upadacitinib.
Au final, 46,9 % des sujets du groupe placebo et 23,5 % de ceux du groupe adalimumab avaient reçu le médicament de rattrapage à la 26e semaine comparativement à 19,2 % des sujets du groupe upadacitinib. Au terme de l’essai, la proportion de sujets ayant eu besoin de ce type de traitement se chiffrait à 48,6 % dans le groupe adalimumab, mais à 38,7 % dans le groupe upadacitinib.
Selon le Dr Fleischmann, les mesures des résultats se sont fait l’écho des taux de rattrapage relatifs, qui sont une mesure de substitution de l’efficacité relative. Il a en effet noté à la 48e semaine, en plus de celui observé pour la réponse ACR50, un avantage significatif pour les critères suivants : réponse ACR20, score DAS28-CRP ≤ 3,2 et score DAS28-CRP ≤ 2,6.
Peu d’évolution selon la radiographie réalisée à 48 semaines
Le score de Sharp total modifié (mTSS), le pincement de l’interligne articulaire et le score d’érosion ont permis de constater que les sujets des deux groupes de traitement actif avaient été mieux protégés que ceux du groupe placebo contre les atteintes structurelles révélées par la radiographie. Cette protection, qui a été documentée pour la première fois à la 26e semaine, s’est maintenue jusqu’à la 48e, les mesures prises lors de ces deux évaluations ayant montré peu de changement, voire aucun. Par exemple, la variation moyenne du score mTSS dans le groupe placebo entre le début et les 26e et 48e semaines de l’essai s’élevait respectivement à 0,94 et à 1,73. Ce même score calculé aux mêmes moments se chiffrait à 0,16 et à 0,28 dans le groupe tofacitinib comparativement à 0,19 et à 0,39 dans le groupe adalimumab.
Les deux agents ont été bien tolérés, aucune différence significative n’ayant été notée pour les effets indésirables d’intérêt. Constat typique avec les inhibiteurs des JAK, le nombre d’infections par l’herpès zoster était plus élevé chez les sujets traités par l’upadacitinib que chez ceux ayant reçu de l’adalimumab. En revanche, les incidents cardiovasculaires majeurs (ICVM) et les thromboembolies veineuses ont été moins nombreux.
Analyse de la permutation : taux de réponse relatifs
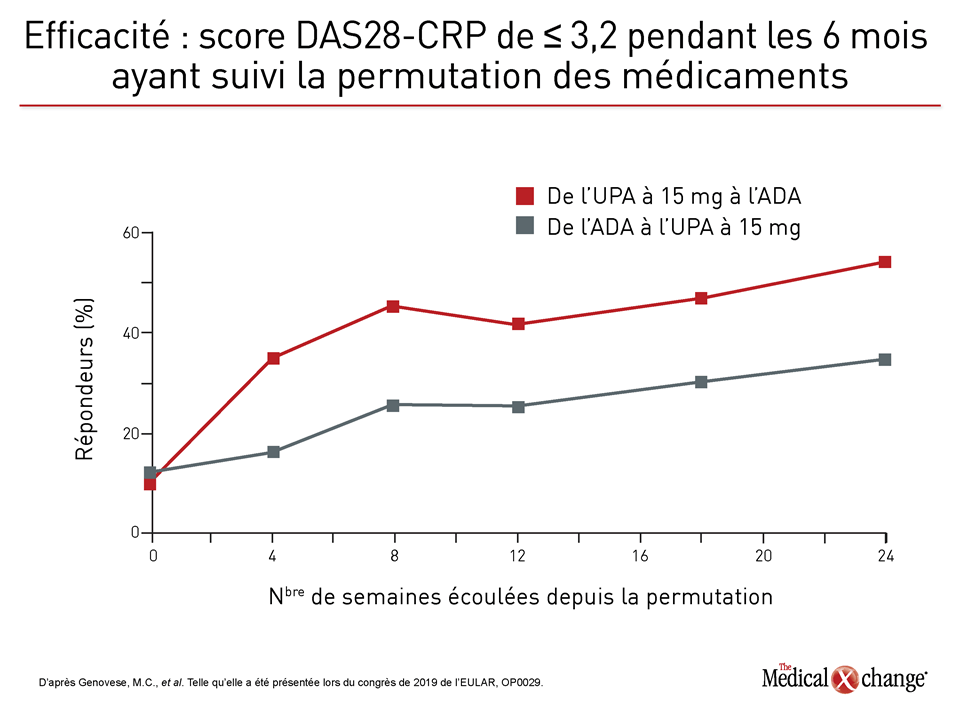
L’analyse approfondie des réponses relatives obtenues pendant l’essai SELECT-COMPARE a révélé que les traitements de rattrapage administrés pour cause de réponse insatisfaisante ont été avantageux pour les sujets, qu’ils soient passés de l’adalimumab à l’upadacitinib ou vice versa. Cela dit, un avantage plus marqué et plus durable a été objectivé chez ceux qui avaient remplacé l’adalimumab par de l’upadacitinib et non l’inverse.
À la 14e semaine, le premier moment où les remplacements étaient permis, 35 % des sujets recevant le placebo avaient besoin d’un médicament de rattrapage. Dans le groupe adalimumab, le taux de rattrapage enregistré a été 50 % moins élevé que dans le groupe placebo, mais 30 % plus élevé que celui observé dans le groupe upadacitinib. Les taux de rattrapage calculés aux évaluations suivantes étaient similaires, mais, dans l’ensemble, un moins grand nombre de sujets traités par l’upadacitinib ont eu besoin d’un tel traitement (Figure 3).
Selon le principal chercheur responsable de cette analyse, le Dr Mark Genovese, directeur de la Clinique de rhumatologie de la Division de l’immunologie et de la rhumatologie de l’université Stanford, à Stanford, en Californie, il faut souligner qu’un effet positif immédiat, important et graduel a été observé dans les deux groupes après la permutation. Toutefois, les toutes dernières données montrent qu’au bout de six mois, les sujets qui étaient passés à l’upadacitinib bénéficiaient toujours d’une plus grande efficacité que ceux qui étaient passés à l’adalimumab. En a notamment témoigné la proportion de sujets ayant obtenu un score DAS28-CRP inférieur à 2,6 (Figure 4).
« La bonne nouvelle, c’est que les sujets qui avaient d’abord répondu à l’upadacitinib ou à l’adalimumab selon le cas ont tiré avantage du changement de traitement, a déclaré le Dr Genovese. Une forte proportion de ceux qui ont changé de médicament ont atteint leurs objectifs thérapeutiques et obtenu une atténuation importante de leurs symptômes cliniques et de la douleur, ainsi qu’une amélioration marquée de leur indice HAQ-DI. »
Il a ajouté : « Aucun problème d’innocuité supplémentaire ou inattendu n’a été relevé dans l’un ou l’autre groupe même si le changement s’est fait sans période de sevrage ».
« La bonne nouvelle, c’est que les patients qui avaient d’abord répondu à l’upadacitinib ou à l’adalimumab selon le cas ont tiré avantage du changement de traitement. »
Données collectées à la 48e semaine de l’essai SELECT-MONOTHERAPY
D’autres données à long terme issues d’essais de phase III faisant partie du programme d’essais déterminants sur l’upadacitinib vont dans le même sens. De nouvelles données tirées de l’essai SELECT-MONOTHERAPY, qui ont aussi été présentées lors du congrès, ont en effet révélé que l’efficacité rapportée à la fin des 14 premières semaines n’avait pas fléchi à la 48e.
Lors de cet essai, des patients recevant un traitement stable par le méthotrexate ont été répartis aléatoirement de façon à poursuivre cette monothérapie ou à la remplacer par une dose de 15 ou de 30 mg d’upadacitinib. Au bout de 14 semaines, les sujets traités par le méthotrexate ont joint celui des deux groupes traités par l’upadacitinib qui avait préalablement été déterminé pendant leur recrutement. L’ajout d’antirhumatismaux de fond classiques était autorisé chez les sujets qui n’obtenait pas un indice CDAI (Clinical Disease Activity Index) inférieur à 10 pendant les 14 premières semaines de l’essai ni pendant la période de suivi à long terme mené à l’insu.
« À 48 semaines, nous avons constaté l’efficacité durable du traitement chez les patients traités d’emblée par l’upadacitinib. Nous avons aussi noté que les patients qui avaient remplacé le méthotrexate par cet agent à la 14e semaine les avaient rejoints en affichant une réponse similaire. »
« À 48 semaines, nous avons constaté l’efficacité durable du traitement tant chez les sujets traités d’emblée par l’upadacitinib que chez ceux qui avaient remplacé le méthotrexate par cet agent à la 14e semaine », a rapporté le Dr Josef S. Smolen, directeur du Département de rhumatologie, à l’Hôpital général de Vienne, en Autriche.
Cet essai, à l’instar d’autres essais de ce programme de phase III, confirme l’innocuité de l’upadacitinib. La pneumonie, qui a touché moins de 2 % des sujets, a été l’effet indésirable grave le plus répandu. Une TEV a été objectivée chez trois des 532 sujets traités d’emblée par l’upadacitinib et qui présentaient tous des facteurs de risque de cette complication. L’analyse d’innocuité réalisée à 48 semaines n’a rien révélé de nouveau ni d’inquiétant à ce chapitre par rapport à celle effectuée à 14 semaines.
La sélectivité pour les JAK, moteur de la mise au point de nouveaux agents
D’autres inhibiteurs de JAK sont actuellement recherchés en raison de l’avantage clinique que pourrait conférer une plus grande sélectivité relative pour la voie de la JAK1, qui est impliquée dans la pathogenèse de la PR. Le tofacitinib est certes efficace contre la PR, mais il inhibe toutes les voies de signalisation JAK/STAT. Or en ciblant davantage la voie de signalisation JAK1 que les autres membres de la famille JAK/STAT (JAK2, JAK3 et Tyk2), on pourrait théoriquement obtenir une activité anti-inflammatoire plus intense tout en évitant les effets collatéraux. Il est ressorti d’essais expérimentaux que la sélectivité de l’upadacitinib pour la voie JAK1 est 74 fois et 58 fois plus grande que pour les voies JAK2 et JAK3, respectivement. Par comparaison, le baricitinib est doté d’une sélectivité moins marquée pour la JAK3 que pour les voies JAK1 et JAK2 envers lesquelles il a une sélectivité pour ainsi dire égale.
Des essais visant à comparer directement des inhibiteurs des JAK dotés d’une sélectivité relative différente sont attendus. Entretemps, les résultats d’une comparaison indirecte entre l’upadacitinib et le tofacitinib ont été présentés lors du congrès. Cette analyse reposait sur une méthode appelée « comparaison indirecte ajustée par appariement » (CIAA).
« Cette analyse préparatoire a servi à comparer l’efficacité de ces deux inhibiteurs des JAK après ajustement en fonction des différences recensées dans les effectifs des essais », a expliqué le Dr Christopher Edwards, directeur de la Rhumatologie clinique, du NHS Foundation Trust de l’Université de Southampton, au R.-U.
Un essai par appariement tient compte des caractéristiques des patients
Une des deux analyses réalisées avec la méthode CIAA et qui ont été présentées ensemble visait à comparer les taux de réponse enregistrés chez les sujets affectés aléatoirement à l’upadacitinib à 15 mg au cours de l’essai SELECT-MONOTHERAPY à ceux obtenus chez les sujets affectés aléatoirement au tofacitinib à 5 mg dans le cadre de l’essai ORAL, un essai de phase III déterminant publié sur cet agent. L’autre analyse a servi à comparer la dose de 15 mg d’upadacitinib à la dose de 5 mg de tofacitinib chez les participants aux essais SELECT-COMPARE et ORAL Strategy, respectivement.
« D’après ces analyses par CIAA, 15 mg d’upadacitinib semblent donner de meilleurs résultats à 3 et à 6 mois que 5 mg de tofacitinib. »
L’appariement a porté sur un large éventail de variables de référence, dont les biomarqueurs de l’inflammation, le nombre d’articulations enflées et l’âge. Les médicaments ont été comparés d’après les résultats enregistrés pour plusieurs paramètres d’évaluation, notamment les réponses ACR20, ACR50 et ACR70 ainsi que le score DAS28-CRP.
Selon les deux analyses, les taux de réponse obtenus avec l’upadacitinib ont été significativement plus élevés que ceux enregistrés avec le tofacitinib, et ce pour plusieurs mesures. Une de ces deux analyses a notamment mis au jour un avantage significatif du côté de la proportion de sujets en rémission clinique au bout de six mois de suivi, celle-ci étant définie en fonction de l’indice CDAI (p = 0,038) et du score DAS28-ESR (p = 0,003). Une tendance s’est également dessinée vers un avantage pour la rémission clinique définie d’après le score DAS28-CRP (p = 0,057).
« Les résultats de ces deux analyses par CIAA portent à croire que le traitement par l’upadacitinib à 15 mg en monothérapie ou en association avec du méthotrexate permet d’obtenir de meilleurs résultats au troisième ou au sixième mois que le tofacitinib à 5 mg administré avec du méthotrexate », a rapporté le Dr Edwards. Il faudra réaliser des essais comparatifs directs avec répartition aléatoire et double insu pour vérifier cette hypothèse, mais le Dr Edwards a affirmé que ces observations viennent étayer l’hypothèse voulant que la sélectivité pour les JAK puisse être un facteur important dans le déclenchement de réactions anti-inflammatoires.
Conclusion
En tant que médicament ciblé pour voie orale, le tofacitinib, un inhibiteur des JAK, s’est révélé une solution de rechange précieuse aux inhibiteurs du TNF. Or les inhibiteurs des JAK plus récents, tels que l’upadacitinib et le baricitinib, viennent enrichir les options de traitement au sein de cette classe de médicaments. Même si des chercheurs étudient encore l’hypothèse voulant qu’une plus grande sélectivité pour la voie JAK1 ait un lien avec l’efficacité, les données issues des essais de phase III présentées lors du congrès de 2019 de l’EULAR ont démontré que les inhibiteurs de cette voie de signalisation offrent des avantages substantiels pour les patients qui obtiennent une maîtrise insatisfaisante de leur maladie avec les inhibiteurs du TNF.