Neurologie
7e congrès de l’Académie européenne de neurologie (EAN) — 2021
Étude STR1VE-EU : une thérapie de substitution génique utilisée dans des cas d’amyotrophie spinale — gains considérables
Réunion en ligne — Les données d’une étude de phase III ont récemment établi un lien entre une thérapie de substitution génique employée contre l’amyotrophie spinale (AS) de type 1 et des gains importants, même en présence de symptômes. Bon nombre des sujets de cette étude avaient besoin d’assistance respiratoire ou d’une alimentation entérale ou des deux au moment du traitement. Les 33 enfants recrutés ont tous connu une certaine amélioration de leur état clinique. Sur les 32 enfants évaluables, 31 (97 %) étaient toujours en vie à 18 mois et sans ventilation permanente. Tous les enfants ont franchi les étapes de leur développement moteur, ce qu’ils n’auraient pu faire sans traitement.
La plupart des sujets des études antérieures sur l’onasemnogène abéparvovec, l’agent employé pour cette thérapie de substitution génique, ont franchi les étapes de leur développement sans régresser après avoir reçu une seule perfusion de cet agent quelques semaines après leur naissance. Les résultats de cette étude européenne de phase III, appelée STR1VE-EU, montrent qu’il est possible d’obtenir des effets positifs importants sur le plan clinique, même si le traitement est retardé. Ils sont similaires à ceux de l’étude STR1VE-US publiés récemment, une étude de moins grande envergure menée dans 12 établissements étatsuniens (Day, J.W. et al. Lancet Neurol 2021;20:284-293), mais les sujets de l’étude STR1VE-EU avaient tendance à être plus malades au départ.
« L’étude STR1VE-EU a permis de constater la grande efficacité de l’onasemnogène abéparvovec au chapitre de la survie et des capacités fonctionnelles, des améliorations ayant même été enregistrées dans les cas avancés », a rapporté le Dr Eugenio Mercuri, du Département de neurologie pédiatrique de l’Université catholique de Rome, en Italie. Il a qualifié le rapport entre les avantages et les risques de « remarquablement favorable dans les cas de type 1 symptomatiques ».
« L’étude STR1VE-EU permis de constater la grande efficacité de [la thérapie de substitution génique] au chapitre de la survie et des capacités fonctionnelles. »
L’AS de type 1, une maladie habituellement mortelle
Tous les patients recrutés dans l’étude STR1VE-EU étaient atteints d’AS de type 1, la forme la plus répandue et la plus grave de cette maladie. Comme les autres formes d’AS, elle se caractérise par des mutations par perte de fonction du gène SMN1, un gène codant pour la production de la protéine de survie du motoneurone 1 essentielle au développement neuromusculaire. Les patients atteints d’AS de type 1 n’ont pas plus de 2 copies du gène SMN2 qui code aussi pour la protéine SMN. Contrairement aux patients atteints d’AS de type 2 ou 3, qui sont porteurs d’un plus grand nombre de copies du gène SMN2, ceux aux prises avec l’AS de type 1 atteignent rarement l’âge de 24 mois s’ils ne sont pas traités.
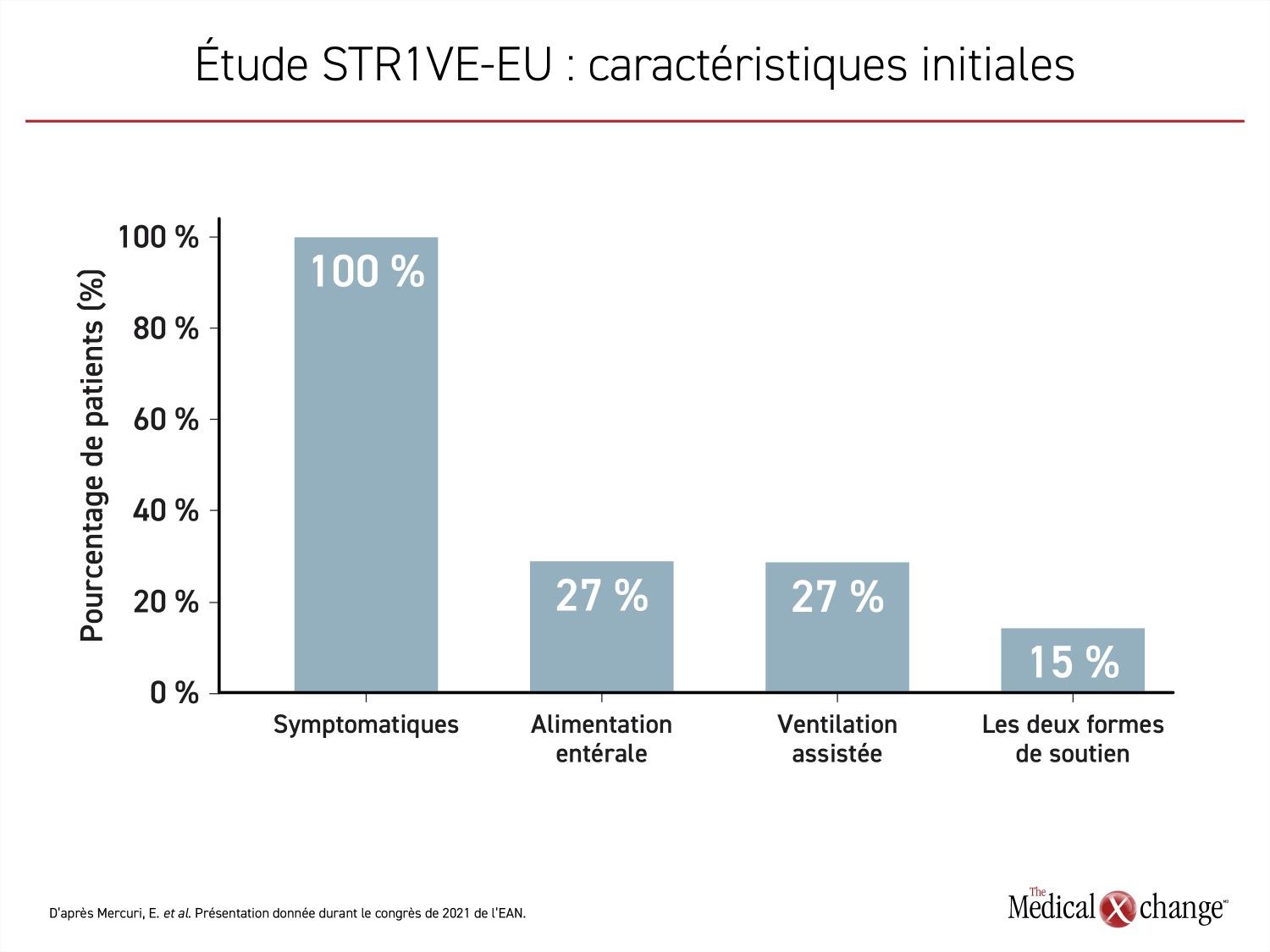
Les participants à l’étude STR1VE-EU devaient être âgés de moins de 6 mois; l’âge médian au moment du traitement était de 4,1 mois. À 3 mois, soit le plus bas âge auquel le traitement a été entrepris, tous les nourrissons étaient symptomatiques. L’âge moyen à l’apparition des symptômes était de 1,5 mois. Au moment de leur recrutement, 9 enfants (27 %) avaient besoin de ventilation assistée, 9 (27 %), d’une alimentation entérale, et 5 (15 %) avaient besoin des deux. L’état de 20 patients n’était pas encore assez grave pour exiger ces formes d’assistance vitale (Figure 1).
Le paramètre d’évaluation principal de cette étude était la capacité à s’asseoir seul pendant au moins 10 secondes avant l’âge de 18 mois, telle qu’elle est définie par l’Organisation mondiale de la Santé (OMS). Le paramètre d’évaluation secondaire était le taux de survie sans assistance respiratoire. Les paramètres d’évaluation exploratoires comprenaient la variation des fonctions motrices confirmée au moyen du test CHOP INTEND (Children’s Hospital of Philadelphia Infant Test of Neurological Disorders) et de l’échelle III de Bayley pour les étapes du développement moteur. Les résultats obtenus ont été comparés à ceux enregistrés pour la cohorte de patients atteints d’AS de type 1 non traitée du PNCR (Pediatric Neuromuscular Clinical Research Network).
44 % des sujets ont satisfait au paramètre d’évaluation principal
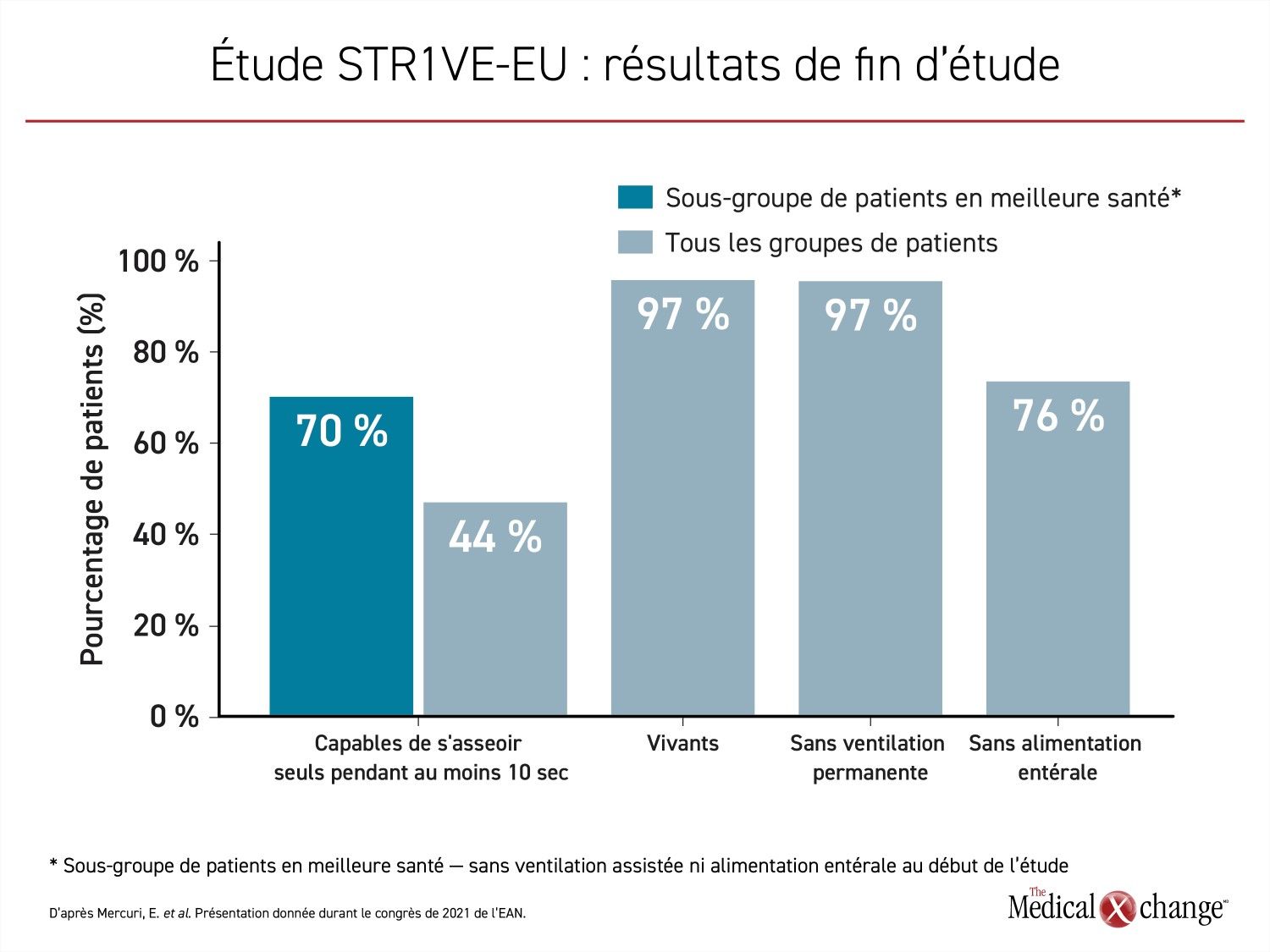
Le paramètre d’évaluation principal de cette étude, soit la capacité de s’asseoir seul pendant au moins 10 secondes, a été respecté par 14 (44 %) des 32 patients évaluables. Ils y sont parvenus à un âge médian de 15,9 mois. Le plus jeune enfant à y être arrivé avait 7,7 mois. En outre, 70 % des nourrissons qui, au départ, n’avaient pas besoin d’aide respiratoire ni de ventilation assistée y sont parvenus (Figure 2).
L’administration plus tardive du traitement ne laissait pas forcément présager d’une plus faible probabilité de satisfaire le paramètre d’évaluation principal, puisque comme le Dr Mercuri l’a mentionné, un des nourrissons recrutés ayant été écarté de l’analyse finale parce qu’il avait plus de 6 mois lorsqu’il a reçu la thérapie de substitution, l’a quand même respecté.
Or aucun des enfants atteints d’AS de type 1 non traitée de la cohorte du PNCR utilisés comme témoins n’a réussi à s’asseoir seul avant de mourir. Lors de l’étude STR1VE-EU, un seul enfant est décédé pendant la période de suivi et la cause du décès n’avait aucun lien avec le traitement. On obtient donc un taux de survie de 97 % comparativement à 0 % dans la cohorte du PNCR (p < 0,0001). Aucun des 32 patients évaluables ayant survécu jusqu’à l’âge de 18 mois au moins n’a eu besoin de ventilation permanente. Sur les 9 patients qui avaient besoin d’une méthode non effractive de ventilation assistée au début de l’étude, 2 pouvaient s’en passer complètement à la fin de la période de suivi. Sur les 24 patients qui n’étaient pas sous ventilation assistée au départ, 16 ne l’étaient toujours pas à la fin de la période de suivi.
Hausse constante des résultats au test CHOP INTEND et à l’échelle III de Bayley
Le score médian enregistré au test CHOP INTEND au moment du recrutement à l’étude se chiffrait à 28,0, ce qui témoigne de déficits moteurs importants, le score le plus bas étant de 22,0. Après l’administration de l’onasemnogène abéparvovec, les scores ont commencé à augmenter au moins légèrement chez tous les patients et abruptement chez la plupart d’entre eux. Il avait grimpé en moyenne de 6,0 points à 1 mois, de 10,3 points à 3 mois et de 13,8 points à 6 mois.
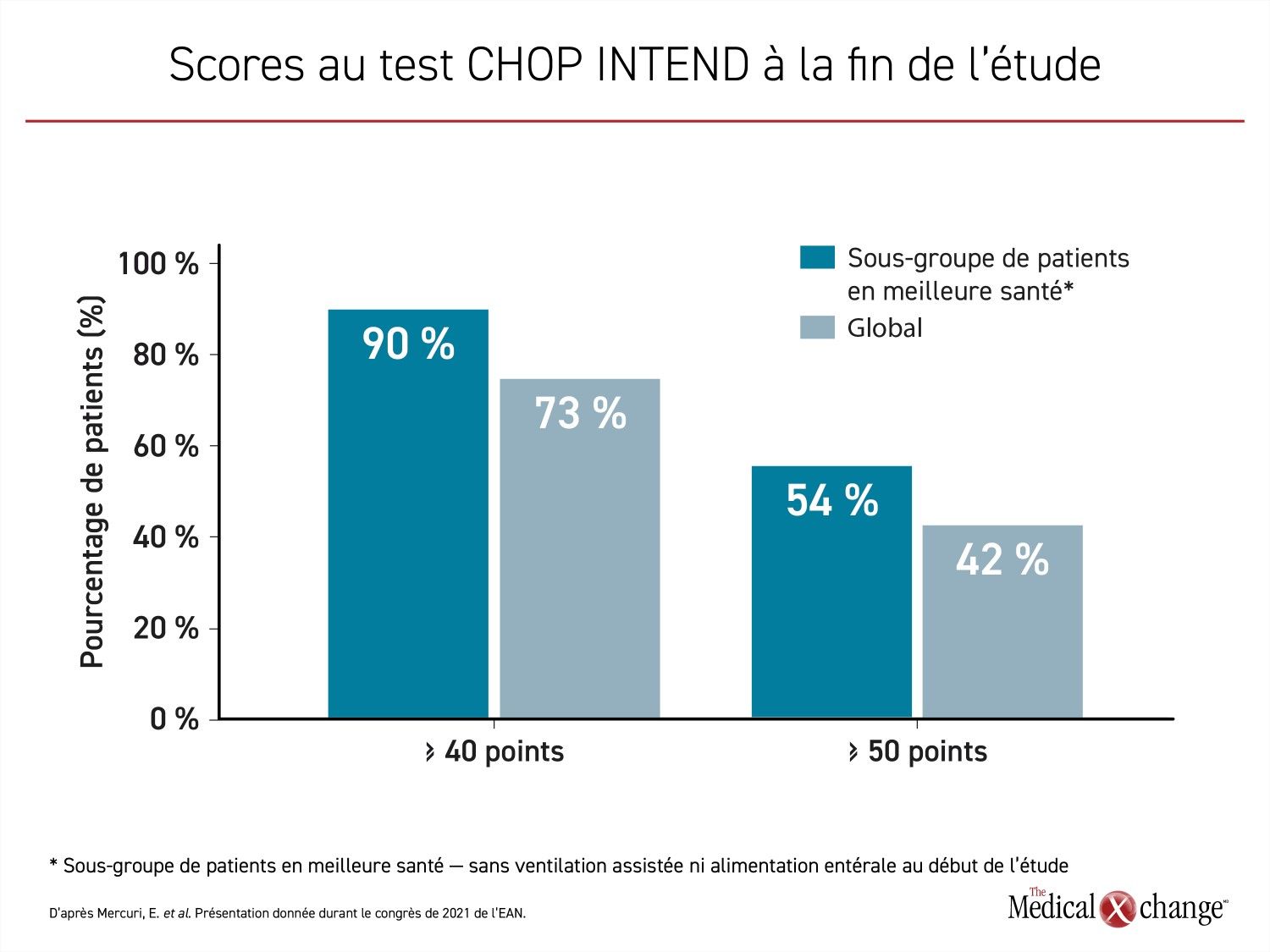
« À la fin de l’étude, 24 patients (73 %) avaient obtenu un score de 40 ou plus au test CHOP INTEND, 14 (42 %) avaient atteint 50 points ou plus et 3 (9 %), 58 points ou plus, a affirmé le Dr Mercuri. Ces scores sont remarquables, puisque ceux obtenus par les patients non traités contre leur AS de type 1 ne dépassent presque jamais 40 points ».
« Ces scores sont remarquables, puisque ceux obtenus par les patients non traités contre leur AS de type 1 ne dépassent presque jamais 40 points. »
Les enfants qui n’avaient pas besoin d’assistance ventilatoire ou d’une alimentation entérale au départ ont marqué des gains encore plus importants au test CHOP INTEND tout au long de l’étude (Figure 3).
Sur les 30 nourrissons incapables de tenir leur tête droite au moment du recrutement, 27 (90 %) y parvenaient à la fin de l’étude. Selon l’échelle III de Bayley des fonctions motrices, 19 patients (56 %) ont réussi à rouler sur le côté après avoir été couchés sur le dos et 16 patients (49 %) ont été capables de rester assis sans aide pendant au moins 30 secondes.
Plus de 75 % des enfants n’avaient pas besoin d’une alimentation entérale
À la fin de l’étude, 8 patients avaient besoin d’une forme ou d’une autre d’alimentation entérale; 4 d’entre eux faisaient partie des 9 enfants qui étaient déjà alimentés de cette façon au début de l’étude. Les 5 autres sont devenus capables de se nourrir sans aide mécanique. Même si à la fin de l’étude il fallait avoir recours à une alimentation entérale chez 4 nourrissons qui n’en avaient pas besoin au début de l’étude, 25 (78 %) des 32 patients évaluables s’en passaient complètement.
Aucun problème d’innocuité jusqu’alors inconnu
Les effets indésirables les plus susceptibles d’être liés au traitement étaient de nature hépatotoxique. Les taux d’enzymes hépatiques ont été élevés chez 22 patients (63,7 %) à un moment ou à un autre durant l’étude. Une fibrose, une cirrhose et d’autres signes d’atteinte hépatique ont été observés chez 18 patients (54,5 %). Cela dit, ces effets étaient généralement asymptomatiques et spontanément résolutifs ou ont cédé à la prednisone.
Selon le Dr Mercuri, le bilan d’innocuité de l’onasemnogène abéparvovec dressé pendant cette étude correspondait à celui obtenu lors des autres études sur cet agent, notamment l’étude STR1VE-US. Au cours de cette dernière, 2 des 3 cas d’effets indésirables graves ayant un lien possible avec l’onasemnogène abéparvovec impliquaient des hausses des aminotransférases hépatiques, alors qu’il s’agissait d’une hydrocéphalie dans le troisième cas. Ces patients se sont tous rétablis.
« Nous n’avons relevé aucun problème d’innocuité jusqu’alors inconnu », a déclaré le Dr Mercuri. Hormis les hausses des taux d’enzymes hépatiques, les effets indésirables les plus souvent rapportés étaient de la fièvre et des infections respiratoires. Le lien entre le traitement et ces manifestations, qui sont fréquentes chez les nourrissons, n’était pas clair.
Des avantages similaires sont ressortis de l’étude STR1VE-US
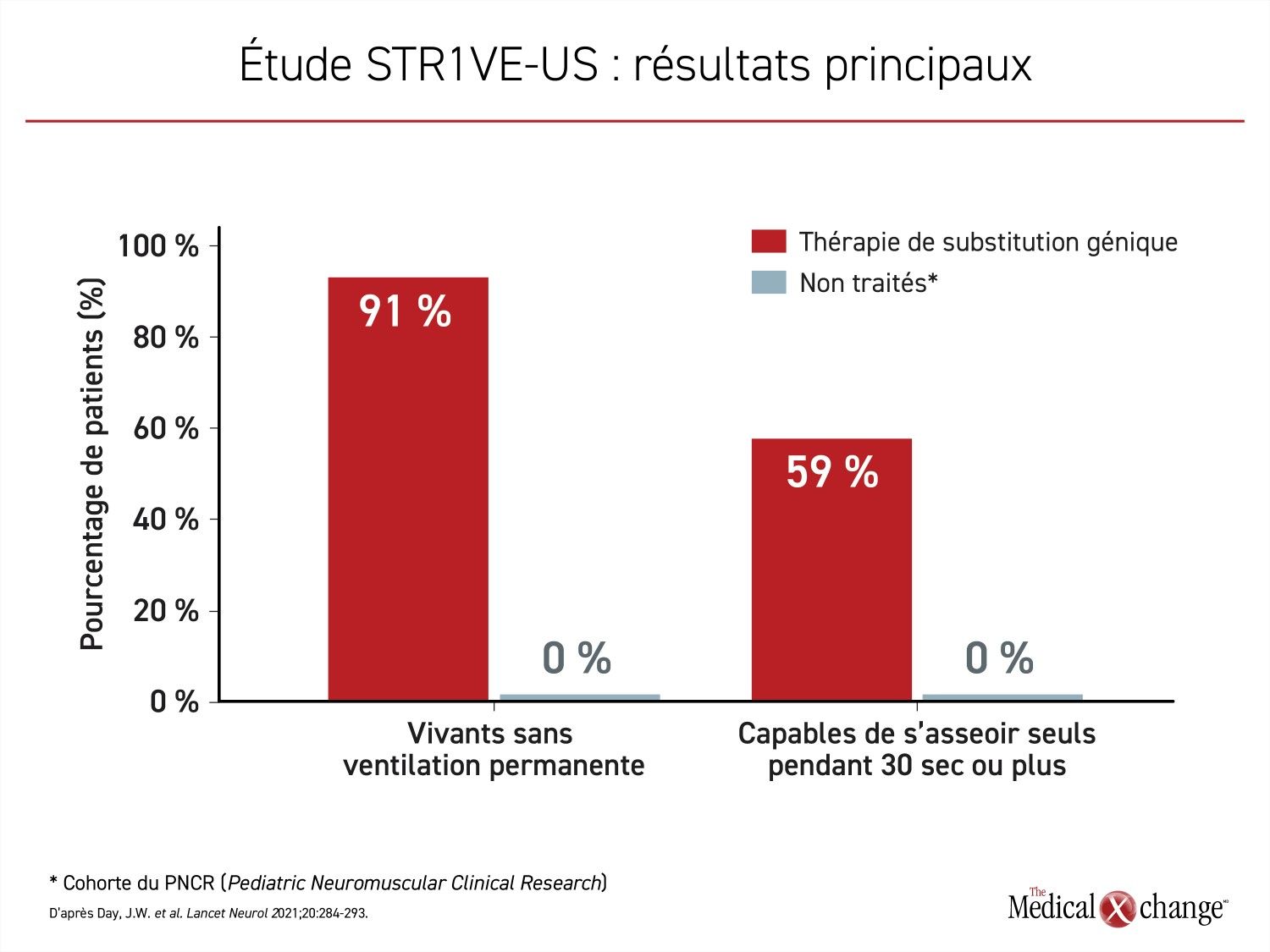
Ont été recrutés dans l’étude STR1VE-US 22 patients atteints d’AS de type 1 symptomatique qui ont tous reçu de l’onasemnogène abéparvovec avant l’âge de 6 mois. Le paramètre d’évaluation principal de cette étude était la capacité de rester assis sans aide pendant au moins 30 secondes avant l’âge de 18 mois, ce qu’ont réussi 13 (59 %) de ces patients. La différence entre les enfants de la cohorte du PNCR qui n’ont jamais franchi cette étape de leur développement, et ceux de l’étude STR1VE-US était très significative (p < 0,0001), comme ce fût le cas lors de l’étude STR1VE-EU (Figure 4).
Les résultats de l’étude STR1VE-EU reproduisent ceux de l’étude STR1VE-US
Comme ce fût le cas lors de l’étude STR1VE-EU, 20 (91 %) patients de l’étude STR1VE-US ont survécu sans avoir besoin de ventilation permanente, ce qui confirme les bienfaits majeurs de la thérapie de substitution génique contre l’AS de type 1 symptomatique. Ces études ne visaient pas à examiner le bien-fondé de l’administration de la thérapie de substitution génique le plus tôt possible après l’établissement du diagnostic d’AS de type 1, mais elles confirment bel et bien l’utilité de ce traitement même quand le diagnostic est posé plus tard.
« Les patients ayant d’emblée une meilleure fonction respiratoire ont obtenu des scores beaucoup plus élevés que ceux affichant une ventilation déficiente. Ces derniers ont quand même obtenu des améliorations même si dans l’absolu, elles étaient moins prononcées », a précisé le Dr Mercuri.
« Les patients atteints d’insuffisance respiratoire au début de l’étude ont quand même obtenu des améliorations même si dans l’absolu, elles étaient moins prononcées. »
Aucune donnée systématique n’a été publiée sur l’utilité clinique de l’onasemnogène abéparvovec chez les enfants atteints d’AS de type 1 âgés de plus de 6 mois, mais plus de 45 de ces patients ayant été traités par cet agent à l’âge de 6 mois ou plus tard sont actuellement suivis au moyen du registre RESTORE. Comme ce fut le cas pendant les études STR1VE de phase III, une atténuation des symptômes y a été rapportée. Bien qu’en théorie certaines étapes du développement puissent être irrécupérables si l’expression de la protéine SMN n’est pas rétablie au moment où elles devraient normalement être atteintes ou avant, ces données confirment l’utilité du traitement de l’AS de type 1 même chez les enfants devenus symptomatiques.
L’idéal : administrer la thérapie de substitution génique avant l’apparition des symptômes
Si l’onasemnogène abéparvovec leur est administré quelques semaines après leur naissance et avant l’apparition des symptômes, la plupart des enfants réussissent à franchir les premières grandes étapes de leur développement. Au cours de l’étude de phase III SPR1NT, qui a fait l’objet d’une présentation de dernière minute durant le congrès de 2021 de l’EAN, les 14 sujets de la cohorte de patients atteints d’AS de type 1 et porteurs de deux copies du gène SMN2 ont satisfait au paramètre d’évaluation principal en réussissant à s’asseoir sans aide pendant au moins 30 secondes. Ils y sont presque tous parvenus à un âge normal.
À ce jour, aucun des patients de cette étude « n’a eu besoin de quelque forme d’assistance ventilatoire ou d’alimentation entérale que ce soit », selon le Dr Kevin A. Strauss, directeur médical de la Clinique des enfants ayant des besoins particuliers, de Strasburg, en Pennsylvanie.
« Aucun des patients de cette étude [SPR1NT] n’a eu besoin de quelque forme d’assistance ventilatoire ou d’alimentation entérale que ce soit. »
Même si la période de suivi ne s’est pas étendue au-delà de la fenêtre temporelle où d’autres étapes devraient normalement être franchies, le Dr Strauss a affirmé que 79 % des enfants traités alors qu’ils étaient asymptomatiques parviennent aujourd’hui à se tenir debout sans aide pendant au moins 3 secondes et que 61 % d’entre eux marchent.
Somme toute, ces données « soulignent encore plus l’importance de diagnostiquer l’AS rapidement », a ajouté le Dr Strauss qui préconise le dépistage prénatal ou périnatal universel pour accélérer l’établissement du diagnostic.
Parmi les enfants atteints d’AS de type 1 qui ont été traités peu de temps après leur naissance et qui sont suivis depuis, au moins quelques-uns d’entre eux sont parvenus à franchir normalement et de façon soutenue les étapes de leur développement neurologique. Certains des enfants ayant participé à l’étude de phase III sur l’onasemnogène abéparvovec sont maintenant suivis depuis plus de 5,5 ans.
Conclusion
Les résultats finaux de l’étude STR1VE-EU, qui concordent avec ceux de l’étude STR1VE-US publiés auparavant, montrent que l’onasemnogène abéparvovec, l’agent utilisé pour la thérapie de substitution génique, permet d’obtenir des gains substantiels même quand il est administré à des nourrissons atteints d’AS de type 1 symptomatique. Lors de ces deux études, les enfants ont réussi à franchir des étapes importantes de leur développement après avoir reçu une seule perfusion de cet agent. Même si les symptômes des patients au début de l’étude STR1VE-EU étaient plus graves que ceux des sujets de l’étude STR1VE-US maintenant terminée, l’étude STR1VE‑EU est venue confirmer l’intérêt de la thérapie de substitution génique, même quand elle est administrée après que la fenêtre temporelle idéale soit passée.