Hématologie
Toronto Complement Conference (TCC) de 2024
HPN : cibler le vide thérapeutique avec les tout derniers inhibiteurs proximaux du complément
Toronto – Le recours aux inhibiteurs de la fraction C5 du complément pour traiter l’hémoglobinurie paroxystique nocturne (HPN) a permis de prolonger la survie et de raréfier les thromboses. Toutefois, une nouvelle classe de médicaments, les inhibiteurs proximaux du complément, bloquent l’activation du complément en agissant plus tôt dans la cascade du complément. Les données collectées à ce jour sur l’HPN relient cette nouvelle classe de médicaments à une diminution de l’anémie résiduelle imputable à l’hémolyse extravasculaire (HEV), un fardeau thérapeutique allégé et une meilleure qualité de vie. Selon un résumé présenté à la Toronto Complement Conference de cette année, ces agents, à l’instar d’autres stratégies thérapeutiques opposées à cette maladie rarissime, pourraient bientôt réorienter la prise en charge de l’HPN si ce n’est pas déjà fait.
Triade classique des symptômes de l’HPN
Selon l’explication du Dr Christopher Patriquin, professeur adjoint de médecine et clinicien-chercheur à l’Université de Toronto, et consultant, Hématologie et aphérèse, pour le Réseau universitaire de santé, l’HPN est une maladie clonale acquise, non cancéreuse rarissime des cellules souches hématopoïétiques. Elle est causée par la mutation d’un gène situé sur le chromosome X provoquant une perte d’ancrage membranaire (GPI) de CD55 et CD59, deux protéines inhibitrices du complément.
Sans ces protéines, les dépôts de C3 et de ses produits de dégradation s’accumulent, ce qui stimule l’activation de la voie terminale du complément et la constitution de complexes d’attaque membranaire à la surface des cellules sanguines.
« C’est l’histoire naturelle de la maladie telle que nous la voyons. Elle entraîne une hémolyse intravasculaire parce que cela se produit sur les globules rouges. Le risque de thrombose est également plus élevé parce que cela peut aussi se produire à la surface des monocytes, des neutrophiles et des plaquettes. »
Pour une entrevue exclusive avec le Dr Christopher Patriquin couvrant l’impact sur la pratique clinique, cliquez ici.
Bien que beaucoup de ses symptômes soient aspécifiques, l’HPN se manifeste par trois symptômes classiques : thrombose, hémolyse à test de Coombs négatif et insuffisance médullaire. Les symptômes de l’HPN sont causés par une activité hémolytique intravasculaire, a affirmé le Dr Patriquin.
« L’hémoglobine, c’est merveilleux à l’intérieur des globules rouges, mais à l’extérieur, c’est très dangereux », ce qui s’explique par son avidité pour l’oxyde nitrique et les divers effets en aval qui en découlent. Certains ont des répercussions directes sur la survie, comme la thrombose veineuse ou artérielle et l’insuffisance rénale, mais aussi sur la qualité de vie. La fatigue est un symptôme souvent débilitant dont beaucoup de patients se plaignent. Les symptômes varient grandement et peuvent comprendre les suivants : hémoglobinurie, dyspnée, dysphagie et dysfonction érectile.
« L’hémoglobine, c’est merveilleux à l’intérieur des globules rouges, mais à l’extérieur, c’est très dangereux. »
CATCH : le diagnostic passe par un indice de présomption élevé
Pour diagnostiquer l’HPN, comme toute autre maladie rare, « il faut l’avoir à l’esprit », a déclaré le Dr Patriquin. Pour ce faire, il suggère d’utiliser un acronyme approuvé par Le réseau HPN Canada, pour mettre en évidence les caractéristiques cliniques susceptibles d’inciter les médecins à demander des tests à visée un diagnostic. L’acronyme CATCH est formé de Cytopénie inexpliquée, Anémie aplasique (ou syndromes myélodysplasiques avec anémie réfractaire), Thrombose inexpliquée, hémolyse à test de Coombs négatif et Hémoglobinurie (Figure 1). « La bonne nouvelle, a-t-il ajouté, c’est qu’une fois que l’HPN est soupçonnée, la cytométrie en flux à grande sensibilité est facilement accessible au Canada dans les établissements universitaires ou les laboratoires communautaires ».
Il est important de reconnaître ces patients et d’amorcer le bon traitement. Les données sur l’évolution naturelle de l’HPN font état d’un taux de mortalité à 5 ans de 35 %. « L’inhibition ininterrompue du complément est essentielle pour améliorer le sort des patients auxquels elle convient », a-t-il expliqué.
Survol des inhibiteurs du complément déjà offerts ou en cours de développement
Plusieurs agents destinés au traitement de l’HPN en sont à la phase III, au-delà de la phase III ou déjà homologués au Canada (Figure 2). Les anticorps monoclonaux anti-C5 pour voie intraveineuse sont devenus la norme thérapeutique après que Santé Canada ait homologué l’éculizumab en 2009 à la lumière des résultats d’études montrant une maîtrise de l’hémolyse intravasculaire et une prolongation de la survie à long terme comparativement à un placebo. Le ravulizumab à action prolongée, qui a été lancé par la suite et s’administre toutes les 8 semaines au lieu de toutes les 2 semaines, fait preuve d’une efficacité comparable.
Toutefois, les inhibiteurs de C5 ne permettant pas de régler tous les problèmes, dont l’anémie persistante de certains patients, il est à prévoir que l’inhibition proximale du complément jouera un rôle croissant dans le traitement de l’HPN, selon les données présentées par le Dr Patriquin.
« Les inhibiteurs de C5 ne permettant pas de régler tous les problèmes, il est à prévoir que l’inhibition proximale du complément jouera un rôle croissant dans le traitement de l’HPN. »
Le rôle exact des inhibiteurs proximaux du complément contre l’HPN est encore à l’étude. Le pegcétacoplan, un inhibiteur de C3 qui est injecté par voie sous-cutanée, et le danicopan à prise orale utilisé en appoint à un inhibiteur de C5 sont déjà homologués contre cette maladie au Canada.
L’analyse intermédiaire des résultats de l’étude ALPHA de 12 semaines a révélé que le danicopan, un inhibiteur du facteur D qui y a été utilisé en appoint à l’éculizumab ou au ravulizumab, a eu un effet positif sur l’hémoglobinémie comparativement au placebo et chez les patients présentant une HEV d’importance clinique.
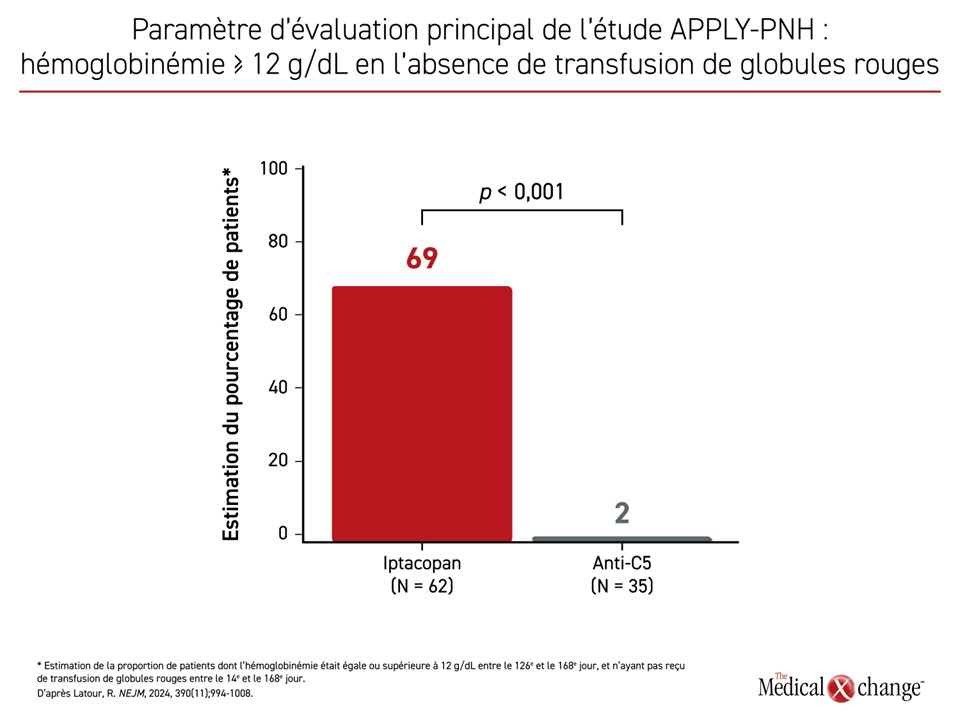
L’homologation de l’iptacopan, un inhibiteur proximal du complément à prise orale utilisé seul, est à l’examen considérant les résultats favorables des études de phase III. Cet inhibiteur du facteur B a fait l’objet de deux études de phase III publiées ensemble dans le New England Journal of Medicine. Les patients recrutés dans l’étude APPLY-PNH présentaient une hémoglobinémie moyenne < 10 g/dL, même s’ils suivaient un schéma thérapeutique stable par l’éculizumab ou le ravulizumab depuis 6 mois au minimum. Malgré cette réponse insatisfaisante au traitement anti-C5, signe d’un risque élevé de complications de l’HPN, 69 % des patients traités par l’iptacopan ont affiché une hémoglobinémie ≥ 12 g/dL entre le 126e et le 168e jour comparativement à 2 % de ceux (p < 0,001) ayant poursuivi leur traitement par l’inhibiteur de C5 (Figure 3). La proportion de patients réfractaires au traitement standard dont l’hémoglobinémie a connu une hausse ≥ 2 g/dL a aussi considérablement augmenté (82 % vs 2 %; p < 0,001). Seulement 5 % des patients traités par l’iptacopan ont eu besoin d’une transfusion comparativement à 40 % des témoins.
Lors de l’étude de phase III à un seul groupe de sujets APPOINT-PNH, des patients atteints d’HPN jamais traitée par un anti-C5 étaient recrutés si leur taux de lacticodéshydrogénase (LDH) correspondait à plus de 1,5 fois la limite supérieure de la normale (LSN). Même si les patients n’avaient pas reçu d’inhibiteur de C5 ni d’autres traitements dirigés contre l’HPN, aucun d’eux n’a eu besoin d’une transfusion et l’hémoglobinémie 31 des 33 patients a augmenté d’au moins 2 g/dL.
Les résultats des études APPLY-PNH et APPOINT-PNH ont fait ressortir une tolérabilité et une innocuité similaires et systématiques, et ont révélé que l’iptacopan à prise orale permet de maîtriser l’hémolyse tout en éliminant presque complètement les transfusions sanguines. « L’amélioration que nous voyons avec l’inhibition proximale en général, c’est presque un effet de classe », a déclaré le Dr Patriquin.
« L’amélioration que nous voyons avec l’inhibition proximale en général, c’est presque un effet de classe. »
Maîtrise globale de l’hémolyse intravasculaire et extravasculaire
Même si les trois inhibiteurs proximaux du complément (pegcétacoplan, danicopan et iptacopan) ont des modes d’action différents, ils interviennent tous plus tôt dans la cascade du complément. On a d’abord cru que cette action plus hâtive pourrait augmenter le risque d’hémolyse extravasculaire (HEV), mais c’est plutôt l’inverse qui se produit. Chacun d’eux a été relié à une réduction de l’anémie, un effet positif probablement attribuable à la diminution de l’HEV, du moins en partie. Notons que des résultats solides ont été observés chez les patients traités par l’iptacopan au cours de l’étude APPLY-PNH où ont été recrutés des patients présentant une anémie résiduelle. Encore là, ces résultats laissent entrevoir la possibilité que les inhibiteurs proximaux du complément transforment la prise en charge de l’HPN.
Les inhibiteurs de C5 prolongent la survie, mais certains besoins restent à combler
Si l’arrivée des inhibiteurs de C5 a constitué une avancée majeure, il demeure que les patients présentant une HEV ont besoin d’autres solutions. Pendant les études cliniques, l’éculizumab a rapidement abaissé les taux de LDH, un marqueur de substitution de l’hémolyse intravasculaire, à des valeurs voisines de la LSN. Cette observation a été reliée à une prolongation de la survie, peut-être largement attribuable à une diminution importante des incidents thrombotiques, selon le Dr Patriquin. Il a également ajouté que les grossesses des patientes atteintes d’HPN ont aussi connu une bien meilleure issue.
« Mais il reste encore beaucoup à faire », a-t-il affirmé. Premièrement, la qualité de vie de ces patients pourrait être améliorée et « en lien avec cela, il faudrait réduire le fardeau thérapeutique ».
Une partie du fardeau thérapeutique vient de la fréquence et du mode d’administration des médicaments. L’éculizumab et le ravulizumab sont injectés par voie intraveineuse. Un autre inhibiteur de C5, le crovalimab, qui n’est pas inférieur à l’éculizumab, s’administre par voie sous-cutanée toutes les quatre semaines au terme d’une période de charge, mais les injections restent nécessaires.
Parmi les inhibiteurs proximaux du complément, le pegcétacoplan s’administre aussi par voie sous-cutanée, mais deux fois par semaine. Le danicopan se prend par voie orale, mais il n’est homologué qu’à titre de traitement d’appoint à un inhibiteur de C5. L’iptacopan est donc possiblement le seul agent qui soit véritablement à prise orale.
D’après le Dr Patriquin, la surveillance de l’inhibition de C5 doit reposer sur le dosage de la LDH, un marqueur de l’hémolyse intravasculaire et, si possible, sur celui du CH50, un marqueur de l’activation de la voie terminale du complément. Précisant que les inhibiteurs de C5 restent les agents de première intention, il a suggéré d’envisager le recours à un inhibiteur proximal du complément ou de le combiner à un inhibiteur de C5 chez les patients qui n’obtiennent pas une réponse satisfaisante au bout de 3 à 6 mois d’un traitement anti-C5 ou s’ils ne peuvent le supporter.
Si le taux de LDH post-thérapeutique reste supérieur à 1,5 fois la LSN, surtout si le dosage du CH50 montre qu’une activation de la voie terminale du complément peut toujours être décelée, il faut alors soupçonner une poussée d’hémolyse, qu’elle soit imputable à des processus pharmacocinétiques ou pharmacodynamiques, ou à d’autres phénomènes responsables d’une inhibition insuffisance du complément.
Le Dr Patriquin a toutefois insisté sur le fait que même si le taux de LDH est inférieur à 1,5 fois la LSN, environ 40 % des patients présentent toujours une anémie marquée qui peut être assez symptomatique et qui peut être provoquée par une HEV, signe d’un blocage imparfait du complément.
Vers de nouvelles options thérapeutiques pour aplanir encore plus de difficultés
Même si les choses peuvent changer au cours des prochaines années, admet le Dr Patriquin, pour l’heure, il est recommandé d’amorcer le traitement de l’HPN avec un inhibiteur de la voie terminale du complément, comme l’éculizumab ou le ravulizumab, même si d’autres inhibiteurs de C5 pourraient arriver bientôt sur le marché.
Advenant que l’hémoglobinémie du patient ne réagisse pas favorablement à un traitement de 3 à 6 mois, « nous explorerions alors d’autres possibilités de traitement, qui pourraient bien être des inhibiteurs proximaux, et en discuterions avec le patient », a-t-il ajouté.
Parlant des inhibiteurs proximaux, le Dr Patriquin a déclaré : « Nous devons faire en sorte que le taux de LDH reste inférieur à 1,5 fois la LSN, et même si les données dont nous disposons jusqu’à maintenant sont encore fragmentaires, c’est essentiellement ce à quoi nous assistons ».
D’autres données à l’appui du rôle des inhibiteurs proximaux du complément dans le traitement de l’HPN sont à prévoir. Lors du congrès de 2024 de l’ASH 2024, par exemple, les résultats recueillis au bout des 48 semaines d’une étude de phase III sur l’iptacopan et de sa phase de prolongation menée en mode ouvert ont témoigné d’une amélioration de la qualité de vie liée à la santé rapportée par les patients et des signes et symptômes évalués par les chercheurs.
Les consultations avec les patients sont généralement « bien plus complexes, parce que nous devons évidemment passer en revue la plupart des nouvelles données, mais aussi parce que nous devons discuter de leurs préférences quant à la voie d’administration », a-t-il ajouté. « Le pegcétacoplan s’administre deux fois par semaine par voie sous-cutanée, ce que le patient peut faire par lui-même. Les agents pour voie orale se prennent deux fois par jour pour l’iptacopan ou trois fois par jour pour le danicopan en plus d’un traitement de fond par un anti-C5. »
Conclusion
L’HPN, qui se manifeste par des symptômes courants et aspécifiques, commande « un indice de présomption élevé et un minimum de justifications pour le dépistage », selon le Dr Patriquin. Certes, les inhibiteurs de C5 sont efficaces contre l’HPN, mais ils peuvent masquer une HEV d’importance clinique chez certains patients.
Les inhibiteurs proximaux du complément règlent ce problème en agissant plus tôt dans la cascade du complément, ce qui se traduit par une atténuation de l’anémie, des transfusions moins fréquentes et une meilleure qualité de vie. Les agents comme le pegcétacoplan, le danicopan et l’iptacopan constituent de nouvelles avenues vers une maîtrise globale de l’hémolyse. En outre, les médicaments à prise orale, comme l’iptacopan, qui peuvent être employés seuls viennent avec une plus grande souplesse d’administration et la possibilité de personnaliser le traitement.
Plus les données à long terme sur les nouveaux inhibiteurs proximaux se multiplieront, plus les médecins et leurs patients disposeront d’options parmi lesquelles ils pourront choisir celle qui répondra le mieux à leurs besoins en matière d’efficacité et d’innocuité, mais qui correspondra aussi aux caractéristiques de la maladie et au mode de vie des patients.