Revue d’experts
L'asthme grave : caractérisation aux fins de personnalisation du traitement
Chapitre 1 : L’asthme grave et ses phénotypes
Richard Leigh, M.D., Ph. D.
Professeur de médecine
Université de Calgary,
Calgary, Alberta
C’est un fait reconnu aujourd’hui que l’inflammation des voies aériennes propre à l’asthme est le fruit de processus moléculaires pluriels et distincts. Les phénotypes, qui sont des catégories fondées sur des observations empiriques, témoignent de cette hétérogénéité. Les différences enregistrées au chapitre des éléments déclencheurs, de la réaction au traitement, de l’âge à l’apparition de la maladie et autres caractéristiques étayent l’hypothèse selon laquelle l’asthme ne serait pas une entité pathologique unique, mais bien un ensemble de syndromes cliniques. L’utilisation du phénotypage dans le diagnostic et le traitement de l’asthme grave constitue un virage profond par rapport à la thèse voulant qu’un algorithme de traitement séquentiel puisse s’appliquer à tous les cas d’asthme. Le phénotypage a permis de mieux cerner l’hétérogénéité de l’asthme grave réfractaire aux traitements types et a été le point de départ de la recherche de moyens pour personnaliser le traitement. Dernièrement, il a catalysé les efforts visant à déceler les différences entre les immunomodulateurs qui entrent en jeu dans la médiation de l’inflammation des voies aériennes. Le nombre croissant de traitements opposés à cette maladie grave peut être attribué aux progrès réalisés dans ce domaine.
L’asthme grave : définition et caractéristiques épidémiologiques
Selon les lignes directrices, l’asthme grave se définit comme un asthme réfractaire aux traitements types. Dans leurs toutes dernières lignes directrices, l’European Respiratory Society et l’American Thoracic Society (ERS/ATS) stipulent que le critère qui signe l’asthme grave est la persistance, ou la récurrence, de symptômes incontrôlables depuis un an en dépit de l’utilisation de fortes doses d’un corticostéroïde pour inhalation (CSI) allié à un β-agoniste à longue durée d’action (BALA) ou à un antagoniste des récepteurs de leucotriènes1. Un asthme impossible à maîtriser sans une corticothérapie à action générale administrée sans interruption pendant au moins la moitié de l’année précédente constitue un autre critère définissant un asthme grave selon l’ERS/ATS. Par définition, on entend par asthme non maîtrisé une maladie ponctuée d’exacerbations fréquentes (au moins 2 traitements de courte durée par des corticostéroïdes à action générale depuis un an), d’exacerbations graves (au moins 1 hospitalisation ou séjour aux soins intensifs depuis un an) ou accompagnée d’une obstruction des voies aériennes (VEMS correspondant à moins de 80 % de la valeur théorique) malgré un traitement bien conduit par des agents bronchodilatateurs (Fig. 1). Selon les estimations, environ 10 % des patients atteints d’asthme sont aux prises avec une forme grave de la maladie2. Au Canada, où la prévalence de l’asthme se chiffrerait entre 7 et 10 %3, 250 000 personnes seraient donc victimes d’asthme grave, d’après les données citées par Asthme Canada4. L’asthme grave prélève un lourd tribut au pays, 250 personnes environ y succombant chaque année (Fig. 2). Il monopolise également une part disproportionnée des coûts engagés pour le traitement de l’asthme. Une étude étatsunienne a en effet révélé que sur une période de 2 ans, les coûts étaient deux fois plus élevés chez les patients atteints d’un asthme difficilement maîtrisable que chez ceux dont la maladie était bien maîtrisée5. Compte tenu de la persistance des symptômes et de la multiplication des consultations médicales, la corrélation entre un asthme de plus en plus grave et la diminution de la qualité de vie n’étonnera personne6,7. Des antécédents d’hospitalisations répétées et de recours à une ventilation assistée sont autant de facteurs de risque de crises d’asthme menaçant le pronostic vital8,9. Les cliniciens considèrent qu’il est possible d’éviter les crises d’asthme catastrophiques, voire mortelles, en intensifiant le traitement, mais l’asthme grave n’est pas une maladie uniforme ni un phénotype utile en soi10. Le groupement des patients en fonction du phénotype vise plutôt à jeter un meilleur éclairage sur l’évolution de la maladie, sur la réaction au traitement et, à terme, sur des traits biopathologiques sous-jacents communs qui pourraient être pris pour cibles. C’est la variabilité des réactions aux divers traitements opposés à l’asthme, notamment ceux dirigés contre la forme caractéristique d’inflammation causée par cette affection, qui a permis de conclure que les phénomènes physiopathologiques qui régissent l’asthme ne sont pas uniformes11.
Évolution de la notion d’asthme et de phénotypage
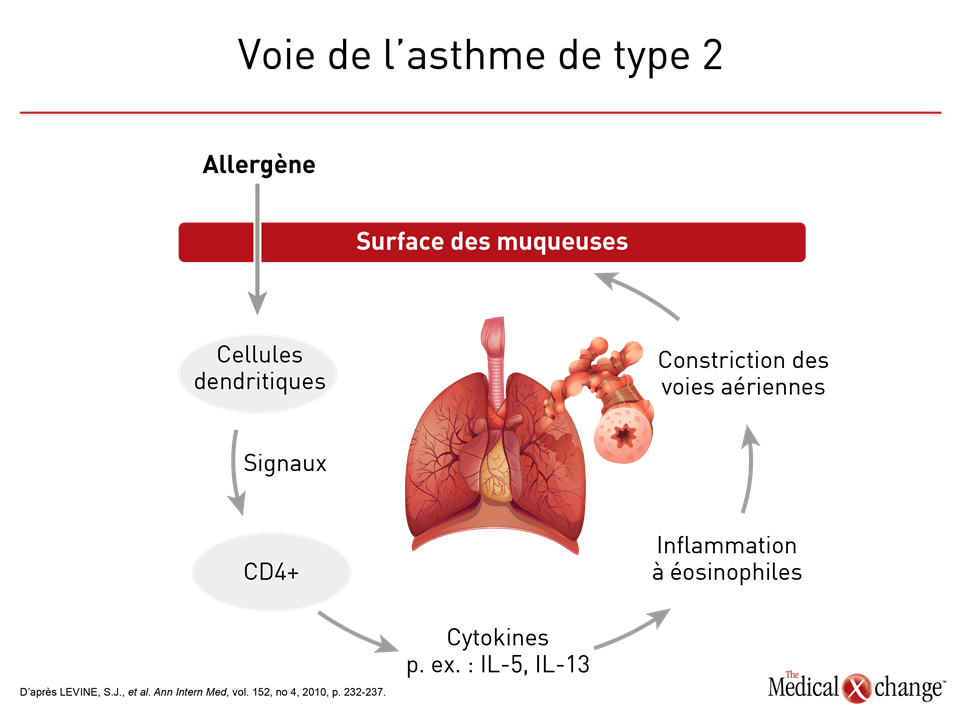
Les tentatives visant à donner un sens clinique aux multiples visages de l’asthme remontent à des décennies. En 1947, il a d’abord été proposé de classer les différents types d’asthme en fonction des déclencheurs environnementaux en cause12. En 1958, le nombre de cellules dans les expectorations, selon qu’il était élevé ou faible, a été vu comme une méthode possible pour classer les sous-types d’intérêt sur le plan clinique en fonction de la probabilité qu’ils répondent à une corticothérapie13. Voici d’autres exemples de sous-groupes ou de phénotypes proposés par la suite d’après des caractéristiques observables : manifestations d’allergies ou non14, présence de cellules inflammatoires dans les pièces biopsiques15 et gravité de la maladie sur le plan clinique16. Comme le nombre de caractéristiques pouvant avoir une portée clinique augmentait, les chercheurs ont commencé à réaliser des analyses par grappes aux fins de détermination des phénotypes. Un projet de recherche intitulé Severe Asthma Research Program (SARP), qui a servi à condenser 34 variables en 5 phénotypes cliniques en est un exemple bien connu17,18. Les travaux visant à définir les phénotypes de l’asthme ont largement été axés, et le sont encore, sur la participation relative des diverses cellules inflammatoires, notamment les lymphocytes T auxiliaires de type 2 (ou lymphocytes T CD4+ ou encore TH2) et les cytokines qui y sont associées. Si l’asthme a déjà été vu comme le résultat d’un processus inflammatoire principalement ou exclusivement placé sous la médiation de la voie des TH2 (Fig. 3), force a été de constater que certains patients expriment peu les cytokines ayant un lien avec ce type de réaction immunitaire19. Par la suite, les chercheurs ont cerné deux phénotypes moléculaires distincts qu’ils ont qualifiés d’asthme à inflammation lymphocytaire TH2 élevée et d’asthme à inflammation lymphocytaire TH2 faible. Or il est maintenant admis que d’autres cellules hormis les TH2, notamment les mastocytes, ont aussi un rapport avec la régulation positive des cytokines classiques associées aux TH2, dont font partie les interleukines 4, 5 et 13 (IL4, IL-5 et IL-13)11. C’est ce qui explique que les appellations « asthme à inflammation de type 2 élevée » et « asthme à inflammation de type 2 faible », d’où la notion de TH2 est escamotée, soient parfois utilisées. Les principales caractéristiques de l’asthme à inflammation de type 2 élevée sont une hyperéosinophilie sanguine et bronchique, une hyperréactivité des voies aériennes, un épaississement de la membrane basale sous-épithéliale et des concentrations d’IgE élevées20. La hausse des concentrations de polynucléaires éosinophiles est imputée à une expression de type 2 de l’IL-5 et à l’expression de l’IL-1321. Bien que l’asthme à inflammation de type 2 élevée soit depuis toujours considéré comme sensible à la corticothérapie, l’asthme grave hyperéosinophilique y est, par définition, plutôt réfractaire22. L’asthme à inflammation de type 2 faible n’est pas aussi bien caractérisé. Bien qu’il soit associé de plus près à une inflammation de type neutrophile10, cette forme d’asthme n’exclut pas l’expression de polynucléaires éosinophiles. Au cours d’une analyse réalisée dans le cadre du programme SARP, par exemple, quatre grappes phénotypiques établies selon les neutrophiles présents dans les expectorations ont été recensées, dont un qui s’accompagne d’une hyperéosinophilie concomitante23. Des modèles animaux ont corroboré l’intervention de l’IL-17 dans l’inflammation de type neutrophile24. Cela dit, l’hypothèse voulant que ce type d’inflammation, du moins chez certains patients atteints d’asthme, soit provoqué par une exposition prolongée aux corticostéroïdes a été avancée11. Dans l’ensemble, une revue récente de la littérature a révélé qu’aucun marqueur biologique propre au phénotype à inflammation de type 2 faible n’est encore considéré comme valable sur le plan clinique25. Un large éventail de phénotypes peut être élaboré à l’intérieur même de cette classification « faible ou élevée » à partir de caractéristiques pathologiques précises telles que la gravité de l’asthme, l’âge à l’apparition de la maladie ou son lien avec des éléments déclencheurs environnementaux, mais il se peut que les cas d’asthme ne correspondent pas tous à l’une ou l’autre de ces voies des réactions immunitaires. Une expression marquée de l’IL-17, par exemple, peut constituer une voie distincte qui n’est ni de type 2 élevée ni de type 2 faible, mais plutôt le résultat d’une régulation positive des cellules TH1726. L’obésité, qui est un facteur de risque de l’asthme, en est un autre exemple. Des facteurs tels que le comportement biomécanique des parois thoraciques et la compliance pulmonaire pourraient être pour quelque chose dans les processus biopathologiques aboutissant à l’asthme chez les personnes obèses indépendamment de leur réaction immunitaire27. Chez certains patients atteints d’asthme grave, la grande coupable pourrait être une résistance aux corticostéroïdes exercée par au moins un mécanisme, notamment une altération de la liaison aux récepteurs des glucocorticostéroïdes28.
Phénotypage, endotypage et génétique
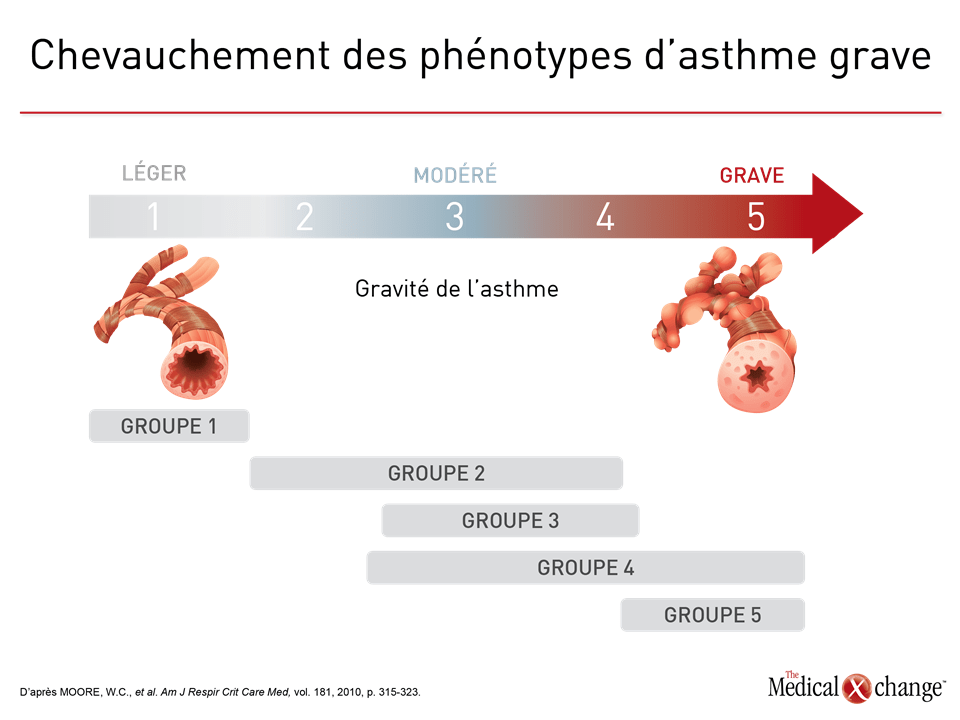
Si le phénotypage a servi à cerner empiriquement l’hétérogénéité de l’asthme, le but ultime des chercheurs reste bel et bien de comprendre les phénomènes moléculaires sous-jacents et de les traiter. L’urgence se fait particulièrement sentir pour les phénotypes d’asthme grave qui se caractérisent par une réaction médiocre aux traitements classiques. Plus les mécanismes moléculaires se dévoilent, plus les phénotypes sont susceptibles de se transformer en endotypes, c’est-à-dire des sous-types de la maladie dont les mécanismes moléculaires sont connus. L’efficacité des médicaments ciblés comme l’omalizumab, qui se lie aux IgE, et les agents dirigés contre l’IL-5, qui ont été homologués récemment, visent des molécules bien précises, mais pas des endotypes d’asthme nettement définis pour lesquels l’efficacité ou le manque d’efficacité est totalement ou à tout le moins fortement en corrélation avec la présence ou l’absence de cibles moléculaires putatives. Bien que nécessaires, de telles cibles putatives pourraient être insuffisantes en pareils cas pour prédire une réaction favorable au traitement. Des analyses réalisées a posteriori à partir de données issues d’études contrôlées par placebo ayant porté sur l’omalizumab, par exemple, ont révélé que le taux annualisé d’exacerbations est plus bas chez les patients ayant des antécédents d’asthme allergique et des concentrations d’IgE supérieures à 75 UI/mL que chez ceux chez lesquels elles sont plus faibles, mais on n’observe aucune relation dose-réponse pour les concentrations qui excèdent ce seuil. Par ailleurs, d’autres caractéristiques, telles qu’une piètre réponse à une corticothérapie administrée à des doses relativement élevées, constituent des facteurs prévisionnels d’une réaction favorable au traitement, peu importe la molécule visée29. Comparativement à un placebo, l’omalizumab est efficace chez les patients aux prises avec une forme modérée ou grave d’asthme persistant ayant obtenu un résultat positif à un test cutané ou à un test in vitro de réactivité à un aéroallergène apériodique, mais il est habituellement offert en appoint à d’autres traitements antiasthmatique en raison de la maîtrise insuffisante qu’il permet d’obtenir lorsqu’il est employé seul30. Les agents ciblant l’IL-5 sont, semble-t-il, plus spécifiques. Les premières études menées sur le mépolizumab n’ont fait ressortir aucun gain par rapport au placebo chez des patients tout-venant atteints d’asthme réfractaire à la corticothérapie31. Les études réalisées par la suite avec ce médicament et avec deux autres agents dirigés contre l’IL-5, soit le reslizumab et le benralizumab, au cours desquelles l’hyperéosinophilie tenait lieu de critère d’admissibilité, ont quant à elles mis au jour une protection significative contre les exacerbations32-34. Même si l’IL-5 s’est révélée un biomarqueur important pour repérer les patients les plus susceptibles de tirer avantage de ces agents ciblés, il faut savoir que les patients présentant une hyperéosinophilie ne réagissent pas tous favorablement à ce médicament, ce qui donne à penser que d’autres mécanismes entreraient en jeu dans l’expression de leur maladie. Les nombreuses tentatives visant à définir les phénotypes de l’asthme aux fins de détermination d’endotypes traitables se sont heurtées à un obstacle majeur : leur complexité. Elles ont en effet mis en évidence un chevauchement des caractéristiques moléculaires et cliniques de l’asthme, ce qui porte à croire que cette affection est le résultat de plusieurs phénomènes chez beaucoup de patients, voire chez la majorité d’entre eux35. Au cours d’une étude ayant réuni plus de 500 adultes et enfants, plus de la moitié des patients appartenaient à deux phénotypes ou plus définis en fonction des critères que sont l’atopie, l’hyperéosinophilie et la présence d’un asthme à inflammation de type 236. Les taux de chevauchement dépendaient du mode de définition de ces phénotypes. Par exemple, de 31 à 78 % des enfants et de 21 à 69 % des adultes étaient considérés porteurs d’un phénotype hyperéosinophilique selon que les valeurs seuils utilisées pour l’hyperéosinophilie étaient fixées à 150, 300 ou 450 ou plus d’éosinophiles/μL. De nombreuses autres études ont fait état de la fréquence d’un tel chevauchement (Figure 4)37,38. Au cours d’une étude réalisée dans le cadre du programme SARP, Moore et ses collègues ont effectué une classification hiérarchique non dirigée afin de répertorier cinq phénotypes distincts, mais se chevauchant. Les sujets du groupe 1 sont atteints d’un asthme atopique apparu tôt, qui sont traités au moyen de deux agents de fond au maximum et utilisant très peu les ressources en santé étant donné que leur fonction respiratoire est normale18. Les sujets du groupe 2 sont atteints d’un asthme atopique apparu tôt, leur fonction respiratoire est préservée, mais ils ont recours à leur médication et aux ressources de santé plus souvent. Les patients du groupe 3 sont surtout des femmes âgées et obèses qui sont aux prises avec un asthme apparu tardivement et qui n’est pas d’origine allergique; leur VEMS est moyennement réduit et leurs exacerbations commandent un usage fréquent de corticostéroïdes pour voie orale. Les sujets des groupes 4 et 5 sont quant à eux affligés d’une obstruction grave des voies aériennes qui réagit de façon variable aux bronchodilatateurs et ils sont plus ou moins capables de retrouver une fonction respiratoire normale, selon les cas. En outre, leur asthme n’est pas apparu au même âge, est d’origine allergique ou pas, et ils n’ont pas tous recours aux corticostéroïdes pour voie orale dans la même mesure. Exception faite des groupes 1 et 5, les chercheurs ont observé un chevauchement important de la gravité de l’asthme (Fig. 4). Le chevauchement des phénotypes a été corroboré au terme de l’analyse transcriptomique de l’ensemble des gènes extraits d’échantillons d’expectorations prélevés chez 104 patients atteints d’une forme modérée ou grave d’asthme39. Trois phénotypes moléculaires distincts sont ressortis du processus de typologie hiérarchique. Si l’asthme hyperéosinophilique dominait dans l’un de ces groupes, il n’y était pas limité. En effet, sa présence était également marquée dans un second groupe, tandis que deux groupes considérés comme n’étant pas de phénotype « type 2 » ont été reliés à l’expression des cytokines que sont l’interféron et le facteur de nécrose tumorale. Bien qu’il s’agisse d’une seule étude réalisée chez un petit effectif de patients, les observations qui en ont été tirées mettent en relief la complexité potentielle de la signalisation moléculaire qui sous-tend la gravité de l’asthme. Le large éventail de phénotypes créé à partir des caractéristiques moléculaires et cliniques, le constat d’un chevauchement considérable des phénotypes et la possibilité que ces derniers changent au fur et à mesure que l’asthme léger évolue vers l’asthme grave expliquent, en partie, pourquoi l’utilisation du phénotypage dans la prise en charge clinique de la maladie est si complexe. Bien que tous s’entendent pour dire qu’à terme, le phénotypage ou l’analyse par grappes se révélera un moyen utile pour personnaliser les soins prodigués aux patients atteints d’asthme17, pour l’heure, ces techniques ont surtout leur raison d’être en recherche40.
Conclusion
Les phénotypes fournissent un cadre d’analyse pour l’étude des tendances au sein des facteurs hétérogènes régissant l’asthme grave. Ces phénotypes, qui sont définis de manière variable, prouvent irréfutablement que l’asthme n’est pas une maladie unique, mais bien l’expression finale de nombreux phénomènes pathologiques. En ce qui concerne les patients dont les voies aériennes sont gravement enflammées, cet axe de recherche a abouti à un cadre d’analyse des phénomènes moléculaires à l’origine de l’expression de l’asthme, qui servira à personnaliser de plus en plus les traitements utilisés pour maîtriser cette maladie.
Références
- CHUNG, K.F., S.E. Wenzel, J.L. Brozek, et al. « International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma », Eur Respir J, vol. 43, 2014, p. 343-373.
- HEKKING, P.P., R.R. Wener, M. Amelink, A.H. Zwinderman, M.L. Bouvy et E.H. Bel. « The prevalence of severe refractory asthma », J Allergy Clin Immunol, vol. 135, 2015, p. 896-902.
- ROWE, B.H., C. Villa-Roel, R.B. Abu-Laban, et al. « Admissions to Canadian hospitals for acute asthma: a prospective, multicentre study », Can Respir J, vol. 17, 2010, p. 25-30.
- Asthma Facts and Statistics. Asthme Canada. Toronto, Canada: https://asthma.ca/wp-content/uploads/2017/06/Asthma-Facts-and-Stats.pdf; consulté le 9 août 2017.
- SULLIVAN, S.D., L. Rasouliyan, P.A. Russo, T. Kamath, B.E. Chipps, T.S. Group. « Extent, patterns, and burden of uncontrolled disease in severe or difficult-to-treat asthma », Allergy, vol. 62, 2007, p. 126-133.
- SIROUX, V., A. Boudier, J.M. Anto, et al. « Quality-of-life and asthma-severity in general population asthmatics: results of the ECRHS II study », Allergy, vol. 63, 2008, p. 547-554.
- GONZALEZ-BARCALA, F.J., R. de la Fuente-Cid, M. Tafalla, J. Nuevo et F. Caamano-Isorna. « Factors associated with health-related quality of life in adults with asthma. A cross-sectional study », Multidiscip Respir Med, vol. 7, 2012, p. 32.
- MCFADDEN, E.R., fils et E.L. Warren. « Observations on asthma mortality », Ann Intern Med, vol. 127, 1997, p. 142-147.
- OMACHI, T.A., C. Iribarren, U. Sarkar, et al. « Risk factors for death in adults with severe asthma », Ann Allergy Asthma Immunol, vol. 101, 2008, p. 130-136.
- RAY, A., M. Raundhal, T.B. Oriss, P. Ray et S.E. Wenzel. « Current concepts of severe asthma », J Clin Invest, vol. 126, 2016, p. 2394-2403.
- GAUTHIER, M., A. Ray et S.E. Wenzel. « Evolving Concepts of Asthma », Am J Respir Crit Care Med, vol. 192, 2015, p. 660-668.
- RACKEMANN, F.M. « A working classification of asthma », Am J Med, vol. 3, 1947, p. 601-606.
- BROWN, H.M. « Treatment of chronic asthma with prednisolone; significance of eosinophils in the sputum », Lancet, vol. 2, 1958, p. 1245-1247.
- WALKER, C., J.C. Virchow, fils, P.L. Bruijnzeel et K. Blaser. « T cell subsets and their soluble products regulate eosinophilia in allergic and nonallergic asthma », J Immunol, vol. 146, 1991, p. 1829-1835.
- WENZEL, S.E., L.B. Schwartz, E.L. Langmack, et al. « Evidence that severe asthma can be divided pathologically into two inflammatory subtypes with distinct physiologic and clinical characteristics », Am J Respir Crit Care Med, vol. 160, 1999, p. 1001-1008.
- MIRANDA, C., A. Busacker, S. Balzar, J. Trudeau et S.E. Wenzel. « Distinguishing severe asthma phenotypes: role of age at onset and eosinophilic inflammation », J Allergy Clin Immunol, vol. 113, 2004, p. 101-108.
- HALDAR, P., I.D. Pavord, D.E. Shaw, et al. « Cluster analysis and clinical asthma phenotypes », Am J Respir Crit Care Med, vol. 178, 2008, p. 218-224.
- MOORE, W.C., D.A. Meyers, S.E. Wenzel, et al. « Identification of asthma phenotypes using cluster analysis in the Severe Asthma Research Program », Am J Respir Crit Care Med, vol. 181, 2010, p. 315-323.
- FAHY, J.V. « Type 2 inflammation in asthma–present in most, absent in many », Nat Rev Immunol, vol. 15, 2015, p. 57-65.
- WOODRUFF, P.G., B. Modrek, D.F. Choy, et al. « T-helper type 2-driven inflammation defines major subphenotypes of asthma », Am J Respir Crit Care Med, vol. 180, 2009, p. 388-395.
- POPE, S.M., E.B. Brandt, A. Mishra, et al. « IL-13 induces eosinophil recruitment into the lung by an IL-5- and eotaxin-dependent mechanism », J Allergy Clin Immunol, vol. 108, 2001, p. 594-601.
- BUHL, R., M. Humbert, L. Bjermer, et al. « Severe eosinophilic asthma: a roadmap to consensus », Eur Respir J, vol. 49, no5, 2017.
- MOORE, W.C., A.T. Hastie, X. Li, et al. « Sputum neutrophil counts are associated with more severe asthma phenotypes using cluster analysis », J Allergy Clin Immunol, vol. 133, no6, 2014, p. 1557-63 e5.
- LAJOIE, S., I.P. Lewkowich, Y. Suzuki, et al. « Complement-mediated regulation of the IL‑17A axis is a central genetic determinant of the severity of experimental allergic asthma », Nat Immunol, vol. 11, 2010, p. 928-935.
- ROBINSON, D., M. Humbert, R. Buhl, et al. « Revisiting Type 2-high and Type 2-low airway inflammation in asthma: current knowledge and therapeutic implications », Clin Exp Allergy, vol. 47, 2017, p. 161-175.
- BUSSE, W.W., S. Holgate, E. Kerwin, et al. « Randomized, double-blind, placebo-controlled study of brodalumab, a human anti-IL-17 receptor monoclonal antibody, in moderate to severe asthma », Am J Respir Crit Care Med, vol. 188, 2013, p. 1294-1302.
- AL-ALWAN, A., J.H. Bates, D.G. Chapman, et al. « The nonallergic asthma of obesity. A matter of distal lung compliance », Am J Respir Crit Care Med, vol. 189, 2014, p. 1494-1502.
- LEUNG, D.Y., R.J. Martin, S.J. Szefler, et al. « Dysregulation of interleukin 4, interleukin 5, and interferon gamma gene expression in steroid-resistant asthma », J Exp Med, vol. 181, 1995, p. 33-40.
- CHAPMAN, K.R., A. Cartier, J. Hebert, R.A. McIvor et R.R. Schellenberg. « The role of omalizumab in the treatment of severe allergic asthma », Can Respir J, vol. 13, suppl. B, 2006, p. 1B-9B.
- HOLGATE, S.T., A.G. Chuchalin, J. Hebert, et al. « Efficacy and safety of a recombinant anti-immunoglobulin E antibody (omalizumab) in severe allergic asthma », Clin Exp Allergy, vol. 34, 2004, p. 632-638.
- FLOOD-PAGE, P., C. Swenson, I. Faiferman, et al. « A study to evaluate safety and efficacy of mepolizumab in patients with moderate persistent asthma », Am J Respir Crit Care Med, vol. 176, 2007, p. 1062-1071.
- PAVORD, I.D., S. Korn, P. Howarth, et al. « Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial », Lancet, vol. 380, 2012, p. 651-659.
- CASTRO, M., J. Zangrilli, M.E. Wechsler, et al. « Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicentre, parallel, double-blind, randomised, placebo-controlled, phase 3 trials », Lancet Respir Med, vol. 3, 2015, p. 355-366.
- Fitzgerald, J.M., E.R. Bleecker, P. Nair, et al. « Benralizumab, an anti-interleukin-5 receptor alpha monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised, double-blind, placebo-controlled phase 3 trial », Lancet, vol. 388, 2016, p. 2128-2141.
- PAPI, A., M. Saetta et L. Fabbri. « Severe asthma: phenotyping to endotyping or vice versa? », Eur Respir J, vol. 49, 2017.
- TRAN, T.N., R.S. Zeiger, S.P. Peters, et al. « Overlap of atopic, eosinophilic, and TH2-high asthma phenotypes in a general population with current asthma », Ann Allergy Asthma Immunol, vol. 116, 2016, p. 37-42.
- LOZA, M.J., R. Djukanovic, K.F. Chung, et al. « Validated and longitudinally stable asthma phenotypes based on cluster analysis of the ADEPT study », Respir Res, vol. 17, 2016, p. 165.
- GAGA, M., P.L. Brand et N.C. Thomson. « The quest for the grail: multidimensional efforts for understanding and targeting severe asthma », Eur Respir J, vol. 46, 2015, p. 1227-1231.
- KUO, C.S., S. Pavlidis, M. Loza, et al. « T-helper cell type 2 (Th2) and non-Th2 molecular phenotypes of asthma using sputum transcriptomics in U-BIOPRED », Eur Respir J, vol. 49, 2017.
- DESAI, M. et J. Oppenheimer. « Elucidating asthma phenotypes and endotypes: progress towards personalized medicine », Ann Allergy Asthma Immunol, vol. 116, 2016, p. 394-401.
Chapitre 1 : L’asthme grave et ses phénotypes
C’est un fait reconnu aujourd’hui que l’inflammation des voies aériennes propre à l’asthme est le fruit de processus moléculaires pluriels et distincts. Les phénotypes, qui sont des catégories fondées sur des observations empiriques, témoignent de cette hétérogénéité. Les différences enregistrées au chapitre des éléments déclencheurs, de la réaction au traitement, de l’âge à l’apparition de la maladie et autres caractéristiques étayent l’hypothèse selon laquelle l’asthme ne serait pas une entité pathologique unique, mais bien un ensemble de syndromes cliniques. L’utilisation du phénotypage dans le diagnostic et le traitement de l’asthme grave constitue un virage profond par rapport à la thèse voulant qu’un algorithme de traitement séquentiel puisse s’appliquer à tous les cas d’asthme. Le phénotypage a permis de mieux cerner l’hétérogénéité de l’asthme grave réfractaire aux traitements types et a été le point de départ de la recherche de moyens pour personnaliser le traitement. Dernièrement, il a catalysé les efforts visant à déceler les différences entre les immunomodulateurs qui entrent en jeu dans la médiation de l’inflammation des voies aériennes. Le nombre croissant de traitements opposés à cette maladie grave peut être attribué aux progrès réalisés dans ce domaine.
Afficher la revue