oncologie
Conférence annuelle de l’American Society of Clinical Oncology (ASCO) de 2010
De nouvelles données issues d’essais de phase III n’auront aucune répercussion sur le traitement classique du cancer du cerveau
Chicago – Dans les cas de glioblastome, la norme en matière de traitement consiste, dans un premier temps, à allier radiothérapie et chimiothérapie, et dans un deuxième temps, à faire appel à une chimiothérapie adjuvante. Or, les résultats de deux nouvelles études de phase III effectuées chez des personnes âgées ne viendront vraisemblablement rien y changer. Présentées à titre de données de dernière minute dans le cadre de la conférence annuelle de l’ASCO qui a eu lieu début juin, ces études s’inscrivent dans une recherche constante des meilleurs moyens d’améliorer les résultats des traitements tout en conservant une tolérabilité acceptable. Ces deux études menées chez des patients âgés dont le diagnostic remontait à peu de temps ont en fin de compte, servi de points de départ aux discussions sur la définition de ce que l’on entend par « personne âgée » et sur le rôle de l’âge comme facteur de discrimination en matière de traitement, indépendamment de l’indice fonctionnel. Les résultats de ces études viennent souligner l’équilibre complexe entre les bienfaits des traitements sur la survie globale médiane et la qualité de vie. Les facteurs de discrimination tels que l’état de méthylation du gène de la O6 méthylguanine ADN méthyltransférase (MGMT) peuvent se révéler plus utiles que l’âge pour déterminer l’intensité du traitement et ultimement, prolonger la survie des patients sans compromis pour la tolérabilité.
Essais de phase III sur un traitement du glioblastome modifié chez les personnes âgées
Deux essais de phase III effectués récemment chez des personnes âgées atteintes d’un glioblastome nouvellement diagnostiqué sont venus confirmer l’utilisation concomitante de la radiothérapie et du témozolomide, suivie d’un traitement adjuvant au témozolomide comme traitement de première intention chez les patients ayant un bon indice fonctionnel. Bien que les chercheurs aient abordé avec quelques nuances la question de la meilleure conduite à tenir dans les cas de glioblastome nouvellement diagnostiqué chez les personnes âgées, le Dr Stuart Grossman, Professeur de médecine, d’oncologie et de neurochirurgie à l’École de médecine Johns Hopkins, de Baltimore, au Maryland, qui avait été invité à discuter de ce sujet à la conférence de l’ASCO, en a déduit qu’à lui seul, l’âge n’est pas un critère utile quand vient le temps de choisir un traitement. Jouant le rôle d’animateur pendant ces deux présentations de dernière heure, il a conclu en disant que les données ne justifiaient aucun changement au traitement actuellement privilégié en première intention dans les cas de glioblastome nouvellement diagnostiqué.
« La radiothérapie alliée au témozolomide et suivie d’un traitement adjuvant de 6 mois à l’aide de témozolomide est sans contredit la norme en matière de traitement du glioblastome et constitue probablement le traitement optimal pour les patients autrement en santé atteints de ce type de tumeur, peu importe leur âge. »
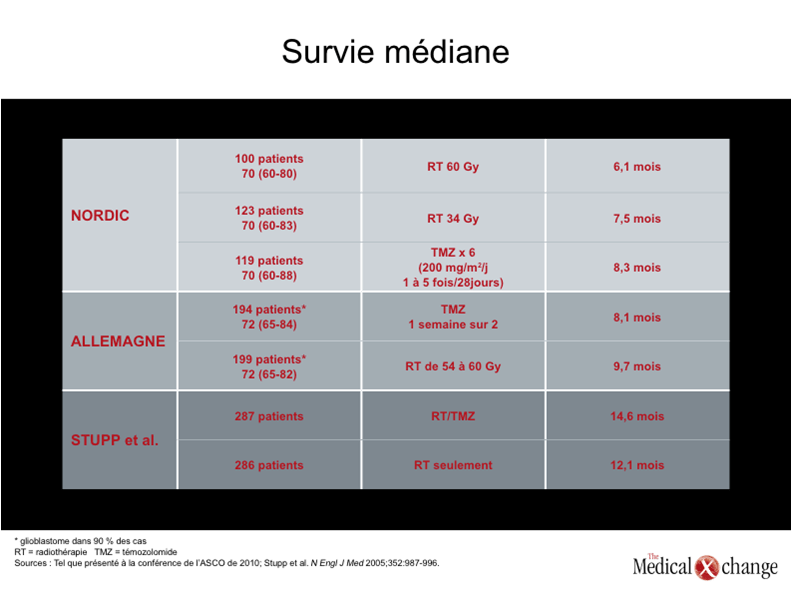
En se fondant sur les données publiées dernièrement ou non, le Dr Grossman a affirmé : « La radiothérapie alliée au témozolomide et suivie d’un traitement adjuvant de 6 mois à l’aide de témozolomide est sans contredit la norme en matière de traitement du glioblastome et constitue probablement le traitement optimal pour les patients autrement en santé atteints de ce type de tumeur, peu importe leur âge. En fait, l’âge chronologique d’un patient ne reflète pas forcément sa condition physique et, à moins de contre-indications claires, il est important que les patients puissent recevoir le traitement le plus susceptible de les aider à vivre plus longtemps ». Si la radiothérapie conjuguée au témozolomide est devenue la norme en matière de traitement, on le doit à une étude multicentrique dont les résultats ont été publiés il y a cinq ans (Stupp et al. N Engl J Med 2005;352:987-996). Les patients y avaient été répartis au hasard de façon à recevoir soit une radiothérapie seulement (5 journées par semaine pendant 6 semaines [dose totale : 60 Gy]), soit cette même radiothérapie alliée à l’administration concomitante de témozolomide (à raison de 75 mg/m2, 7 jours sur 7, pendant toute la durée de la radiothérapie), suivie d’un traitement adjuvant par le témozolomide (à raison de 150 à 200 mg/m2 pendant 5 jours au cours de 6 cycles de 28 jours). Au terme d’une période de suivi médiane de 28 mois, on a constaté que la survie médiane avait légèrement augmenté chez les patients traités par la radiothérapie conjuguée au témozolomide administré d’abord de manière concomitante, puis adjuvante (14,6 vs 12,1 mois; p < 0,001), mais que la survie à long terme était bien supérieure. En effet, selon le rapport de recherche original, 26,5 % des sujets qui avaient reçu du témozolomide étaient toujours vivants à 2 ans contre 10,4 % de ceux qui avaient été traités par radiothérapie uniquement. « Comme les données à 5 ans étaient disponibles, une mise à jour a été publiée dernièrement [Stupp et al. Lancet Oncol 2009;10:459-466]. Or, elles sont venues étayer avec encore plus de force les observations initiales. À preuve, on sait maintenant que 10,9 % des patients qui avaient reçu du témozolomide étaient toujours en vie au bout de 5 ans comparativement à 1,9 % de ceux qui avaient été traités par radiothérapie seulement [p < 0,0001] », a déclaré le Dr Grossman en insistant sur le fait que l’accent mis sur la survie médiane dans le rapport original n’avait pas permis de faire ressortir les bienfaits relatifs considérables du témozolomide au chapitre de la survie à long terme. Ces renseignements sont importants pour qui veut bien comprendre les deux études les plus récentes parce que les efforts déployés pour adapter les schémas thérapeutiques aux patients âgés ne se sont pas traduits par des taux de survie médiane de la même ampleur que dans l’essai ayant servi à établir la norme en matière de traitement du glioblastome nouvellement diagnostiqué. Au cours de l’une des deux études de phase III présentées à la conférence de l’ASCO, des patients âgés (65 ans ou plus) atteints d’un glioblastome ou d’un astrocytome anaplasique ont été répartis au hasard de manière à recevoir soit une radiothérapie aux mêmes doses que celles utilisées pendant l’étude de Stupp et de ses collaborateurs, soit du témozolomide à raison de 100 mg/m2 (la dose pouvait être modifiée), une semaine sur deux. La méthodologie choisie prévoyait l’utilisation de l’autre traitement en cas d’évolution de la tumeur, une stratégie de traitement à la fois plus facilement tolérable et plus pratique. Toutefois, selon le Dr Wolfgang Wick, du Service de neurooncologie, de l’Université de Heidelberg, en Allemagne, la non-infériorité du témozolomide n’ayant pas été démontrée, peu de patients d’un groupe ou l’autre sont passés à l’autre traitement. Prévoyant que le Dr Grossman ferait la même remarque en évaluant ces résultats, le Dr Wick ajouté : « Chez les patients âgés, on ne peut pas différer la radiothérapie impunément et entreprendre le traitement en administrant du témozolomide en monothérapie ».
Une nouvelle étude vient appuyer l’utilisation de plus faibles doses de radiations chez les personnes âgées
En expliquant la méthodologie utilisée pour cette étude de phase III allemande (NOA-08), le Dr Wick a précisé que 143 patients ont subi le processus de répartition aléatoire, la majorité d’entre eux (environ 90 %) étant atteints d’un glioblastome. Pour être admis à l’étude, les patients devaient avoir un score de Karnofsky supérieur à 60; le score de Karnofsky médian se chiffrait à 80. L’âge médian des sujets était de 71 ans. Le principal critère d’évaluation était la survie médiane, qui s’est chiffrée à 293 jours (9,7 mois) dans le groupe traité par radiothérapie et à 245 jours (8,1 mois) dans le groupe traité à l’aide du témozolomide. Cet écart n’a pas été suffisant pour que la non-infériorité du témozolomide soit établie compte tenu du seuil qui avait été préalablement fixé pour ce paramètre (Tableau 1). Lors de la deuxième étude de phase III, réalisée par le groupe d’étude Nordic, 291 « personnes âgées » (60 ans ou plus selon le protocole) atteintes d’une tumeur nouvellement diagnostiquée, ont été réparties au hasard en trois groupes de manière à recevoir : une radiothérapie type (dose totale de radiations : 60 Gy) administrée sur une période de 6 semaines, une radiothérapie à dose réduite (34 Gy) administrée sur une période de 6 semaines également ou du témozolomide administré à raison d’une dose de 200 mg/m2pendant 5 journées consécutives au cours de chacun des 6 cycles de 28 jours. Tout comme ce fut le cas pour l’étude allemande, les chercheurs de cette étude ont traité un des groupes à l’aide de la dose type de radiations, mais se sont écartés des schémas thérapeutiques classiques du témozolomide.
« Chez les patients âgés de 60 à 70 ans, on n’a noté aucune différence entre les groupes de traitement. En revanche, chez les patients plus âgés, le témozolomide a permis de prolonger la survie davantage que la radiothérapie à forte dose. Or, cette dernière ne s’est pas une seule fois révélée supérieure à la radiothérapie à faible dose ».
La survie globale médiane s’élevait à 8,3 mois pour le témozolomide, à 7,5 mois pour la radiothérapie dosée à 34 Gy et à 6,0 mois pour celle dosée à 60 Gy. Ces différences n’ont pas franchi le seuil de la signification statistique. Cela dit, la survie médiane des patients âgés de plus de 70 ans se chiffrait respectivement à 9,0 mois, à 7,1 mois et à 5,2 mois, et dans cette fois-ci, les différences étaient significatives sur le plan statistique (p < 0,001 pour le témozolomide vs la radiothérapie et p = 0,02 pour la radiothérapie à faible dose vs celle à haute dose). « Chez les patients âgés de 60 à 70 ans, on n’a noté aucune différence entre les groupes de traitement. En revanche, chez les patients plus âgés, le témozolomide a permis de prolonger la survie davantage que la radiothérapie à forte dose. Or, cette dernière ne s’est pas une seule fois révélée supérieure à la radiothérapie à faible dose », a déclaré la Dre Annika Malmström, du Service d’oncologie de l’hôpital universitaire de Linköping, en Suède. Elle a conclu en ajoutant : « on devrait s’abstenir d’avoir recours à la radiothérapie dosée à 60 Gy chez les patients âgés ». Cela dit, le Dr Grossman a remis en question l’expression « personnes âgées ». En effet, il juge arbitraire toute limite d’âge préétablie. Peu importe la définition que l’on donne à cette expression, le Dr Grossman considère que la condition physique plutôt que l’âge devrait servir de fondement au choix d’un traitement. Il a attiré notre attention sur le fait que la survie médiane rapportée dans ces études, qui allait de 6,1 à 9,7 mois, est plus courte que celle associée au traitement alliant radiothérapie et témozolomide, suivi d’un traitement adjuvant par le témozolomide, qui elle, dépasse 12 mois. C’est pourquoi il en est venu à la conclusion que ce traitement de première intention doit continuer d’être privilégié chez les patients ayant un indice fonctionnel acceptable.
« Nous allons devoir envisager la fragilité et la condition physique comme facteurs de discrimination plutôt que l’âge, notamment parce que tout porte à croire que le traitement de première intention tel que nous le définissons aujourd’hui exerce des bienfaits plus appréciables pour les patients en bonne condition physique que les autres avenues étudiées jusqu’à maintenant ».
Une raison importante qui justifierait que l’on examine d’autres critères hormis l’âge pour stratifier les patients est que la moyenne d’âge au moment où on diagnostique le glioblastome se situe entre 60 et 65 ans, ce qui était considéré comme « âgé » lors de l’étude Nordic. D’après le Dr Grossman, les indicateurs pronostiques tels que l’état de méthylation du gène de la O6 méthylguanine ADN méthyltransférase (MGMT) sont beaucoup plus prometteurs à ce chapitre. Il a d’ailleurs cité une étude récente au cours de laquelle les chercheurs ont fait le rapprochement entre la positivité de ce paramètre et un prolongement considérable de la survie médiane comparativement à sa négativité (16,2 vs 8,7 mois; p = 0,002) (Gerstner et al. Neurology 2009;73:1509-1510). « Nous allons devoir envisager la fragilité et la condition physique comme facteurs de discrimination plutôt que l’âge, notamment parce que tout porte à croire que le traitement de première intention tel que nous le définissons aujourd’hui exerce des bienfaits plus appréciables pour les patients en bonne condition physique que les autres avenues étudiées jusqu’à maintenant », a affirmé le Dr Grossman.