Dermatologie
L’urticaire chronique spontanée : revue d'expert et commentaires tirés de la littérature
L’urticaire chronique spontanée n’est pas phénomène allergique : la multiplication des analyses a peu d’intérêt
Philippe Bégin, M.D., FRCP(C), Ph.D.
Professeur agrégé de clinique, Département de médecine, Université de Montréal
Immuno-allergologue, CHU Sainte-Justine
Directeur, Clinique d’immunothérapie orale (CITO), CHU Sainte-Justine et CHUM
Chercheur, CHU Sainte-Justine
Montréal, Québec
Devant un tableau clinique d’urticaire chronique (UC), les épreuves diagnostiques, dont les tests cutanés visant à découvrir des allergènes, sont superflues, puisque le diagnostic de cette maladie peut et devrait essentiellement reposer sur l’anamnèse et l’examen physique. Elles se justifient si le tableau évoque d’autres maladies hormis l’urticaire, mais en présence de manifestations types d’UC, les examens approfondis ou la recherche de déclencheurs tels que des allergènes sont vains et retardent le traitement. En pareil cas, il faut avant tout appliquer l’algorithme de traitement fondé sur des données probantes afin que le patient retrouve une qualité de vie acceptable.
L’urticaire est dite chronique si ses symptômes persistants ou intermittents durent plus de 6 semaines. Les formes inductibles, telles que l’urticaire au froid ou l’urticaire cholinergique, représentent une minorité de cas. Plus fréquente, l’urticaire chronique spontanée (UCS), auparavant appelée urticaire chronique idiopathique parce que sa cause exacte est inconnue, est facile à distinguer des formes inductibles et d’autres affections au moyen de l’anamnèse et de l’examen physique. Or il est improbable que la multiplication des épreuves diagnostiques entraîne une modification du traitement d’attaque ou, dans la plupart des cas, mette au jour un élément déclencheur évitable.
Les médecins de première ligne sont en mesure de diagnostiquer l’UCS et d’amorcer un traitement de première intention. Seule la nécessité de soins spécialisés, et non pas la réalisation d’épreuves supplémentaires, peut justifier l’orientation vers un spécialiste des cas d’UCS que les traitements de première intention ne permettent pas de maîtriser convenablement.
Contexte
L’urticaire se caractérise par la formation de papules ortiées prurigineuses, œdémateuses et érythémateuses. Les papules s’accompagnent d’un œdème de Quincke dans environ 40 % des cas d’UC1. Contrairement à l’urticaire aiguë, qui disparaît souvent en quelques heures ou quelques jours, l’UC se distingue par des symptômes persistants ou intermittents durant 6 semaines ou plus2. L’UC est un motif de consultation assez fréquent, à preuve sa prévalence à vie de 15 à 20 % et sa prévalence ponctuelle de 0,5 à 1,0 %3.
Pour visionner un programme d’eLearning avec le Dr Philippe Bégin, cliquez ici
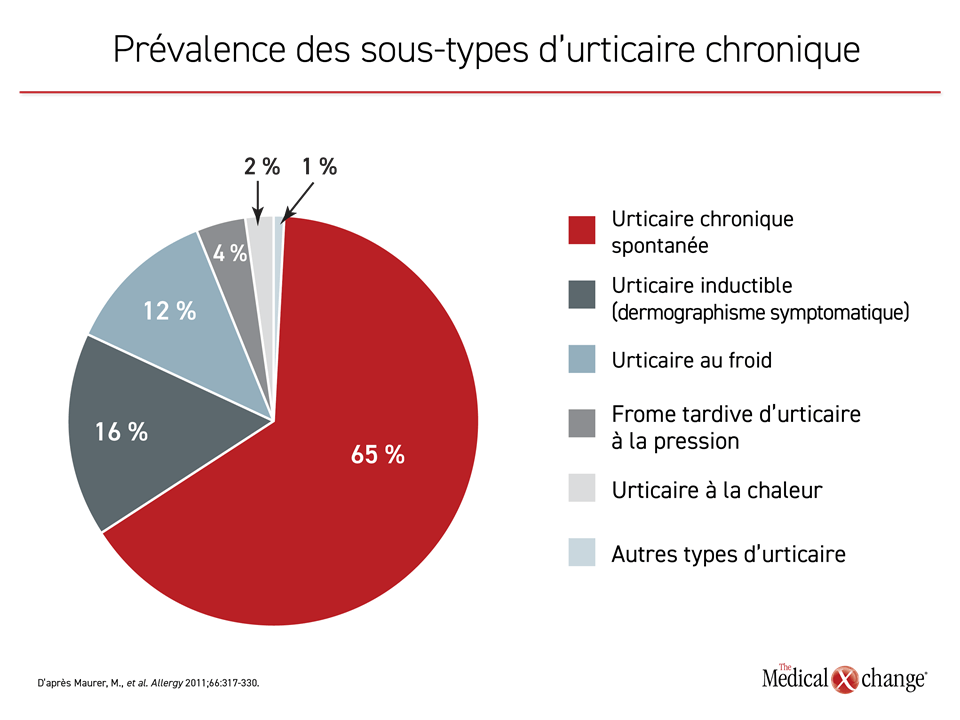
L’UCS est le type d’UC le plus répandu, car elle représente jusqu’à 65 % des cas3 (Figure 1). Contrairement aux formes inductibles comme le dermographisme symptomatique ou l’urticaire cholinergique, elle risque moins d’être reliée à un déclencheur. Nous disposons de plus en plus de données probantes indiquant que l’UCS est souvent imputable à des phénomènes auto-immuns ou allergiques entraînant l’activation des mastocytes, une libération d’histamine et la formation de papules ortiées4.
L’UCS peut frapper à tout âge, mais sa prévalence culmine entre 20 et 40 ans3. Elle semble légèrement plus fréquente chez les femmes que chez les hommes5. Les papules ortiées, qui font habituellement de 1 à 3 mm et se rejoignent parfois pour former de grands placards, peuvent apparaître n’importe où sur la peau et sont plus souvent prurigineuses que douloureuses. Les lésions douloureuses causant une sensation de brûlure évoquent une vascularite urticarienne, une maladie pouvant être grave, et justifient une évaluation en ce sens.
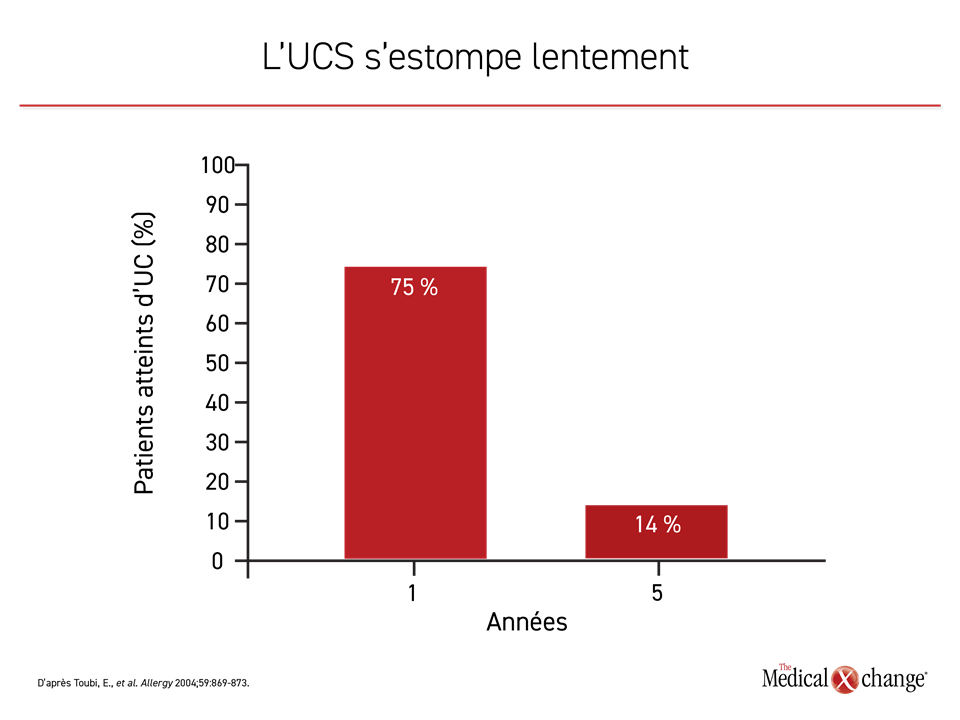
La durée de l’UCS est extrêmement variable. Lors d’une étude, les symptômes de 35 % des sujets avaient disparu à 1 an et avaient diminué chez près de la moitié des autres6, alors que 70 % des sujets non traités suivis pendant 5 ans dans une autre étude éprouvaient encore des symptômes à 1 an, qui se sont toutefois estompés avec le temps7. Seulement 14 % des sujets non traités restaient symptomatiques à 5 ans (Figure 2).
L’UCS nuit beaucoup à la qualité de vie. Non seulement ses lésions cutanées persistantes, prurigineuses, voire douloureuses, peuvent-elles perturber le sommeil et la productivité du lendemain8, mais elles peuvent aussi être une source d’embarras9, d’où le lien possible entre l’UC et un risque plus élevé de dépression et d’anxiété10. L’UCS ne menace pas le pronostic vital, mais le fardeau qu’elle représente commande un diagnostic rapide et une intervention adaptée.
Physiopathologie : pourquoi ne pas rechercher des éléments déclencheurs?
Les lignes directrices déconseillent la multiplication des épreuves diagnostiques en raison de la faiblesse de leurs résultats. Si l’anamnèse évoque l’implication possible de déclencheurs, ces derniers peuvent inspirer des stratégies d’évitement. Sinon, les essais de provocation sont inutiles. Quand l’évitement permet de maîtriser les symptômes, il confirme la présence d’un facteur causal favorisant. Cela dit, la recherche de déclencheurs à l’aide d’essais de provocation est un gaspillage de ressources, car les chances d’en découvrir sont faibles. Dans la majorité des cas d’UCS, il est impossible de trouver un coupable11.
Les lignes directrices déconseillent la multiplication des épreuves diagnostiques en raison de la faiblesse de leurs résultats.
Les lignes directrices actuelles recommandent la réalisation d’analyses standard (p. ex., formule sanguine et formule leucocytaire, dosage de la protéine C-réactive [CRP] ou détermination de la vitesse de sédimentation [VS]) pour procéder par élimination en complétant l’anamnèse et l’examen physique2. Des signes de maladie générale, comme un taux élevé de CRP, justifient la réalisation d’analyses plus poussées, mais il est peu probable qu’une autre affection soit en cause chez les patients présentant des lésions cadrant avec une UCS, mais aucun autre problème de santé12. Il faut savoir que les patients atteints de maladies générales sous-jacentes, dont certaines sont assez rares comme le syndrome de Schnitzler et les cryopyrinopathies13,14, ne seront pas affligés de symptômes cutanés uniquement.
Qu’elle soit aiguë ou chronique, inductible ou spontanée, l’urticaire est généralement le fait de la dégranulation des mastocytes et des basophiles dans la peau. Lorsque les récepteurs de l’IgE situés à leur surface sont stimulés, ces cellules libèrent de l’histamine et des médiateurs pro-inflammatoires, tels que l’IL-4 (interleukine-4), l’IL-5 et l’IL-8, et le facteur d’activation plaquettaire (PAF)15. Il y a œdème de Quincke quand l’activation des mastocytes se produit plus en profondeur, dans le derme ou l’hypoderme16. Les mastocytes sont vus comme des acteurs cruciaux dans la réaction inflammatoire responsable de l’urticaire, mais d’autres cellules telles que les lymphocytes, et d’autres médiateurs hormis l’histamine, comme les leucotriènes, interviennent dans certaines lésions urticariennes.
Dans l’urticaire chronique inductible, l’activation des mastocytes est provoquée par l’exposition à un agent précis. Dans bien des cas, mais pas toujours, elle est le résultat d’une réaction d’hypersensibilité de type 1, celle-ci se produisant quand des allergènes se lient à des anticorps à la surface cellulaire. Le déclencheur de l’UCS reste à élucider et pourrait varier d’un sujet à l’autre. Une théorie veut que des auto-anticorps IgG ciblent l’IgE ou son récepteur, d’où la libération d’histamine4. Il est possible de les détecter en contexte expérimental au moyen d’un test au sérum autologue (TSA). Un résultat positif a été relié à une maladie plus grave, un pronostic plus sombre et une réponse tardive au traitement.
Un autre mécanisme décrit récemment repose sur la production d’anticorps IgE dirigés contre des antigènes du soi ou des antigènes de la flore colonisatrice (auto-allergie). Ces anticorps IgE sont dirigés contre la TPO, l’ADNsb, la thyroglobuline, le facteur tissulaire et l’entérotoxine staphylococcique. Pour l’heure, aucun de ces derniers ne peut être soumis à des tests en dehors du milieu de la recherche. Des recherches récentes ayant établi une corrélation entre le phénotype et un mécanisme sous-jacent de l’UCS laissent entrevoir la possibilité de découvrir des biomarqueurs17.
Concrètement, le diagnostic de l’UCS est un processus d’élimination empirique. Bien qu’il n’y ait aucun biomarqueur ni test de référence pour la diagnostiquer, il est possible d’assurer aux patients qu’il s’agit bien d’UCS quand leurs seuls symptômes sont de nature cutanée, sans aucune manifestation générale. L’atténuation des symptômes consécutive à l’emploi d’antihistaminiques en première intention est une autre preuve de l’activation mastocytaire et de l’UCS sous-jacente.
Traiter tôt : l’algorithme est simple
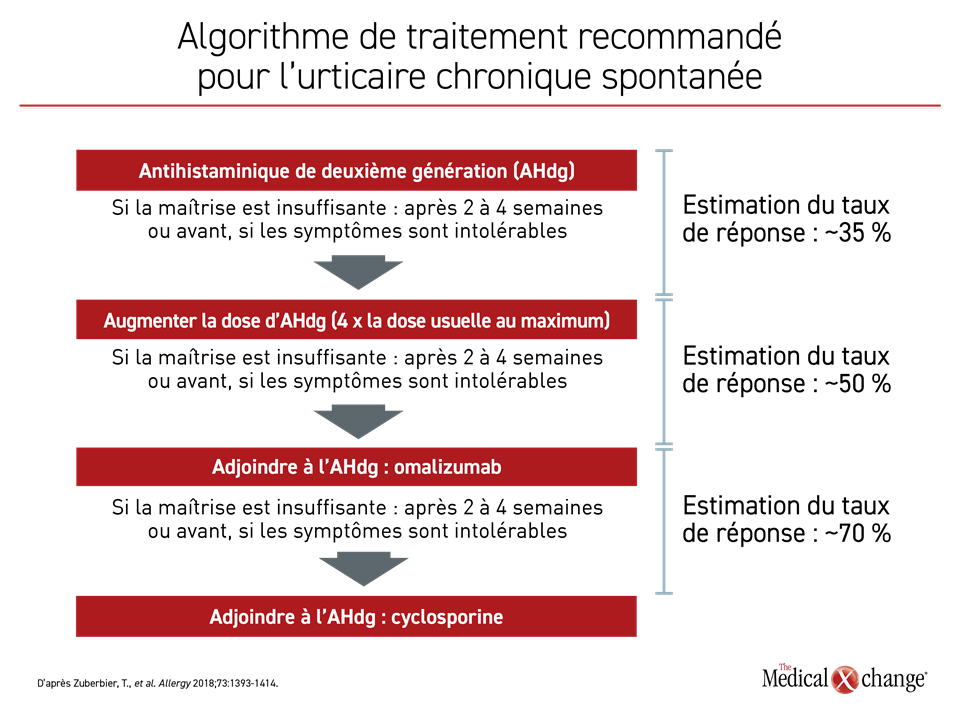
Il est possible de bien maîtriser les symptômes de l’UCS chez la grande majorité des patients en appliquant les trois étapes indiquées dans les lignes directrices. Première étape : antihistaminiques à dose usuelle (Figure 3). Les lignes directrices privilégient les antihistaminiques de deuxième génération, qui sont mieux tolérés que leurs prédécesseurs, ainsi qu’un traitement continu qui est plus avantageux qu’un autre administré au besoin, surtout pour ce qui est de la qualité de vie18. Les études ayant comparé directement des inhibiteurs de deuxième génération ont révélé une légère variabilité de leur efficacité, mais n’importe quel d’entre eux fait l’affaire selon les lignes directrices surtout s’il risque peu de provoquer des interactions médicamenteuses1.
Il est possible de bien maîtriser les symptômes de l’UCS chez la grande majorité des patients en appliquant les trois étapes indiquées dans les lignes directrices.
Si les symptômes ne sont pas bien maîtrisés, l’étape suivante consiste à augmenter la dose d’antihistaminique, à plusieurs reprises s’il le faut, jusqu’à concurrence de 4 fois la dose usuelle. Les lignes directrices recommandent d’espacer ces hausses de 2 à 4 semaines, mais il est possible d’y aller plus rapidement si les symptômes sont intolérables. Environ la moitié des patients peuvent espérer maîtriser leurs symptômes avant d’atteindre la dose maximale permise12.
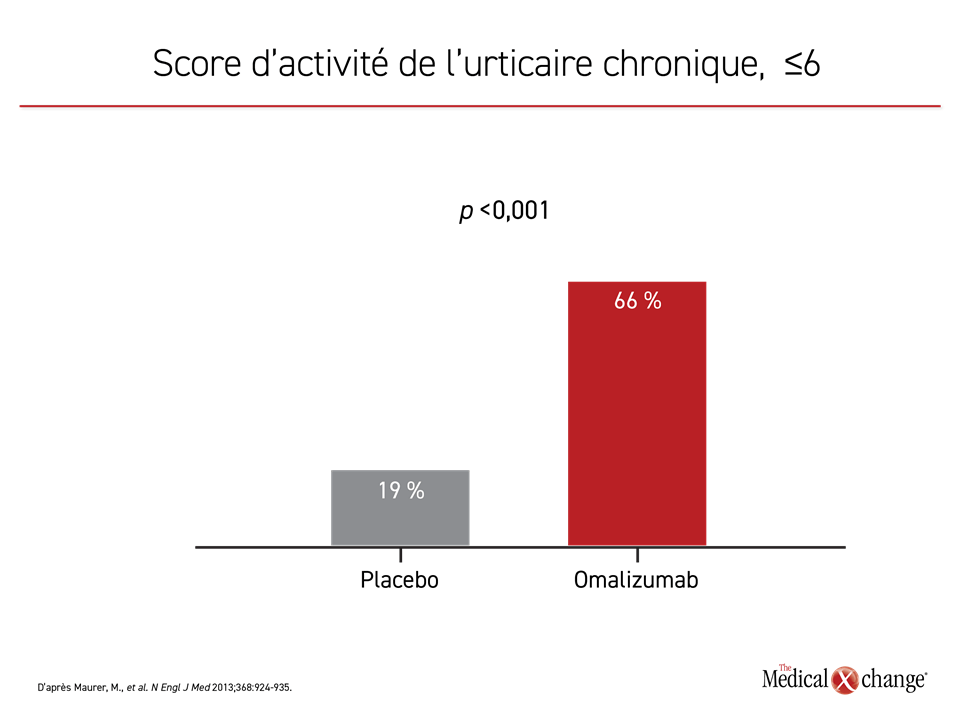
Le recours à l’omalizumab, un anticorps monoclonal dirigé contre l’IgE, est la troisième étape de l’algorithme de traitement. Il bloque l’activation des mastocytes et des basophiles en empêchant l’IgE de se fixer à ses récepteurs à leur surface19. Lors d’un essai de phase III contrôlé par placebo, la dose de 300 mg, la plus élevée qui ait été évaluée, a permis d’abaisser de plus de 70 % le score moyen attribué à l’intensité du prurit entre le début et la 12e semaine de l’essai et de 60 % par rapport au placebo20. L’atténuation des papules ortiées était d’une ampleur similaire. La comparaison de la maîtrise des symptômes, définie par un score d’activité de l’urticaire (UAS) de 6 ou moins, a révélé que la différence était extrêmement significative à 12 semaines (p < 0,001) (Figure 4). Cette atténuation des symptômes s’est traduite par des améliorations de l’indice DLQI (Dermatology Life Quality Index) et le bilan d’innocuité de l’omalizumab était comparable à celui du placebo.
L’ajout d’une dose usuelle d’omalizumab (300 mg) injectée par voie sous-cutanée toutes les quatre semaines permet de bien maîtriser les symptômes chez de 70 à 80 % des patients environ. Quant à la minorité qui n’y répondra pas, les lignes directrices conseillent d’utiliser de la cyclosporine, qui a aussi été reliée à un soulagement des symptômes dans des essais contrôlés par placebo21,22. Cela dit, le risque d’effets indésirables augmentant avec le temps, son emploi durant plus de quelques semaines doit s’accompagner d’une surveillance étroite des effets exercés sur la pression artérielle et la fonction rénale. A fortiori, un usage de plusieurs mois commande la prudence23.
Les lignes directrices déconseillent fortement l’emploi de corticostéroïdes comme traitement d’entretien de l’UCS, même si ces agents peuvent être efficaces à court terme pour en maîtriser les symptômes. Or ils sont utilisés dans de nombreux pays pour cette indication même si elle n’est pas homologuée. Selon les lignes directrices, la corticothérapie ne doit pas durer plus de 10 jours.
Les lignes directrices de thérapeutique dressent souvent une liste des traitements employés de façon empirique contre l’UCS, tels que la dapsone, le méthotrexate, la photothérapie, les immunoglobulines pour voie intraveineuse et les inhibiteurs de leucotriènes, mais aucun d’eux ne s’est révélé efficace dans les essais contrôlés2. De même, des cas d’obtention d’une meilleure réponse ont été rapportés lorsque des doses plus élevées ou plus fréquentes d’omalizumab étaient opposées à des symptômes qui n’étaient pas suffisamment maîtrisés avec la dose usuelle, mais il faudra réaliser des essais contrôlés pour le valider24.
Quant aux cas réfractaires, des agents expérimentaux étudiés dans le cadre d’essais cliniques semblent prometteurs. À preuve, des rapports de cas ont fait état des bienfaits du dupilumab, un antagoniste des récepteurs de l’IL-4 utilisé dans le traitement de l’eczéma atopique25, tandis qu’un essai de phase IIb de détermination de la dose mené avec du ligélizumab, un anticorps anti-IgE de prochaine génération, a montré que la dose la plus efficace de cet agent l’avait emporté sur l’omalizumab (51 % vs 26 %) pour le paramètre d’évaluation principal, soit la disparition complète des papules ortiées à 12 semaines26. Aucun des patients affectés au placebo n’a obtenu pareil résultat. Des essais de phase III sur ces deux agents injectés par voie sous-cutanée sont prévus ou en cours de réalisation.
UCS : une méthode concrète
Malgré les nombreuses questions en suspens à propos de l’UCS, y compris les incertitudes concernant les phénomènes qui en sont le moteur, cette maladie n’est pas forcément difficile à diagnostiquer ni à traiter en médecine de première ligne. L’UC se caractérise par l’apparition de papules ortiées persistantes en l’absence de toute maladie générale à l’anamnèse et à l’examen physique. La disparition des symptômes après évitement des déclencheurs pressentis à l’anamnèse confirme le diagnostic d’une forme inductible de la maladie. Si aucun déclencheur n’est soupçonné ou si l’évitement de ceux recensés pendant l’anamnèse ne donne rien, l’atténuation des symptômes au moyen d’antihistaminiques vient appuyer le diagnostic d’UCS sous-jacente.
Il est déconseillé de procéder à des épreuves diagnostiques en plus de l’anamnèse et de l’examen physique. Elles risquent de retarder le traitement et ne permettront probablement pas un choix de traitement plus éclairé ou d’en améliorer l’issue.
Il est important d’amorcer le traitement le plus tôt possible. Lors d’une étude internationale d’observation de cohortes, les scores attribués aux symptômes d’UCS ou à leur retentissement sur la qualité de vie témoignaient d’une évolution modérée à intense de la maladie chez environ la moitié des sujets9. Selon cette étude, l’UCS nuit énormément à la qualité de vie et aux activités du quotidien, y compris au sommeil et au rendement au travail. Le nombre moyen de consultations motivées par l’UCS s’élevait à 3,3 chez les patients (72 %) qui avaient consulté un médecin au cours des 12 mois précédents. Les hospitalisations étaient plus rares (8,2 % des patients), mais selon les estimations, elles ont imposé à la société un fardeau économique substantiel compte tenu de leurs coûts directs et indirects.
Une question, similaire à celle de l’œuf et de la poule, reste à élucider : l’incidence élevée de maladies concomitantes est-elle la cause ou la conséquence de l’UCS? À la fréquence des maladies auto-immunes concomitantes plus élevée que celle attendue dans la population générale (p. ex., la maladie de Basedow, le vitiligo et la polyarthrite rhumatoïde)27, vient s’ajouter une hausse du taux de dépression et d’anxiété liées à l’UCS que l’on suppose provoquée par le stress que cette maladie peut déclencher et exacerber28. Le rôle du stress dans l’apparition de l’UCS, de l’éruption cutanée ou du prurit reste controversé même si pareils rapprochements ont maintes fois été faits empiriquement, mais la démonstration de l’existence d’un axe cerveau-intestin-peau vient appuyer la composante neurogène de maladies concomitantes possiblement apparentées29.
Les lignes directrices de 2017 n’abordent pas le risque des maladies concomitantes de l’UCS ni les stratégies de prise en charge de ces affections, mais il est fort probable qu’il en sera question dans les prochaines éditions compte tenu des études de plus en plus nombreuses publiées à ce sujet. Par exemple, il est fréquent que les patients atteints d’UCS souffrent aussi de troubles psychiatriques30. La fatigue et les troubles digestifs sont également répandus29. Dans une prise en charge complète, il faut s’informer au sujet des maladies concomitantes bien que la possibilité qu’un traitement efficace contre l’UCS permette de les raréfier ou d’en réduire la gravité n’ait pas été évaluée convenablement.
Les lignes directrices factuelles régissant le traitement de l’UCS sont bien appliquées en médecine de première ligne. Les antihistaminiques, les agents utilisés en première intention, sont efficaces et bien tolérés, même s’il faut parfois en augmenter la dose pour maîtriser les symptômes. Il est à prévoir que certains cliniciens seront réticents à prescrire ou à administrer de l’omalizumab, la prochaine étape pour les cas rebelles aux fortes doses d’antihistaminiques, surtout en raison de son coût élevé, mais l’orientation de ces patients ne doit pas être différée. Aucune inquiétude majeure concernant son innocuité n’a été soulevée depuis qu’il a commencé à être employé abondamment en clinique, il y a plus de cinq ans. Il maîtrise bien les symptômes de la plupart des patients atteints d’UCS, une maladie débilitante si elle n’est pas traitée.
Selon les lignes directrices actuelles, la cyclosporine est la solution suivante pour les rares cas réfractaires aux trois premières étapes de traitement recommandées. Les effets indésirables qu’elle provoque exigent une surveillance systématique, mais il est souvent justifié d’y avoir recours dans les cas graves qui ne répondent pas aux étapes précédentes de l’algorithme. Beaucoup d’immunomodulateurs ont été utilisés de façon empirique dans la prise en charge de l’UCS, mais très peu ont fait l’objet d’études.
Même si elle est très répandue, l’UCS n’est pas reconnue ni traitée comme il se doit en médecine de première ligne. Cette maladie auparavant difficile à maîtriser, surtout dans les cas ne répondant pas suffisamment aux antihistaminiques, est maintenant mieux caractérisée. Nous disposerons peut-être un jour de biomarqueurs qui nous en apprendront davantage sur le processus morbide à l’origine de l’UCS et qui pourront servir d’épreuves diagnostiques objectives, mais d’ici là, la marche à suivre recommandée dans les lignes directrices actuelles pour la diagnostiquer et la traiter est simple et facilement applicable.
Résumé
L’UCS ne menace pas le pronostic vital, mais elle peut nuire énormément à la qualité de vie même si elle est d’intensité légère ou modérée. Il n’existe pas d’épreuve diagnostique de référence pour l’UCS, mais un diagnostic de présomption peut être posé en présence de lésions cutanées prurigineuses caractéristiques et en l’absence de signes d’une maladie générale majeure. Les antihistaminiques sont les agents à privilégier en première intention. L’algorithme de traitement actuel, qui comporte de fortes doses d’antihistaminiques de deuxième génération et, au besoin, un anticorps monoclonal anti-IgE, permet de maîtriser les symptômes chez la plupart des patients.
Références
1. Kaplan AP. Clinical practice. Chronic urticaria and angioedema. N Engl J Med 2002;346:175-9.
2. Zuberbier T, Aberer W, Asero R, et al. The EAACI/GA(2)LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. Allergy 2018;73:1393-414.
3. Maurer M, Weller K, Bindslev-Jensen C, et al. Unmet clinical needs in chronic spontaneous urticaria. A GA(2)LEN task force report. Allergy 2011;66:317-30.
4. Bracken SJ, Abraham S, MacLeod AS. Autoimmune Theories of Chronic Spontaneous Urticaria. Front Immunol 2019;10:627.
5. Eun SJ, Lee JY, Kim DY, Yoon HS. Natural course of new-onset urticaria: Results of a 10-year follow-up, nationwide, population-based study. Allergol Int 2019;68:52-8.
6. Kozel MM, Mekkes JR, Bossuyt PM, Bos JD. Natural course of physical and chronic urticaria and angioedema in 220 patients. J Am Acad Dermatol 2001;45:387-91.
7. Toubi E, Kessel A, Avshovich N, et al. Clinical and laboratory parameters in predicting chronic urticaria duration: a prospective study of 139 patients. Allergy 2004;59:869-73.
8. Hay RJ, Johns NE, Williams HC, et al. The global burden of skin disease in 2010: an analysis of the prevalence and impact of skin conditions. J Invest Dermatol 2014;134:1527-34.
9. Maurer M, Abuzakouk M, Berard F, et al. The burden of chronic spontaneous urticaria is substantial: Real-world evidence from ASSURE-CSU. Allergy 2017;72:2005-16.
10. Tat TS. Higher Levels of Depression and Anxiety in Patients with Chronic Urticaria. Med Sci Monit 2019;25:115-20.
11. Schaefer P. Acute and Chronic Urticaria: Evaluation and Treatment. Am Fam Physician 2017;95:717-24.
12. Kaplan AP. Chronic Spontaneous Urticaria: Pathogenesis and Treatment Considerations. Allergy Asthma Immunol Res 2017;9:477-82.
13. Davis MDP, van der Hilst JCH. Mimickers of Urticaria: Urticarial Vasculitis and Autoinflammatory Diseases. J Allergy Clin Immunol Pract 2018;6:1162-70.
14. Keddie S, Parker T, Lachmann HJ, Ginsberg L. Cryopyrin-Associated Periodic Fever Syndrome and the Nervous System. Curr Treat Options Neurol 2018;20:43.
15. Jain S. Pathogenesis of chronic urticaria: an overview. Dermatol Res Pract 2014;2014:674709.
16. Champion RH, Roberts SO, Carpenter RG, Roger JH. Urticaria and angio-oedema. A review of 554 patients. Br J Dermatol 1969;81:588-97.
17. Folci M, Heffler E, Canonica GW, Furlan R, Brunetta E. Cutting Edge: Biomarkers for Chronic Spontaneous Urticaria. J Immunol Res 2018;2018:5615109.
18. Grob JJ, Auquier P, Dreyfus I, Ortonne JP. How to prescribe antihistamines for chronic idiopathic urticaria: desloratadine daily vs PRN and quality of life. Allergy 2009;64:605-12.
19. Beck LA, Marcotte GV, MacGlashan D, Togias A, Saini S. Omalizumab-induced reductions in mast cell Fce psilon RI expression and function. J Allergy Clin Immunol 2004;114:527-30.
20. Maurer M, Rosen K, Hsieh HJ, et al. Omalizumab for the treatment of chronic idiopathic or spontaneous urticaria. N Engl J Med 2013;368:924-35.
21. Grattan CE, O’Donnell BF, Francis DM, et al. Randomized double-blind study of cyclosporin in chronic ‘idiopathic’ urticaria. Br J Dermatol 2000;143:365-72.
22. Vena GA, Cassano N, Colombo D, Peruzzi E, Pigatto P, Neo ISG. Cyclosporine in chronic idiopathic urticaria: a double-blind, randomized, placebo-controlled trial. J Am Acad Dermatol 2006;55:705-9.
23. Koski R, Kennedy KK. Treatment with omalizumab or cyclosporine for resistant chronic spontaneous urticaria. Ann Allergy Asthma Immunol 2017;119:397-401.
24. Clark JJ, Secrest AM, Hull CM, et al. The effect of omalizumab dosing and frequency in chronic idiopathic urticaria: Retrospective chart review. J Am Acad Dermatol 2016;74:1274-6.
25. Lee JK, Simpson RS. Dupilumab as a novel therapy for difficult to treat chronic spontaneous urticaria. J Allergy Clin Immunol Pract 2019;7:1659-61 e1.
26. Maurer M, Gimenez-Arnau AM, Sussman G, et al. Ligelizumab for Chronic Spontaneous Urticaria. N Engl J Med 2019;381:1321-32.
27. Kolkhir P, Borzova E, Grattan C, Asero R, Pogorelov D, Maurer M. Autoimmune comorbidity in chronic spontaneous urticaria: A systematic review. Autoimmun Rev 2017;16:1196-208.
28. Bansal CJ, Bansal AS. Stress, pseudoallergens, autoimmunity, infection and inflammation in chronic spontaneous urticaria. Allergy Asthma Clin Immunol 2019;15:56.
29. Aitella E, De Bartolomeis F, Savoia A, Fabiani M, Romano M, Astarita C. The overlap syndrome of urticaria and gastroesophageal reflux disease. PLoS One 2018;13:e0207602.
30. Konstantinou GN, Konstantinou GN. Psychiatric comorbidity in chronic urticaria patients: a systematic review and meta-analysis. Clin Transl Allergy 2019;9:42.