Rhumatologie
Congrès en ligne de 2020 de la Ligue européenne contre le rhumatisme (EULAR)
Rôle concret d’un nouvel agent contre la polyarthrite rhumatoïde révélé par des données supplémentaires
Congrès en ligne – Un essai multicentrique à répartition aléatoire a de nouveau établi qu’un inhibiteur sélectif des JAK administré à la dose homologuée était plus efficace qu’un agent injectable contre les formes modérées ou graves de la polyarthrite rhumatoïde (PR). Les données tirées de cet essai et de plusieurs analyses sur l’innocuité à long terme présentées au congrès en ligne de 2020 de l’EULAR ont permis de préciser où s’insère ce traitement dans l’arsenal thérapeutique actuel.
Comparativement au tofacitinib, un inhibiteur des JAK de première génération, les nouveaux agents de cette classe ont été pensés de façon à exercer une plus grande sélectivité pour le sous-type de JAK le plus étroitement lié à l’évolution de la PR. Deux de ces agents ont récemment été homologués au Canada : l’upadacitinib et le baricitinib. L’upadacitinib est le seul des deux à s’être montré plus efficace que l’adalimumab, un inhibiteur du facteur de nécrose tumorale (TNF) lorsqu’il est administré à la dose homologuée. Or il s’est aussi révélé supérieur à l’abatacept, un inhibiteur de l’activation des lymphocytes T.
Pour une entrevue exclusive avec la Dre Marie-Anaïs Rémillard sur l’impact sur la pratique clinique, cliquez ici
Supériorité observée pendant l’essai de non-infériorité SELECT-CHOICE
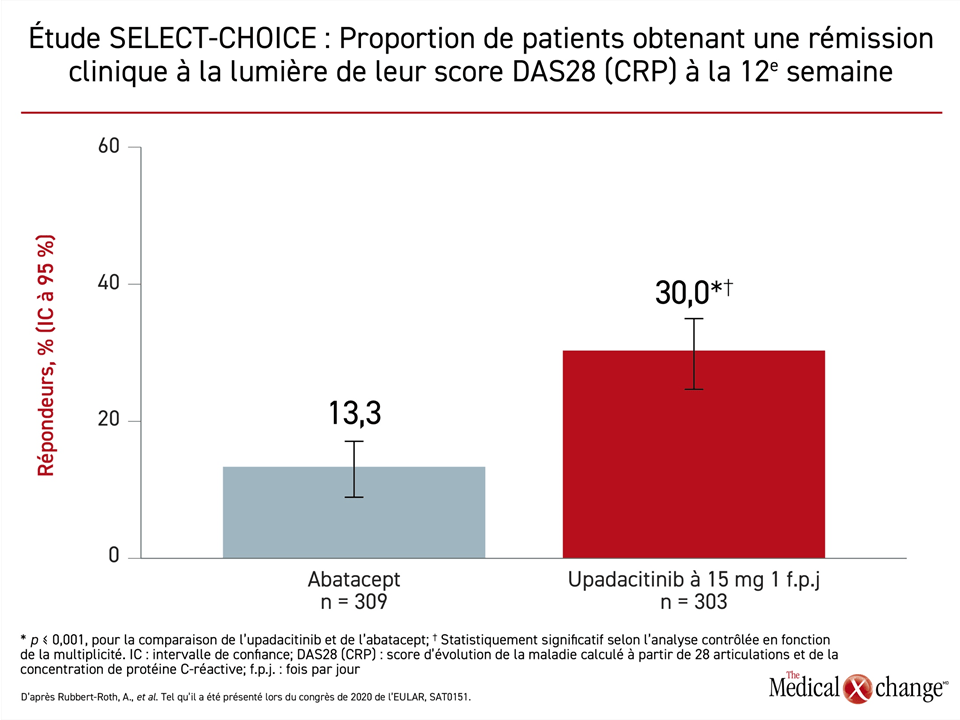
Le nouvel essai comparatif intitulé SELECT-CHOICE a porté sur 612 patients atteints de PR réfractaires à au moins un antirhumatismal de fond biologique ou ne les ayant pas tolérés, qui ont été répartis aléatoirement en deux groupes de façon à recevoir la dose homologuée de 15 mg d’upadacitinib une fois par jour par voie orale ou de l’abatacept par voie intraveineuse aux intervalles posologiques types. Le paramètre d’évaluation principal était le score d’activité pathologique calculé pour 28 articulations (DAS28 [CRP]) à 12 semaines.
Il s’agissait bien d’un essai de non-infériorité, mais la proportion de patients ayant obtenu un score DAS28 (CRP) inférieur à 2,6 à 12 semaines était plus de deux fois plus élevée dans le groupe traité par l’upadacitinib à prise orale (30 % vs 13,3 %; p < 0,001) (Figure 1). Le seuil fixé pour la supériorité a donc été franchi, selon la Dre Andrea Rubbert-Roth, de la Division de rhumatologie, de la Clinique cantonale St-Gallen, en Suisse.
Selon la Dre Rubbert-Roth, en prouvant la supériorité de l’upadacitinib à 15 mg sur un agent biologique, cet essai nous renseigne sur ses bienfaits et les risques qu’il comporte.
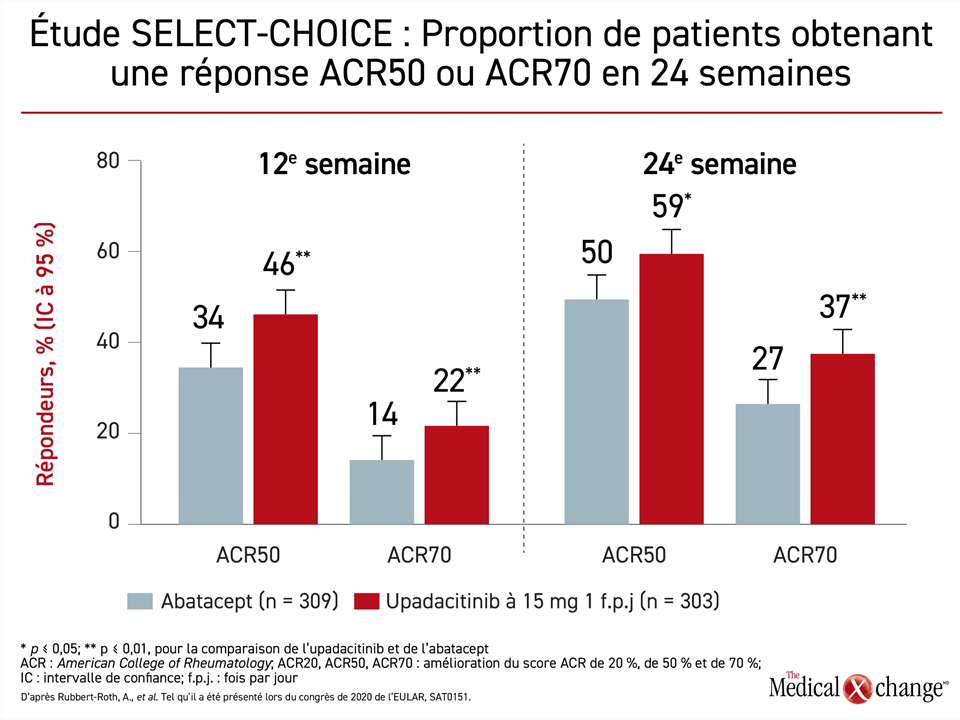
L’avantage noté pour le paramètre d’évaluation principal s’est reflété dans plusieurs autres mesures des bienfaits cliniques. Ainsi, l’avantage significatif de l’upadacitinib objectivé à 12 semaines (p < 0,01) a persisté jusqu’à la 24e pour les paramètres d’évaluation suivants : un indice CDAI (Clinical Disease Activity Index) maximal de 2,8 et un indice SDAI (Simplified Disease Activity Index) maximal de 3,3. De plus, à 12 et à 24 semaines, la proportion de patients traités par l’upadacitinib ayant manifesté une réponse ACR50 ou ACR70 était significativement plus élevée que chez les patients traités par l’abatacept (Figure 2).
Soulagement rapide de la douleur
L’upadacitinib a soulagé la douleur plus rapidement que l’abatacept; l’écart entre les deux est devenu significatif dès la 2e semaine et l’est resté jusqu’à la 12e. Quant aux critères physiques du questionnaire SF-36 sur la qualité de vie, l’écart entre les deux l’est devenu dès la 12e semaine (p < 0,001) et l’était toujours à la 24e (p = 0,02). En outre, l’avantage relatif enregistré par l’upadacitinib pour l’atteinte d’une amélioration d’au moins 0,22 point au questionnaire HAQ-DI (Health Assessment Questionnaire – Disability Index) était significatif à 12 semaines (p < 0,01).
Prolongation de longue durée de l’essai SELECT-COMPARE
Il existe encore peu d’essais comparant directement des traitements ciblés contre les formes modérées ou graves de PR, mais un essai intitulé SELECT-COMPARE a démontré la supériorité de l’upadacitinib sur l’adalimumab à 48 semaines, les deux agents étant alliés au méthotrexate (Fleischmann, R.M., et al. Ann Rheum Dis 2019;78:1454-1462). Or cet avantage relatif demeure pendant la phase de prolongation de longue durée de cet essai qui a été présentée lors du congrès en ligne de 2020 de l’EULAR.
« En regard du score CDAI de 2,8 ou moins, la proportion de patients prenant de l’upadacitinib et du méthotrexate ayant obtenu une rémission clinique soutenue jusqu’à la 72e semaine a été significativement plus élevée [p = 0,004] que celle des sujets traités par l’adalimumab et du méthotrexate », a rapporté le Dr Peter Nash, de l’Université Griffith, de Brisbane, en Australie. Les chercheurs ont fait le même constat après la 72e semaine pour la faiblesse de l’évolution pathologique, qu’elle ait été définie par un score DAS28 (CRP) inférieur à 2,6 ou de 3,2 ou moins (p < 0,001 dans les deux cas).
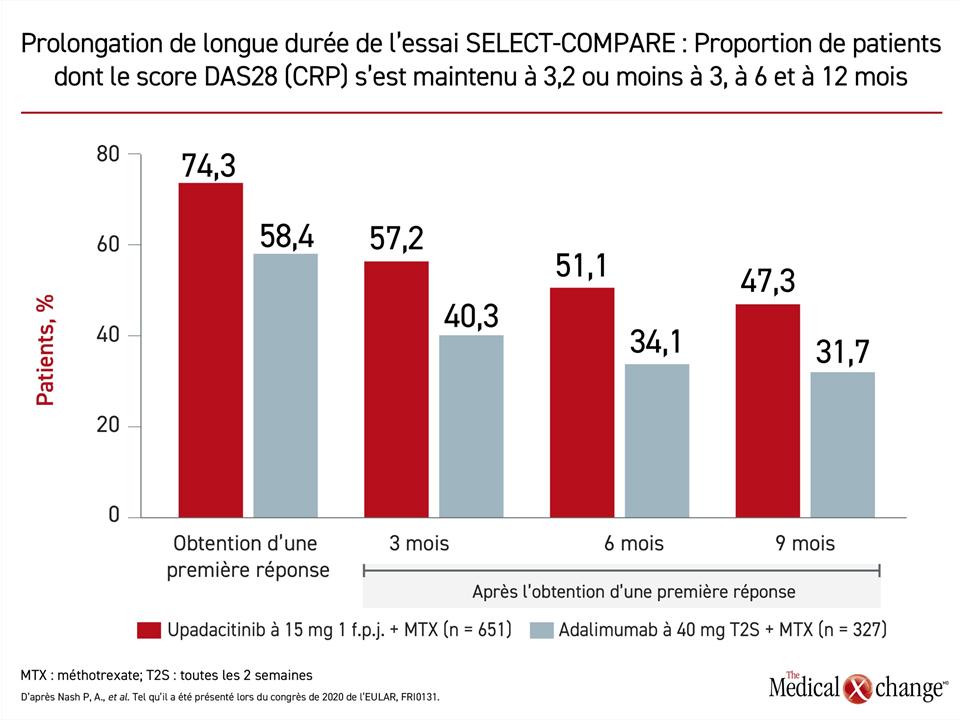
Taux de réponse : avantage soutenu pendant plus de 12 mois
Pendant les 48 premières semaines de l’essai, non seulement la proportion de patients répondant au traitement a-t-elle été plus élevée dans le groupe traité par l’upadacitinib, peu importe les paramètres d’évaluation mesurés, mais le suivi prolongé a également fait ressortir des taux de réponse soutenue supérieurs. Par exemple, 74,3 % des patients traités par l’upadacitinib ont obtenu un score DAS28 (CRP) de 3,2 ou moins pendant l’essai comparativement à 58,4 % de ceux ayant reçu l’adalimumab, mais pendant les 12 mois suivants, la proportion de sujets qui ont continué de répondre au traitement est toujours restée plus forte dans le groupe upadacitinib, même si elle s’est atténuée au fil du temps dans les deux groupes (Figure 3).
Cet avantage de l’upadacitinib sur l’inhibiteur du TNF n’a pas été observé dans d’autres essais comparatifs portant sur un inhibiteur des JAK administré à la dose homologuée au Canada. La comparaison du tofacitinib et de l’adalimumab a révélé que ces deux agents étaient supérieurs au placebo, mais aucun des deux ne s’est démarqué significativement pour les trois paramètres d’évaluation principaux (van Vollenhoven, R.F., et al.N Engl J Med 2012;367:508-519). Le baricitinib a eu le dessus sur l’adalimumab pour ce qui est du taux de réponse ACR20 (p = 0,014), mais la dose étudiée était de 4 mg (Taylor, P.C., et al. N Engl J Med 2017;376:652-662), soit le double de la dose quotidienne actuellement homologuée pour le traitement de la RA au Canada.
Si les données de l’essai SELECT-COMPARE collectées à 72 semaines confirment le bien-fondé de l’utilisation de l’upadacitinib chez les patients ayant obtenu des résultats insatisfaisants avec des antirhumatismaux de fond de synthèse classiques, l’essai SELECT-CHOICE quant à lui confirme que cet agent est une option raisonnable pour les patients réfractaires aux antirhumatismaux de fond biologiques ou qui ne les tolèrent pas. Les données comparatives applicables à l’une ou l’autre de ces situations étant rares, ces observations apportent heureusement des données objectives pour orienter le choix d’un traitement.
Comparaison de l’innocuité avec celle de produits actifs
Selon les données recueillies pendant ces essais et dans le cadre du programme clinique de phase III dans son ensemble, le taux d’effets indésirables provoqués par l’upadacitinib était faible et acceptable. Lors de l’essai SELECT-CHOICE, les taux d’infections graves (1,0 % vs 0,3 %) et d’infections opportunistes (1,3 % vs 0,3 %) étaient plus élevés dans le groupe upadacitinib que dans le groupe abatacept, mais force est de constater qu’ils étaient bas dans les deux groupes. L’incidence des cas de zona était la même dans les deux groupes (1,3 %). Le taux d’abandon du traitement pour cause d’effet indésirable était plus élevé dans le groupe upadacitinib (4,6 % vs 2,9 %), mais il demeure qu’il était inférieur à 5 % dans les deux groupes.
Les données collectées à 72 semaines de l’essai de prolongation de longue durée de l’essai SELECT-COMPARE ont fait ressortir des résultats semblables. Exprimées en tant qu’effets indésirables survenus pendant le traitement par tranche de 100 années-patients de suivi, les infections graves (3,7 vs 4,3) étaient légèrement moins fréquentes avec l’upadacitinib qu’avec l’adalimumab, mais les infections opportunistes (0,9 vs 0,6) l’étaient un peu plus. Les taux de néoplasie (0,4 vs 0,8), d’incidents cardiaques majeurs (0,4 vs 0,6) et de thromboembolie veineuse (TEV : 0,3 vs 1,0) étaient plus bas dans le groupe upadacitinib, mais encore là, les taux étaient déjà faibles dans les deux groupes.
« Grâce au suivi plus long, on constate que le bilan d’innocuité de l’upadacitinib établi par comparaison à l’adalimumab reste en phase avec celui dressé à partir des données rapportées antérieurement », a déclaré le Dr Roy Fleischmann, Professeur clinicien de rhumatologie, à l’École de médecine de l’Université du sud-ouest du Texas, à Dallas. Par rapport à l’adalimumab, « l’upadacitinib allié à un traitement de fond par le méthotrexate est doté d’un rapport favorable entre les bienfaits qu’ils exercent et les risques qu’il comporte ».
Analyse détaillée de l’innocuité à partir des données groupées
Au Canada, l’homologation de l’upadacitinib et du baricitinib a été accordée à la lumière de l’innocuité acceptable de ces agents pendant les essais contrôlés, mais le faisceau important de nouvelles données sur l’innocuité de l’upadacitinib présenté lors du congrès en ligne de 2020 de l’EULAR a permis d’étudier en profondeur plusieurs problèmes d’innocuité particuliers qui avaient été soulevés pendant le programme clinique, notamment un lien possible avec la thromboembolie veineuse. En outre, les données collectées à plus long terme étant devenues disponibles, il a été possible d’évaluer le risque d’effets retardés chez les patients suivant un traitement chronique.
L’analyse de l’innocuité la plus appréciable a été réalisée à partir des données de cinq essais à répartition aléatoire, qui comprenaient, en plus de l’essai SELECT-COMPARE, deux essais ayant porté sur l’upadacitinib en monothérapie (essais SELECT-EARLY et SELECT-MONOTHERAPY) et deux autres sur l’upadacitinib allié à des antirhumatismaux de fond de synthèse classiques (essais SELECT-NEXT et SELECT-BEYOND). Certains des participants à ces essais sont suivis depuis trois ans maintenant. Plusieurs de ces essais ont servi à évaluer la dose de 30 mg d’upadacitinib, ce qui n’a pas été mentionné, mais les données sur cette dose plus élevée ont permis de rechercher d’éventuels effets indésirables ayant un lien avec la durée de l’exposition à ce médicament.
Ce qui est surtout ressorti de cette analyse, qui a porté sur les données de 2629 patients traités au moyen de la dose de 15 mg (4566 années-patients de suivi) et de 1204 patients traités avec celle de 30 mg (2310 années-patients de suivi), c’est l’absence de tout effet indésirable tardif, inattendu ou jusqu’alors inconnu.
Aucun nouveau signal d’alarme concernant l’innocuité à long terme
« L’actualisation de notre analyse de l’innocuité a généré des données comparables à celles tirées des analyses précédentes. Nous n’avons recensé aucun risque inconnu jusqu’à maintenant », a affirmé son auteur principal, le Dr Gerd R. Burmester, Directeur du Département de rhumatologie, de l’Hôpital universitaire La Charité, de Berlin en Allemagne.
Comme les essais antérieurs menés avec les doses de 15 et de 30 mg d’upadacitinib avaient permis de le constater, la dose de 30 mg a été reliée à un risque plus élevé d’infections graves ou opportunistes, mais cette différence avait disparu lorsque la dose de 15 mg a été comparée au méthotrexate utilisé en monothérapie ou avec de l’adalimumab à partir des données groupées. Le Dr Burmester a également rapporté que la nature des infections graves analysées en détail « cadrait avec celle des infections à prévoir chez les patients atteints de PR ».
L’incidence des cas de zona répertoriés avec l’upadacitinib était élevée par rapport à celle observée avec le méthotrexate en monothérapie ou l’adalimumab.
L’incidence des cas de zona pour 100 années-patients s’élevait à 3,4 pour la dose de 15 mg d’upadacitinib comparativement à moins de 1,5 avec les agents de comparaison. Cela dit, on n’a déploré aucun cas de méningite consécutive au zona avec la dose de 15 mg et 95 % de tous les cas de zona ont été considérés comme « bénins ». Selon le Dr Burmester, les facteurs de risque recensés étaient les suivants : être d’origine asiatique, être âgés de 50 ans ou plus et avoir des antécédents de zona.
Aucune hausse des taux de TEV n’a été observée
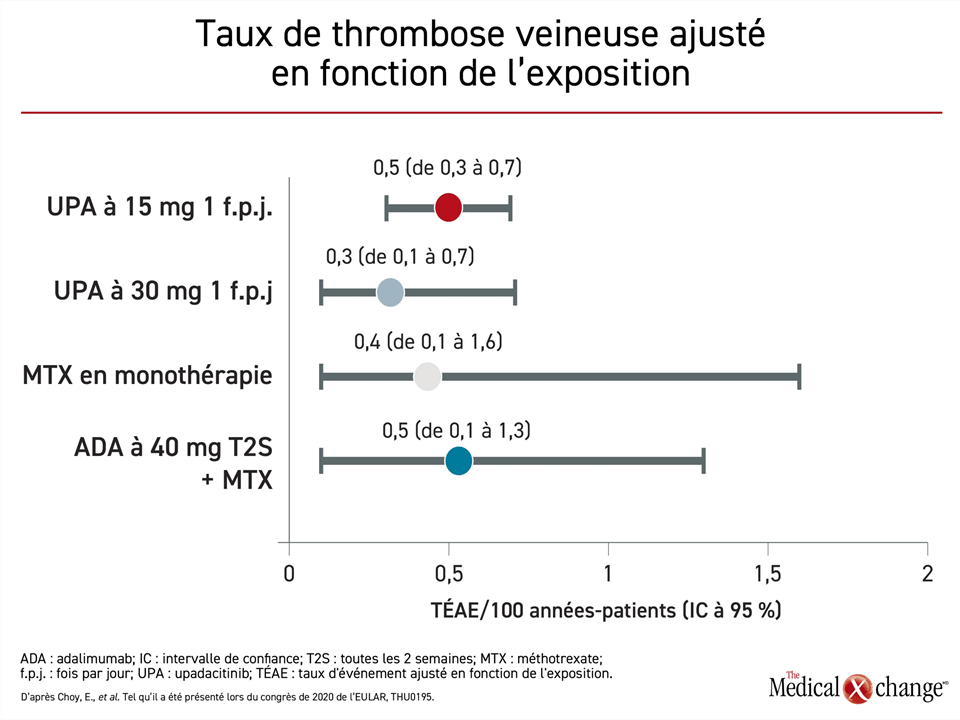
D’après cette analyse des données groupées, les taux de TEV et d’incidents cardiaques majeurs étaient similaires que les patients aient été traités à l’aide d’upadacitinib, d’adalimumab ou de méthotrexate. Or une autre analyse, plus détaillée celle-là, a été réalisée après que des rapports de cas portent à croire que le risque de TEV pourrait être plus grand chez les patients exposés aux inhibiteurs des JAK. En partant de la même série de cinq essais et en utilisantdes taux d’événements ajustés en fonction de l’exposition (TÉAE) pour comparer les taux enregistrés dans les différents groupes de sujets, on obtient des TÉAE/100 années-patients de 0,3, de 0,4, de 0,5 et de 0,5 pour les groupes traités par l’upadacitinib à 30 mg, par le méthotrexate, par l’upadacitinib à 15 mg et par l’adalimumab, respectivement (Figure 4).
« Les taux de TEV ont semblé stables entre les doses d’upadacitinib et les agents auxquels elles étaient comparées », a souligné le Dr Ernest Choy, du Centre CREATE, de l’Université de Cardiff, à Cardiff, au R.-U. Comme on pouvait s’y attendre, les antécédents de TEV et un indice de masse corporelle relativement élevé se sont révélés des facteurs prévisionnels de TEV, mais la proportion de patients présentant ces facteurs de risque ne variait pas d’un groupe de traitement à l’autre.
L’analyse des données groupées a également permis de constater que certains effets indésirables étaient plus fréquents avec l’upadacitinib à 15 mg qu’avec les agents auxquels il était comparé, mais l’importance de ces observations sur le plan clinique était incertaine. Par exemple, l’upadacitinib a entraîné des hausses des taux de créatine kinase (CK) plus marquées que les agents auxquels il était comparé, comme ce fut le cas aussi de certaines cytopénies, notamment la lymphopénie. Ces observations n’ont pas été reliées à des manifestations cliniques graves. Selon le Dr Burmester, la poursuite du suivi et les études de pharmacosurveillance permettront d’examiner les risques relatifs plus en profondeur, mais les données réunies à ce jour sont rassurantes.
Conclusion
L’upadacitinib, qui a été homologué récemment au Canada, est le premier inhibiteur sélectif des JAK à prise orale qui se soit montré supérieur à l’adalimumab chez des patients atteints d’une forme modérée ou grave de PR réfractaire aux antirhumatismaux de fond de synthèse classiques ainsi qu’à l’abatacept chez des patients réfractaires aux antirhumatismaux de fond biologiques ou ne les tolérant pas. Il s’agit, semble-t-il, d’un agent polyvalent exerçant une activité à tout le moins égale à celle des médicaments injectables. Au terme d’un suivi de trois ans, son bilan d’innocuité et de tolérabilité n’a pas dévié de celui dressé lors des essais de phase III déterminants. Les données confirment que l’upadacitinib constitue une option alliant commodité et tolérabilité acceptable pour les types de patients chez lesquels il a été étudié.