Rhumatologie
Congrès en ligne de 2020 de la Ligue européenne contre le rhumatisme (EULAR)
Essai d’inhibiteurs sélectifs des JAK pour maîtriser le rhumatisme psoriasique
Congrès en ligne – Le premier de deux essais de phase III sur le traitement du rhumatisme psoriasique (RPs), qui a fait l’objet d’une présentation de dernière minute lors du congrès en ligne de 2020 de l’EULAR et qui a servi à comparer directement un inhibiteur sélectif des JAK et un inhibiteur du facteur de nécrose tumorale (TNF), laisse entrevoir un éventail élargi d’indications pour les agents associés à la sous-classe des inhibiteurs sélectifs des JAK, dont deux ont été récemment homologués au Canada pour le traitement de la polyarthrite rhumatoïde (PR).
Les agents ciblés actuellement opposés à la RPs sont surtout des anticorps monoclonaux injectables inhibant le TNF ou d’autres cytokines pro-inflammatoires. Fait exception le tofacitinib, un inhibiteur des JAK de première génération à prise orale indiqué contre la RPs. Or les patients ne répondent pas tous aux agents offerts et bon nombre de ceux qui y réagissent favorablement y deviennent réfractaires au fil du temps. Les nouveaux inhibiteurs des JAK à prise orale ont été créés pour cibler les sous-types de JAK les plus étroitement liés à l’inflammation.
Les données tirées d’essais sur le filgotinib et l’upadacitinib, des inhibiteurs des JAK, ont été présentées lors du congrès. L’un d’eux était un essai de phase III mené chez des patients réfractaires aux antirhumatismaux de fond biologiques ou ne les tolérant pas. Les données sur le filgotinib, un inhibiteur sélectif des JAK expérimental, ont été tirées de l’essai ouvert EQUATOR2 mené à la suite de l’essai de phase II EQUATOR. Celles sur l’upadacitinib, qui à l’instar du baricitinib est désormais indiqué contre la PR au Canada, ont fait l’objet d’une présentation de dernière minute et sont issues d’un essai de phase III mené chez des patients n’ayant jamais reçu d’agents ciblés.
Ces données sont parlantes. Lors de l’essai multinational SELECT-PsA 1 présenté à la dernière minute, l’upadacitinib administré à la plus forte des deux doses étudiées l’a emporté sur l’agent de comparaisons, un inhibiteur du TNF.
Selon le Dr Iain B. McInnes, Directeur de l’Institut de recherche sur les infections, l’immunité et l’inflammation, de l’Université de Glasgow, au R.-U. : « La dose uniquotidienne de 30 mg d’upadacitinib à prise orale s’est révélée supérieure à l’adalimumab » chez des patients réfractaires à des antirhumatismaux de fond de synthèse non biologiques classiques.
Lors de cet essai, 1704 patients ont été affectés aléatoirement à la dose uniquotidienne de 15 ou de 30 mg d’upadacitinib, à un traitement type de 40 mg d’adalimumab pris une semaine sur deux ou à un placebo. Au départ, les caractéristiques des sujets, dont un IMC moyen légèrement supérieur à 30 et une RPs remontant à 6 ans en moyenne environ, étaient réparties de manière équilibrée entre les groupes.
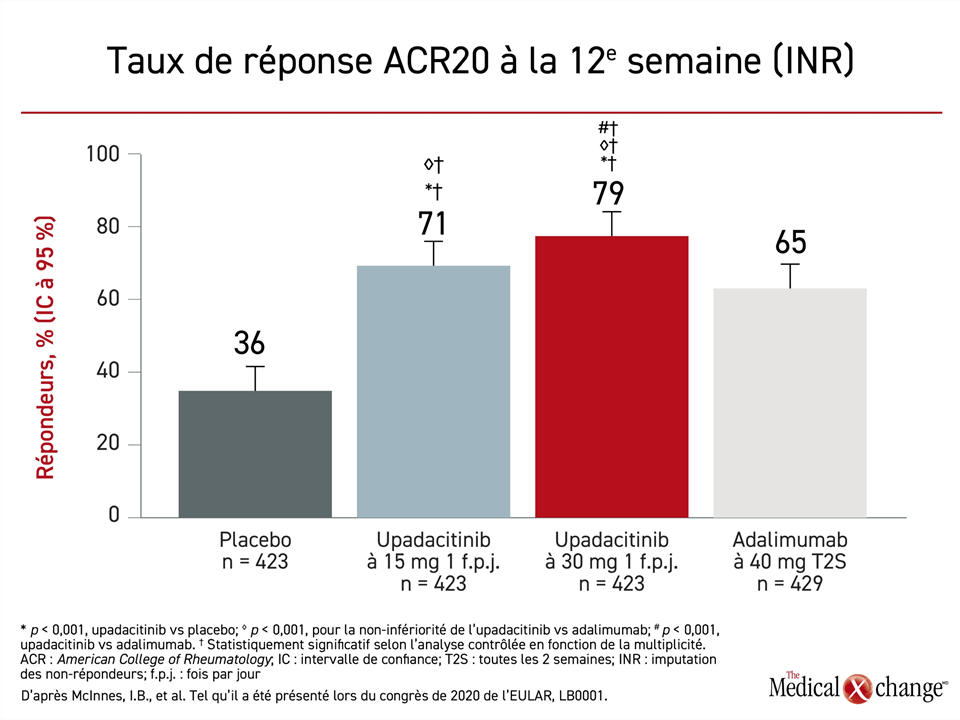
Pour ce qui est du taux de réponse ACR20, le paramètre d’évaluation principal composé entre autres d’une baisse de 20 % des articulations enflées et douloureuses, les trois agents actifs se sont révélés significativement plus efficaces que le placebo, mais les deux doses d’upadacitinib ont eu un avantage à tout le moins numérique sur l’adalimumab (Figure 1). L’efficacité de la dose faible d’upadacitinib s’est révélée non inférieure à celle de l’adalimumab sans problème (p < 0,001) et celle de la dose élevée a été significativement supérieure (p < 0,001).
« L’efficacité de la dose faible d’upadacitinib s’est révélée non inférieure à celle de l’adalimumab sans problème et celle de la dose élevée a été significativement supérieure. »
Des résultats du même ordre ont été obtenus pour ce qui est des taux de réponse ACR50 et ACR70. Dans les deux cas, le taux obtenu avec la dose de 30 mg d’upadacitinib était supérieur à celui produit par l’adalimumab (p < 0,001). En outre, la dose de 15 mg d’upadacitinib a continué d’avoir un avantage numérique sur l’adalimumab à ce chapitre, mais il n’était pas significatif.
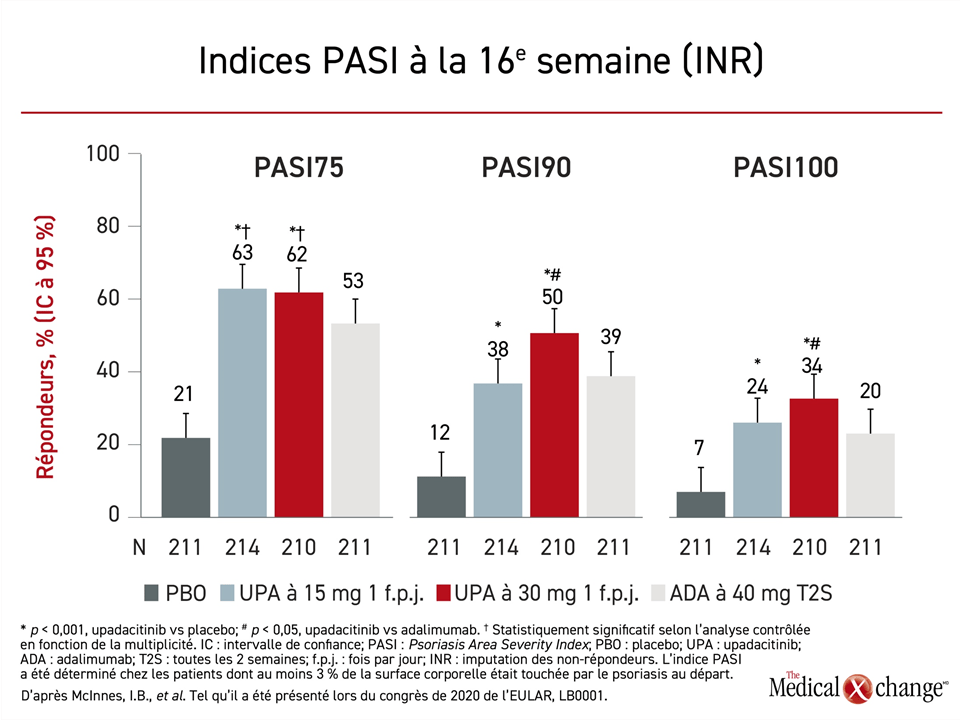
Quant à la composante cutanée de la RPs évaluée à l’aide de l’indice PASI (Psoriasis Area and Severity Index), l’avantage que la dose de 30 mg d’upadacitinib a eu sur l’adalimumab pour les indices PASI90 et PASI100 était statistiquement significatif (p < 0,05), mais pas l’avantage numérique noté avec les deux doses d’upadacitinib pour l’indice PASI75 (Figure 2).
L’activité pathologique minimale
À la 24e semaine, 37 % et 45 % des patients ayant reçu les doses de 15 et de 30 mg d’upadacitinib affichaient une activité pathologique minimale par rapport à 33 % des sujets traités par l’adalimumab. La différence entre la dose de 30 mg et l’inhibiteur du TNF était statistiquement significative (p < 0,001). À la 12e semaine, cette dose a également marqué le même avantage relatif pour l’indice fonctionnel HAQ-DI (Health Assessment Questionnaire – Disability Index) et pour les résultats obtenus au questionnaire SF-36 sur la qualité de vie et à l’échelle de la douleur (p < 0,001 pour toutes les comparaisons). Dans tous les cas, le taux de réponse obtenu avec la dose de 15 mg était plus élevé, mais la différence avec l’adalimumab n’était pas significative.
Au moment de leur recrutement, environ 30 % des patients étaient atteints de dactylite et 60 %, d’enthésite. La dactylite a disparu chez plus de 75 % des patients, peu importe le traitement actif suivi. La réponse obtenue avec l’upadacitinib était plus élevée numériquement que celle enregistrée avec l’adalimumab, mais la différence n’était pas significative sur le plan statistique. Quant à l’enthésite, le taux de réponse plus élevé dans le groupe traité par l’upadacitinib à 30 mg par rapport au groupe adalimumab était statistiquement significatif (58 % vs 47 %; p < 0,05), mais pas le taux de 54 % de disparition obtenu dans le groupe ayant reçu l’upadacitinib à 15 mg.
Des taux d’effets indésirables différents
Les taux d’abandon pour cause d’effet indésirable étaient faibles et comparables chez les sujets traités par l’upadacitinib à 30 mg et chez ceux ayant reçu l’adalimumab (5,0 % vs 5,1 %), mais les premiers comptaient plus de victimes d’effets indésirables graves que les seconds (6,1 % vs 3,7 %). Le taux d’abandon était plus faible dans le groupe traité par l’upadacitinib à 15 mg que dans l’un ou l’autre des deux autres groupes de traitement actif, tant pour les effets indésirables en général (3,1 %) que pour les effets indésirables graves (3,1 %).
Après avoir comparé les effets indésirables graves recensés, les chercheurs ont constaté que la différence entre l’upadacitinib à 30 mg et l’adalimumab s’expliquait par un nombre plus élevé d’infections graves et opportunistes, comme le zona (4,3 % vs 0,7 %). Un taux global similaire avait été observé pendant l’essai de phase III SELECT-COMPARE ayant servi à comparer ces deux agents dans le traitement de la PR. Là encore, le zona s’était révélé plus répandu avec l’upadacitinib, mais dans l’ensemble, les taux étaient bas, la plupart des cas étant bénins et aucun n’ayant affiché d’atteinte extracutanée.
Faisant référence aux essais de phase III antérieurs sur l’upadacitinib dans le traitement de la PR, le Dr McInnes a affirmé que les résultats obtenus avec cet agent pendant l’essai SELECT-PsA 1 « cadraient avec le bilan d’innocuité qu’on lui connaît déjà et n’ont rien fait ressortir de nouveau à ce chapitre ».
Aucun essai d’envergure à répartition aléatoire n’avait encore documenté l’effet supérieur d’un inhibiteur des JAK sur un inhibiteur du TNF.
L’essai SELECT-PsA 2, le deuxième essai de phase III sur l’upadacitinib dans le traitement de la RPs, aussi présenté lors du congrès de 2020 de l’EULAR, ne comportait pas d’agent de comparaison, mais l’échec d’au moins un agent de fond biologique ou l’intolérance à un tel agent comptaient parmi ses critères d’admissibilité. Les caractéristiques des sujets ne variaient pas significativement au départ d’un groupe à l’autre; en moyenne, leur RPs remontait à une dizaine d’années et ils avaient 53 ans environ. Le paramètre d’évaluation principal était le taux de réponse ACR20.
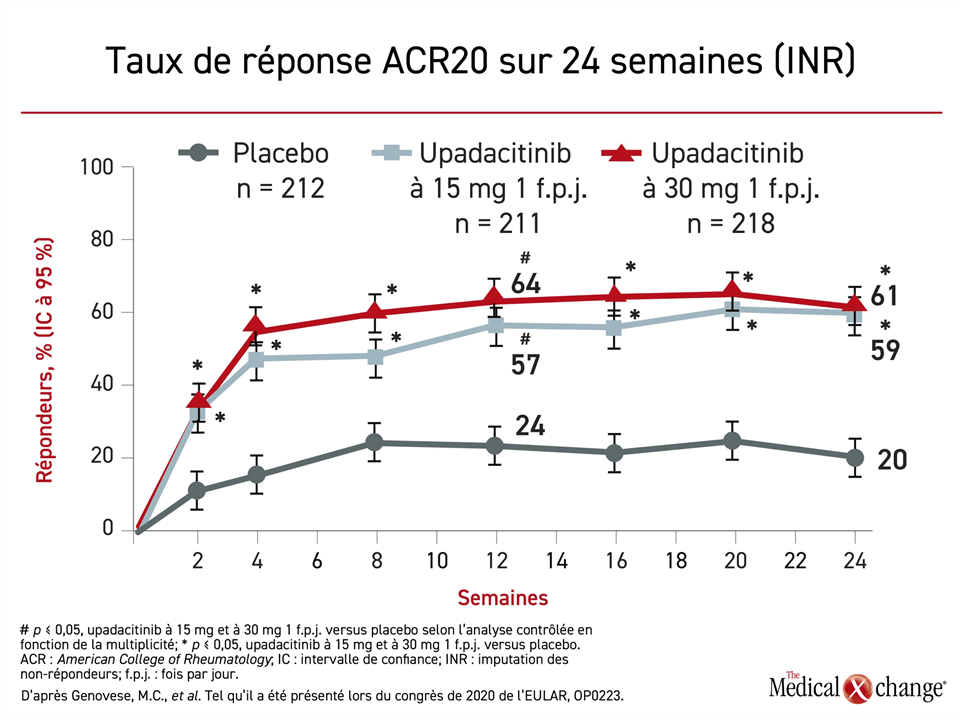
Les deux doses d’upadacitinib (15 et 30 mg) se sont montrées significativement plus efficaces que le placebo au bout de 2 semaines et le sont restées pendant tout le suivi de 24 semaines, selon le Dr Philip J. Mease, Directeur de la recherche en rhumatologie, au Centre médical Swedish, de l’Université de l’état de Washington, à Seattle (Figure 3). Un avantage similaire a été observé pour les taux de réponse ACR50 et ACR70.
Activité pathologique chez les patients déjà traités contre leur RPs
Des réductions cliniquement significatives de l’activité pathologique ont été « objectivées dans tous les domaines principaux », a signalé le Dr Mease, insistant sur le fait que l’avantage de l’upadacitinib sur le placebo a été constaté en deux semaines.
« La supériorité de l’efficacité de l’inhibiteur des JAK sur celle de l’inhibiteur du TNF a été objectivée dans tous les domaines principaux. »
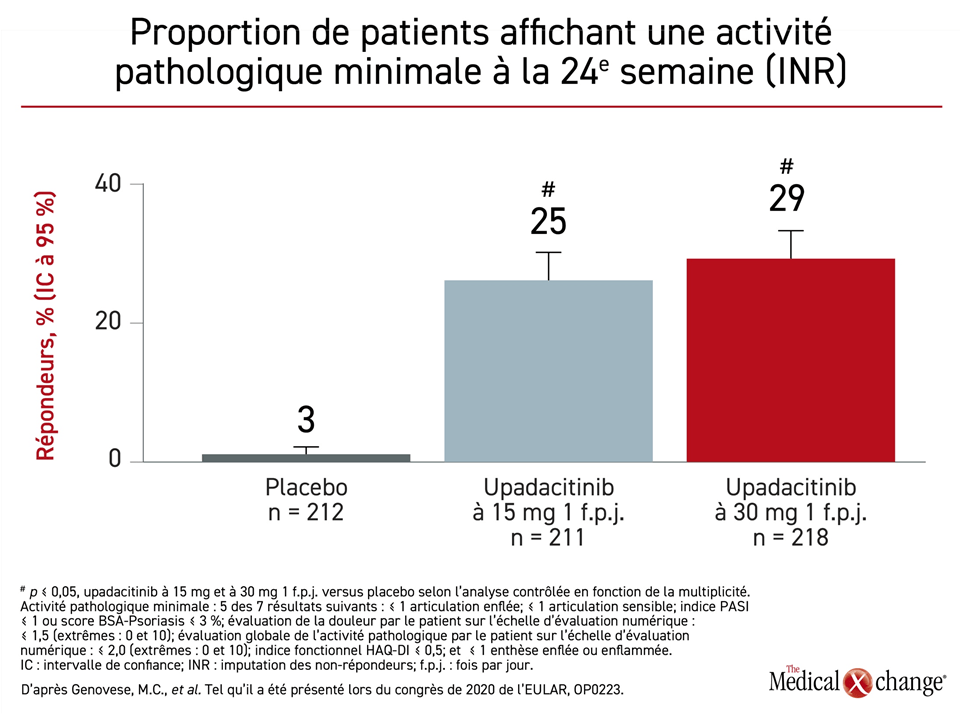
À la 24e semaine, une activité pathologique minimale, se définissant essentiellement par l’obtention de scores de symptomatologie bas ou par l’absence de symptômes corroborée par plusieurs mesures, dont les indices PASI et HAQ-DI, a été constatée chez 3 %, 25 % et 29 % des sujets des groupes témoin, upadacitinib à 15 mg et upadacitinib à 30 mg. L’avantage des deux doses d’upadacitinib sur le placebo était significatif (p < 0,05) (Figure 4).
Les deux doses d’upadacitinib se sont également montrées supérieures au placebo pour de nombreux paramètres d’évaluation secondaires pris individuellement, dont l’indice fonctionnel HAQ-DI (p < 0,05) et les résultats au questionnaire SF-36 (p < 0,05), au questionnaire FACIT-F (Functional Assessment of Chronic Illness Therapy – Fatigue) (p < 0,01), à l’échelle ISGA (Investigator Static Global Assessment) pour le psoriasis (p < 0,05) et au questionnaire SAPS (Self-Assessment of Psoriasis Symptoms) (p < 0,05).
Au début de l’essai, environ 25 % des patients étaient atteints de dactylite et 65 %, d’enthésite. À la 24e semaine, la dactylite avait disparu chez seulement 28 % des témoins comparativement à 58 % des sujets affectés à l’upadacitinib à 15 mg et à 68 % de ceux affectés à l’upadacitinib à 30 mg (p < 0,05 vs le placebo dans les deux cas). L’enthésite est disparue chez 15 % des témoins par rapport à 43 % et 45 % des sujets des groupes upadacitinib à 15 et à 30 mg (p < 0,05 vs le placebo dans les deux cas).
Effets indésirables : 30 mg vs 15 mg
Les abandons du traitement attribué pour cause d’effet indésirable ont été plus nombreux chez les sujets traités par l’upadacitinib à 30 mg (9,2 %) que chez ceux prenant la dose de 15 mg de cet agent (7,1 %) ou le placebo (5,2 %). Ce fut aussi le cas des effets indésirables graves (8,3 % vs 5,7 % vs 1,9 % respectivement), ce qui s’explique, entre autres, par la fréquence plus grande d’infections graves (2,8 % vs 0,5 % vs 0,5 %, respectivement).
Pendant cette étude, le seul cas de thromboembolie veineuse a été observé chez un patient affecté à la dose de 15 mg d’upadacitinib et le seul décès est survenu chez un témoin. Les anomalies biologiques de grade 3 ou plus, telles que des valeurs évoquant un dysfonctionnement hépatique ou des cytopénies, étaient peu répandues dans les trois groupes.
Selon le Dr Mease, les résultats obtenus pour l’innocuité lors de l’essai SELECT-PsA 2 cadraient avec le bilan d’innocuité reconnu de l’upadacitinib dans le traitement de la polyarthrite rhumatoïde, comme ce fut d’ailleurs le cas pendant l’essai SELECT-PsA 1, et n’ont rien fait ressortir de nouveau à ce chapitre.
« Les résultats obtenus pour l’innocuité lors de l’essai SELECT-PsA 2 cadraient avec le bilan d’innocuité reconnu de l’upadacitinib dans le traitement de la polyarthrite rhumatoïde. »
Lors de la mise à jour des données à la 52e semaine de l’essai EQUATOR2 sur le filgotinib, l’état de 122 des 131 patients ayant participé à l’essai EQUATOR, un essai de phase II de 16 semaines mené avec contrôle placebo, a été évalué sous l’angle de l’efficacité et de l’innocuité du traitement. Les patients affectés d’emblée à la dose uniquotidienne de 200 mg de filgotinib avaient continué de prendre cette dose, alors que les témoins avaient remplacé le placebo par le traitement actif.
Sur les 11 patients qui ne suivaient plus leur traitement à la 52e semaine, 3 seulement l’ont fait en raison d’un effet indésirable, les autres étant revenus sur leur décision de participer à l’essai. Les chercheurs ont constaté que depuis la fin de la phase à double insu à la 16e semaine où le taux de réponse ACR20 s’élevait à 86,7 % (versus 33,3 % dans le groupe placebo), les sujets avaient continué de répondre au traitement, puisqu’à 52 semaines, ce taux se chiffrait à 83,3 % chez les sujets affectés au filgotinib et à 78,6 % chez ceux d’abord affectés au placebo, puis passés au filgotinib, a rapporté la Dre Dafna D. Gladman, Professeure de médecine à l’université de Toronto, en Ontario.
Elle a ajouté que d’autres mesures, dont le taux de réponse ACR50 et l’activité pathologique minimale, ont témoigné de taux de réponse soutenue semblables. Pendant la période de suivi prolongée, rien n’a laissé soupçonner un quelconque problème d’innocuité inattendu ou inconnu jusque-là.
Dans l’ensemble, les données tirées des essais à répartition aléatoire indiquent que les inhibiteurs sélectifs des JAK exercent des bienfaits cliniques considérables dans les cas de RPs et pourraient donc être un ajout important à l’éventail d’agents ciblés à prise orale contre cette maladie.
Conclusion
Les nouveaux inhibiteurs sélectifs des JAK ont fait la preuve de leur grande efficacité et de leur bilan d’innocuité acceptable dans le traitement de la RPs au cours d’essais à répartition aléatoire. Dans le cadre d’un essai de phase III sur l’upadacitinib à prise orale, la dose de 15 mg a donné des résultats à tout le moins aussi bons que ceux de l’adalimumab, un inhibiteur du TNF injectable, et celle de 30 mg a significativement surpassé l’adalimumab pour de nombreux paramètres d’évaluation. En outre, pendant l’essai ouvert mené à la suite d’un essai de phase II portant sur un agent expérimental, le filgotinib, ce dernier est resté efficace jusqu’à la 52e semaine sans lancer de signaux d’alarme inattendus en matière d’innocuité. Les données probantes confirment que ces agents pourraient avoir leur place dans le traitement d’une maladie complexe.