Oncologie
Thromboembolie veineuse : revue d'experts et commentaires tirés de la littérature
Prévention de la TEV après une chirurgie gynécologique
Danielle Vicus, M.D., M.Sc.
Professeure agrégée, Département d’obstétrique et de gynécologie, Université de Toronto
Scientifique attachée à l’Institut de recherche Sunnybrook
Gynécologue oncologue, Centre de cancérologie Odette, Centre des sciences de la santé Sunnybrook
Toronto (Ontario)
La thromboembolie veineuse (TEV) est une complication fréquente et parfois mortelle des interventions chirurgicales gynécologiques, surtout dans les cas de cancer. À preuve, le taux de décès postopératoires est plus de deux fois plus élevé chez les patientes qui présentent une TEV que chez celles qui en sont exemptes1. Lorsqu’elle n’est pas mortelle, la TEV peut laisser des séquelles comme le syndrome post-thrombotique (SPT) qui s’exprime par un œdème et une douleur chroniques2. C’est pourquoi la prophylaxie mécanique (bas de contention élastiques ou dispositifs de compression séquentielle) jumelée à une prophylaxie pharmacologique prolongée au moyen d’héparine de faible poids moléculaire (HFPM) est recommandée chez toutes les patientes subissant une intervention chirurgicale gynéco-oncologique.
Risque de TEV et chirurgie gynéco-oncologique
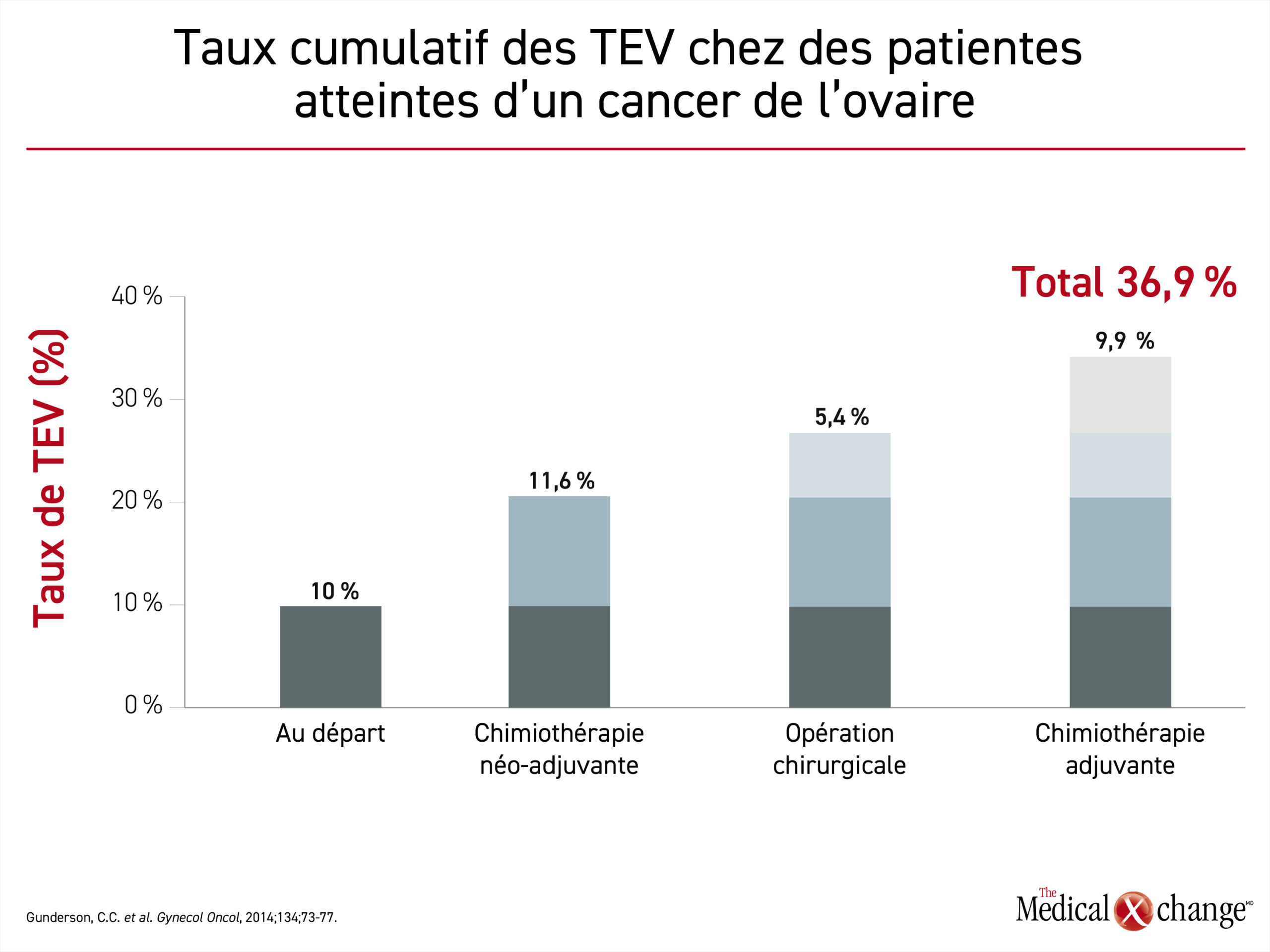
La TEV d’importance clinique comprend la thromboembolie veineuse profonde (TVP) et l’embolie pulmonaire (EP). La triade de Virchow en illustre les facteurs étiologiques classiques : l’altération de l’endothélium vasculaire, la stase veineuse et l’hypercoagulabilité. Une étude portant sur plus de 1200 victimes d’une TEV a montré que le risque était multiplié par 10 chez celles ayant subi une chirurgie lourde et qu’il l’était encore plus chez les malades du cancer ou présentant d’autres facteurs de risque tels qu’un âge supérieur à 40 ans, l’obésité ou des antécédents de cette complication7. Le cancer et la chimiothérapie se sont révélés des facteurs de risque indépendants de TEV. Dans une série de cas de cancer de l’ovaire, elle était le signe d’appel dans 10 % des cas8. Il ressort du suivi de leur traitement que 11,6 % d’entre elles ont subi une TEV pendant une chimiothérapie néoadjuvante, 5,4 % en contexte postopératoire et 9,9 % durant une chimiothérapie adjuvante (Figure 1).
Répercussions de la TEV après une chirurgie gynéco-oncologique
Les conséquences de la TVP peuvent être graves. Quand la TEV survient au décours d’une chirurgie motivée par un cancer de l’ovaire, elle multiplie le nombre de décès par 2,31. Jusqu’à 50 % des patientes présentant une TVP proximale seront atteintes du syndrome post-thrombotique (SPT) malgré une anticoagulothérapie9. D’une intensité et d’une durée variables, les symptômes du SPT (p. ex., douleur, œdème, crampes) nuisent à la qualité de vie2.
Quoiqu’assez peu fréquente, l’EP est une forme de TEV ayant un taux de létalité considérable; il irait jusqu’à 5 % après une chirurgie gynéco-oncologique selon une évaluation du risque10,11. Une étude des répercussions de l’EP postopératoire chez des femmes atteintes d’un cancer gynécologique a fait état d’un taux de survie à 1 an de 77 % en l’absence d’EP et de 48 % dans le cas contraire10,11.
La TEV est une cause évitable de décès et de complications4. Sa prévention doit absolument prendre le pas sur son traitement parce que beaucoup de ses effets néfastes, y compris le décès, peuvent survenir avant l’obtention d’une reperfusion. En plus de l’invalidité liée au SPT2, les survivants d’une EP peuvent rester avec une dyspnée persistante, une intolérance à l’effort ou, dans les cas graves, une hypertension pulmonaire thromboembolique chronique12,13.
La prévention de la TEV doit absolument prendre le pas sur son traitement.
Lignes directrices factuelles sur la prévention de la TEV postopératoire
La longue liste des méthodes mécaniques et pharmacologiques utilisées pour prévenir la TEV comprend les bas de contention élastiques, les dispositifs de compression séquentielle, l’héparine non fractionnée (HNF), l’héparine de faible poids moléculaire (HFPM), les anticoagulants oraux directs (AOD), l’AAS et les filtres de veine cave inférieure (VCI). Les grandes lignes directrices sur la prévention de la TEV postopératoire émettent des recommandations pour chaque type d’intervention et chacun des facteurs de risque de TEV et de saignement.
Dans ses lignes directrices, l’ACCP fonde ses recommandations pour la thromboprophylaxie après une opération abdomino-pelvienne sur le risque de TEV et sur les facteurs de risque d’hémorragie (p. ex., trouble hémostatique non maîtrisé, antécédents d’hémorragie majeure ou concentration d’hémoglobine < 13 g/dL)4.
Selon les estimations du risque qui y sont citées, le risque de TEV chez les patientes opérées sans thromboprophylaxie pour un cancer gynécologique est 6 fois plus élevé que chez les personnes saines. On peut y lire aussi qu’une certaine forme de prévention de la TEV convient à toutes ces patientes, mais qu’elle doit être mise en contexte avec le risque de saignement. Les données citées dans les lignes directrices de l’ACCP laissent présager un rapport favorable entre les risques que comporte la prévention pharmacologique de la TEV et les bienfaits qu’on en attend chez ces patientes et chez les autres individus qui y sont très exposés, même quand le risque de saignement est grand. Or ce rapport ne tient plus quand le risque d’hémorragie majeure est extrêmement élevé, soit de 4 %. Quant aux sujets qui autrement ne sont pas très exposés aux complications hémorragiques majeures, l’ACCP prône une prophylaxie dite prolongée, soit une héparinothérapie par l’HFPM amorcée avant l’opération et poursuivie pendant les quatre semaines qui la suivent.
La recommandation générale formulée dans les lignes directrices de l’ASCO stipule que tous les patients devant subir une chirurgie oncologique lourde doivent recevoir une héparinothérapie préopératoire par l’HFPM ou l’HNF, sauf si elle est contre-indiquée en raison d’un risque de saignement élevé5. En situation périopératoire, l’HFPM est préférée à l’HNF parce qu’elle est facile à utiliser en consultation externe. Une revue systématique Cochrane a révélé que l’HFPM et l’HNF sont comparables pour ce qui est des paramètres d’évaluation suivants : TVP, EP, mortalité et saignements14. Cela dit, bien des préparations d’HFPM ont l’avantage de s’administrer une fois par jour et ce type d’héparine est assorti d’un risque relatif de thrombopénie plus faible15.
Les lignes directrices de l’ASCO recommandent d’avoir aussi recours à la thromboprophylaxie mécanique pendant que le patient récupère de son opération. Elles la déconseillent toutefois comme unique moyen prophylactique, sauf si les anticoagulants sont contre-indiqués.
La Société européenne de médecine interne cancérologique (ESMO) abonde dans le même sens que l’ASCO au sujet de la thromboprophylaxie dans les cas de cancer traités par chirurgie16. Elle précise elle aussi que le risque de TEV, qui est déjà grand chez les patients cancéreux, l’est encore plus chez ceux qui sont opérés.
Selon une recherche documentaire de l’ESMO, l’HFPM et de l’HNF feraient preuve d’une efficacité et d’une innocuité similaires pour prévenir la TEV chez les patients cancéreux traités par chirurgie. Toutefois, à l’instar des lignes directrices déjà citées, l’HFPM y est privilégiée en première intention en raison de ses avantages, dont sa posologie uniquotidienne, ses caractéristiques pharmacocinétiques plus favorables et un risque de thrombopénie plus faible. Des doses assez fortes (p. ex., 4000 U d’énoxaparine ou 5000 U de daltéparine) sont recommandées, des données probantes ayant confirmé leur plus grande efficacité, mais pas au prix de saignements plus fréquents.
L’HBPM y est privilégiée en première intention en raison de ses avantages, dont sa posologie uniquotidienne et son risque de thrombopénie plus faible.
Se faisant l’écho des autres sociétés savantes, l’ESMO préconise d’allier la prophylaxie mécanique à l’anticoagulation pharmacologique chez les patients cancéreux opérés, dans la région abdomino-pelvienne par exemple, et convient que la prophylaxie mécanique ne doit pas être la seule méthode utilisée, sauf si les anticoagulants sont contre-indiqués.
Dans un bulletin publié en 2007 et réédité en 2012, l’American College of Obstetrics and Gynecology (ACOG) affirme que l’HFPM ou l’HNF alliée à la prophylaxie mécanique convient aux femmes subissant une chirurgie17, mais qu’il faut privilégier l’HFPM en raison de sa posologie uniquotidienne et de son activité antithrombine relativement plus faible, d’où une baisse des saignements et de la formation d’hématomes. L’ACOG se joint à l’ACCP pour recommander l’association de mesures préventives mécaniques et pharmacologiques postopératoires, surtout chez les patients très vulnérables.
La prophylaxie mécanique ne doit pas être la seule méthode utilisée, sauf si les anticoagulants sont contre-indiqués.
Dans ses lignes directrices sur la chirurgie gynécologique, Thrombose Canada privilégie l’administration d’HFPM pendant 30 jours pour prévenir la TEV6, la prophylaxie mécanique comme unique moyen préventif étant réservée aux patientes très exposées aux saignements. Cet organisme appuie aussi le choix d’une thromboprophylaxie veineuse fondée sur les évaluations objectives du risque de TEV et de saignement de chaque patiente.
Les lignes directrices appuient la prophylaxie en deux volets
À la lecture de ces lignes directrices, on constate que l’ACCP, l’ASCO, l’ACOG, l’ESMO et Thrombose Canada ont une vision très proche de la prévention de la TEV après une chirurgie abdomino-pelvienne lourde. Elles n’émettent pas toutes des recommandations sur la chirurgie gynécologique précisément et encore moins dans les cas de cancer gynécologique, mais elles s’entendent sur l’ampleur du risque de TEV et donc sur l’importance d’une prévention en deux volets.
La prophylaxie pharmacologique repose sur l’HNF ou l’HFPM, cette dernière étant privilégiée en raison de son gros avantage : elle s’administre moins souvent tout en étant aussi efficace. Certaines lignes directrices font état d’un risque de thrombopénie et d’un taux de saignement possiblement plus faibles comme avantages potentiels de l’HFPM. Or elles préconisent toutes d’y adjoindre des moyens préventifs mécaniques. La plupart des lignes directrices émettant des recommandations sur la chirurgie abdomino-pelvienne appuient le recours à l’HFPM avant l’opération et durant les 28 à 30 jours qui suivent.
Mise à jour des lignes directrices ERAS sur la prévention de la TEV postopératoire
Les lignes directrices portant expressément sur la chirurgie gynéco-oncologique s’appuient sur les mêmes principes thromboprophylactiques que ceux professés par les sociétés savantes. Les lignes directrices actualisées en 2019 de la Enhanced Recovery After Surgery (ERAS) Society réaffirment que la TEV constitue un risque majeur pour toutes les patientes atteintes d’un cancer gynécologique3 et ce risque relatif augmente chez celles qui affichent des facteurs de risque additionnels, dont un indice de masse corporelle élevé, un âge avancé, une chimiothérapie en cours, l’immobilité, une maladie extrapelvienne et une hypercoagulabilité sous-jacente. C’est pourquoi les lignes directrices ERAS recommandent une prophylaxie mécanique et pharmacologique prolongée (28 jours) pour prévenir la TEV chez toutes les patientes soumises à une chirurgie gynécologique lourde de plus de 30 minutes.
La TEV constitue un risque majeur pour toutes les patientes atteintes d’un cancer gynécologique.
Ces lignes directrices tiennent également compte du risque accru de TEV chez les malades recevant une chimiothérapie adjuvante ou néo-adjuvante. Des études comparatives menées avec répartition aléatoire ont révélé que l’administration d’HFPM ou d’apixaban avait abaissé le risque de TEV de 50 à 60 % chez des patients porteurs de tumeurs solides traitées par chimiothérapie18-20. Il faudra toutefois recueillir plus de données probantes chez les patientes atteintes d’un cancer gynécologique traité par chimiothérapie avant de pouvoir émettre des recommandations précises à leur endroit.
Lignes directrices ERAS : des données factuelles à l’appui de la prolongation de l’anticoagulation
Les lignes directrices ERAS sur la chirurgie abdomino-pelvienne recommandent que l’opération soit suivie de mesures préventives pendant 30 jours au maximum, les données étayant l’emploi de l’HFPM étant de grande qualité. Cette recommandation repose sur deux essais ayant relié l’utilisation prolongée de l’HFPM à une baisse du risque de TEV21,22. Un de ces essais a servi à comparer un traitement de 28 jours par la daltéparine au traitement type de 7 jours chez 427 patients subissant une chirurgie abdominale lourde. Or le traitement préventif le plus long a été relié à une baisse du risque relatif de TEV de 55 % (7,3 % vs 16,3 %; p = 0,012)21.
Dans le deuxième essai comparatif intitulé ENOXACAN II, 322 patients subissant une opération abdominale ou pelvienne non urgente contre un cancer ont été répartis aléatoirement de façon à recevoir un traitement postopératoire par de l’énoxaparine d’une durée standard (de 6 à10 jours) ou de 21 jours de plus22. Au bout de 3 mois, les chercheurs ont noté une baisse de 60,1 % (5,5 % vs 13,8 %; p = 0,01) à l’avantage du traitement prolongé. L’écart entre les taux de saignement n’était pas significatif entre les deux groupes.
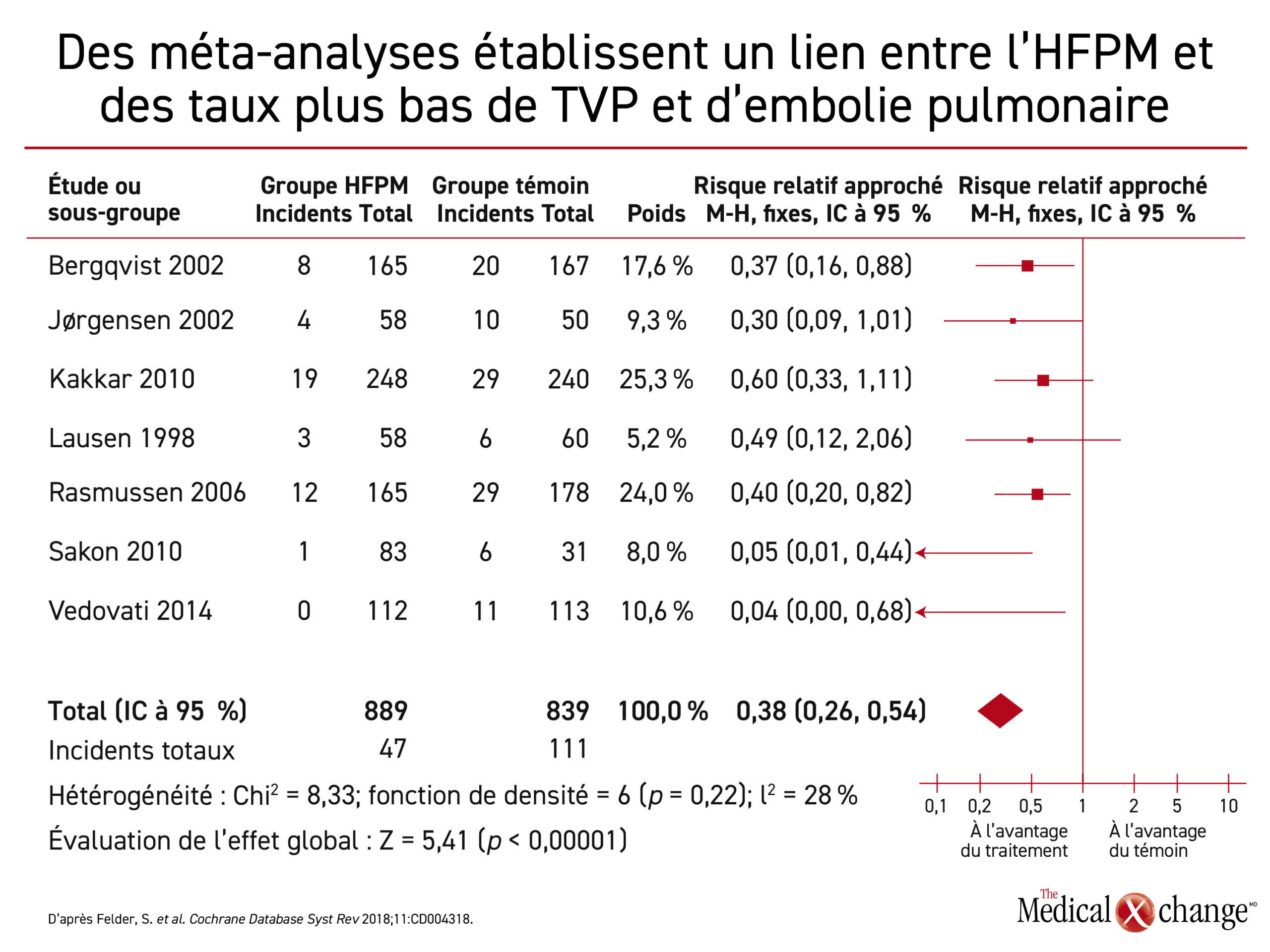
Plusieurs méta-analyses récentes ont aussi mis au jour des taux de TEV et d’EP plus faibles chez les patients ayant reçu un traitement préventif prolongé à l’aide d’HFPM (28 jours) que chez les autres traités plus brièvement23-25. Dans une recension systématique récente de la littérature, Felder et al. ont établi un lien entre une baisse de 62 % de la probabilité de formation d’une TEV après une opération abdomino-pelvienne chez les patients ayant suivi pareil traitement par rapport à d’autres, traités préventivement en milieu hospitalier (Figure 2).
Données probantes comparatives sur les différents types d’héparine
L’étude à répartition aléatoire ENOXACAN a servi à comparer l’énoxaparine à l’HNF chez des patients opérés pour un cancer21. Il n’y avait aucune différence entre les taux de complications thromboemboliques recensées dans les deux groupes de sujets, et l’énoxaparine administrée 1 fois par jour s’est montrée aussi efficace et sûre que l’HNF administrée 3 fois par jour.
Il demeure que les lignes directrices ERAS privilégient l’HFPM parce qu’elle risque moins d’entraîner une thrombopénie et que son comportement pharmacocinétique est plus prévisible que celui de l’HNF. Elle peut donc être administrée à doses fixes sans qu’il soit nécessaire d’en ajuster la posologie d’après les résultats des analyses biologiques de contrôle.
Les lignes directrices ERAS abordent également le rôle que pourraient jouer les AOD dans la prévention de la TEV à la suite d’une opération gynéco-oncologique, mais la qualité des données probantes laisse beaucoup à désirer. Bien que leur efficacité pour prévenir la TEV ait été documentée à la suite d’opérations orthopédiques26, aucune étude de grande qualité visant à évaluer le risque de saignement comparativement à l’HFPM n’a encore été réalisée en chirurgie pelvienne. Pour l’heure, les AOD ne peuvent donc être considérés comme la norme en matière de soins.
Résumé
Les recommandations des différentes lignes directrices à propos de la thromboprophylaxie veineuse suivant une chirurgie abdomino-pelvienne ou gynéco-oncologique se ressemblent beaucoup. Celles de l’ACCP, de l’ASCO, de l’ESMO, de l’ACOG, de Thrombose Canada et de la Société ERAS prônent une prévention à deux volets alliant des moyens mécaniques à l’emploi prolongé d’HFPM (Tableau 1). La prophylaxie mécanique au moyen de bas de contention élastiques ou de dispositifs de compression séquentielle est recommandée pour un surcroît de protection, mais est déconseillée en monothérapie dans les cas où la chimioprophylaxie est contre-indiquée. Selon plusieurs de ces lignes directrices, la chimioprophylaxie doit être amorcée avant l’intervention chirurgicale et la plupart d’entre elles préconisent un traitement préventif postopératoire de 28 à 30 jours. Fondées sur des données factuelles, ces lignes directrices visent à prévenir la morbidité et la mortalité accrues liées à la TVP au sein d’une population très vulnérable.
Références
1. Gunderson CC, Thomas ED, Slaughter KN, et al. The survival detriment of venous thromboembolism with epithelial ovarian cancer. Gynecol Oncol 2014;134:73-77.
2. Baldwin MJ, Moore HM, Rudarakanchana N, Gohel M et Davies AH. Post-thrombotic syndrome: a clinical review. J Thromb Haemost 2013;11:795-805.
3. Nelson G, Bakkum-Gamez J, Kalogera E, et al. Guidelines for perioperative care in gynecologic/oncology: Enhanced Recovery After Surgery (ERAS) Society recommendations-2019 update. Int J Gynecol Cancer 2019;29:651-668.
4. Gould MK, Garcia DA, Wren SM, et al. Prevention of VTE in nonorthopedic surgical patients: Antithrombotic Therapy and Prevention of Thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012;141:e227S-e277S.
5. Key NS, Khorana AA, Kuderer NM, et al. Venous Thromboembolism Prophylaxis and Treatment in Patients With Cancer: ASCO Clinical Practice Guideline Update. J Clin Oncol 2020;38:496-520.
6. TC. Thromboprophylaxis after non-orthopedic surgery. Thrombosis Canada. http://thrombosiscanada.ca/guides/pdfs/ThromboprophylaxisNonorthopedic_Surgery.pdf: Consulté le 15 juin 2020.
7. Anderson FA, Jr., Spencer FA. Risk factors for venous thromboembolism. Circulation 2003;107:I9-16.
8. Greco PS, Bazzi AA, McLean K, et al. Incidence and Timing of Thromboembolic Events in Patients With Ovarian Cancer Undergoing Neoadjuvant Chemotherapy. Obstet Gynecol 2017;129:979-985.
9. Kahn SR, Hirsch A et Shrier I. Effect of postthrombotic syndrome on health-related quality of life after deep venous thrombosis. Arch Intern Med 2002;162:1144-1148.
10. Martino MA, Borges E, Williamson E, et al. Pulmonary embolism after major abdominal surgery in gynecologic oncology. Obstet Gynecol 2006;107:666-671.
11. Hogen L, Vicus D, Ferguson SE, et al. Patterns of recurrence and impact on survival in patients with clear cell ovarian carcinoma. International Journal of Gynecologic Cancer 2019;29:1164-1169.
12. Sista AK et Klok FA. Late outcomes of pulmonary embolism: The post-PE syndrome. Thromb Res 2018;164:157-162.
13. Klok FA, van Kralingen KW, van Dijk AP, Heyning FH, Vliegen HW et Huisman MV. Prospective cardiopulmonary screening program to detect chronic thromboembolic pulmonary hypertension in patients after acute pulmonary embolism. Haematologica 2010;95:970-975.
14. Matar CF, Kahale LA, Hakoum MB, et al. Anticoagulation for perioperative thromboprophylaxis in people with cancer. Cochrane Database Syst Rev 2018;7:CD009447.
15. Junqueira DR, Perini E, Penholati RR et Carvalho MG. Unfractionated heparin versus low molecular weight heparin for avoiding heparin-induced thrombocytopenia in postoperative patients. Cochrane Database Syst Rev 2012:CD007557.
16. Mandala M, Falanga A, Roila F et Group EGW. Management of venous thromboembolism (VTE) in cancer patients: ESMO Clinical Practice Guidelines. Ann Oncol 2011;22 Suppl. 6:vi85-92.
17. ACOG. Prevention of Deep Vein Thrombosis and Pulmonary Embolism. Obstet Gynecol 2007;110(2 Pt 1):429-440.
18. Agnelli G, Gussoni G, Bianchini C, et al. Nadroparin for the prevention of thromboembolic events in ambulatory patients with metastatic or locally advanced solid cancer receiving chemotherapy: a randomised, placebo-controlled, double-blind study. Lancet Oncol 2009;10:943-949.
19. Agnelli G, George DJ, Kakkar AK, et al. Semuloparin for thromboprophylaxis in patients receiving chemotherapy for cancer. N Engl J Med 2012;366:601-609.
20. Carrier, Marc, et al. Apixaban to prevent venous thromboembolism in patients with cancer. N Engl J Med 2018;380.8: 711-719.
21. Rasmussen MS, Jorgensen LN, Wille-Jorgensen P, et al. Prolonged prophylaxis with dalteparin to prevent late thromboembolic complications in patients undergoing major abdominal surgery: a multicenter randomized open-label study. J Thromb Haemost 2006;4:2384-2390.
22. Bergqvist D, Agnelli G, Cohen AT, et al. Duration of prophylaxis against venous thromboembolism with enoxaparin after surgery for cancer. N Engl J Med 2002;346:975-980.
23. Felder S, Rasmussen MS, King R, et al. Prolonged thromboprophylaxis with low molecular weight heparin for abdominal or pelvic surgery. Cochrane Database Syst Rev 2018;11:CD004318.
24. Fagarasanu A, Alotaibi GS, Hrimiuc R, Lee AY et Wu C. Role of Extended Thromboprophylaxis After Abdominal and Pelvic Surgery in Cancer Patients: A Systematic Review and Meta-Analysis. Ann Surg Oncol 2016;23:1422-1430.
25. Carrier M, Altman AD, Blais N, et al. Extended thromboprophylaxis with low-molecular weight heparin (LMWH) following abdominopelvic cancer surgery. Am J Surg 2019;218:537-550.
26. Forster R et Stewart M. Anticoagulants (extended duration) for prevention of venous thromboembolism following total hip or knee replacement or hip fracture repair. Cochrane Database Syst Rev 2016;3:CD004179.