Neurologie
Sclérose en plaques : revue d'experts et commentaires tirés de la littérature
La sclérose en plaques récurrente-rémittente : les immunomodulateurs pour voie orale employés en première intention
Liesly Lee, M.D.
Professeur agrégé de médecine (neurologie)
Centre des sciences de la santé Sunnybrook
Université de Toronto
Toronto (Ontario)
Les immunomodulateurs à prise orale peuvent être utilisés en première intention chez les patients atteints de sclérose en plaques récurrente-rémittente (SP-RR) incapables, ou qui refusent, de tolérer l’acétate de glatiramer (AG) et les interférons bêta injectables. Or il est possible de personnaliser le traitement d’une SP-RR débutante à l’aide de ces agents ou lorsqu’une stratégie dégressive est envisagée. La prise d’un immunomodulateur par voie orale constitue une option valable, efficace et sûre qui convient à la plupart des patients.
Le principe à la base des immunomodulateurs
La sclérose en plaques (SP) peut évoluer de bien des façons; elle peut s’exprimer par de longues périodes d’accalmie ou, à l’opposé, par des rechutes fréquentes et fortement symptomatiques, signes d’une accélération du processus morbide. Les traitements très efficaces, notamment les immunosuppresseurs ciblés, sont venus enrichir les options thérapeutiques dirigées contre les formes agressives de la maladie. Dans les cas de SP-RR débutante, peu évolutive ou imposant une charge morbide légère, les immunomodulateurs employés en première intention demeurent un choix valable compte tenu des bienfaits qu’on en attend en regard des risques qu’ils comportent.
D’après les données sur l’évolution de la maladie recueillies pendant les essais cliniques, de 10 à 34 % des patients verraient leur SP-RR évoluer intensément dès ses débuts1, les autres, qui représentent la majorité, étant aux prises avec des rechutes intermittentes, sans évolution soutenue ni immédiate.
Une analyse de 26 études a révélé que 30 % des patients atteints de SP-RR avaient obtenu un score inférieur à 3 sur l’échelle EDSS (Expanded Disability Status Scale) à 10 ans2. Lors d’une étude canadienne où a été suivie pareille cohorte de patients, 52,1 % en étaient au même point après un suivi de 10 années de plus3. Ces observations rétrospectives sont importantes pour le choix du traitement à opposer à une SP nouvellement diagnostiquée. En pratique, quand la méthode « d’intensification » est celle adoptée, les patients sont habituellement traités à l’aide d’agents de première intention, car il est difficile de prédire à quelle vitesse la maladie évoluera vers l’invalidité pendant les premières phases de la SP-RR. À ce stade, la maladie évolue lentement chez la plupart des patients, ce qui fait de ces agents efficaces quoique bien tolérés une option intéressante4.
Même si elle est traitée, la SP-RR finit le plus souvent par se transformer en SP progressive secondaire (SPPS)5. L’éventualité d’une telle évolution sert de fondement au modèle « d’induction» qui repose sur l’utilisation rapide d’agents puissants, quoique souvent moins bien tolérés, au lieu des agents ordinairement employés en première intention. C’est pourquoi les immunomodulateurs de choix ont continué d’être couramment utilisés contre la SP-RR au départ peu agressive6. Toutefois, les arguments en faveur de l’intensification au détriment de l’induction et vice versa pour la prise en charge de la SP à ses débuts continuent d’évoluer.
Les immunomodulateurs à prise orale versus pour injection
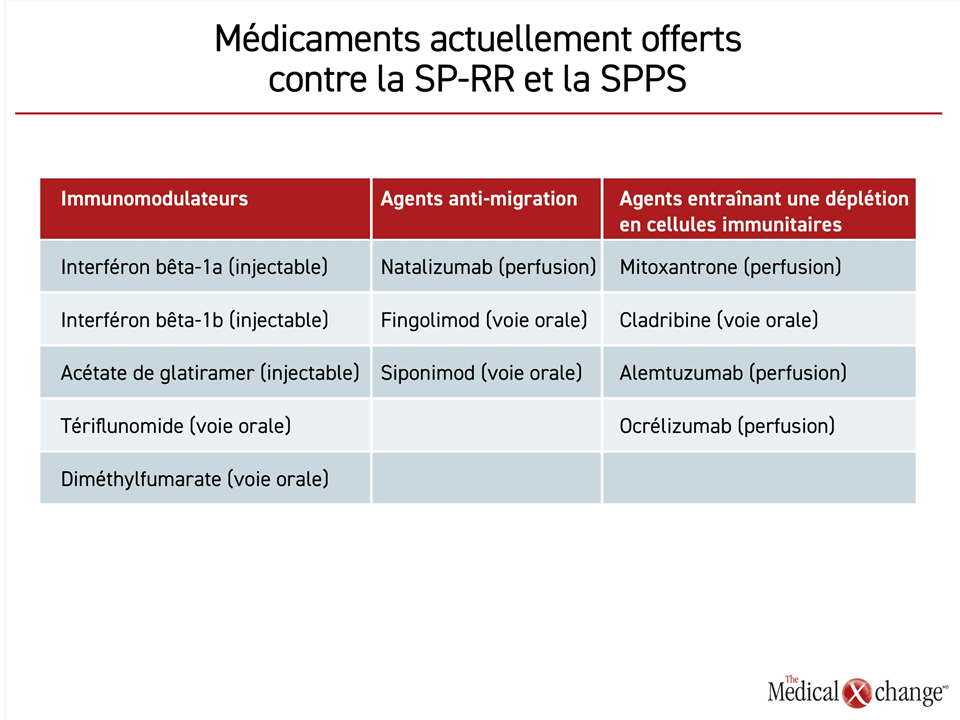
Les cinq immunomodulateurs actuellement offerts pour maîtriser la SP-RR en première intention sont l’interféron bêta-1b, l’interféron bêta-1a, l’acétate de glatiramer (AG), le tériflunomide et le diméthylfumarate (DMFu). Les trois premiers agents doivent être injectés; les deux autres se prennent par voie orale (Tableau 1). En plus des données comparatives tirées des essais cliniques et des essais de prolongation subséquents, des analyses sur l’efficacité et l’innocuité de tous ces agents en pratique clinique continuent de confirmer leurs bienfaits et leur innocuité à long terme.
Peu d’études ont servi à comparer directement des immunomodulateurs à prise orale à d’autres, injectables ceux-là, mais des comparaisons indirectes ont été tentées par appariement des patients. Lors de l’essai de phase III CONFIRM, un essai sur le DMFu contrôlé par placebo, l’AG a fait office d’agent de référence7. Une comparaison a posteriori du taux de rechutes annualisé (TRA) a établi un lien entre le DMFu pris 2 fois par jour et une meilleure maîtrise de la maladie que celle obtenue avec l’AG (p = 0,02). Deux études reposant sur l’appariement des patients portent aussi à croire à la supériorité de l’efficacité de cet agent à prise orale sur celle de l’AG pour ce paramètre et plusieurs autres, dont l’évolution de la maladie objectivée par les clichés d’IRM8,9.
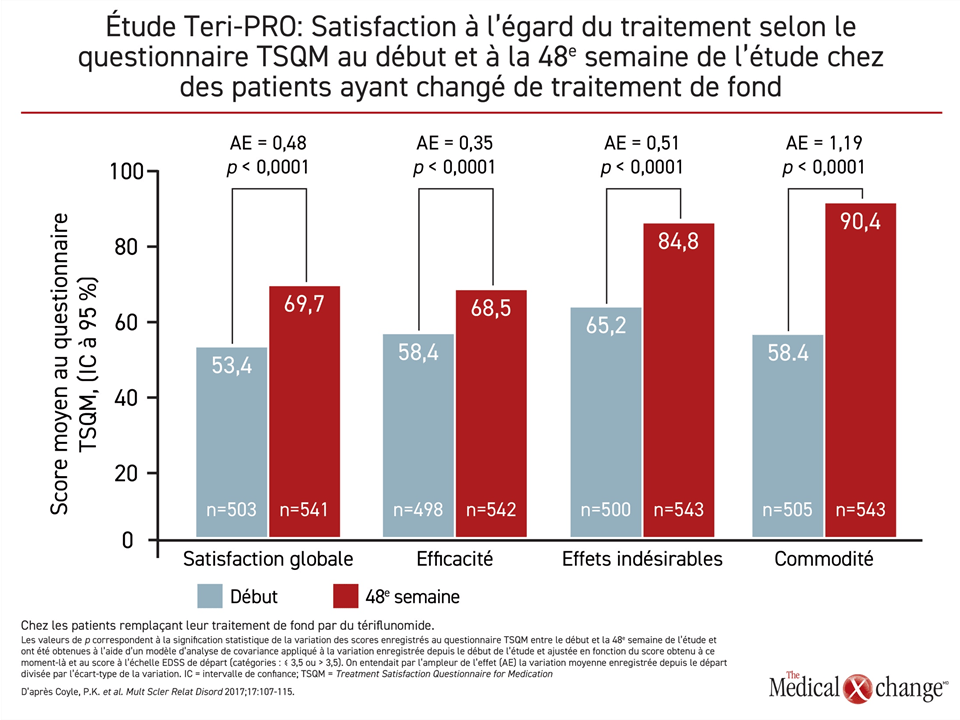
Dans une étude comparative portant sur le tériflunomide et l’interféron bêta-1a, les chercheurs n’ont relevé aucune différence entre la dose de 14 mg de tériflunomide et l’interféron pour ce qui est du paramètre d’évaluation principal, soit le délai écoulé avant l’échec du traitement celui-ci étant corroboré par la survenue d’une première rechute confirmée ou l’abandon définitif du traitement pour quelque raison que ce soit10. Ils ont également noté une différence au chapitre du TRA, un paramètre d’évaluation secondaire, mais le tériflunomide a permis d’obtenir de meilleurs résultats au questionnaire TSQM (Treatment Satisfaction Questionnaire for Medication). Pendant une étude de phase IV intitulée Teri-PRO, 768 patients atteints de SP-RR ont été suivis pendant 48 semaines après avoir remplacé le traitement de fond qui leur était injecté par du tériflunomide à 14 mg11. D’après leurs réponses au questionnaire TSQM, ils étaient significativement plus satisfaits de leur traitement par le tériflunomide, et ce pour les quatre aspects évalués (Figure 1), le gain le plus important étant selon eux sa plus grande commodité. Si l’on se fie aux données probantes selon lesquelles l’adhésion des patients à leur traitement est tributaire de leur satisfaction à son égard12, ces résultats confirment qu’un immunomodulateur à prise orale est une option de rechange valable aux agents injectables comme traitement de première intention.
Il a été démontré que l’incommodité des injections périodiques nuit plus à l’adhésion au traitement que l’aversion pour les aiguilles et l’appréhension de la douleur causée par les injections13,14. Au cours de l’étude STICK, qui a été menée chez 445 patients atteints de SP-RR suivant un traitement stable par injections, les scores moyens obtenus au questionnaire TSQM pour chacun des agents injectables étaient acceptables dans l’ensemble, mais faibles pour ce qui est de la commodité15. Interrogés à propos de modes d’administration de rechange, 83 % des participants ont affirmé préférer un traitement administré par voie orale une fois par jour à tous les autres.
Cela dit, malgré l’intérêt que présentent les agents à prise orale aux yeux de certains patients, il demeure que l’AG est souvent l’agent privilégié contre la SP-RR. Bien que nous disposions de peu de données le comparant à d’autres agents utilisés en première intention, deux analyses des études publiées ont permis de conclure que la protection contre les rechutes conférée par l’AG est comparable à celle offerte par les interférons16,17. Une conclusion semblable a été tirée d’une analyse sur l’efficacité relative de l’AG et du DMFu par rapport à un placebo en matière de protection contre les rechutes7. Selon les auteurs de ces trois analyses, il se peut que l’AG inhibe moins bien l’évolution de la maladie mesurée par IRM, mais ils n’ont émis aucune hypothèse quant à la portée possible de cette observation sur l’issue à long terme. Dans l’ensemble, l’AG a fait preuve d’activité et d’une bonne tolérabilité au cours des 20 années et plus d’expérience clinique acquise avec ce produit. Son innocuité n’exige aucune mesure de surveillance particulière et le risque d’interactions médicamenteuses est très faible. On ne lui prête aucun pouvoir tératogène ni d’effet défavorable sur l’issue des grossesses18. Il s’agit d’un médicament de catégorie B en ce qui concerne la grossesse.
La SP-RR : les agents à prise orale utilisés en première intention
Le tériflunomide et le DMFu, qui ont été homologués il y a sept ans environ à la lumière des résultats positifs obtenus pour leur efficacité et leur innocuité dans des essais multicentriques de phase III, n’ont pas été comparés directement dans le cadre d’une étude à répartition aléatoire, mais ils sont aujourd’hui appuyés par une abondance de données cliniques. Le fingolimod, un autre agent à prise orale, est jugé plus efficace que les traitements employés en première intention contre la SP‑RR19,20, mais il est réservé à un usage de deuxième intention en Europe en raison du risque relatif d’effets indésirables plus élevé qui lui est accollé21.
Le tériflunomide et le DMFu agissent différemment. Le tériflunomide inhibe la dihydro-orotate déshydrogénase, une enzyme jouant un rôle important dans la prolifération des lymphocytes T et des lymphocytes B activés22. Ses bienfaits cliniques viendraient de son aptitude à réduire le nombre de lymphocytes activés qui traversent la barrière hémato-encéphalique22. Le tériflunomide s’est montré efficace dans les essais de phase III, qu’il ait été utilisé chez des patients jamais traités auparavant ou déjà exposés à un immunomodulateur injectable23,24. En plus de son activité plus marquée que celle d’un placebo pour les paramètres d’évaluation cliniques classiques, comme le TRA, le tériflunomide a exercé un effet protecteur contre l’atrophie cérébrale et l’altération des fonctions cognitives à 2 ans25,26.
L’efficacité du tériflunomide administré à la dose recommandée s’est révélée similaire à celle de l’interféron bêta-1a auquel il était comparé dans le cadre d’une étude à répartition aléatoire. L’avantage numérique du tériflunomide pour un paramètre d’évaluation composé du délai écoulé avant l’échec du traitement, du délai écoulé avant la première rechute ou du délai écoulé avant l’arrêt du traitement, peu importe la raison, n’a pas franchi le seuil de la signification statistique10, mais les scores enregistrés pour la satisfaction des patients étaient plus élevés qu’avec l’interféron bêta-1a.
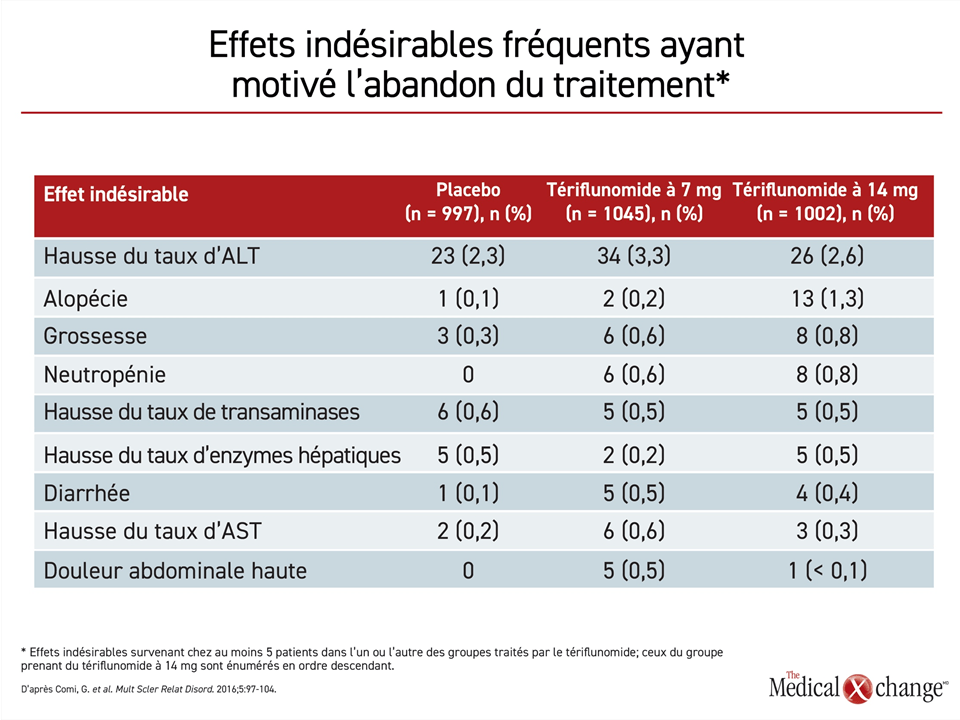
Selon des analyses des données sur l’innocuité tirées des essais de phase III TEMSO et TOWER contrôlés par placebo, 12,5 % des patients ont cessé de prendre du tériflunomide en raison d’un effet indésirable27, le tiers d’entre eux à cause d’une hausse de leur taux d’enzymes hépatiques. Les autres raisons, telles que la perte de cheveux, la neutropénie et la diarrhée, n’ont pas été invoquées souvent (Tableau 2 ). Pendant la phase de prolongation de l’essai TEMSO, qui a permis d’accumuler des données pendant 9 ans28, aucun effet indésirable inattendu ou jusque-là inconnu n’a été observé. Les chercheurs ont recensé peu d’infections graves et opportunistes. La nature et l’incidence des néoplasies correspondaient à celles qui étaient escomptées.
Le DMFu inhibe la voie Nrf2 qui intervient dans la libération de cytokines pro-inflammatoires29. De plus, cet agent provoque l’apoptose lymphocytaire, un autre mode d’action qui expliquerait son effet thérapeutique30,31. Au cours des essais de phase III DEFINE et CONFIRM contrôlés par placebo7,32, une dose de 240 mg de DMFu administrée 2 fois par jour a permis de réduire significativement le TRA à 2 ans, ainsi que le nombre de lésions de novo ou de lésions en hypersignal à croissance récente en T2 et de lésions prenant le gadolinium. Pendant l’essai CONFIRM, le DMFu a également été relié à une réduction de l’aggravation de l’invalidité confirmée sur 12 semaines. Cet essai comportait un groupe traité par l’AG, mais les patients n’y ont pas été affectés aléatoirement. L’analyse a posteriori des données collectées chez les patients traités par le DMFu et chez ceux du groupe recevant l’AG a permis d’établir un parallèle entre le DMFu et un nombre moins élevé de lésions de novo ou de lésions en hypersignal à croissance récente sur la séquence pondérée en T2.
Même si aucune étude à répartition aléatoire n’a servi à comparer directement le DMFu aux autres traitements de première intention de la SP-RR, plusieurs études rétrospectives portent à croire que son efficacité est comparable à celle des interférons, de l’AG et du tériflunomide. Selon un registre allemand, les TRA et le temps écoulé avant la première rechute observés avec le DMFu soutenaient avantageusement la comparaison avec ceux enregistrés avec tous ces agents9. Le fingolimod, qui a été pris en compte dans cette analyse, s’est révélé supérieur aux autres agents pour la majorité des paramètres d’évaluation. Le temps écoulé avant l’abandon du traitement était similaire pour tous ces agents, exception faite du fingolimod, pour lequel il était plus long. Dans une comparaison indirecte du DMFu et de l’AG ajustée en fonction de l’appariement, le DMFu s’est révélé supérieur pour le TRA (p= 0,0474) et l’aggravation de l’invalidité confirmée à 12 semaines (p < 0,0001)8. Il est ressorti d’une analyse rétrospective des dossiers de 143 patients recevant de l’interféron et de 307 patients prenant du DMFu que ces agents étaient comparables sur le plan de l’efficacité et de la persévérance des patients envers leur traitement33.
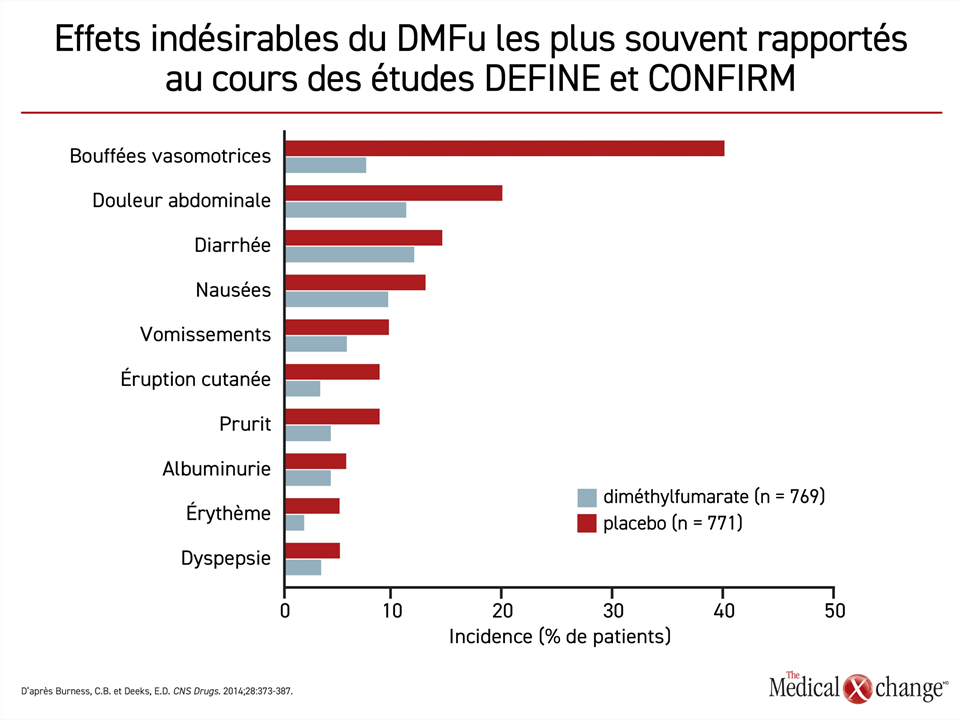
Les bouffées vasomotrices ont été reconnues comme l’effet indésirable le plus fréquent du DMFu au terme d’une analyse des données sur l’innocuité tirées des essais de phase III déterminants. Les bouffées vasomotrices, qui se sont produites chez plus de 40 % des patients, et les troubles digestifs étaient les effets indésirables les plus répandus (Figure 2)34. Cela dit, ils ont rarement motivé l’abandon du traitement. En outre, une analyse à 5 ans de l’étude ENDORSE, une étude de prolongation de longue durée menée chez les participants aux études DEFINE et CONFIRM, n’a mis au jour aucun effet indésirable inattendu ou jusque-là inconnu35. Quelques cas de leucoencéphalopathie multifocale progressive (LEMP) ont toutefois été objectivés chez des patients prenant du DMFu. Or ce risque intéresserait essentiellement les patients exposés à un autre agent ayant un lien avec la LEMP ou ceux affichant une lymphopénie prolongée (< 500 cells/μL)36,37.
Faute d’essais à répartition aléatoire, des chercheurs ont mené plusieurs études pour comparer le tériflunomide et le DMFu à partir de données recueillies en pratique clinique, avec des résultats inégaux. Dans l’une d’elles, après avoir comparé 50 patients atteints de SP-RR traités par du tériflunomide à 50 autres prenant du DMFu au moyen de divers paramètres cliniques et d’imagerie médicale, ils ont constaté la similarité de ces deux médicaments pour la plupart d’entre eux. Ils ont toutefois relié le tériflunomide à une meilleure protection contre l’atrophie cérébrale au bout de 2 années de traitement38. Les chercheurs d’une autre étude ont noté que la proportion de patients présentant au moins une nouvelle lésion en T2 sur les clichés d’IRM était plus faible avec le DMFu, même si encore là, les mesures cliniques de l’efficacité ne permettaient pas à l’un de ces agents de se démarquer significativement de l’autre39. Ces études n’ayant pas été menées avec répartition aléatoire, les facteurs influençant l’adhésion des patients au traitement, comme les effets indésirables ou la commodité d’administration, n’ont pu être vérifiés.
Personnalisation du traitement : faire le bon choix
La multiplication des options thérapeutiques a facilité la personnalisation du traitement. Les patients n’ont pas tous les mêmes objectifs ni les mêmes préférences et il faut en tenir compte lors du choix du traitement initial et pour la suite des choses. Même si les immunomodulateurs à prise orale sont sûrs et conviennent au traitement de première intention, il se peut qu’un patient préfère un immunomodulateur injectable pour plusieurs raisons, notamment pour éviter une administration quotidienne. À l’inverse, une forte proportion de patients atteints d’une forme légère ou modérée de SP-RR opteront plutôt pour un agent à prise orale s’ils y voient un produit mieux toléré. Aucun des agents à prise orale n’est dépourvu d’effets indésirables, mais leur bilan d’innocuité à long terme est acceptable.
Un patient dont la maladie risque d’évoluer ou que cette perspective inquiète pourrait juger raisonnable d’avoir recours à un agent plus puissant utilisé en deuxième intention s’il était assorti de la promesse d’une plus grande efficacité, quitte à ce que le risque d’effets indésirables soit plus élevé. Au moment de guider un patient dans le choix de l’immunomodulateur qui lui convient le mieux, la transmission de tous les renseignements concernant les risques relatifs ne facilite pas seulement ce processus, mais elle pourrait aussi améliorer sa tolérance aux effets indésirables.
L’objectif : guider les patients vers le traitement avec lequel ils se sentiront à l’aise, ce qui sera influencé par leur propre perspective de la commodité et des risques relatifs. D’autres facteurs comme la planification familiale ou le coût du traitement pourraient entrer en ligne de compte. Le tériflunomide a été relié à un effet tératogène chez les animaux40, mais le risque d’une issue défavorable en cas de grossesse n’a pas été confirmé par une étude populationnelle41. Les patients traités par cet agent devraient donc utiliser un moyen de contraception. Le DMFu n’a pas été relié à un effet tératogène chez les animaux ni à une issue défavorable au terme d’une grossesse, mais la FDA le classe dans la catégorie C, ce qui signifie que les données sont insuffisantes pour déterminer son innocuité chez la femme enceinte42.
Ni le tériflunomide ni le DMFu n’exclut le recours ultérieur à d’autres agents opposés à la SP-RR, y compris d’autres immunomodulateurs. Ils peuvent être utilisés tous les deux sans problème après un immunomodulateur injectable et être envisagés dans le cadre d’une stratégie dégressive chez les patients dont la maladie évolue plus lentement après un traitement très efficace. Le concept reposant sur l’utilisation précoce de traitements très efficaces pour ensuite passer à la puissance inférieure avec les immunomodulateurs employés en première intention reste une stratégie intéressante pour atténuer les risques associés aux traitements très efficaces43, mais son retentissement sur l’issue à long terme est inconnu.
Résumé
Les immunomodulateurs à prise orale peuvent être envisagés comme traitement de première intention de la SP-RR. Le tériflunomide, qui est administré 1 fois par jour et pour lequel nous disposons de données d’innocuité collectées pendant plus de 10 ans dans le cadre d’essais comparatifs et de la pratique clinique, affiche une innocuité et une tolérabilité qui rivalisent avec celles des immunomodulateurs injectables. Le faisceau de preuves à l’appui de l’innocuité du DMFu est similaire. Exception faite des quelques cas de LEMP observés avec le DMFu, ces agents à prise orale, qui sont souvent vus comme plus pratiques que les immunomodulateurs injectables, n’auraient pas tendance, semble-t-il, à provoquer des effets indésirables de nature immunologique inopinés comme des infections opportunistes ou des néoplasies. Les données publiées portent à croire qu’ils ne sont pas moins efficaces pour prévenir les rechutes, pour ralentir l’évolution de la maladie visible à l’IRM ni pour retarder l’aggravation de l’invalidité.
Références
1. Fernandez O. Is there a change of paradigm towards more effective treatment early in the course of apparent high-risk MS? Mult Scler Relat Disord 2017;17:75-83.
2. Reynders T, D’Haeseleer M, De Keyser J, Nagels G et D’Hooghe MB. Definition, prevalence and predictive factors of benign multiple sclerosis. eNeurologicalSci 2017;7:37-43.
3. Sayao AL, Devonshire V et Tremlett H. Longitudinal follow-up of « benign » multiple sclerosis at 20 years. Neurology 2007;68:496-500.
4. Langer-Gould A, Popat RA, Huang SM, et al. Clinical and demographic predictors of long-term disability in patients with relapsing-remitting multiple sclerosis: a systematic review. Arch Neurol 2006;63:1686-1691.
5. Gross HJ et Watson C. Characteristics, burden of illness, and physical functioning of patients with relapsing-remitting and secondary progressive multiple sclerosis: a cross-sectional US survey. Neuropsychiatr Dis Treat 2017;13:1349-1357.
6. Freedman MS, Selchen D, Prat A et Giacomini PS. Managing Multiple Sclerosis: Treatment Initiation, Modification, and Sequencing. Can J Neurol Sci 2018;45:489-503.
7. Fox RJ, Miller DH, Phillips JT, et al. Placebo-controlled phase 3 study of oral BG-12 or glatiramer in multiple sclerosis. N Engl J Med 2012;367:1087-1097.
8. Chan A, Cutter G, Fox RJ, Xiao J, Lewin JB et Edwards MR. Comparative effectiveness of delayed-release dimethyl fumarate versus glatiramer acetate in multiple sclerosis patients : results of a matching-adjusted indirect comparison. J Comp Eff Res 2017;6:313-323.
9. Braune S, Grimm S, van Hovell P, et al. Comparative effectiveness of delayed-release dimethyl fumarate versus interferon, glatiramer acetate, teriflunomide, or fingolimod: results from the German NeuroTransData registry. J Neurol 2018;265:2980-2992.
10. Vermersch P, Czlonkowska A, Grimaldi LM, et al. Teriflunomide versus subcutaneous interferon beta-1a in patients with relapsing multiple sclerosis: a randomised, controlled phase 3 trial. Mult Scler 2014;20:705-716.
11. Coyle PK, Khatri B, Edwards KR, et al. Patient-reported outcomes in relapsing forms of MS: Real-world, global treatment experience with teriflunomide from the Teri-PRO study. Mult Scler Relat Disord 2017;17:107-115.
12. Barbosa CD, Balp MM, Kulich K, Germain N et Rofail D. A literature review to explore the link between treatment satisfaction and adherence, compliance, and persistence. Patient Prefer Adherence 2012;6:39-48.
13. Klauer T et Zettl UK. Compliance, adherence, and the treatment of multiple sclerosis. J Neurol 2008;255 Suppl 6:87-92.
14. Reynolds MW, Stephen R, Seaman C et Rajagopalan K. Persistence and adherence to disease modifying drugs among patients with multiple sclerosis. Curr Med Res Opin 2010;26:663-674.
15. Fernandez O, Duran E, Ayuso T, et al. Treatment satisfaction with injectable disease-modifying therapies in patients with relapsing-remitting multiple sclerosis (the STICK study). PLoS One 2017;12:e0185766.
16. Scott LJ. Glatiramer acetate : a review of its use in patients with relapsing-remitting multiple sclerosis and in delaying the onset of clinically definite multiple sclerosis. CNS Drugs 2013;27:971-988.
17. La Mantia L, Di Pietrantonj C, Rovaris M, et al. Interferons-beta versus glatiramer acetate for relapsing-remitting multiple sclerosis. Cochrane Database Syst Rev 2016;11:CD009333.
18. Sandberg-Wollheim M, Neudorfer O, Grinspan A, et al. Pregnancy Outcomes from the Branded Glatiramer Acetate Pregnancy Database. Int J MS Care 2018;20:9-14.
19. Cohen JA, Barkhof F, Comi G, et al. Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. N Engl J Med 2010;362:402-415.
20. Braune S, Lang M, Bergmann A et le groupe d’étude NeuroTransData. Efficacy of fingolimod is superior to injectable disease modifying therapies in second-line therapy of relapsing remitting multiple sclerosis. J Neurol 2016;263:327-333.
21. Dorr J et Paul F. The transition from first-line to second-line therapy in multiple sclerosis. Curr Treat Options Neurol 2015;17:354.
22. Bar-Or A, Pachner A, Menguy-Vacheron F, Kaplan J et Wiendl H. Teriflunomide and its mechanism of action in multiple sclerosis. Drugs 2014;74:659-674.
23. O’Connor P, Wolinsky JS, Confavreux C, et al. Randomized trial of oral teriflunomide for relapsing multiple sclerosis. N Engl J Med 2011;365:1293-1303.
24. Confavreux C, O’Connor P, Comi G, et al. Oral teriflunomide for patients with relapsing multiple sclerosis (TOWER): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Neurol 2014;13:247-256.
25. Sprenger T, Lebrun-Frenay C, Vermersch P et Park MS. Investigation the effect of teriflunomide on brain volume loss in the phase 3 TOPIC study. Neurology 2019;92 (15 supplement):P3.2-046.
26. Sprenger T. Cognitive Outcomes in TEMSO Core Study. European Committee for Treatment and Research in Multiple Sclerosis (ECTRIMS); 2017; Paris, France. p. P685.
27. Comi G, Freedman MS, Kappos L, et al. Pooled safety and tolerability data from four placebo-controlled teriflunomide studies and extensions. Mult Scler Relat Disord 2016;5:97-104.
28. O’Connor P, Comi G, Freedman MS, et al. Long-term safety and efficacy of teriflunomide: Nine-year follow-up of the randomized TEMSO study. Neurology 2016;86:920-930.
29. Linker RA, Lee DH, Ryan S, et al. Fumaric acid esters exert neuroprotective effects in neuroinflammation via activation of the Nrf2 antioxidant pathway. Brain 2011;134:678-692.
30. Li W, Khor TO, Xu C, et al. Activation of Nrf2-antioxidant signaling attenuates NFkappaB-inflammatory response and elicits apoptosis. Biochem Pharmacol 2008;76:1485-1489.
31. Treumer F, Zhu K, Glaser R et Mrowietz U. Dimethylfumarate is a potent inducer of apoptosis in human T cells. J Invest Dermatol 2003;121:1383-1388.
32. Gold R, Kappos L, Arnold DL, et al. Placebo-controlled phase 3 study of oral BG-12 for relapsing multiple sclerosis. N Engl J Med 2012;367:1098-1107.
33. Ernst FR, Barr P, Elmor R et Wong SL. Relapse outcomes, safety, and treatment patterns in patients diagnosed with relapsing-remitting multiple sclerosis and initiated on subcutaneous interferon beta-1a or dimethyl fumarate: a real-world study. Curr Med Res Opin 2017;33:2099-2106.
34. Burness CB et Deeks ED. Dimethyl fumarate : a review of its use in patients with relapsing-remitting multiple sclerosis. CNS Drugs 2014;28:373-387.
35. Gold R, Arnold DL, Bar-Or A, et al. Long-term effects of delayed-release dimethyl fumarate in multiple sclerosis: Interim analysis of ENDORSE, a randomized extension study. Mult Scler 2017;23:253-265.
36. Gieselbach RJ, Muller-Hansma AH, Wijburg MT, et al. Progressive multifocal leukoencephalopathy in patients treated with fumaric acid esters: a review of 19 cases. J Neurol 2017;264:1155-1164.
37. Diebold M, Altersberger V, Decard BF, Kappos L, Derfuss T et Lorscheider J. A case of progressive multifocal leukoencephalopathy under dimethyl fumarate treatment without severe lymphopenia or immunosenescence. Mult Scler 2019;25:1682-1685.
38. Zivadinov R, Kresa-Reahl K, Weinstock-Guttman B, et al. Comparative effectiveness of teriflunomide and dimethyl fumarate in patients with relapsing forms of MS in the retrospective real-world Teri-RADAR study. J Comp Eff Res 2019;8:305-316.
39. Laplaud DA, Casey R, Barbin L, et al. Comparative effectiveness of teriflunomide vs dimethyl fumarate in multiple sclerosis. Neurology 2019;93:e635-e646.
40. Cada DJ, Demaris K, Levien TL et Baker DE. Teriflunomide. Hosp Pharm 2013;48:231-240.
41. Andersen JB, Moberg JY, Spelman T et Magyari M. Pregnancy Outcomes in Men and Women Treated With Teriflunomide. A Population-Based Nationwide Danish Register Study. Front Immunol 2018;9:2706.
42. Gold R, Phillips JT, Havrdova E, et al. Delayed-Release Dimethyl Fumarate and Pregnancy : Preclinical Studies and Pregnancy Outcomes from Clinical Trials and Postmarketing Experience. Neurol Ther 2015;4:93-104.
43. Stankiewicz JM et Weiner HL. An argument for broad use of high efficacy treatments in early multiple sclerosis. Neurol Neuroimmunol Neuroinflamm 2020;7.