Cardiologie
Insuffisance cardiaque : revue d'experts et commentaires tirés de la littérature
Nouvelles données : l’instauration rapide d’un traitement par l’ARNI, une norme dans les cas d’ICFEr accompagnée ou non de diabète
Michel White, M.D.
Professeur titulaire de médecine, Université de Montréal
Titulaire de la Chaire Carolyn et Richard Renaud en insuffisance cardiaque
Institut de cardiologie de Montréal
Montréal (Québec)
Kim Connelly, MBBS, Ph.D., FSCMR, FCCS
Professeur agrégé de médecine, Université de Toronto
Toronto (Ontario)
Les quatre agents aujourd’hui considérés comme les piliers du traitement de l’insuffisance cardiaque à fraction d’éjection réduite (ICFEr) prolongent tous la survie. Si l’association sacubitril-valsartan formée d’un inhibiteur de l’angiotensine et d’un inhibiteur de la néprilysine (ARNI) a accédé à ce titre, c’est qu’elle avait permis pendant l’essai phare PARADIGM-HF de raréfier les décès toutes causes confondues après son ajout aux traitements classiques. Ce gain est en grande partie attribuable à la régulation négative de l’activation neurohormonale et à la diminution des concentrations de la fraction N-terminale du peptide natriurétique de type B (NT-proBNP)1. L’essai PROVE-HF a par la suite établi un lien entre l’observation de cet effet à 12 mois et l’inversion du remodelage cardiaque qui caractérise l’ICFEr, et une amélioration de la fraction d’éjection ventriculaire gauche (FEVG) frôlant les 10 % (p < 0,001)2. Une nouvelle analyse de cet essai tout juste publiée a confirmé un effet d’une ampleur comparable chez les sujets atteints de diabète de type 2 (DT2)3. Ces données probantes parmi d’autres montrent que l’ARNI ne fait pas que ralentir le processus pathologique sous-jacent de l’ICFEr, mais qu’il permet bel et bien de le renverser. C’est pourquoi les nouvelles lignes directrices préconisent d’amorcer le traitement par cet agent rapidement, à l’instar des autres piliers, dans les cas d’ICFEr, qu’il y ait présence ou non d’un DT2.
Contexte
Les quatre piliers du traitement médical de l’ICFEr préconisé dans les lignes directrices (TMPLD) actuelles ont tous été reliés à une prolongation de la survie. Les études phares qui ont établi leur efficacité à ce chapitre l’ont toutes démontrée chez des patients qui suivaient déjà le TMPLD optimal. L’ARNI, soit l’association sacubitril-valsartan, a accédé au titre de troisième pilier du traitement type de l’ICFEr dans les lignes directrices de 2017 de la Société canadienne de cardiologie (SCC) rejoignant ainsi les β-bloquants et les antagonistes des minéralocorticoïdes (ARM) après avoir supplanté les inhibiteurs de l’ECA4 en produisant une réduction de 20 % (p < 0,001) du critère d’évaluation principal de l’essai PARADIGM-HF composé des manifestations majeures de l’insuffisance cardiaque (IC) par rapport à l’énalapril, un inhibiteur de l’ECA. En plus d’avoir raréfié ces manifestations (décès d’origine cardiovasculaire et hospitalisation motivée par l’IC), il a réduit de 16 % le risque de décès toutes causes confondues (p < 0,001). La plupart des sujets de l’essai PARADIGM-HF recevaient une combinaison d’agents alors considérée comme la norme, 90 % d’entre eux prenant des β-bloquants et plus de la moitié, des ARM.
Pour une entrevue exclusive avec le Dr Michel White couvrant l’impact sur la pratique clinique, cliquez ici
Un quatrième pilier a par la suite été ajouté au traitement de l’ICFEr à la lumière des essais DAPA-HF et EMPEROR-Reduced. L’essai DAPA-HF a permis d’établir un parallèle entre la dapagliflozine, un inhibiteur du cotransporteur sodium-glucose de type 2 (SGLT2), et une baisse de 26 % (p < 0,001) du critère d’évaluation composé des manifestations de l’IC par rapport à un placebo5. La protection conférée contre ces dernières (décès d’origine cardiovasculaire et traitement administré d’urgence par voie intraveineuse) s’est accompagnée d’une baisse de 17 % (p < 0,001) des décès toutes causes confondues. Au cours de l’essai EMPEROR-Reduced, la dapagliflozine, un inhibiteur du SGLT2, a été reliée à une baisse de 25 % (p < 0,001) d’un critère d’évaluation de l’ICFEr similaire comparativement au placebo6.
Comme ce fut le cas lors de l’essai PARADIGM-HF sur l’association sacubitril-valsartan, les chercheurs des essais sur l’inhibition du SGLT2 ont observé un effet favorable semblable chez les patients atteints de diabète et chez ceux qui en étaient indemnes. Dans les trois essais, ces effets favorables sont venus s’ajouter à ceux produits par le traitement de l’ICFEr jusqu’alors considéré comme la norme. Même si au début des essais DAPA-HF et EMPEROR-Reduced l’ARNI n’était pas encore vu comme une composante du traitement type, il demeure qu’il avait été prescrit à 10 % des sujets de l’essai DAPA-HF et à 20 % de ceux de l’essai EMPEROR-Reduced. Par ailleurs, plus de 90 % des sujets utilisaient des β‑bloquants, plus de 70 %, un ARM, et presque tous ceux qui ne prenaient pas l’ARNI recevaient un inhibiteur du système rénine-angiotensine.
Pour prendre la pleine mesure des quatre piliers du TMPLD, il faut comprendre que les baisses des décès qu’ils permettent d’obtenir sont cumulatives7. Les lignes directrices de la SCC, qui avaient pourtant été mises à jour l’an dernier de façon à y intégrer les inhibiteurs du SGLT2 pour les patients atteints d’ICFEr aux prises ou non avec le diabète5, ont quand même été remplacées par une nouvelle version plus exhaustive. Les β-bloquants, les ARM, l’ARNI et les inhibiteurs du SGLT2 y sont plus explicitement reconnus comme les quatre principales classes de médicaments à employer en première intention chez tous les patients affligés d’une ICFEr, sauf en cas de contre-indication8. Il y est également préconisé d’amorcer tous ces traitements rapidement afin d’obtenir des résultats cliniques optimaux.
L’American College of Cardiology (ACC) est du même avis si l’on se fie au cheminement décisionnel qu’il a créé pour l’ICFEr et mis à jour récemment9. Les β-bloquants, les ARM, l’ARNI et les inhibiteurs du SGLT2 y étaient déjà vus comme le TMPLD à privilégier en première intention dans les cas d’ICFEr. Selon la version actualisée, ils doivent être envisagés chez tous les patients atteints d’ICFEr, peu importe leur âge et la présence ou non d’un DT2. On a estimé récemment qu’un patient de 55 ans recevant les quatre types d’agents pourrait gagner 8,3 années de vie sans incident majeur lié à l’ICFEr et un patient âgé de 80 ans, jusqu’à 2,7 années10.
S’il y est préconisé d’avoir recours aux quatre piliers du TMPLD dès que le diagnostic d’ICFEr est posé, c’est en raison de leurs effets complémentaires et additifs. Notons qu’il n’y a pas de hiérarchie entre ces agents et qu’il n’existe donc pas de consigne quant à l’ordre dans lequel ils doivent être utilisés, mais que l’ACC conseille de commencer par un β-bloquant ou l’ARNI. Les diverses stratégies mises en place pour amener efficacement les patients à la dose optimale de chacun des quatre piliers dépendront des facteurs propres à chacun d’eux, comme les traitements qu’ils suivent déjà, mais il faut savoir que les quatre peuvent être utilisés en première intention.
Si on insiste particulièrement sur l’intérêt d’instaurer rapidement le traitement par l’ARNI, c’est que tout indique que l’utilisation de cet agent accuse un retard. Les nouvelles lignes directrices prennent souvent du temps à être adoptées, un problème courant en médecine. Or il semble que beaucoup de patients atteints d’ICFEr sont privés de cet agent qui offre pourtant un avantage documenté pour la survie. Une enquête a révélé que moins de 15 % des quelque 200 000 Canadiens atteints d’ICFEr qui répondaient aux critères justifiant le recours à l’ARNI en 2018 recevaient effectivement ce produit, un important décalage si l’on se fie aux lignes directrices et aux données probantes11. Tout comme les autres piliers du traitement de l’ICFEr, l’ARNI agit sur un moteur important du processus responsable de cette maladie, mais il comporte un avantage de plus : il fait rétrocéder le remodelage cardiaque.
L’ARNI : cibler le processus pathologique à l’origine de l’ICFEr
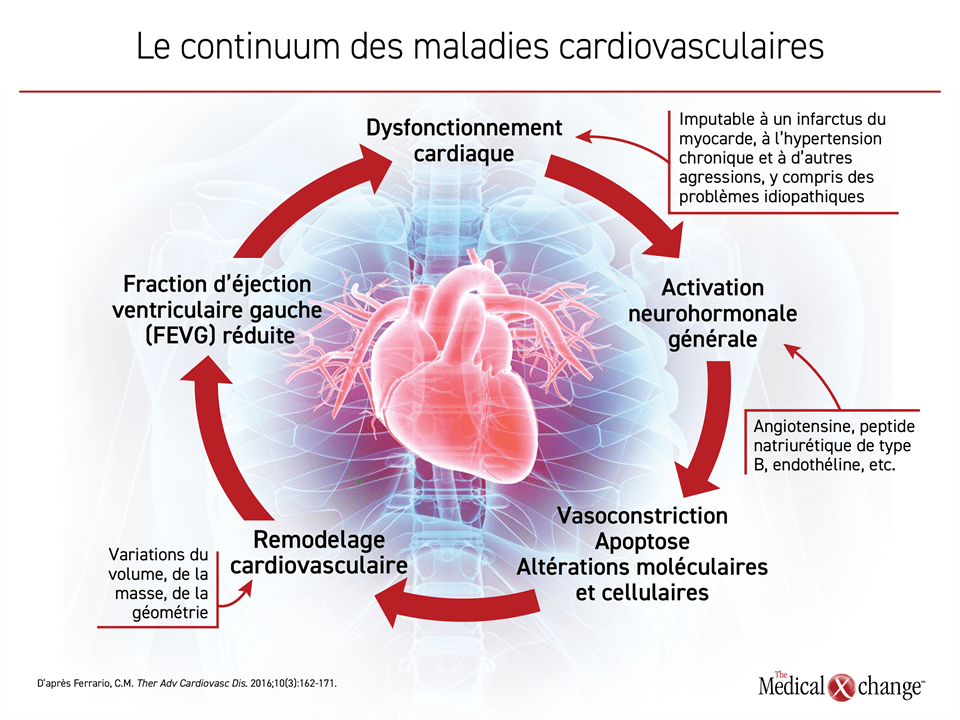
C’est pendant l’essai PARADIGM-HF que l’effet clinique marqué de l’ARNI a été constaté, mais ce sont les études suivantes qui nous ont renseignés davantage sur son mode d’action. On a présumé que le ralentissement du cours de la maladie était le résultat des baisses abruptes des taux de NT-proBNP produites par l’ARNI, mais les chercheurs de l’essai PROVE-HF les ont reliées à un remodelage cardiaque inverse2, ce qui laisse entrevoir un effet positif déterminant sur le processus physiopathologique de l’ICFEr. L’intérêt de faire rétrocéder le remodelage cardiaque au lieu de simplement le ralentir se comprend mieux quand on connaît le continuum des différentes manifestations cardiovasculaires de l’ICFEr caractérisé il y a une vingtaine d’années12. Ce continuum, dont le coup d’envoi est une activation neurohormonale, est un cercle vicieux ponctué de phases de détérioration progressive, puis terminales de la fonction cardiaque (Figure 1).
Il est maintenant clair que la suppression des neurohormones activées, dont celles du système rénine-angiotensine-aldostérone (SRAA) et la NT‑proBNP, ont un effet modulateur sur l’évolution de l’ICFEr13. Les taux de ces neurohormones circulantes grimpent vite en réaction à un infarctus du myocarde (IM), mais une agression à progression plus lente telle que l’hyperglycémie suffit aussi à les activer14. En phase aiguë, l’activation des neurohormones intervient dans les étapes favorisant une homéostasie cardiovasculaire rapide comme la vasoconstriction et la rétention aqueuse. À terme toutefois, la chronicité de leur activation endommage la structure du cœur en provoquant notamment un remodelage de la paroi ventriculaire, ce qui nuit à la fonction cardiaque et déclenche le cercle vicieux qui sous-tend l’évolution de l’ICFEr13.
Si les quatre piliers du traitement de l’ICFEr exercent tous des bienfaits cliniques, c’est au moins en partie parce qu’ils atténuent les effets nocifs de l’activation neurohormonale. Par exemple, les effets positifs de l’ARNI sont attribuables au sacubitril qui empêche la dégradation de la NT-proBNP par la néprilysine. Cette inhibition de la néprilysine, jumelée au blocage du SRA par le valsartan, l’autre composante de l’ARNI, se traduit par une vidange ventriculaire puissante, d’où l’amélioration de la fonction cardiaque consécutivement à la réduction de l’activation des neurohormones, ce dont témoigne la baisse soutenue des taux de NT-proBNP15. Le valsartan quant à lui empêche la régulation positive de l’angiotensine consécutive à l’inhibition de la néprilysine, qui pourrait être contre-productive, tout en ciblant une autre hormone intervenant dans le processus physiopathologique de l’ICFEr. Il est ressorti de l’essai PARADIGM-HF que l’inhibition de la néprilysine combinée à l’effet du valsartan a permis d’obtenir de meilleurs résultats contre l’ICFEr, mais les études qui ont suivi, dont l’essai PROVE-HF, ont montré que cette association inverse aussi le remodelage cardiaque, la cause profonde de l’ICFEr2.
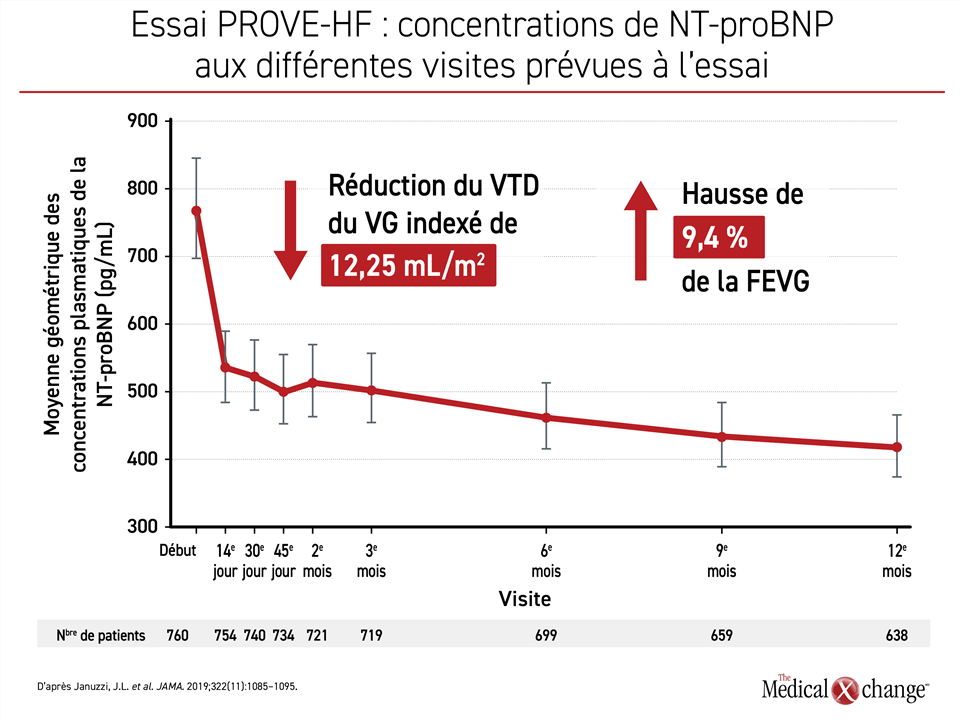
Pendant 12 mois, les chercheurs de l’essai prospectif PROVE-HF ont surveillé les taux de NT‑proBNP circulante chez les 794 patients atteints d’ICFEr ayant entrepris un traitement par l’association sacubitril-valsartan et ont pris plusieurs mesures échocardiographiques de leur structure cardiaque. Ils se sont également servis de cette technique pour mesurer la fraction d’éjection du ventricule gauche (FEVG) afin d’évaluer les variations de la fonction cardiaque.
Partant de 816 pg/mL, la concentration médiane de NT-proBNP a rapidement chuté à une valeur médiane de 455 pg/mL, soit une baisse de 45 %. Il convient de noter que les réductions des concentrations de NT-proBNP étaient en corrélation avec des changements favorables visibles à l’échocardiographie concernant le volume télédiastolique (VTD) du ventricule gauche (VG) indexé, le volume télésystolique (VTS) du VG indexé, le volume indexé de l’oreillette gauche (OG) et le rapport entre la vitesse de remplissage protodiastolique et la vitesse annulaire protodiastolique (p < 0,001 pour toutes les comparaisons) (Figure 2). Quoique plus prononcé au 12e mois, un remodelage cardiaque inverse pouvait être décelé dès le 6e mois.
Ces changements se sont accompagnés d’améliorations de la fonction cardiaque comme en témoignait la FEVG médiane qui, à la fin du 12e mois, avait augmenté de près de 10 %, passant de 28,2 % à 37,8 % (p < 0,001). Par rapport aux valeurs initiales, l’amplification des améliorations structurelles et l’augmentation de la FEVG reliées à l’ARNI se sont ajoutées aux effets d’un traitement de fond comprenant un β-bloquant et un ARM chez 95 % et environ le tiers des patients, respectivement.
Le parallèle établi entre les réductions des concentrations de NT-proBNP et les signes d’un remodelage cardiaque inverse s’est perpétué, même après de multiples stratifications. Elle a également été constatée dans les groupes de patients qui avaient été écartés de l’essai PARADIGM-HF, notamment ceux qui affichaient de légères hausses des concentrations de peptides natriurétiques ou qui ne prenaient pas une dose stable d’un inhibiteur du système angiotensine au début du traitement.
Importance de l’efficacité de l’ARNI dans les cas de DT2
Il est ressorti d’une analyse a posteriori des données de l’essai PROVE-HF que l’ARNI avait exercé des effets positifs comparables chez les patients atteints de DT23. Il y a un lien entre des concentrations d’HbA1c élevées et une augmentation des taux de NT-proBNP circulante, chacune d’elles étant responsable d’une hausse des décès d’origine cardiaque16. Il est particulièrement important d’offrir un traitement optimal aux patients atteints d’ICFEr affligés également d’un DT2. La prévalence de l’IC est environ quatre fois plus forte chez les patients atteints de DT2 que dans la population générale17, et à peu près 40 % des patients atteints d’IC sont diabétiques18. En fin de compte, la croissance rapide de l’incidence de l’ICFEr au Canada et ailleurs peut s’expliquer par l’épidémie actuelle de DT219.
Sur les 794 sujets de l’essai PROVE-HF, 361 (45,5 %) étaient aux prises avec le DT2 et étaient moins susceptibles d’avoir des antécédents d’IM (39,3 % vs 44,0 %; p = 0,02). Une forte proportion d’entre eux, tout comme ceux qui étaient indemnes de DT2, suivaient un traitement optimal au moment de leur recrutement; ils étaient plus de 95 % à prendre un β‑bloquant et plus de 75 % à recevoir un inhibiteur du système angiotensine.
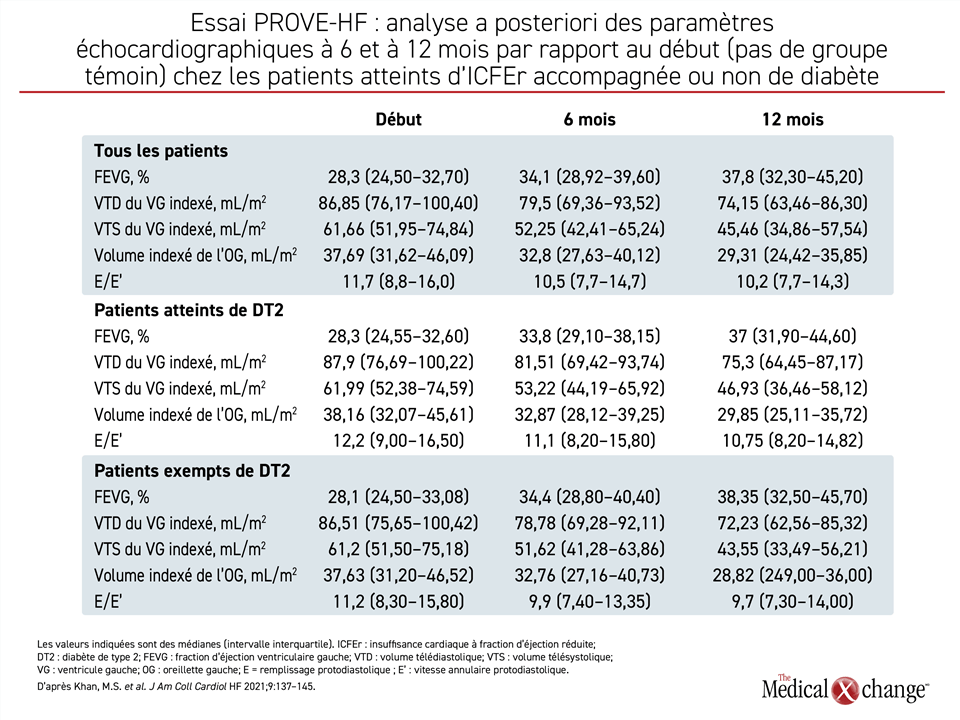
Au moment de leur recrutement à l’essai PROVE-HF, les sujets diabétiques affichaient un taux moyen de NT-proBNP plus élevé que les non-diabétiques (854,1 vs 706,3 pg/mL), mais la baisse abrupte de ce taux observée chez les premiers s’est révélée analogue à celle obtenue chez les seconds, notamment une réduction du taux de NT-proBNP de 39 % au 14e jour et de 43 % à la fin de l’essai. Pendant les 12 mois de suivi, les améliorations des paramètres structurels mesurés par échocardiographie, dont le VTD du VG indexé, le VTS du VG indexé et le volume indexé de l’OG étaient comparables que les patients soient atteints de DT2 ou non (Tableau 1).
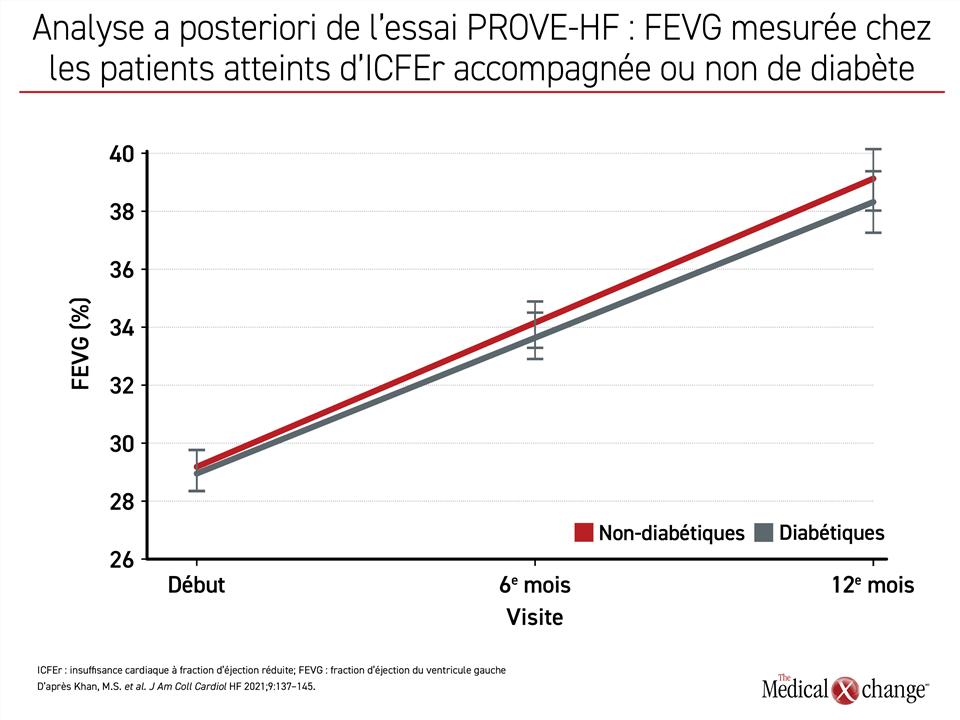
À la fin de l’essai, l’amélioration de la fonction cardiaque mesurée d’après la FEVG s’est aussi fait l’écho de celle enregistrée dans le groupe de sujets non diabétiques, passant de 28,3 % qu’elle était au début de l’essai à 37 %, soit un gain à peine inférieur à 9 % (Figure 3).
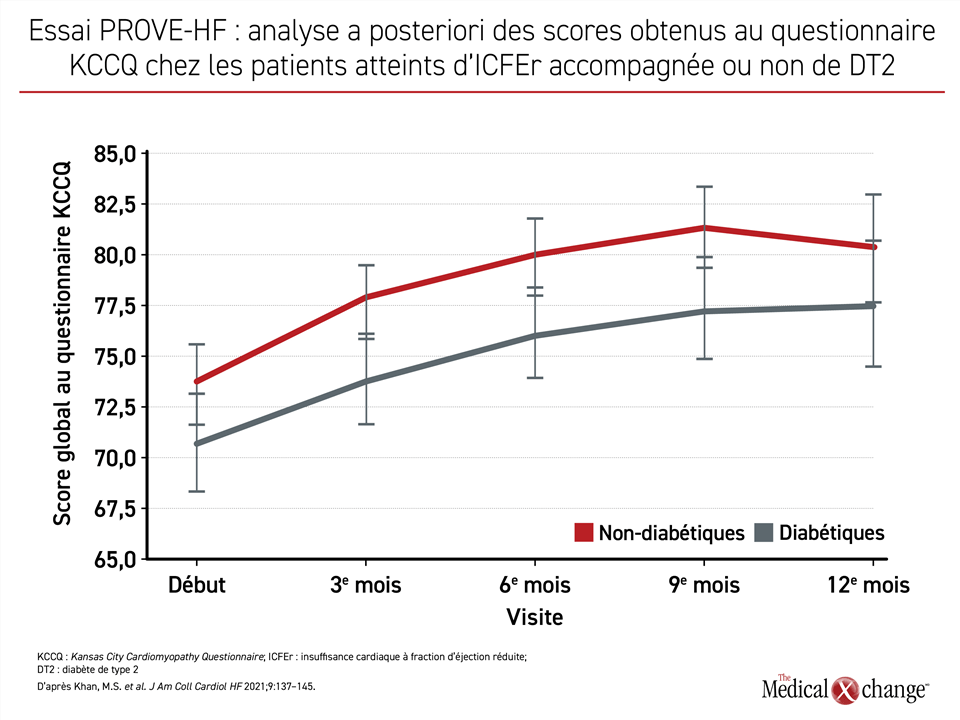
Les gains enregistrés pour la fonction cardiaque étaient significatifs sur le plan clinique que les patients soient atteints de DT2 ou non, selon les évaluations de la qualité de vie réalisées au bout de 2, 3, 4, 6, 7, 8, 9 et 12 mois à l’aide du questionnaire KCCQ-23 (Kansas City Cardiomyopathy Questionnaire). Les scores globaux et les scores de symptomatologie totaux obtenus au début de l’essai par les patients atteints de DT2 étaient légèrement inférieurs à ceux des sujets indemnes de cette maladie (60,4 vs 66,8 et 70,8 vs 76,0, respectivement), signes d’une moins bonne qualité de vie chez les patients diabétiques, mais les gains absolus enregistrés chez ces derniers étaient légèrement supérieurs à 6 et à 12 mois. Un gain de 5 points au questionnaire KCCQ est jugé significatif sur le plan clinique20, l’amélioration observée dans les deux groupes était donc vigoureuse. Au terme des 12 mois de l’essai, le score obtenu pour la symptomatologie avait augmenté dans les deux groupes. Même s’il est resté plus faible dans le groupe atteint de DT2 (83,3 vs 87,5), l’écart entre les deux groupes s’était aminci, ce qui porte à croire que le gain enregistré était à tout le moins aussi grand dans cette sous-population (Figure 4).
L’accession récente des inhibiteurs du SGLT2 au titre de pilier du traitement de l’ICFEr ne doit pas faire ombrage au rôle de l’ARNI en tant que l’un des quatre piliers du traitement pharmacologique fondamental dans ce sous-groupe important. Une analyse a posteriori de l’essai PROVE-HF a révélé que le remodelage cardiaque inverse et l’amélioration de la fonction cardiaque étaient d’une ampleur comparable que les patients soient atteints de DT2 ou non. Le risque d’incidents majeurs, dont une augmentation de 50 % du risque d’hospitalisation motivée par l’ICFEr, augmente énormément chez les patients atteints d’ICFEr et de DT219. En tant que composante du TMPLD, l’ARNI est au moins aussi important pour les patients atteints d’ICFEr aux prises avec un DT2 que ceux qui ne le sont pas.
L’ARNI, traitement de première intention de l’ICFEr préconisé dans les lignes directrices
Lorsque l’essai PARADIGM-HF a été mené, l’association sacubitril-valsartan en était encore au stade expérimental, ce qui justifiait l’augmentation très prudente de sa posologie pour des questions d’innocuité. Même si les patients affectés à l’ARNI ont subi moins d’effets indésirables marqués que ceux ayant reçu l’énalapril (p. ex., une hypotension symptomatique [2,7 % vs 1,4 %]), les premières lignes directrices thérapeutiques à s’inspirer du plan de l’essai PARADIGM-HF en appelaient à la prudence pour remplacer un inhibiteur du système angiotensine par l’ARNI. Le texte en question, qui recommande entre autres une période de sevrage entre les deux, peut avoir donné la fausse impression, surtout aux non-spécialistes, que l’amorce du traitement par l’ARNI est moins urgente que celle des autres piliers du traitement de l’ICFEr.
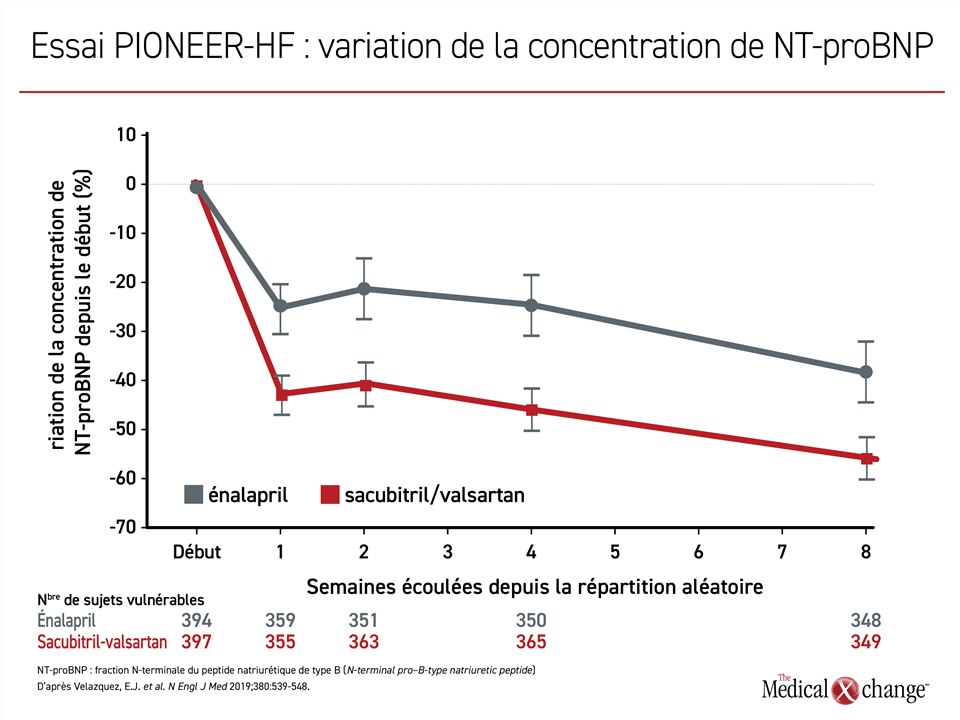
L’expérience acquise depuis avec l’association sacubitril-valsartan a permis d’accumuler des données probantes confirmant qu’elle peut être administrée sans problème pendant la première hospitalisation motivée par l’ICFEr. Lors de l’essai PIONEER-HF, le traitement par l’ARNI entrepris rapidement, y compris pendant les hospitalisations, a eu l’avantage sur l’énalapril en abaissant la concentration de NT-proBNP de façon plus marquée dès la première semaine21 (Figure 5). Même si la réduction des réhospitalisations pour cause d’IC de près de 50 % et la baisse de plus de 30 % des décès observées dans le groupe traité par l’association sacubitril-valsartan durant la période de suivi relativement courte de 8 semaines de l’essai PIONEER-HF n’ont pas franchi le seuil de la signification statistique, la possibilité d’abaisser rapidement la concentration de NT-proBNP de façon relativement sûre a servi de fondement aux recommandations actuelles en faveur de son administration rapide, y compris au moment de la première hospitalisation.
Les données collectées depuis que l’essai PARADIGM-HF est terminé confirment aussi l’efficacité et l’innocuité de l’ARNI. Une méta-analyse de 27 essais comparatifs menés avec répartition aléatoire a établi un parallèle entre cet agent et une baisse de 14 % des décès (RRI : 0,86; IC à 95 % : de 0,79 à 0,94)22. Les effets indésirables graves tels que l’hypokaliémie et l’œdème de Quincke étaient moins répandus chez les patients traités par l’ARNI (RRI : 0,89; IC à 95 % : de 0,86 à 0,93).
L’instauration d’un traitement par l’ARNI chez des patients atteints d’ICFEr qui n’ont jamais été exposés à un inhibiteur du système angiotensine est sûre et efficace23,24. D’ailleurs, le cheminement décisionnel de l’ACC recommandait d’avoir directement recours à l’ARNI9. Bien qu’ils préconisent une augmentation prudente de la posologie de ce médicament et des autres piliers du TMPLD de l’ICFEr, les auteurs de la version actualisée du cheminement décisionnel mettent de l’avant des stratégies précises pour contourner les obstacles à l’atteinte et au maintien des doses cibles des quatre piliers, dont l’ARNI. Ces stratégies sont orientées sur l’adhésion des patients, les coûts du traitement et les autres problèmes concrets s’opposant à l’optimisation des soins.
Il peut être bon pour les médecins de première ligne et les autres praticiens non spécialisés prenant en charge des cas d’ICFEr d’adresser certains de leurs patients à un spécialiste, comme ceux atteints d’arythmies ou de symptômes persistants réfractaires aux traitements classiques, ou ayant besoin d’un traitement inotrope chronique par voie intraveineuse. Cela dit, une telle orientation afin d’obtenir de l’aide pour déterminer la posologique optimale du TMPLD se justifie aussi.
La proportion de patients recevant les traitements classiques dans le cadre des essais phares ayant jeté les bases des troisième et quatrième piliers thérapeutiques de l’ICFEr était rassurante. Depuis près de 30 ans, le traitement de cette affection repose sur les β-bloquants et les inhibiteurs de l’ECA, maintenant supplantés par l’ARNI. La confirmation des bienfaits exercés par les ARM a suivi peu de temps après. Même si l’ajout de l’ARNI et des inhibiteurs du SGLT2 est récent, ces agents ne sont pas utilisés en appoint; ce sont bel et bien des traitements qui, à l’instar des traitements types antérieurs, doivent être systématiquement offerts à tous les patients ne présentant pas de contre-indications et entrepris le plus tôt possible une fois le diagnostic posé. Lors de l’essai PARADIGM-HF, par exemple, l’écart entre les courbes tracées pour les critères d’évaluation principaux était évident dès la première année de traitement25. L’obtention d’une réduction du risque optimale au moyen des quatre piliers du TMPLD de l’ICFEr repose sur leur utilisation concomitante.
Conclusion
Les quatre piliers du TMPLD de l’ICFEr sont appuyés par des données factuelles. Des essais déterminants ont en effet établi un parallèle entre chacun d’eux et une baisse des hospitalisations pour cause d’ICFEr et une prolongation de la survie. Les patients qui risquent le plus de connaître un sort néfaste, tels que les diabétiques, sont ceux qui en bénéficient le plus. Selon les lignes directrices de 2021 de la SCC, l’usage concomitant des quatre piliers du traitement de l’ICFEr constitue désormais un traitement à privilégier en première intention. La séquence optimale pour amorcer chacun de ces traitements n’est pas forcément la même pour tous les patients, mais il faut chercher à atteindre rapidement les doses cibles pour chacun d’eux. C’est grâce à la valeur ajoutée qu’ils apportent, soit le ralentissement, voire l’inversion, de l’évolution de la maladie, la prévention des hospitalisations motivées par l’ICFEr, l’amélioration de la qualité de vie et la prolongation de la survie, que ces traitements administrés en concomitance accèdent au titre de soins optimaux par définition.
Références
1. McMurray JJ, Packer M, Desai AS, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014;371(11):993-1004. DOI: 10.1056/NEJMoa1409077.
2. Januzzi JL, fils, Prescott MF, Butler J, et al. Association of Change in N-Terminal Pro-B-Type Natriuretic Peptide Following Initiation of Sacubitril-Valsartan Treatment With Cardiac Structure and Function in Patients With Heart Failure With Reduced Ejection Fraction. JAMA 2019:1-11. DOI: 10.1001/jama.2019.12821.
3. Khan MS, Felker GM, Pina IL, et al. Reverse Cardiac Remodeling Following Initiation of Sacubitril/Valsartan in Patients With Heart Failure With and Without Diabetes. JACC Heart Fail 2021;9(2):137-145. DOI: 10.1016/j.jchf.2020.09.014.
4. Ezekowitz JA, O’Meara E, McDonald MA, et al. 2017 Comprehensive Update of the Canadian Cardiovascular Society Guidelines for the Management of Heart Failure. Can J Cardiol 2017;33(11):1342-1433. DOI: 10.1016/j.cjca.2017.08.022.
5. O’Meara E, McDonald M, Chan M, et al. CCS/CHFS Heart Failure Guidelines: Clinical Trial Update on Functional Mitral Regurgitation, SGLT2 Inhibitors, ARNI in HFpEF, and Tafamidis in Amyloidosis. Can J Cardiol 2020;36(2):159-169. DOI: 10.1016/j.cjca.2019.11.036.
6. Packer M, Anker SD, Butler J, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med 2020;383(15):1413-1424. DOI: 10.1056/NEJMoa2022190.
7. Burnett H, Earley A, Voors AA, et al. Thirty Years of Evidence on the Efficacy of Drug Treatments for Chronic Heart Failure With Reduced Ejection Fraction: A Network Meta-Analysis. Circ Heart Fail 2017;10(1). DOI: 10.1161/CIRCHEARTFAILURE.116.003529.
8. McDonald M, Virani S, Chan M et Ducharme A. CCS/CHFS heart failure guidelines update: defining a new pharmacologic standard of care for heart failure with reduced ejection fraction. Can J Cardiol 2021;37:531-546.
9. Writing C, Maddox TM, Januzzi JL, fils, et al. 2021 Update to the 2017 ACC Expert Consensus Decision Pathway for Optimization of Heart Failure Treatment: Answers to 10 Pivotal Issues About Heart Failure With Reduced Ejection Fraction: A Report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol 2021;77(6):772-810. DOI: 10.1016/j.jacc.2020.11.022.
10. Vaduganathan M, Claggett BL, Jhund PS, et al. Estimating lifetime benefits of comprehensive disease-modifying pharmacological therapies in patients with heart failure with reduced ejection fraction: a comparative analysis of three randomised controlled trials. Lancet 2020;396(10244):121-128. DOI: 10.1016/S0140-6736(20)30748-0.
11. Huitema AA, Daoust A, Anderson K, et al. Optimal Usage of Sacubitril/Valsartan for the Treatment of Heart Failure: The Importance of Optimizing Heart Failure Care in Canada. CJC Open 2020;2(5):321-327. DOI: 10.1016/j.cjco.2020.03.015.
12. Dzau VJ, Antman EM, Black HR, et al. The cardiovascular disease continuum validated: clinical evidence of improved patient outcomes: part I: Pathophysiology and clinical trial evidence (risk factors through stable coronary artery disease). Circulation 2006;114(25):2850-2870. DOI: 10.1161/CIRCULATIONAHA.106.655688.
13. Hartupee J et Mann DL. Neurohormonal activation in heart failure with reduced ejection fraction. Nat Rev Cardiol 2017;14(1):30-38. DOI: 10.1038/nrcardio.2016.163.
14. Magnusson M, Melander O, Israelsson B, Grubb A, Groop L et Jovinge S. Elevated plasma levels of Nt-proBNP in patients with type 2 diabetes without overt cardiovascular disease. Diabetes Care 2004;27(8):1929-1935. DOI: 10.2337/diacare.27.8.1929.
15. McMurray JJ. Neprilysin inhibition to treat heart failure: a tale of science, serendipity, and second chances. Eur J Heart Fail 2015;17(3):242-247. DOI: 10.1002/ejhf.250.
16. Pastormerlo LE, Mammini C, Giannoni A, et al. Glycosylated haemoglobin is associated with neurohormonal activation and poor outcome in chronic heart failure patients with mild left ventricular systolic dysfunction. J Cardiovasc Med (Hagerstown) 2015;16(6):423-430. DOI: 10.2459/JCM.0000000000000159.
17. Nichols GA, Gullion CM, Koro CE, Ephross SA et Brown JB. The incidence of congestive heart failure in type 2 diabetes: an update. Diabetes Care 2004;27(8):1879-1884. DOI: 10.2337/diacare.27.8.1879.
18. Greenberg BH, Abraham WT, Albert NM, et al. Influence of diabetes on characteristics and outcomes in patients hospitalized with heart failure: a report from the Organized Program to Initiate Lifesaving Treatment in Hospitalized Patients with Heart Failure (OPTIMIZE-HF). Am Heart J 2007;154(2):277 e1-8. DOI: 10.1016/j.ahj.2007.05.001.
19. Dunlay SM, Givertz MM, Aguilar D, et al. Type 2 Diabetes Mellitus and Heart Failure: A Scientific Statement From the American Heart Association and the Heart Failure Society of America: This statement does not represent an update of the 2017 ACC/AHA/HFSA heart failure guideline update. Circulation 2019;140(7):e294-e324. DOI: 10.1161/CIR.0000000000000691.
20. Luo N, O’Connor CM, Cooper LB, et al. Relationship between changing patient-reported outcomes and subsequent clinical events in patients with chronic heart failure: insights from HF-ACTION. Eur J Heart Fail 2019;21(1):63-70. DOI: 10.1002/ejhf.1299.
21. Velazquez EJ, Morrow DA, DeVore AD, et al. Angiotensin-Neprilysin Inhibition in Acute Decompensated Heart Failure. N Engl J Med 2019;380(6):539-548. DOI: 10.1056/NEJMoa1812851.
22. Nielsen EE, Feinberg JB, Bu FL, et al. Beneficial and harmful effects of sacubitril/valsartan in patients with heart failure: a systematic review of randomised clinical trials with meta-analysis and trial sequential analysis. Open Heart 2020;7(2). DOI: 10.1136/openhrt-2020-001294.
23. Myhre PL, Vaduganathan M, Claggett B, et al. B-Type Natriuretic Peptide During Treatment With Sacubitril/Valsartan: The PARADIGM-HF Trial. J Am Coll Cardiol 2019;73(11):1264-1272. DOI: 10.1016/j.jacc.2019.01.018.
24. Senni M, McMurray JJV, Wachter R, et al. Impact of systolic blood pressure on the safety and tolerability of initiating and up-titrating sacubitril/valsartan in patients with heart failure and reduced ejection fraction: insights from the TITRATION study. Eur J Heart Fail 2018;20(3):491-500. DOI: 10.1002/ejhf.1054.
25. Sokos GG et Raina A. Understanding the early mortality benefit observed in the PARADIGM-HF trial: considerations for the management of heart failure with sacubitril/valsartan. Vasc Health Risk Manag 2020;16:41-51. DOI: 10.2147/VHRM.S197291.