Rhumatologie
Réunion annuelle en ligne de l’European Alliance of Associations for Rheumatology (EULAR) de 2021
La prolongation des essais SELECT-PsA 1 et SELECT-PsA 2 met au jour une efficacité persistante contre l’arthrite psoriasique
Réunion en ligne – Les données issues de deux essais de phase III déterminants prolongés à 56 semaines sur l’emploi d’un inhibiteur des JAK de nouvelle génération pour maîtriser l’arthrite psoriasique (AP) sont très importantes pour la prise en charge à long terme de cette maladie. À 56 semaines, la plus faible des deux doses, et la mieux tolérée, a produit des résultats similaires à ceux de la plus forte. Ces essais, l’un mené chez des patients jamais traités par des agents biologiques et l’autre, chez des patients qui y avaient déjà été exposés, ont abouti au même constat. Comme l’AP exige un traitement chronique, l’intérêt de ces données ne concerne pas seulement l’efficacité, mais l’innocuité et la qualité de vie aussi.
Les nouvelles données présentées devant l’EULAR complètent celles recueillies à la 24e semaine de l’essai SELECT-PsA 1 (McInnes, I. et al. N Engl J Med 2021;384:1227-1239). Seule la dose de 30 mg d’upadacitinib, l’inhibiteur des JAK de nouvelle génération, y a fait preuve d’un avantage significatif sur l’adalimumab, un agent biologique, pour le principal paramètre d’évaluation, soit une baisse d’au moins 20 % du nombre d’articulations sensibles ou enflées et une amélioration minimale de 20 % dans au moins trois autres domaines sur cinq selon les critères de l’American College of Rheumatology (ACR20). L’avantage numérique de la dose de 15 mg n’a pas atteint la signification statistique.
Pour une entrevue exclusive avec la Dre Sherry Rohekar couvrant l’impact sur la pratique clinique, cliquez ici
Ces données montrent qu’à la 56e semaine, l’efficacité de la dose de 15 mg dose d’upadacitinib au regard du paramètre d’évaluation principal et de la plupart des autres paramètres d’évaluation de l’efficacité était similaire dans l’essai SELECT-PsA 1 réalisé chez des patients jamais traités par des agents biologiques et dans l’essai SELECT-PsA 2 mené chez des patients qui y avaient été exposés. Les données du programme SELECT ont récemment incité Santé Canada à homologuer l’upadacitinib pour le traitement de l’AP.
Les essais contrôlés par placebo SELECT-PsA 1 et SELECT-PsA 2 comptaient tous les deux des groupes de traitement par l’agent expérimental, l’upadacitinib à 15 ou à 30 mg. L’essai SELECT-PsA 1 comportait un quatrième groupe de sujets affectés aléatoirement à de l’adalimumab. À 24 semaines, les deux doses ayant affiché un avantage significatif sur le placebo pour le paramètre d’évaluation principal, le placebo a été remplacé par de l’upadacitinib dans les deux essais pour la durée de la phase de prolongation. Les sujets affectés d’emblée à l’upadacitinib ont donc reçu cet agent pendant 56 semaines.
Taux de maîtrise de la maladie inchangés à la 56e semaine
À la 56e semaine, les taux de maîtrise de la maladie obtenus chez les témoins ayant remplacé le placebo par l’upadacitinib étaient comparables à ceux des sujets affectés d’emblée à cet agent. Selon le Dr Iain McInnes, directeur de l’Institut d’infectiologie, d’immunologie et de l’inflammation, de l’Université de Glasgow, au R.-U., l’efficacité du traitement chez ces derniers n’avait pas fléchi par rapport à la 24e semaine. Il l’a même qualifiée de « somme toute similaire », quoique l’amélioration graduelle de la réponse des sujets affectés à l’upadacitinib à 15 mg ait fini par effacer le léger écart entre les deux groupes de traitement actif.
Même si dans son résumé le Dr McInnes faisait référence aux résultats de l’essai SELECT-PsA 1, dont il était le chercheur principal, celui-ci pourrait aussi s’appliquer à l’essai SELECT-PsA 2.
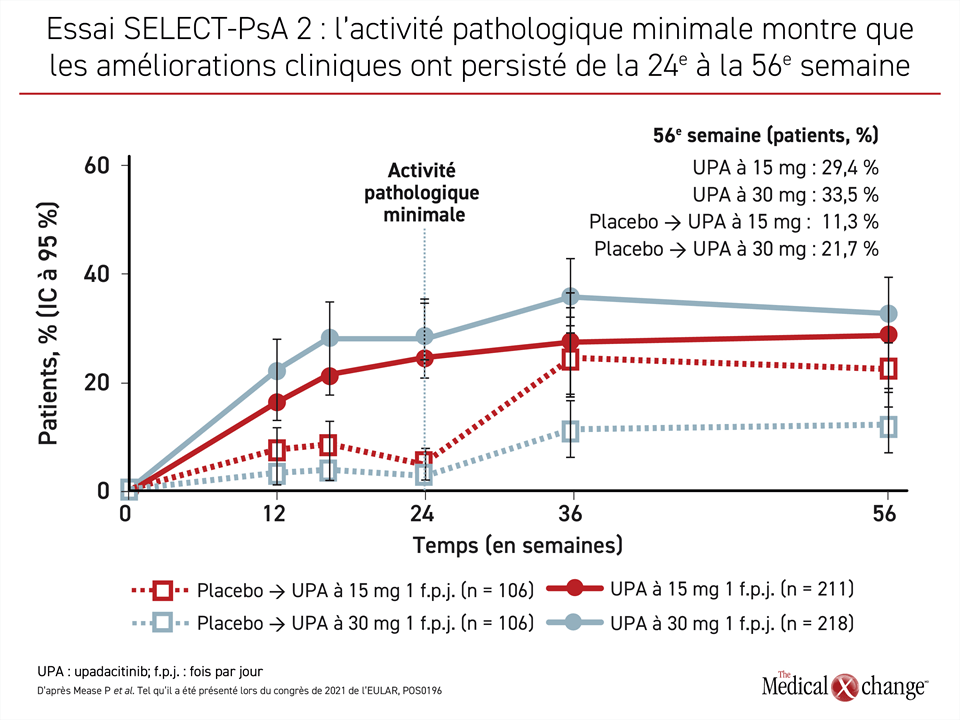
Chez les sujets déjà exposés aux agents biologiques de l’essai SELECT-PsA 2, une maîtrise durable de la maladie a été observée, et ce même pour les critères les plus contraignants tels que les taux de réponse ACR50 et ACR70. Pour ceux-ci et pour l’ACR20, le paramètre d’évaluation principal, les taux de maîtrise de la maladie enregistrés à la 56e semaine étaient à peu près les mêmes que ceux obtenus à la 24e ou à la 36e semaine. Quant au paramètre « activité pathologique minimale », l’effet positif vu dans le groupe traité à la dose de 15 mg avait atteint la même ampleur que celui obtenu avec la dose de 30 mg (Figure 1).
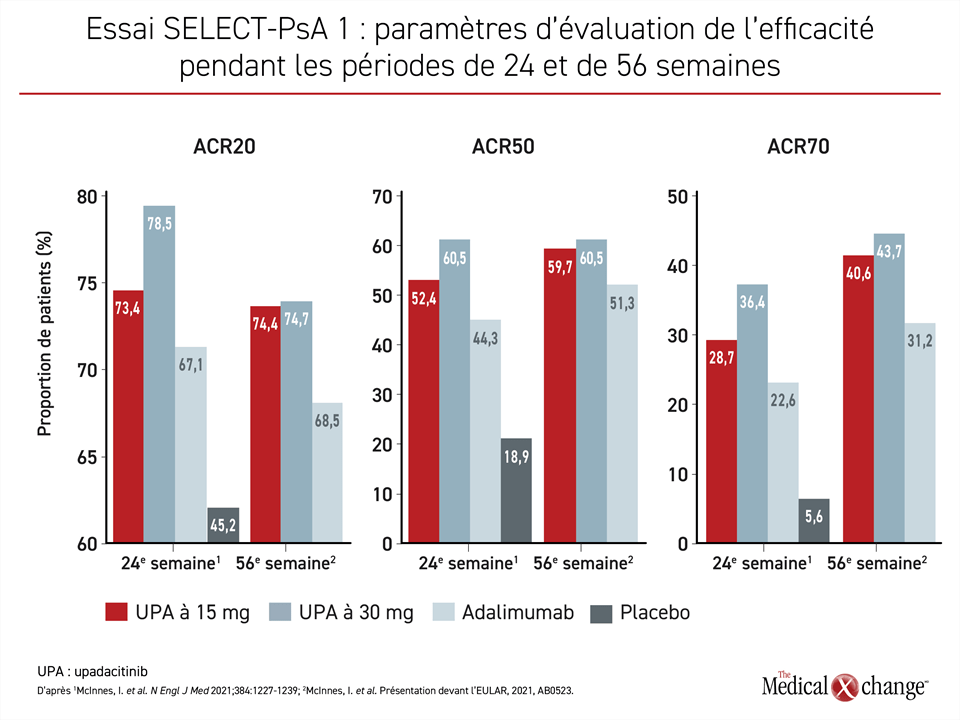
Un scénario similaire a été observé pendant l’essai SELECT-PsA 1. À la 12e semaine, les taux de réponse ACR20 ont été plus élevés avec l’upadacitinib à 15 et à 30 mg qu’avec l’adalimumab. Il faut toutefois savoir que la dose de 30 mg a eu l’avantage sur celle de 15 mg pour la plupart des paramètres d’évaluation. Cela dit, pendant la période de prolongation, les taux de réponse ont augmenté davantage chez les sujets recevant la dose de 15 mg que chez ceux prenant celle de 30 mg au point où l’écart entre les deux a été presque entièrement comblé (Figure 2).
Essai SELECT-PsA 1 : patients jamais traités par des agents biologiques auparavant
Pour l’essai SELECT-PsA 1, 1704 patients atteints d’AP jamais exposés aux agents biologiques ont été répartis aléatoirement en quatre groupes. Dans trois d’entre eux, les patients ont pris des doses quotidiennes de 15 mg ou de 30 mg d’upadacitinib, ou un placebo. Dans le quatrième, les sujets recevaient une injection sous-cutanée de 40 mg d’adalimumab toutes les deux semaines. Le taux de réponse ACR20 obtenu à 12 semaines (paramètre d’évaluation principal) s’élevait à 70,6 % et à 78,5 % avec les doses de 15 et de 30 mg d’upadacitinib, et à 36,3 % dans le groupe placebo (p < 0,001 versus l’une ou l’autre des doses d’upadacitinib). Le taux de réponse enregistré avec l’adalimumab était de 65,0 %.
Numériquement parlant, presque tous les résultats de l’essai SELECT-PsA 1 publiés étaient à l’avantage des deux doses d’upadacitinib au détriment de l’adalimumab, y compris les mesures de l’activité pathologique cutanée. Les taux de réponse enregistrés à la 16e semaine pour l’indice PASI 75 (75% Psoriasis Area Severity Index) s’élevaient à 62,6 %, à 62,4 % et à 53,1 % pour l’upadacitinib à 15 mg, l’upadacitinib à 30 mg et l’adalimumab. Quant à l’activité pathologique minimale, on a mesuré des taux de 36,6 %, de 45,4 % et de 33,3 %, respectivement à la 24e semaine.
Selon les données de la 56e semaine présentées lors du congrès de l’EULAR, la différence d’efficacité observée à la 24e semaine, notamment avec l’adalimumab, s’est maintenue ou améliorée. Les taux de réponse obtenus à 24 semaines pour l’activité pathologique minimale, par exemple, étaient de 36,6 % contre 45,4 % pour les doses de 15 et de 30 mg d’upadacitinib. À la 56e semaine, ils s’élevaient à 44,8 % contre 47,3 %.
Quant aux mesures de l’activité pathologique cutanée, les taux de réponse obtenus à la 56e semaine avec les doses de 15 et de 30 mg étaient très proches selon l’analyse réalisée à l’insu. Pour l’indice PASI 75, par exemple, aux 16e et 56e semaines, le taux de réponse calculé pour la dose de 15 mg se chiffrait à 62,6 % et à 62,4 %, alors qu’il s’élevait à 62,4 % et à 63,3 % pour la dose de 30 mg. Une maîtrise stable de la maladie a également été observée à la 56e semaine chez les sujets affichant un indice PASI 90 ou PASI 100 à la 16e semaine.
Essai SELECT-PsA 2 : patients déjà exposés à plus d’un agent biologique, mais sans succès
Même si le traitement des patients déjà exposés aux agents biologiques peut être plus problématique, les résultats obtenus dans cet effectif à la 56e semaine de l’essai SELECT-PsA 2 étaient comparables à ceux publiés antérieurement pour la 24e semaine (Mease, P.J. Ann Rheum Dis 2021;80:312-320). Dans cet essai, 644 patients ont été affectés aléatoirement à de l’upadacitinib à 15 mg, à de l’upadacitinib à 30 mg ou à un placebo. Plus de 25 % d’entre eux avaient reçu sans succès au moins deux agents biologiques.
À la 24e semaine, 56,9 % des sujets affectés à l’upadacitinib à 15 mg et 63,8 % de ceux affectés à l’upadacitinib à 30 mg respectaient le paramètre d’évaluation principal en affichant une réponse ACR20; ils étaient 24,1 % dans le groupe témoin (p < 0,001 pour les deux doses versus le placebo). Pendant la phase de prolongation, qui a commencé quand le placebo a été remplacé par l’upadacitinib chez les témoins, les sujets affectés d’emblée à l’upadacitinib n’ont subi aucune perte d’efficacité pendant que les témoins passés à cet agent les rattrapaient presque.
Comme ce fut le cas pendant l’essai SELECT-PsA 1, le gain en efficacité enregistré avec l’upadacitinib à 15 mg entre la 24e et la 56e semaine a été substantiel.
Efficacité similaire des doses de 15 et de 30 mg à 56 semaines
Le Dr Philip J. Mease, directeur de la Recherche en rhumatologie au Centre médical Swedish, de Seattle, Washington, et clinicien-chercheur principal de l’essai SELECT-PsA 2 a déclaré : « Grâce aux améliorations observées avec la dose de 15 mg d’upadacitinib, les résultats enregistrés dans ce groupe au terme de la phase de prolongation étaient similaires à ceux obtenus avec la dose de 30 mg ou s’en approchaient ».
À preuve, à 56 semaines, les taux de réponse ACR20 de 59,7 % contre 59,2 % et d’indice PASI 75 de 52,3 % contre 58,8 %, de même que ceux enregistrés pour les critères ACR et PASI plus contraignants. À ce même intervalle de mesure, parmi les sujets qui présentaient une dactylite au départ, 50,9 % et 58,0 % de ceux traités respectivement par l’upadacitinib à 15 mg et à 30 mg ont vu ce problème se résorber complètement. Les cas de disparition complète d’une enthésite s’élevaient à 42,9 % et à 42,8 %, respectivement.
« Les résultats enregistrés dans le groupe traité par l’upadacitinib à 15 mg au terme de la phase de prolongation étaient similaires à ceux obtenus avec la dose de 30 mg ou s’en approchaient. »
Que les patients aient affiché une réponse insuffisante à un agent biologique ou à plusieurs dotés de modes d’action différents, la stratification de la réponse obtenue chez eux à la 56e semaine a permis de constater l’effet positif que l’upadacitinib a exercé sur l’ensemble des manifestations cliniques, dont les symptômes musculosquelettiques, le psoriasis, le dysfonctionnement physique ou la fatigue. C’est ce qu’a révélé une sous-analyse de l’essai SELECT-PsA 2 présentée séparément devant l’EULAR par le Dr Mease. Plus précisément, ces effets ont été observés que les patients aient déjà reçu ou non un inhibiteur du TNF, un inhibiteur de l’IL-17 ou les deux types de ces agents.
Par exemple, il est ressorti de l’évaluation de la maîtrise globale de la maladie d’après l’activité pathologique minimale (un paramètre d’évaluation composé des éléments suivants : arthropathie, dermatopathie, douleur et mesures de la qualité de vie) que la maîtrise de la maladie évaluée d’après le nombre ou le type d’exposition antérieure à un agent biologique « était généralement comparable avec l’une ou l’autre des doses d’upadacitinib », a déclaré le Dr Mease.
Programme d’essais cliniques SELECT : la phase de prolongation fournit de nouveaux renseignements sur l’innocuité
L’innocuité de l’upadacitinib durant le traitement prolongé a été examinée en détail pendant les essais SELECT-PsA 1 et SELECT-PsA 2. Les chercheurs n’ont rien relevé de nouveau ou d’inattendu à ce chapitre, mais le suivi de longue durée a confirmé ce que l’on savait déjà, à savoir que la dose de 15 mg d’upadacitinib est habituellement mieux tolérée et provoque moins d’effets indésirables que celle de 30 mg.
Lors de l’essai SELECT-PsA 1, les effets indésirables graves ou non liés au traitement, y compris les infections graves, se sont produits à une fréquence comparable dans le groupe upadacitinib à 15 mg et dans le groupe adalimumab. Seule exception, le zona, qui a été plus répandu avec l’upadacitinib. Il est ressorti de la comparaison entre l’upadacitinib à 30 mg et l’upadacitinib à 15 mg ou l’adalimumab, que les infections en général et le zona plus particulièrement, de même que les infections graves ont été plus fréquentes avec la dose élevée, quoique les écarts aient été faibles. Les taux confirmés de manifestations cardiovasculaires (CV), de thromboembolie veineuse et de cancer ne différaient pas d’un groupe à l’autre.
Lors de l’essai SELECT-PsA 2, qui ne comportait pas d’agent de comparaison actif, les taux enregistrés pour plusieurs effets indésirables survenus pendant le traitement étaient plus élevés avec la dose de 30 mg d’upadacitinib qu’avec celle de 15 mg, mais l’écart était généralement modeste. Étaient plus nombreux, entre autres, les cas de zona (8,5 % vs 3,8 %) et d’infections graves (6,1 % vs 2,6 %), et les signes d’un dysfonctionnement hépatique tels qu’une hausse des concentrations d’enzymes hépatiques (17,7 % vs 4,8 %). L’incidence des troubles hématologiques par tranche de 100 années-patients corrigée en fonction de l’exposition, comme la neutropénie (3,1 vs 1,0), l’anémie (5,4 vs 2,1) et la lymphopénie (2,4 vs 0,7) était faible dans les deux groupes, mais plus élevée avec la dose de 30 mg. Comme ce fut le cas pendant l’essai SELECT-PsA 1, rien n’a laissé suggérer que le risque d’incidents CV ou thromboemboliques, ou de cancer puisse être plus élevé.
La dose de 15 mg est généralement mieux tolérée
Une analyse distincte de l’ensemble des données sur l’innocuité recueillies pendant les deux essais faisait partie d’une présentation donnée devant l’EULAR par le Dr Gerd Burmester, directeur du Département de rhumatologie et d’immunologie clinique, de l’Hôpital de la Charité de l’Université Humboldt, à Berlin, en Allemagne. Les conclusions tirées de cette vaste série de données étaient les mêmes : la dose de 30 mg d’upadacitinib comporte généralement un risque légèrement plus grand d’effets indésirables que celle de 15 mg. Les bilans d’innocuité de la dose de 15 mg d’upadacitinib et de l’adalimumab ont été qualifiés de comparables, quoique le zona ait été observé plus souvent avec l’upadacitinib.
Cette analyse de plus grande envergure de l’innocuité a porté sur 2257 patients, ce qui a permis d’examiner de plus près certains effets indésirables particuliers. Dans le cas du zona, par exemple, le Dr Burmester a rapporté que la plupart de ces infections s’étaient limitées à un seul dermatome. À ce jour, aucun cas de zona n’a touché le système nerveux central ou un organe interne. Les effets indésirables de nature hépatique ont « surtout pris la forme de hausses passagères et bénignes de la transaminasémie », a-t-il affirmé. Les signes de troubles hématologiques, comme la neutropénie et la lymphopénie, « étaient ordinairement légers ou modérés et bénins ».
Une tolérabilité comparable dans les études sur l’AP et sur la PR
« Le bilan d’innocuité de l’upadacitinib dressé pendant le programme d’essais cliniques SELECT PsA cadrait avec celui observé dans les cas de polyarthrite rhumatoïde », a conclu le Dr Burmester.
Les agents biologiques ont marqué une avancée majeure dans le traitement de l’AP, mais des agents ciblés sont venus enrichir les options destinées aux patients ayant réagi insuffisamment aux antirhumatismaux de fond classiques. Les nouveaux agents à prise orale ont un rôle évident à jouer chez les patients qui ne peuvent pas recevoir de médicaments injectables ou qui préfèrent ceux administrés par voie orale. Pour l’heure, l’upadacitinib est le seul agent ciblé qui se montre plus efficace qu’un inhibiteur du TNF contre l’AP.
« Le bilan d’innocuité de l’upadacitinib dressé pendant le programme d’essais cliniques SELECT cadrait avec celui observé dans les cas de polyarthrite rhumatoïde ».
Conclusion
Les données tirées de la prolongation de deux essais de phase III menés sur l’emploi de l’upadacitinib dans le traitement de l’AP, soit les essais SELECT-PsA 1 et SELECT-PsA 2, confirment l’efficacité soutenue de cet agent durant 56 semaines et l’absence de tout signe inquiétant et jusque là inconnu en matière d’innocuité. Ces données ont aussi mis au jour un phénomène de rattrapage au cours duquel l’efficacité de la dose de 15 mg, qui est mieux tolérée, avait rattrapé ou presque celle de la dose de 30 mg pour la plupart des paramètres d’évaluation à la fin des 56 semaines. L’upadacitinib à 15 mg est maintenant homologué au Canada pour le traitement de l’AP. L’offre d’un nouvel agent à prise orale efficace devrait se révéler utile pour maîtriser une maladie qui bénéficierait d’un arsenal thérapeutique plus riche.