Hématologie
Réunion annuelle de 2021 de l’American Society of Clinical Oncology (ASCO)
Données d’un essai comparatif direct et du suivi prolongé d’un inhibiteur de la BTK simplifient le choix du traitement en LLC
Réunion en ligne – Un essai comparatif mené sur deux inhibiteurs à petite molécule souvent opposés à la leucémie lymphoïde chronique (LLC) déjà traitée a permis de cerner les points forts de chacun d’eux. Les anticorps monoclonaux et les agents ciblés étant en voie de supplanter la chimiothérapie classique dans les stades peu ou très avancés de la LLC, il a fourni des données objectives très attendues sur les points forts des nouvelles options thérapeutiques. Cet essai, ELEVATE-RR, révèle qu’un inhibiteur de la tyrosine kinase de Bruton (BTK) de nouvelle génération est mieux toléré et aussi efficace que le premier agent de cette classe. Les données à long terme d’un autre essai, ELEVATE-TN, étayent son efficacité et son innocuité en première ligne.
L’essai ELEVATE-RR est le premier qui ait servi à comparer deux inhibiteurs de la BTK chez des patients déjà traités contre une LLC. Après répartition aléatoire, 533 de ces patients y ont pris de l’acalabrutinib à 100 mg 2 fois par jour (inhibiteur de la BTK de nouvelle génération récemment homologué) ou de l’ibrutinib à 420 mg 1 fois par jour (inhibiteur de la BTK de première génération). Conçu pour démontrer la non-infériorité des deux agents pour le paramètre d’évaluation principal, soit la survie sans progression (SSP), le plan expérimental hiérarchique a fait ressortir l’avantage marqué du plus récent pour plusieurs effets indésirables très préoccupants observés avec l’inhibiteur de la BTK de première génération.
Pour une entrevue exclusive avec le Dr Stéphane Doucet couvrant l’impact sur la pratique clinique, cliquez ici
Des inhibiteurs de la BTK qui se distinguent par leurs effets indésirables
Par rapport à l’ibrutinib, « l’acalabrutinib a moins souvent provoqué d’effets indésirables courants, d’effets indésirables de grade 3 ou plus, d’effets indésirables graves et d’abandons du traitement pour cause d’effet indésirable en général », a rapporté le Dr John C. Byrd, président de la Recherche sur la leucémie, au Collège de médecine de l’Université de l’Ohio, à Columbus. Ces résultats corroborent l’hypothèse de l’essai voulant que la plus grande sélectivité de l’acalabrutinib pour la BTK réduise le risque d’effets nocifs ailleurs dans l’organisme, d’où une meilleure tolérabilité.
L’acalabrutinib a moins souvent provoqué d’effets indésirables courants, d’effets indésirables de grade 3 ou plus, et d’effets indésirables graves.
Pour être recrutés, les patients devaient déjà avoir été traités contre leur LLC, afficher un indice fonctionnel ECOG de 2 ou moins, être porteurs de la délétion 17p (del(17p)) ou de la délétion 11q (del(11q)). Des stratifications programmées des résultats ont été réalisées selon les critères suivants : présence ou absence de la del(17p), 3 traitements antérieurs ou moins versus 4 ou plus, et indice fonctionnel maximal de 1 versus 2. En étaient écartés les patients déjà exposés à un inhibiteur de la BTK ou au vénétoclax, un inhibiteur de BCL-2.
Un plan expérimental hiérarchique reposant sur la non-infériorité
Selon le plan expérimental hiérarchique de l’essai ELEVATE-RR, les paramètres d’évaluation secondaires ne pouvaient être étudiés tant que la non-infériorité n’était pas confirmée. De plus, la supériorité de l’acalabrutinib pour chacun d’eux, c’est-à-dire le flutter ou la fibrillation auriculaire (flutter/FA), les infections de grade 3 ou plus, le syndrome de Richter (SR) et la survie globale (SG), devait être confirmée dans l’ordre. Autrement dit, les chercheurs ne pouvaient se pencher sur le taux d’infection de grade 3 ou plus si la supériorité de l’acalabrutinib n’avait pas d’abord été établie pour le flutter/FA. De la même façon, le taux de SR ou la SG ne pouvait être examiné si la supériorité de l’acalabrutinib pour les infections de grade 3 ou plus n’avait pas été démontrée.
Les deux inhibiteurs de la BTK se sont comportés de façon comparable pour la SSP, le paramètre d’évaluation principal, ce qui a été corroboré par un comité d’examen indépendant. Selon le Dr Byrd, au terme d’un suivi médian de 40,9 mois, la SSP médiane s’élevait à 38,4 mois dans les deux groupes, d’où un rapport des risques instantanés (RRI) de 1,0 soit le critère d’équivalence défini statistiquement.
Les stratifications programmées, dont celles réalisées en fonction de l’indice fonctionnel initial, de la présence de la del(17p) ou du nombre de traitements antérieurs, n’ont fait ressortir aucune différence significative, pas plus que celles opposant les patients âgés de 65 ou plus à ceux de moins de 65 ans, ainsi que les femmes aux hommes, les patients atteints d’une tumeur volumineuse (5 cm ou plus) à ceux porteurs d’une plus petite tumeur ou la présence à l’absence de mutations dans la région variable de la chaîne lourde des immunoglobulines (IgVH).
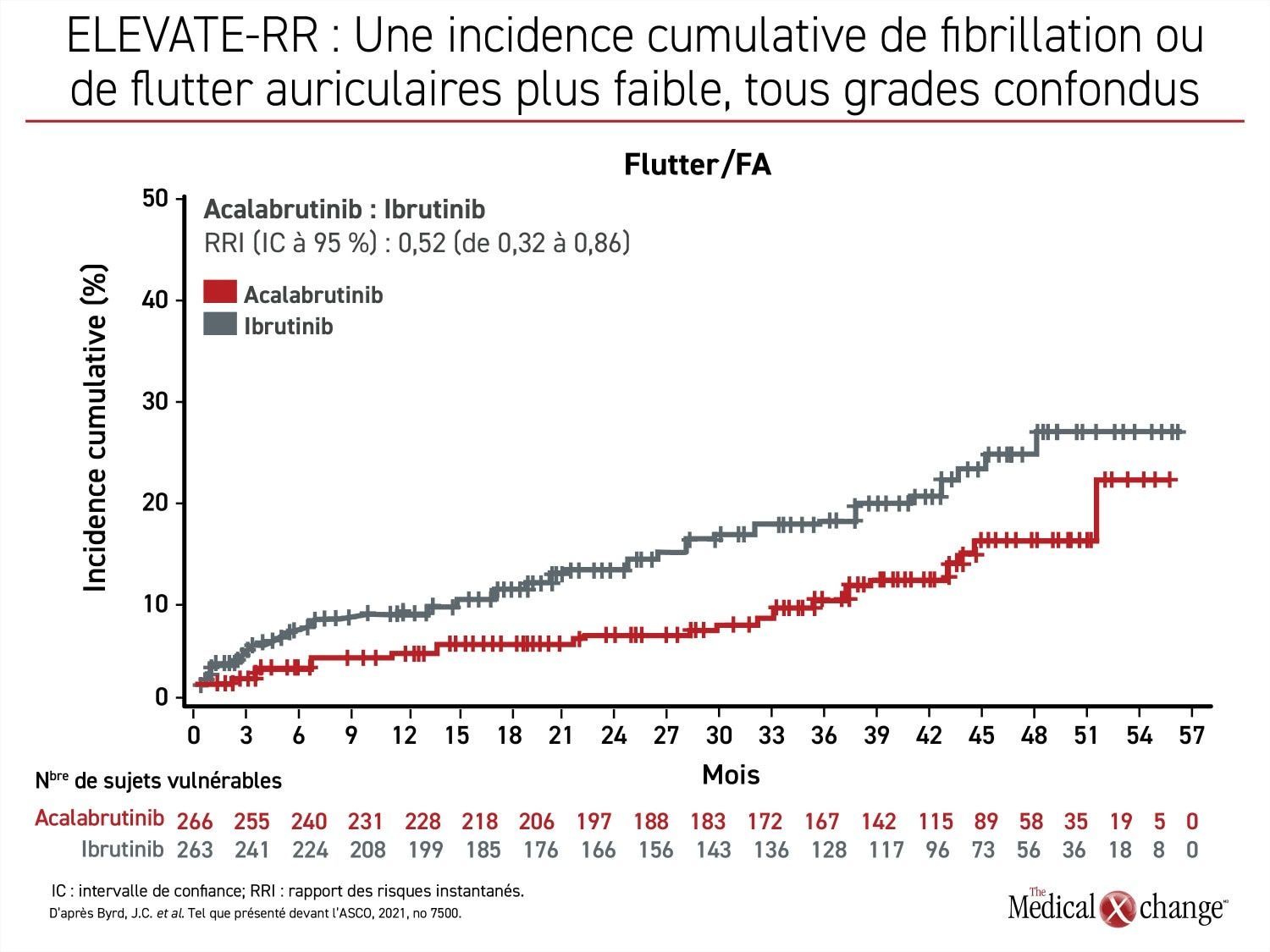
Des taux de fibrillation ou de flutter auriculaires significativement plus bas
La non-infériorité ayant été éprouvée pour la SSP, la supériorité de l’acalabrutinib sur l’ibrutinib pour le flutter/FA a pu être évaluée. Or l’acalabrutinib a produit un taux de flutter/FA par tranche de 100 mois-patients correspondant à environ la moitié de celui obtenu avec l’ibrutinib (0,366 vs 0,721; p = 0,02) (Figure 1). Chez les patients exempts de tout antécédent de flutter/FA, il était plus faible de près de 60 % (6,2 % vs 14,9 %).
Aucun cas de flutter/FA n’a motivé l’abandon du traitement par l’acalabrutinib comparativement à 16,7 % des cas dans le groupe ibrutinib. Chez les patients qui en ont été atteints, le délai médian entre le début du traitement et leur apparition était de 16 mois avec l’ibrutinib et de 29 mois avec l’acalabrutinib.
À ce jour, aucune différence significative n’a été relevée entre les deux groupes de l’étude pour les autres paramètres d’évaluation secondaires. Pour ce qui est des infections de grade 3 ou plus, les taux enregistrés se chiffraient à 30,8 % et à 30,0 % avec l’acalabrutinib et l’ibrutinib, respectivement. Quant au SR, le taux obtenu dans le groupe acalabrutinib, quoique plus faible (3,8 % vs 4,9 %), n’a pas franchi le seuil de la signification statistique. De même, la mortalité enregistrée jusqu’à maintenant est plus faible dans le groupe acalabrutinib (23,5 % vs 27,5 %), mais les intervalles de confiance s’étendent à l’extérieur des bornes fixées pour que la différence soit significative (RRI : 0,82; IC à 95 % : de 0,59 à 1,15).
Moins de décès imputables aux effets indésirables
Le bilan global de l’innocuité était à l’avantage de l’acalabrutinib et témoignait de taux plus faibles pour les effets indésirables de grade 3 ou plusen général (68,8 % vs 74,9 %), les effets indésirables graves (53,8 % vs 58,6 %), les effets indésirables menant à l’abandon du traitement (14,7 % vs 21,3 %) et les décès imputés à un effet indésirable (6,4 % vs 9,5 %).
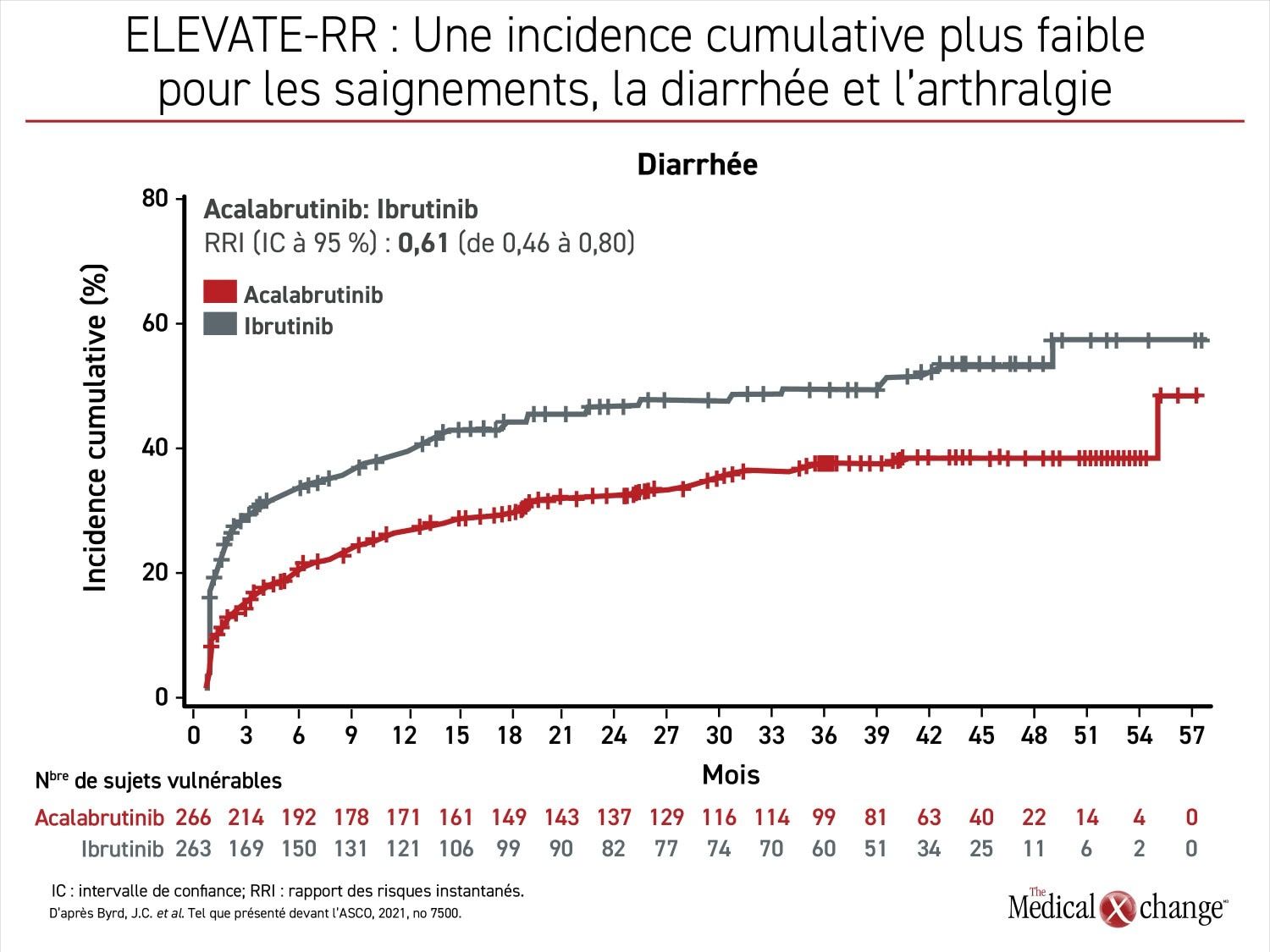
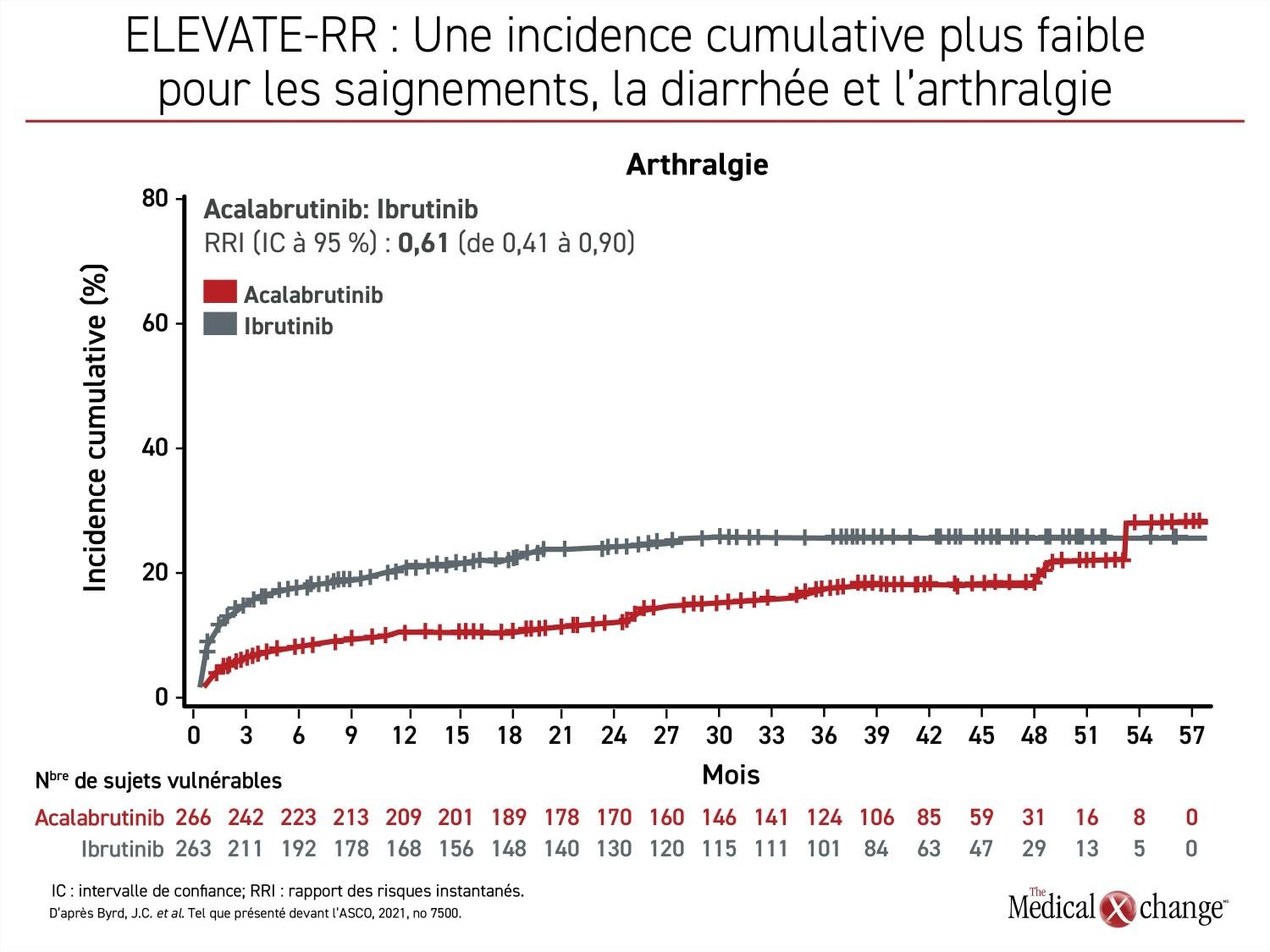
Hormis la fibrillation auriculaire, les effets indésirables tous grades confondus les plus fréquents avec l’ibrutinib étaient la diarrhée (46,0 % vs 34,6 %), l’arthralgie (22,8 % vs 15,8 %), l’hypertension (22,8 % vs 8,6 %) et la confusion (18,3 % vs 11,1 %) (Figure 2a), (Figure 2b), et (Figure 2c) mais les céphalées (20,2 % vs 34,6 %) et la toux (21,3 % vs 28,9 %) l’étaient moins. La diarrhée (4,9 % vs 1,1 %) et l’hypertension (8,7 % vs 4,1 %) ont été les effets indésirables de grade 3 ou plus survenus le plus souvent chez au moins 5 % des sujets traités par l’ibrutinib, mais aucun des effets indésirables de cette ampleur n’a touché plus de sujets traités par l’acalabrutinib.
Les saignements de toute nature (51,3 % vs 38,0 %) ont été plus fréquents avec l’ibrutinib, mais la différence n’était pas significative pour ceux de grade 3 ou plus. Mis à part le flutter/FA, la différence enregistrée pour les manifestations cardiaques n’a pas atteint la signification statistique, bien que celles de grade 3 ou plus aient été plus nombreuses dans le groupe ibrutinib (9,5 % vs 6,6 %).
Les caractéristiques initiales de l’effectif recruté pour l’essai ELEVATE-RR étaient typiques des patients déjà traités contre une LLC. Environ 70 % des sujets étaient des hommes et l’âge médian s’élevait à 66 ans. La plupart des patients présentaient des anomalies cytogénétiques, 45 % d’entre eux étant porteurs de la del(17p), 60 % de la del(11q), 40 % d’un gène TP53 muté, 47 % d’un caryotype complexe et plus de 80 % d’une région IgVH non mutée. Selon le Dr Byrd, la tolérabilité est un facteur important à prendre en considération dans ce groupe de sujets vieillissants.
La sélectivité pour la BTK expliquerait ces différences
Citant plusieurs études sur le rôle de la sélectivité des inhibiteurs à l’égard de la BTK dans la réduction du risque d’effets indésirables, le Dr Byrd a affirmé que, comparativement à l’acalabrutinib, « l’ibrutinib se lie à un plus grand nombre de kinases en plus de la BTK, ce qui augmente probablement le risque d’effets indésirables ». Même si le Dr Byrd a qualifié la BTK de « cible cruciale dans la prolifération et la survie des cellules tumorales produites par la LLC », la sélectivité a un lien avec les taux plus bas d’abandons du traitement et la possibilité d’une meilleure qualité de vie pendant le traitement d’entretien.
Ce qu’il faut retenir de l’essai ELEVATE-RR, c’est que lorsqu’il est utilisé chez des patients déjà traités contre une LLC, l’acalabrutinib « est doté d’une efficacité similaire à celle de l’ibrutinib, mais qu’il est plus sûr et mieux toléré », a conclu le Dr Byrd. Il a ajouté que ces données sont utiles pour orienter les décisions thérapeutiques.
Essai ELEVATE-TN : les données collectées à 47 mois laissent entrevoir des avantages à long terme
L’innocuité à long terme était aussi au cœur des nouvelles données collectées à 4 ans dans l’essai ELEVATE-TN. Quelque 535 patients atteints de LLC jamais traitée y ont été affectés aléatoirement à de l’acalabrutinib seulement, à de l’acalabrutinib et de l’obinutuzumab, ou à de l’obinutuzumab et du chlorambucil. L’association chlorambucil-obinutuzumab, un anticorps monoclonal anti-CD20 qui inhibe les lymphocytes B, était un schéma thérapeutique d’usage courant lorsque l’essai a été amorcé.
Les résultats rapportés après un suivi médian de 28 mois avaient déjà révélé que l’acalabrutinib administré avec ou sans obinutuzumab faisait preuve d’une plus grande efficacité et d’une tolérabilité acceptable comparativement à l’obinutuzumab et à la chimiothérapie. À ce moment-là, la SSP médiane se chiffrait à 27,8 mois dans le groupe traité par chimiothérapie, mais n’avait pas encore été atteinte dans les deux groupes ayant reçu de l’acalabrutinib.
Après un suivi médian de 47 mois, la SSP médiane n’a toujours pas été atteinte dans les deux groupes traités par l’acalabrutinib, selon le chercheur principal, le Dr Jeff Sharman, directeur de la Recherche, au Centre de cancérologie de Willamette Valley, à Eugene, en Oregon.
Après un suivi médian de 47 mois, la SSP médiane n’a toujours pas été atteinte dans les deux groupes ayant reçu de l’acalabrutinib.
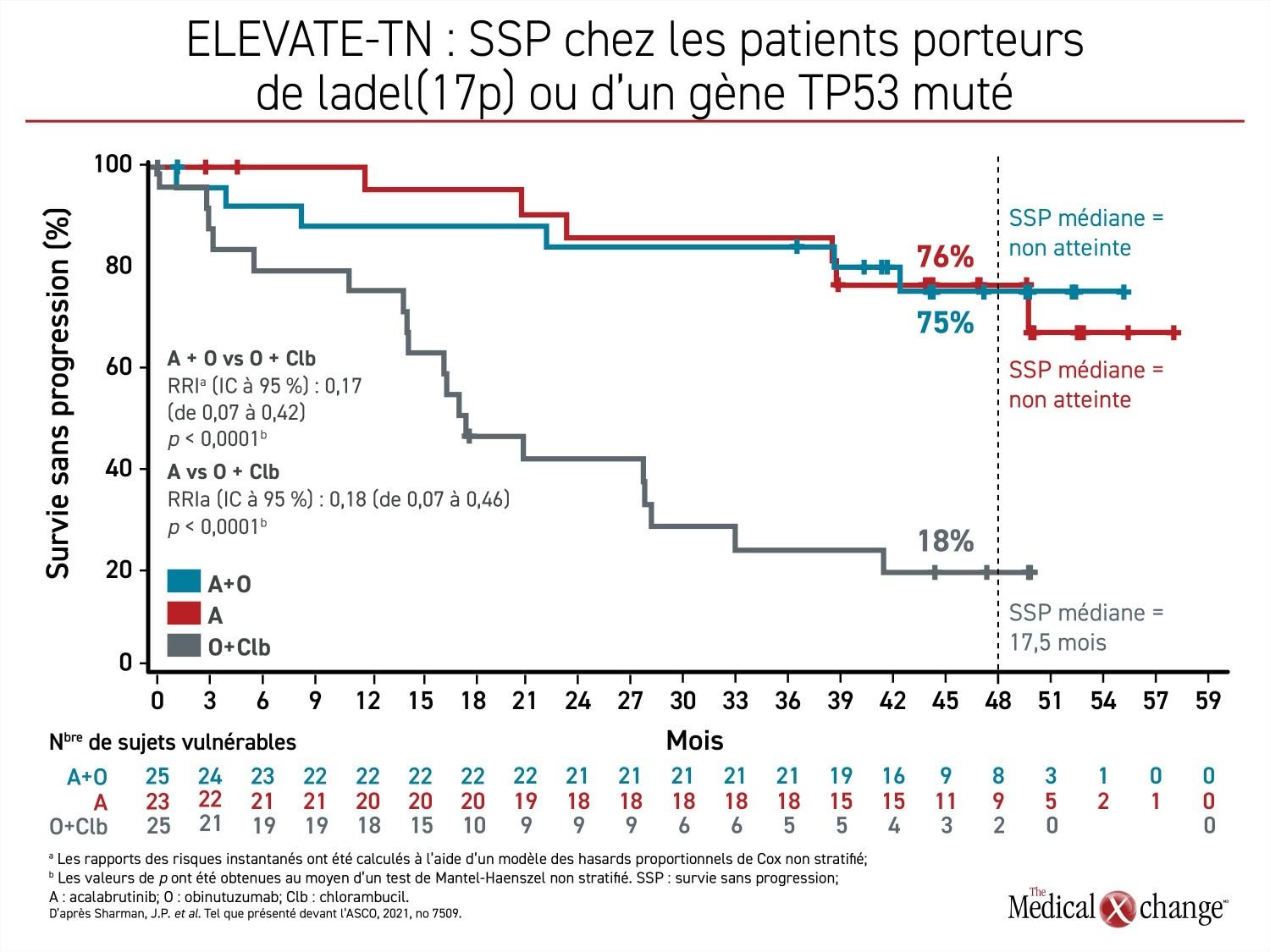
En effet, les taux de maîtrise de la LLC restent très élevés, puisque la maladie n’évolue toujours pas chez 87 % des sujets du groupe traité par l’association médicamenteuse et 78 % de ceux recevant l’acalabrutinib en monothérapie. Les résultats obtenus pour la SSP sont constants d’un sous-groupe de sujets très vulnérables à l’autre. Par exemple, 75 % et 76 % des sujets des sous-groupes de patients porteurs de la del(17p) ou d’un gène TP53 muté sont indemnes de toute progression de la maladie (Figure 3). Comparativement au groupe de sujets traités par l’obinutuzumab et la chimiothérapie, la prolongation relative de la SSP s’élève à 90 % (RRI : 0,10; IC à 95 % : de 0,07 à 0,17) pour l’association acalabrutinib-obinutuzumab et à 81 % (RRI : 0,19; IC à 95 % : de 0,13 à 0,28) pour l’acalabrutinib seulement.
Pas de changement du côté de l’innocuité malgré une exposition prolongée
Aux dires du Dr Sharman, près 4 années de suivi, l’innocuité de l’acalabrutinib employé seul ou en association avec de l’obinutuzumab « cadre avec celle constatée lors des analyses intermédiaires, notamment pour ce qui est de la faible incidence de FA, d’hypertension et de manifestations cardiovasculaires ». Il a ajouté que la tolérabilité relative de l’acalabrutinib seul ou en association avec l’inhibiteur de lymphocytes B se reflète dans les taux d’abandons.
L’innocuité de l’acalabrutinib employé seul ou en association avec de l’obinutuzumab cadre avec celle constatée lors des analyses intermédiaires, notamment pour ce qui est de la faible incidence de FA, d’hypertension et de manifestations cardiovasculaires.
Les patients traités par chimiothérapie étaient autorisés à passer à l’acalabrutinib lorsque leur maladie commençait à évoluer, mais 14,7 % des patients de ce groupe avaient déjà abandonné leur traitement auparavant en raison d’un effet indésirable. Or le taux d’abandon après 4 années de traitement par l’acalabrutinib administré en association ou en monothérapie s’élève seulement à 12,8 % et à 12,3 %.
Les réactions au point d’injection (40,2 % vs 14,0 %), les nausées (31,4 % vs 23,0 %) et la neutropénie (45,0 % vs 33,7 %) étaient plus fréquentes avec l’association obinutuzumab-chlorambucil qu’avec l’association obinutuzumab-acalabrutinib, alors que la diarrhée (21,3 % vs 41,0 %), les céphalées (11,8 % vs 39,9 %) et la fatigue (17,8 % vs 28,1 %) l’ont été moins. Les infections ont été les seuls effets indésirables de grade 3 ou plus qui se sont produits chez plus de 10 % des patients affectés à l’acalabrutinib en monothérapie (16,2 %) ou à l’association acalabrutinib-obinutuzumab (23,6 %). Dans le groupe obinutuzumab-chlorambucil, 8,3 % des sujets en ont été atteints.
La réponse plus profonde observée avec l’inhibiteur de la BTK, promesse d’une plus grande polyvalence
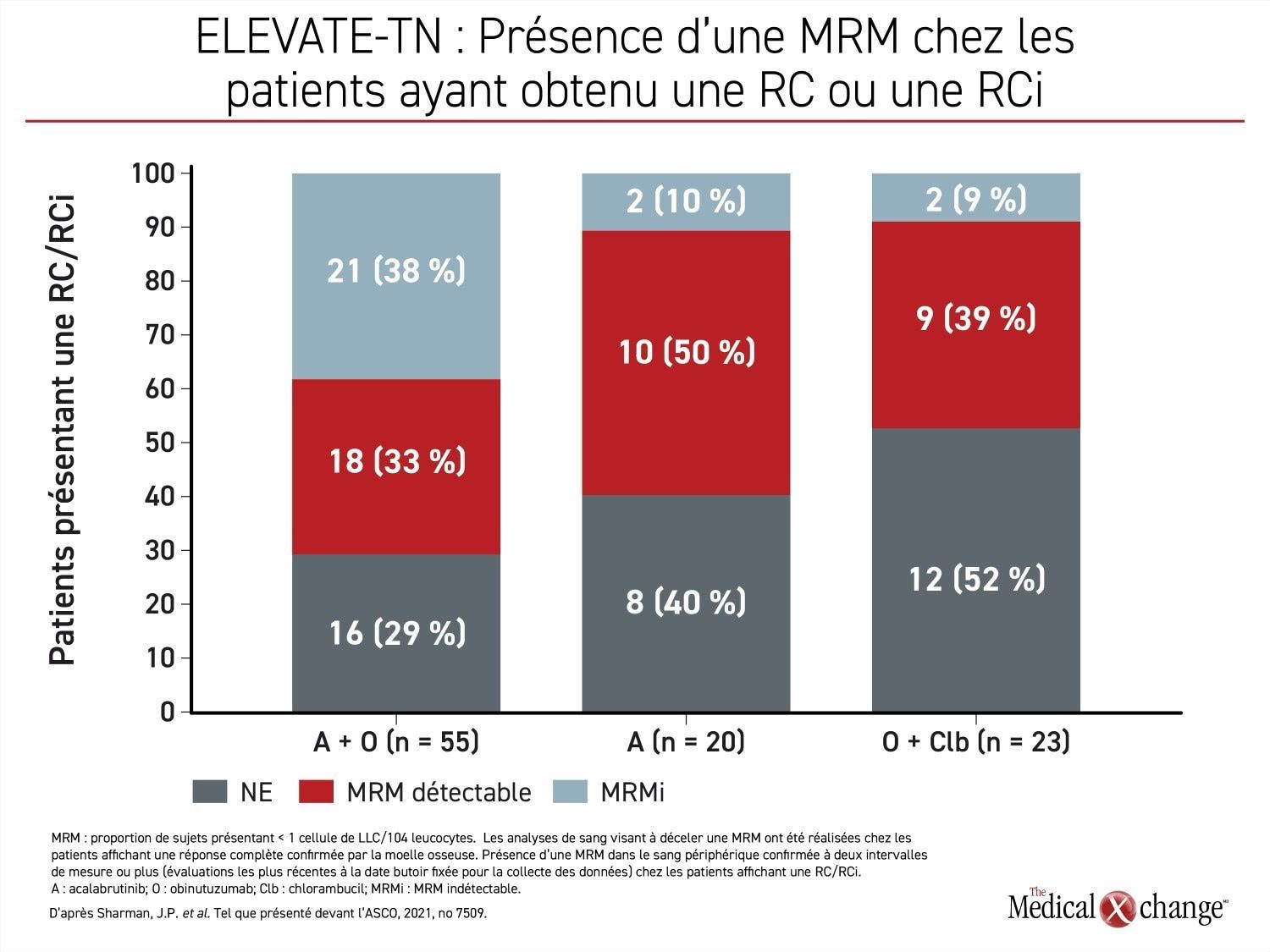
Ce qui ressort le plus de l’essai ELEVATE-TN, c’est l’efficacité relative des traitements. En plus d’avoir l’avantage sur les autres traitements au chapitre de la SSP (RRI : 0,58; p = 0,0297), l’acalabrutinib a généré des réponses plus profondes. Par exemple, le taux de réponse complète était de 30,7 % dans le groupe acalabrutinib-obinutuzumab comparativement à 13,0 % dans le groupe traité par chimiothérapie. En outre, la proportion de sujets ayant affiché une maladie résiduelle minime s’élevait à 38 % et à 9 % dans ces deux groupes (Figure 4).
« Il y a eu moins de décès dans le groupe acalabrutinib-obinutuzumab, mais la différence n’était pas significative sur le plan statistique », a affirmé le Dr Sharman.
Toujours selon lui, à 4 ans, même si les chiffres ont favorisé l’association obinutuzumab-acalabrutinib au détriment de l’acalabrutinib en monothérapie pour plusieurs des résultats obtenus, les écarts étaient minces. Il a ajouté que les données tirées de l’essai ELEVATE-TN « montrent bien la polyvalence de l’acalabrutinib qui peut être utilisé au besoin en monothérapie ou en association avec l’obinutuzumab en première ligne».
Conclusion
Un essai comparatif mené chez des patients atteints d’une LLC déjà traitée auparavant a non seulement révélé que l’acalabrutinib, un inhibiteur doté d’une plus grande sélectivité pour la BTK que l’ibrutinib, est au moins aussi efficace que cet inhibiteur de la BTK de première génération, mais qu’il est aussi mieux toléré. Ces résultats, qui pourraient être applicables à d’autres contextes, étayent l’hypothèse voulant que cette meilleure tolérabilité de l’acalabrutinib lui vienne de la réduction des effets nocifs ailleurs dans l’organisme que permet sa plus grande sélectivité. Près de 90 % des patients étant toujours en vie après 4 ans, les données issues du suivi prolongé du traitement par l’acalabrutinib accompagné ou non d’obinutuzumab dans le traitement de patients atteints de LLC jamais traitée auparavant corroborent le bilan d’innocuité acceptable de cet agent et son efficacité pour la maîtrise soutenue de la maladie.