Cardiologie
Insuffisance cardiaque : revue d'experts et commentaires tirés de la littérature
Optimiser la survie à l’ICFEr en instaurant rapidement tous les traitements médicaux préconisés dans les lignes directrices
Anique Ducharme, M.D., M.Sc., FRCP, FCCS
Professeure agrégée de médecine, Université de Montréal
Directrice, Clinique d’insuffisance cardiaque
Centre de recherche de l’Institut de cardiologie de Montréal
Présidente, Société canadienne d’insuffisance cardiaque
Montréal (Québec)
Jonathan Howlett, M.D., FRCP(C), FCCS, FACC, FHFSA (honorifique)
Professeur clinicien de médecine, Université de Calgary
Libin Cardiovascular Institute of Alberta, South Health Campus
Président fondateur et président sortant, Société canadienne d’insuffisance cardiaque
Calgary (Alberta)
Les lignes directrices récemment actualisées de la Société canadienne de cardiologie (SCC) et de la Société canadienne d’insuffisance cardiaque (SCIC) sont entièrement consacrées au traitement de l’insuffisance cardiaque à fraction d’éjection réduite (ICFEr). La nouveauté, c’est l’insistance mise sur l’importance d’amorcer les quatre traitements médicaux qui y sont préconisés (TMPLD) en première ligne, soit un bêta-bloquant (BB), un inhibiteur des récepteurs minéralocorticoïdes (ARM), l’association formée d’un inhibiteur de l’angiotensine et d’un inhibiteur de la néprilysine (ARNI) et un inhibiteur du cotransporteur sodium-glucose de type 2 (SGLT2) dès que le diagnostic est posé. La version de 2017 conseillait de remplacer l’antagoniste des récepteurs de l’angiotensine (ARA) ou l’inhibiteur de l’enzyme de conversion de l’angiotensine (IECA) par l’ARNI, mais l’adoption de ce dernier a été très lente et inférieure aux attentes même si des gains majeurs pour la survie avaient été démontrés. Alors que cette trithérapie peine à être adoptée, la recommandation d’ajouter un quatrième agent soulève déjà l’inquiétude, puisque la privation d’un traitement optimal par les TMPLD constitue un problème de santé publique préoccupant. Selon les estimations, la prolongation de la survie des patients qui suivent les quatre traitements se mesure en années. À l’inverse, le non-respect des normes de soins se traduit par des hospitalisations et des décès pourtant évitables.
Les TMPLD et l’ICFEr : changements apportés aux lignes directrices
Au Canada et ailleurs, l’ICFer, qui se définit par une fraction d’éjection du ventricule gauche (FEVG) de 40 % ou moins, est une cause importante de morbidité et de mortalité qui génère une part substantielle des coûts de soins de santé liés à son inexorable évolution et de nombreuses hospitalisations1. Les agents pharmacologiques apparus sur le marché au cours des 30 dernières années exercent un effet protecteur important, à la fois croissant et synergique contre l’évolution de la maladie et le décès. Or dans leurs lignes directrices actualisées, la SCC et la SCIC ont repensé les normes de soins2.
Pour une entrevue exclusive avec la Dre Anique Ducharme couvrant l’impact sur la pratique clinique, cliquez ici
Il existe aujourd’hui quatre traitements majeurs offrant des gains attestés pour la survie. L’algorithme de traitement a aussi subi une réorientation importante dans les nouvelles lignes directrices. Si ces dernières s’appuient sur l’édition précédente (2017)3, il n’en demeure pas moins qu’on y insiste maintenant sur l’instauration et l’optimisation des quatre TMPLD dans les trois à six mois qui suivent le diagnostic d’ICFEr chez la plupart des patients, peu importe la gravité de leurs symptômes.
Les gains pour la survie que permettent d’obtenir les quatre TMPLD se sont chaque fois ajoutés à ceux produits par les traitements types à l’époque où les essais déterminants établissant des normes nouvelles ou additionnelles étaient menés2.
Autrement dit, un IECA a réduit de 19 % (p = 0,019) les décès toutes causes confondues par rapport au placebo dans le cadre de l’essai phare SOLVD (Studies of Left Ventricular Dysfunction) au début des années 19904. Les sujets de cet essai suivaient déjà les traitements standards en matière de soins. L’intérêt que présente l’ajout d’un BB à un IECA a été établi dans plusieurs essais menés par la suite. L’essai CIBIS-II (Cardiac Insufficiency Bisoprolol Study II), par exemple, a fait état d’une baisse de 34 % (p < 0,0001) des décès toutes causes confondues par rapport au placebo chez la majorité des patients des deux groupes qui prenaient un IECA5. De même, l’avantage noté pour la survie avec les ARM s’est surajouté à celui produit par les BB et les IECA. En outre, lors de l’essai EMPHASIS-HF (Eplerenone in Mild Patients Hospitalization and Survival Study in Heart Failure), la réduction des décès par rapport au placebo s’élevait à 24 % (p = 0,01)6.
Dans les lignes directrices de 2017, les résultats de l’essai PARADIGM-HF (Prospective Comparison of ARNI with ACEI to Determine Impact on Global Mortality and Morbidity in Heart Failure) ont fait en sorte que l’ARNI, l’association sacubitril-valsartan, avait supplanté les IECA en tant que TMPLD fondamental chez les patients atteints ICFEr. L’ARNI y a permis d’obtenir une réduction de 16 % (p < 0,001) des décès toutes causes confondues par rapport à l’énalapril, l’IECA auquel il était comparé, lorsque plus de 90 % et de 50 % des sujets des deux groupes prenaient respectivement un BB et un ARM7.
Les inhibiteurs du SGLT2 sont les derniers arrivés parmi les TMPLD utilisés chez les patients atteints d’ICFEr. Dans l’essai DAPA-HF (Dapagliflozin and Prevention of Adverse-Outcomes in Heart Failure), un des nombreux essais ayant fait ressortir un gain pour la survie, la dapagliflozine a permis d’abaisser de 17 % (p < 0,01) les décès toutes causes confondues par rapport au placebo lorsqu’elle était ajoutée aux soins optimaux, ceux-ci comprenant un BB et un ARM chez plus de 90 % et de 70 % des sujets, respectivement8. Seulement 10 % des participants environ ont reçu l’ARNI, car il n’était pas encore devenu une norme au moment où l’essai a été amorcé, les autres ayant pris un IECA. Dans un essai semblable intitulé EMPEROR-Reduced (Empagliflozin Outcome Trial in Patients with Chronic Heart Failure and a Reduced Ejection Fraction), environ 20 % ont été traités par l’ARNI9. Les analyses subséquentes ont révélé que les bienfaits exercés par l’empagliflozine, l’inhibiteur du SGLT2 qui y était étudié, étaient comparables que les sujets soient traités ou non par l’ARNI.
On considère que chacun des TMPLD exerce plusieurs effets favorables et complémentaires sur l’appareil cardiovasculaire. Si les médicaments de chacune de ces classes inhibent l’évolution de l’ICFEr et favorisent le remodelage cardiaque, ils le font chacun à leur manière en agissant sur différents systèmes neurohormonaux10. Les BB par exemple, agiraient surtout en inhibant le système nerveux sympathique11. Les effets positifs des IECA et des ARA viendraient de l’inhibition du système rénine-angiotensine (SRA)12. Les ARM quant à eux inhibent l’aldostérone, d’où leur effet antifibrotique13. Pour ce qui est de l’ARNI, il y aurait une interaction favorable entre l’inhibition du SRA produite par l’ARA et l’inhibition de la néprilysine attribuable au sacubitril, qui se traduirait par une diminution des concentrations de NT-proBNP et autres composés similaires, ce qui favorise encore plus la vasodilatation, amplifie la natriurèse, fait rétrocéder le remodelage et atténue l’atteinte cardiaque14.
Effets positifs cumulatifs du recours rapide aux TMPLD
Si on constate que les effets positifs cumulatifs des TMPLD sont considérables, ce n’est pas uniquement grâce à la réduction toujours croissante des décès lors des essais déterminants. En effet, des études récentes ayant servi à estimer l’avantage cumulatif des TMPLD font état de réductions du risque impressionnantes. À preuve, selon une analyse de plusieurs essais rendant compte des résultats de traitements de fond au terme d’une période de suivi médiane de trois ans, l’ajout de l’ARNI, d’un ARM et d’inhibiteurs du SGLT2 entraînerait une réduction estimée à 47 % (RRI de 0,53) des décès toutes causes confondues comparativement à une stratégie classique reposant sur un IECA et un BB15. Selon les estimations, la réduction du paramètre d’évaluation composé des décès d’origine cardiovasculaire et des hospitalisations pour cause d’insuffisance cardiaque durant cette même période s’élevait à 62 % (RRI de 0,38).
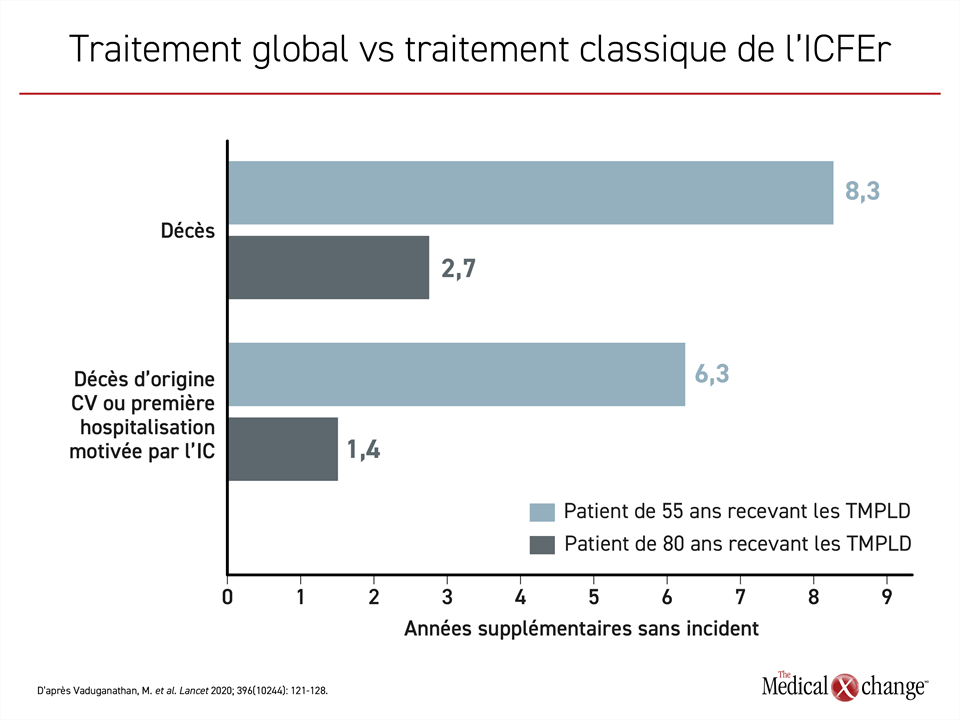
D’après l’analyse de tables de survie modifiées, un patient de 55 ans atteint d’ICFEr recevant les TMPLD plutôt que le traitement classique survivrait 8,3 années de plus à sa maladie cardiovasculaire sans être hospitalisé pour une première fois; pour une personne de 80 ans, ce serait 2,7 ans de plus selon les estimations (Figure 1).
Une analyse distincte des gains cumulatifs a mis au jour l’intérêt de combiner les TMPLD16. Comparativement à des agents tels que la digoxine utilisés en traitements de fond symptomatiques, on estime à 56 % (RRI : 0,44) la réduction supplémentaire du risque de décès toutes causes confondues offerte par une trithérapie classique composée d’IECA, de BB et d’ARM. Or une fois l’ARNI ajouté, cette réduction relative grimpe à 63 % (RRI : 0,37). Une analyse des effets aléatoires a confirmé que chaque type d’agent augmente le gain enregistré en matière de décès.
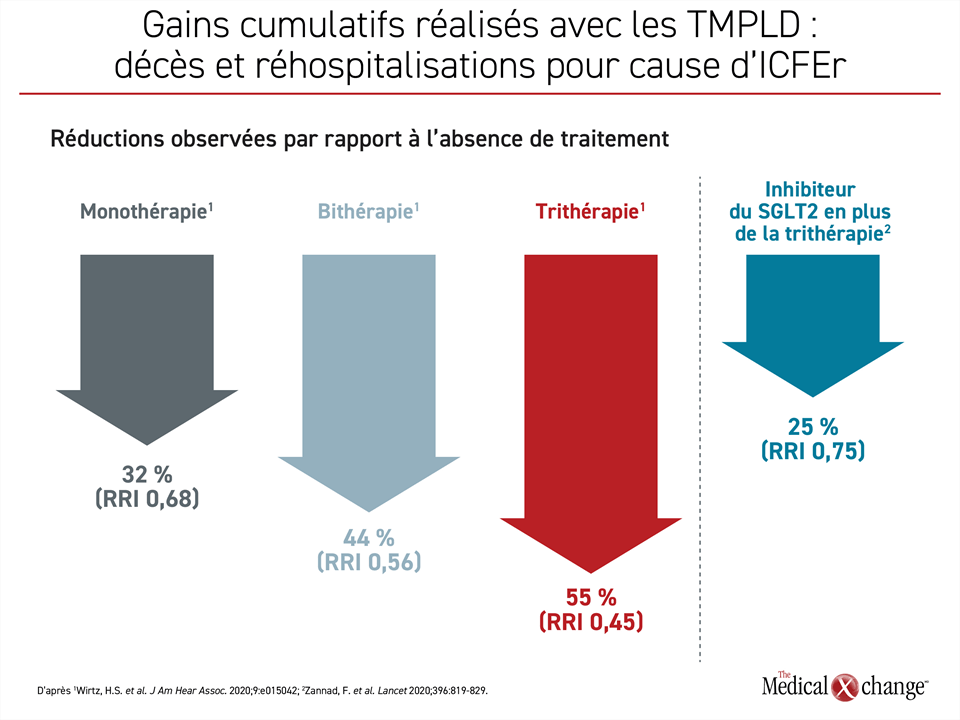
Le même effet est ressorti d’une étude menée à partir des données rétrospectives de 17 106 patients atteints d’ICFEr17. Le premier paramètre évalué était constitué des réhospitalisations pour cause d’IC ou des décès au terme de l’année de traitement ayant suivi une hospitalisation motivée par l’ICFEr. Par rapport aux quelque 4000 patients non traités, un nombre similaire de sujets qui recevaient juste un des TMPLD a affiché une baisse relative du risque de ces incidents de 32 %; elle a grimpé à 44 % chez les plus de 7000 patients qui en recevaient deux, puis à 55 % chez les 2286 patients qui en recevaient trois. Les essais sur les inhibiteurs du SGLT2 dans le traitement de l’IC ont généralement été amorcés avant que l’ARNI ait accédé au titre de pilier du traitement de l’ICFEr ou à peu près en même temps. Par conséquent, l’apport de ces agents a été évalué en tant qu’ajout aux BB, aux ARM et soit aux IECA ou, chez une plus faible proportion de patients, à l’ARNI. Le gain qui s’est ajouté à celui déjà offert par la trithérapie était considérable. En effet, selon une méta-analyse des études DAPA-HF et EMPEROR-Reduced, en étant adjoints à la trithérapie, les inhibiteurs du SGLT2 ont réduit les décès d’origine cardiovasculaire et les hospitalisations motivées par l’ICFEr de 25 % de plus (RRI : 0,75; p < 0,0001) (Figure 2)18.
Les soins sous-optimaux : l’omission de l’ARNI
L’objectif est certes d’amorcer rapidement tous les TMPLD dans les cas d’ICFEr, mais le traitement par l’ARNI mérite une attention particulière. Lors de leur diffusion en 2017, les lignes directrices de la SCC et de la SCIC recommandaient une augmentation lente de la dose de cet agent chez les patients stables non hospitalisés. Bien que les études subséquentes, telles que PIONEER-HF (Comparison of Sacubitril–Valsartan versus Enalapril on Effect on NT-proBNP in Patients Stabilized from an Acute Heart Failure Episode)19, aient montré que l’ajout de l’ARNI dès la première hospitalisation est bien toléré et réduit plus rapidement les taux de NT‑proBNP, les données d’un sondage sur la pratique continuent de montrer que cet agent n’est pas prescrit rapidement aux patients atteints d’ICFEr auxquels conviendrait.
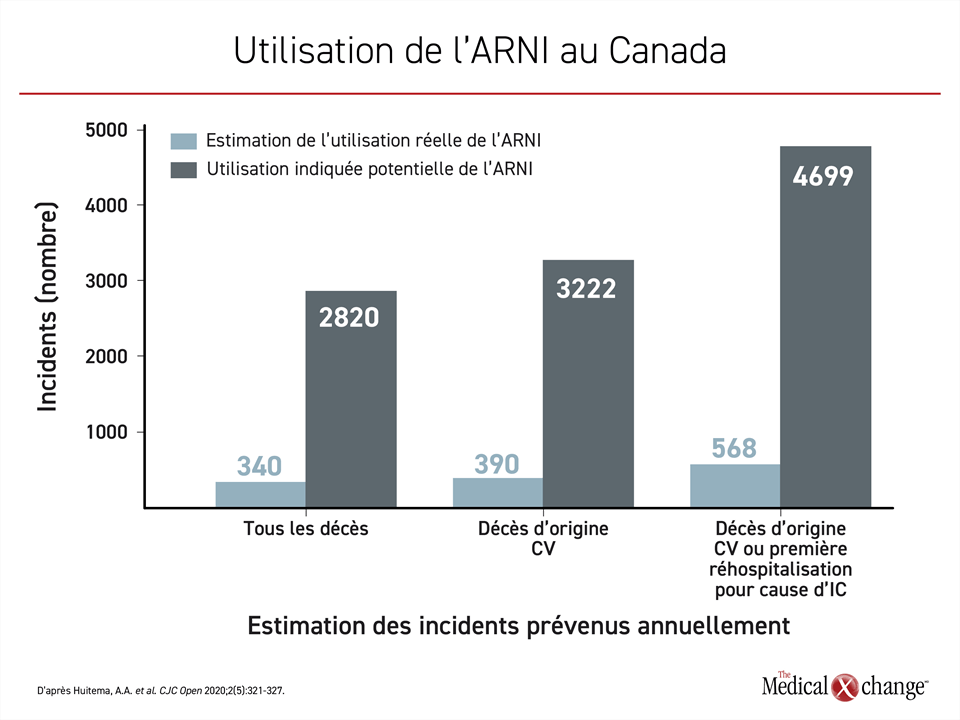
Par exemple, une étude de 2018 a révélé que seulement 27 267 des 225 562 Canadiens (12 %) atteints d’ICFEr pour lesquels l’ARNI était indiqué recevaient ce médicament20. Selon les calculs que les auteurs ont faits à partir des données de l’essai déterminant PARADGIM-HF, si ces 27 267 patients ont pris leur ARNI pendant un an, 340 vies ont probablement été sauvées. En revanche, les vies de 2820 Canadiens auront été perdues chez ceux auxquels il n’avait pas été prescrit alors qu’il leur aurait convenu. En outre, on estime à 568 seulement le nombre de patients qui ont été protégés contre les réhospitalisations et le décès au lieu des 4699 qui l’auraient théoriquement été si l’ARNI avait été uniformément prescrit pour un an (Figure 3).
Afin de dissiper l’impression voulant que l’ARNI soit un agent à envisager en deuxième ligne uniquement lorsque les patients prennent une dose stable de BB, d’ARM et d’un IECA, les nouvelles lignes directrices de la SCC et de la SCIC stipulent qu’il s’agit bel et bien d’un traitement de première ligne qui doit être amorcé chez les patients hospitalisés qui viennent de recevoir un diagnostic d’ICFEr. Elles stipulent également qu’il faut remplacer par l’ARNI l’IECA ou l’ARA que ces patients sont susceptibles de prendre avant leur départ de l’hôpital.
L’American College of Cardiology (ACC) envoie un message très semblable dans le schéma décisionnel consensuel de 2021 établi par ses experts21. L’ARNI, tout comme les trois autres piliers des TMPLD, y est en effet recommandé en première ligne dès qu’un diagnostic d’ICFEr a été posé. Dans ces lignes directrices, l’amorce de l’ARNI, d’un BB et d’un ARM y est vue comme une première étape logique, même si plusieurs variables peuvent entrer en ligne de compte dans la personnalisation de la stratégie à adopter pour veiller à ce que tous les patients atteignent en toute sûreté les doses cibles des quatre TMPLD, qui sont la plupart du temps celles qui ont été éprouvées dans les essais cliniques déterminants.
Les données cliniques relatives à l’ARNI montrent bien l’importance d’instaurer rapidement un traitement par les TMPLD et d’atteindre leurs doses cibles. Les taux élevés de NT-proBNP sont caractéristiques de l’ICFEr et le signe d’un risque clinique et d’une propension aux modifications ininterrompues du ventricule gauche conduisant à une altération de la géométrie et du fonctionnement cardiaques propres au remodelage, un phénomène qui commence tôt et s’amplifie au fil du temps. Au cours de l’étude ouverte PROVE-HF (Prospective Study of Biomarkers, Symptom Improvement, and Ventricular Remodeling During Sacubitril/Valsartan Therapy for Heart Failure), la réduction des taux de NT-proBNP provoquée par l’association sacubitril-valsartan a été reliée à un remodelage cardiaque inverse en dedans de six mois22.
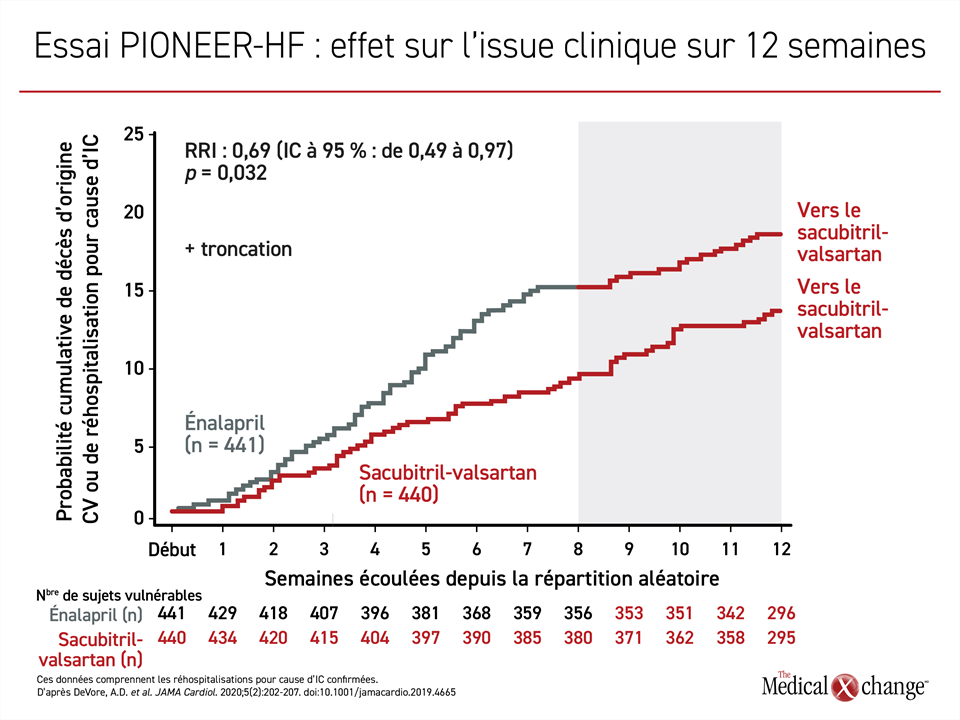
Dernièrement, l’essai PIONEER-HF a révélé que l’instauration d’un traitement par l’ARNI pendant l’hospitalisation était sans danger et avait entraîné une baisse des concentrations de NT-proBNP plus marquée que l’énalapril19, les courbes s’étant séparées en une semaine. Cet essai d’à peine 8 semaines ne visait pas à déceler des différences dans les manifestations cliniques, mais à la fin, une différence très significative sur le plan statistique (p = 0,001) à l’avantage de l’ARNI était déjà évidente pour le paramètre d’évaluation composé des effets indésirables liés à l’IC (réhospitalisation motivée par l’IC, installation d’un dispositif d’assistance ventriculaire gauche, inscription sur une liste d’attente pour une transplantation ou décès). D’ailleurs, les courbes sont restées éloignées l’une de l’autre après la phase de 8 semaines menée à double insu (Figure 4).
Mise en application des lignes directrices
Dans leurs lignes directrices respectives, la SCC, la SCIC et l’American College of Cardiology (ACC) soulignent les obstacles possibles à l’adoption de leurs directives et formulent des solutions, leur préoccupation à l’égard de l’inertie thérapeutique étant probablement une de leurs motivations. Les nouvelles lignes directrices peuvent sembler déroutantes et intimidantes, mais ces organismes y fournissent de nombreux conseils et recommandations afin de simplifier et de préciser la marche à suivre pour leur mise en application.
L’adoption des lignes directrices dans la pratique clinique courante demande habituellement plusieurs années. Même les spécialistes peuvent se montrer prudents lorsqu’ils traitent des patients qu’ils jugent très vulnérables aux effets indésirables inattendus. Par exemple, une étude canadienne ayant servi à évaluer 511 patients atteints d’ICFEr traités dans un établissement de soins tertiaires spécialisé en insuffisance cardiaque a montré que les TMPLD, notamment les BB et les ARM leur avaient été très souvent prescrits (98,6 % et 93,4 %), mais qu’environ le tiers d’entre eux ne prenaient pas les doses optimales23. Il s’agissait surtout de patients âgés ou qui avaient été récemment subi un AVC ou un accident ischémique. La prescription de doses sous-optimales peut avoir été dictée par la prudence dans certains, voire la plupart des cas, mais un des points qu’il faut retenir de cette étude, c’est que mis à part l’inertie des cliniciens, des contraintes surtout physiologiques (rythme cardiaque, pression sanguine, tolérance) et biologiques (fonction rénale et kaliémie) empêchant l’atteinte des doses cibles des TMPLD peuvent aussi expliquer le non-respect des lignes directrices.
Les lignes directrices abordent la nécessité de personnaliser le traitement, y compris l’augmentation relativement lente de la posologie et les doses inférieures aux doses cibles des TMPLD. On y trouve des exemples précis ainsi que des conseils à l’intention des cliniciens qui envisagent d’adresser leurs patients à un spécialiste en raison de préoccupations ou de doutes concernant des patients présentant des caractéristiques cliniques, notamment des maladies concomitantes, qui compliquent le choix des traitements. Les lignes directrices intègrent également les TMPLD aux traitements de soutien et autres contextes appropriés pour améliorer les résultats ou la qualité de vie.
Le plus important peut-être, c’est que ces lignes directrices décrivent une démarche systématique pour veiller à ce que tous les patients reçoivent les TMPLD, ou du moins que cette possibilité soit envisagée pour chacun d’eux. Grâce à leurs lignes directrices, la SCC et la SCIC cherchaient à aider les cliniciens, peu importe leur milieu de pratique, à être les acteurs d’un changement de paradigme afin que tous les TMPLD soient amorcés rapidement.
Conclusion
Le traitement de première ligne de l’ICFEr comporte maintenant 4 types d’agents qui devraient être prescrits d’emblée et non pas l’un après l’autre en fonction des symptômes et de la gravité de la maladie. Une fois que le diagnostic est connu, leurs doses doivent être augmentées graduellement chez pratiquement tous les patients de façon à atteindre les doses cibles optimales le plus tôt possible. L’effet recherché est le suivant : prévenir l’évolution sous-jacente de l’ICFEr, y compris le remodelage cardiaque caractéristique de la maladie entraînant une altération de la pompe cardiaque, l’apparition de symptômes et des incidents. Chacun des quatre TMPLD agit sur des voies indépendantes du remodelage cardiaque, ce qui explique leurs effets positifs additifs. L’administration de l’ARNI, une fois recommandée à certains patients atteints d’ICFEr déjà traités par les TMPLD en première ligne, a été devancée dans l’algorithme. On s’attend à ce que l’adoption stricte aux TMPLD au Canada diminue la morbidité et les décès liés à l’ICFEr.
Références
1. Virani SA, Bains M, Code J, et al. The Need for Heart Failure Advocacy in Canada. Can J Cardiol 2017;33(11):1450-1454. DOI: 10.1016/j.cjca.2017.08.024.
2. McDonald M, Virani S, Chan M et Ducharme A. CCS/CHFS heart failure guidelines update: defining a new pharmacologic standard of care for heart failure with reduced ejection fraction. Can J Cardiol 2021;37:531-546.
3. Ezekowitz JA, O’Meara E, McDonald MA, et al. 2017 Comprehensive Update of the Canadian Cardiovascular Society Guidelines for the Management of Heart Failure. Can J Cardiol 2017;33(11):1342-1433. DOI: 10.1016/j.cjca.2017.08.022.
4. Investigators S, Yusuf S, Pitt B, Davis CE, Hood WB et Cohn JN. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. N Engl J Med 1991;325(5):293-302. DOI: 10.1056/NEJM199108013250501.
5. The Cardiac Insufficiency Bisoprolol Study II (CIBIS-II): a randomised trial. Lancet 1999;353(9146):9-13. (https://www.ncbi.nlm.nih.gov/pubmed/10023943).
6. Zannad F, McMurray JJ, Krum H, et al. Eplerenone in patients with systolic heart failure and mild symptoms. N Engl J Med 2011;364(1):11-21. DOI: 10.1056/NEJMoa1009492.
7. McMurray JJ, Packer M, Desai AS, et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N Engl J Med 2014;371(11):993-1004. DOI: 10.1056/NEJMoa1409077.
8. McMurray JJV, Solomon SD, Inzucchi SE, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med 2019;381(21):1995-2008. DOI: 10.1056/NEJMoa1911303.
9. Packer M, Anker SD, Butler J, et al. Cardiovascular and Renal Outcomes with Empagliflozin in Heart Failure. N Engl J Med 2020;383(15):1413-1424. DOI: 10.1056/NEJMoa2022190.
10. Burchfield JS, Xie M et Hill JA. Pathological ventricular remodeling: mechanisms: part 1 of 2. Circulation 2013;128(4):388-400. DOI: 10.1161/CIRCULATIONAHA.113.001878.
11. Rehsia NS et Dhalla NS. Mechanisms of the beneficial effects of beta-adrenoceptor antagonists in congestive heart failure. Exp Clin Cardiol 2010;15(4):e86-95. (https://www.ncbi.nlm.nih.gov/pubmed/21264074).
12. Werner CM et Bohm M. The therapeutic role of RAS blockade in chronic heart failure. Ther Adv Cardiovasc Dis 2008;2(3):167-77. DOI: 10.1177/1753944708091777.
13. Sica DA. Mineralocorticoid Receptor Antagonists for Treatment of Hypertension and Heart Failure. Methodist Debakey Cardiovasc J 2015;11(4):235-9. DOI: 10.14797/mdcj-11-4-235.
14. Jhund PS et McMurray JJ. The neprilysin pathway in heart failure: a review and guide on the use of sacubitril/valsartan. Heart 2016;102(17):1342-7. DOI: 10.1136/heartjnl-2014-306775.
15. Vaduganathan M, Claggett BL, Jhund PS, et al. Estimating lifetime benefits of comprehensive disease-modifying pharmacological therapies in patients with heart failure with reduced ejection fraction: a comparative analysis of three randomised controlled trials. Lancet 2020;396(10244):121-128. DOI: 10.1016/S0140-6736(20)30748-0.
16. Burnett H, Earley A, Voors AA, et al. Thirty Years of Evidence on the Efficacy of Drug Treatments for Chronic Heart Failure With Reduced Ejection Fraction: A Network Meta-Analysis. Circ Heart Fail 2017;10(1). DOI: 10.1161/CIRCHEARTFAILURE.116.003529.
17. Wirtz HS, Sheer R, Honarpour N, et al. Real-World Analysis of Guideline-Based Therapy After Hospitalization for Heart Failure. J Am Heart Assoc 2020;9(16):e015042. DOI: 10.1161/JAHA.119.015042.
18. Zannad F, Ferreira JP, Pocock SJ, et al. SGLT2 inhibitors in patients with heart failure with reduced ejection fraction: a meta-analysis of the EMPEROR-Reduced and DAPA-HF trials. Lancet 2020;396(10254):819-829. DOI: 10.1016/S0140-6736(20)31824-9.
19. Velazquez EJ, Morrow DA, DeVore AD, et al. Angiotensin-Neprilysin Inhibition in Acute Decompensated Heart Failure. N Engl J Med 2019;380(6):539-548. DOI: 10.1056/NEJMoa1812851.
20. Huitema AA, Daoust A, Anderson K, et al. Optimal Usage of Sacubitril/Valsartan for the Treatment of Heart Failure: The Importance of Optimizing Heart Failure Care in Canada. CJC Open 2020;2(5):321-327. DOI: 10.1016/j.cjco.2020.03.015.
21. Maddox TM, Januzzi JL, fils., Allen LA, et al. 2021 Update to the 2017 ACC Expert Consensus Decision Pathway for Optimization of Heart Failure Treatment: Answers to 10 Pivotal Issues About Heart Failure With Reduced Ejection Fraction: A Report of the American College of Cardiology Solution Set Oversight Committee. J Am Coll Cardiol 2021;77(6):772-810. DOI: 10.1016/j.jacc.2020.11.022.
22. Januzzi JL, fils, Prescott MF, Butler J, et al. Association of Change in N-Terminal Pro-B-Type Natriuretic Peptide Following Initiation of Sacubitril-Valsartan Treatment With Cardiac Structure and Function in Patients With Heart Failure With Reduced Ejection Fraction. JAMA 2019:1-11. DOI: 10.1001/jama.2019.12821.
23. Jarjour M, Henri C, de Denus S, et al. Care Gaps in Adherence to Heart Failure Guidelines: Clinical Inertia or Physiological Limitations? JACC Heart Fail 2020;8(9):725-738. DOI: 10.1016/j.jchf.2020.04.019.