Neurologie
Congrès en ligne de 2021 de la World Muscle Society (WMS)
La thérapie génique est efficace contre l’AS chez les nourrissons asymptomatiques et chez les enfants symptomatiques plus vieux
Réunion en ligne – De nouvelles données probantes présentées lors du congrès en ligne de 2021 de la WMS révèlent qu’une thérapie génique qui est très efficace lorsqu’elle est administrée avant l’apparition des symptômes de l’amyotrophie spinale (AS) l’est également après, ce qui a été documenté chez des enfants plus vieux (6 mois et plus), qu’ils aient déjà reçu un traitement de fond ou non. Même si la thérapie génique doit idéalement être administrée dans les semaines qui suivent la naissance et avant l’apparition des symptômes, un retard de diagnostic et d’amorce du traitement ne l’empêche pas d’exercer ses effets positifs.
Trois médicaments sont homologués contre l’AS au Canada. Le premier, le nusinersen, un oligonucléotide antisens, a été rejoint par un agent employé en thérapie génique, l’onasemnogène abéparvovec à la fin de 2020. Le risdiplam, une petite molécule, a été homologué récemment. Tout comme le nusinersen, il s’agit d’un modificateur d’épissage du gène SMN2 qui amplifie temporairement la production de protéines. Un traitement d’entretien continu est donc essentiel pour empêcher que l’AS ne s’aggrave. L’onasemnogène abéparvovec quant à lui remplace la protéine SMN codant pour le gène SMN1, dont le déficit est la définition même de l’AS. Il exerce des effets positifs durables après une seule dose chez la plupart des patients.
« La délétion du gène SMN1 est associée à la perte de motricité volontaire et des fonctions bulbaires, qui sont essentielles pour respirer et avaler. »
« La délétion du gène SMN1 est associée à la perte de motricité volontaire et des fonctions bulbaires, qui sont essentielles pour respirer et avaler. Tous les traitements de fond permettent d’améliorer énormément le pronostic, mais la durée de leurs effets varie », a affirmé le Dr Laurent Servais, professeur, Maladies neuromusculaires pédiatriques, à l’université d’Oxford, au R.-U.
Étude des effets positifs de la thérapie génique chez des enfants plus vieux
Le nusinersen et le risdiplam ont été étudiés chez des nourrissons et des enfants plus vieux dans le cadre des programmes d’essais cliniques sur ces traitements de fond. La plupart des enfants ayant participé aux essais cliniques sur l’onasemnogène abéparvovec avaient moins de 6 mois au moment de leur recrutement et étaient atteints d’AS de type 1, la forme la plus répandue de cette maladie. Contrairement à l’AS de type 2 et de type 3 dont les symptômes mettent des mois voire des années avant de se manifester, l’AS de type 1 se déclare habituellement dans les premières semaines de vie et emporte inéluctablement les enfants si elle n’est pas traitée. Les agents opposés à l’AS sont efficaces contre toutes les formes de la maladie, mais selon le Dr Servais, nous en savions bien peu sur l’emploi de la thérapie génique chez les enfants plus vieux, car aucun essai clinique n’a été réalisé en ce sens, d’où la « nécessité d’obtenir des données auprès d’enfants traités en pratique clinique qui ont eux aussi des besoins thérapeutiques criants ».
Deux séries de données présentées aux congressistes ont comblé ce manque de connaissances. La première, qui est tirée du registre prospectif multinational RESTORE, a été présentée par le Dr Servais. L’autre a servi à comparer l’utilisation des ressources de soins de santé (URSS) chez des enfants de 6 mois ou plus recevant un traitement par le nusinersen ou une thérapie génique. Or les deux séries de données confirment l’efficacité de la thérapie génique chez les enfants plus vieux, qu’elle leur ait été administrée en première intention ou après un traitement de fond.
Plus de 250 enfants sont inscrits au registre RESTORE jusqu’à présent. Ils ont été recrutés dans toutes sortes de contextes et pas seulement à partir d’essais cliniques. Cent dix-sept d’entre eux avaient au moins 6 mois quand ils ont été traités par l’onasemnogène abéparvovec. Ils étaient majoritairement (66,7 %) atteints d’AS de type 1; environ 10 % des autres étaient présymptomatiques.
Le registre RESTORE : les effets positifs du traitement vérifiés dans deux groupes d’enfants plus vieux
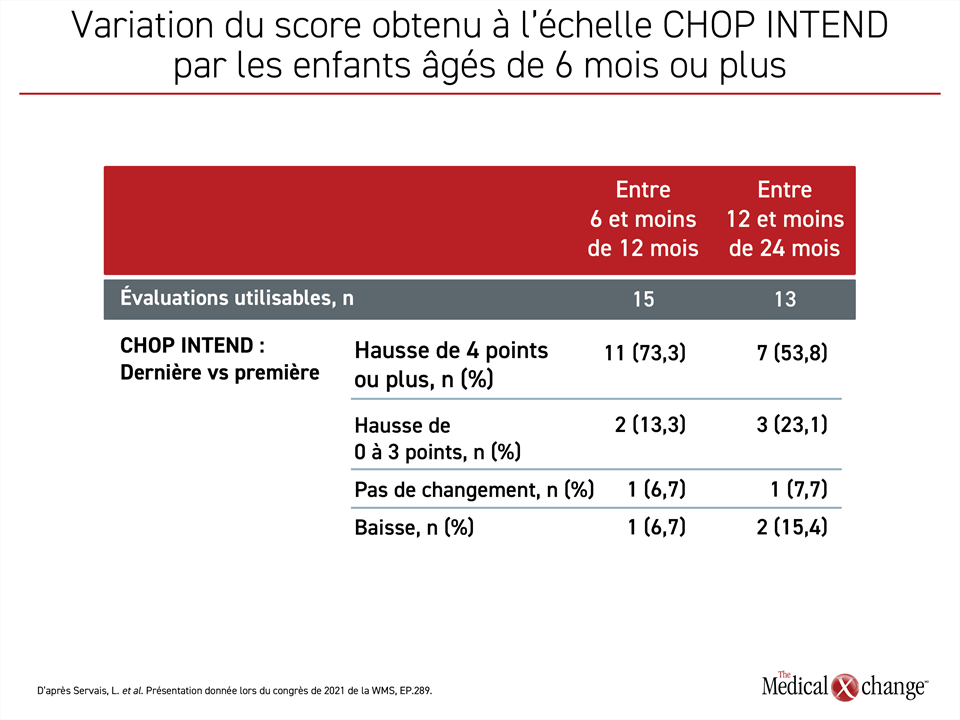
L’effet positif d’une seule perfusion de la thérapie génique chez des enfants plus vieux a été évalué d’après la variation du résultat obtenu à l’échelle de mesure objective des capacités motrices CHOP INTEND (Children’s Hospital of Philadelphia Infant Test of Neurological Disorders). Les patients ont été évalués d’après l’échelle CHOP INTEND au départ, puis au moins une fois au cours du suivi. Pour les besoins de l’analyse, les enfants ont été stratifiés en trois groupes : ceux ayant reçu la thérapie génique entre 6 et moins de 12 mois (n = 15), ceux traités entre 12 et moins de 24 mois (n = 13) et ceux traités à 24 mois ou plus. Les deux groupes d’enfants les plus jeunes comprenaient à peu près le même nombre d’enfants. Les enfants traités après l’âge de 24 mois étaient trop peu nombreux proportionnellement parlant pour être évalués séparément (7,5 %).
Le score obtenu à l’échelle CHOP INTEND au départ a été comparé à ceux du suivi le plus récent. Dans l’ensemble, le score obtenu a augmenté d’au moins 4 points chez 73,3 % des enfants ayant été traités à 6 mois au moins, mais avant l’âge de 12 mois et dont l’évaluation des capacités motrices après la thérapie génique était utilisable. Il a baissé chez un seul des 15 enfants de ce groupe. Quant aux autres enfants, l’un d’eux a obtenu le même score qu’avant son traitement et les autres ont augmenté le leur de 1 à 3 points. Le score a augmenté d’au moins 4 points chez 53,8 % des enfants auxquels la thérapie génique avait été administrée à 12 mois au moins, mais avant l’âge de 24 mois. Deux des 13 enfants de ce groupe ont vu leur score baisser. Un a conservé le même score qu’avant le traitement, alors que les autres ont enregistré une hausse de 1 à 3 points (Figure 1).
Évaluation de l’innocuité de la thérapie génique administrée après un traitement antérieur
La proportion d’enfants âgés entre 6 et moins de 12 mois traités par la thérapie génique en première intention était similaire à celle des enfants qui l’ont été après ou en association un autre traitement de fond. Seulement 29,8 % des enfants de 12 mois ou plus ont été traités par la thérapie génique en première intention, alors que 54,4 % des enfants l’ont été après avoir reçu un autre traitement de fond. Les 15,8 % restants ont subi une association de traitements. Selon le Dr Servais, l’exposition à un traitement antérieur contre l’AS ne semble pas avoir altéré les taux de réponse à la thérapie génique, même si les effectifs comparés étaient de petite taille.
Dans l’ensemble, les taux d’effets indésirables survenus pendant le traitement chez ces enfants plus vieux étaient comparables à ceux déjà rapportés pendant les essais déterminants sur la thérapie génique. Cela dit, il se peut que le risque d’effets indésirables possiblement liés au traitement ait été légèrement plus élevé chez ceux âgés de 12 à 24 mois que chez les plus jeunes. Les effets indésirables comprenaient entre autres, une hépatotoxicité (43,9 % vs 34,0 %) se manifestant surtout par une hausse des taux d’enzymes hépatiques, et une thrombopénie passagère (26,3 % vs 16,0 %). Aucun effet toxique sur les ganglions spinaux n’a été rapporté et les taux d’effets indésirables symptomatiques ont été bas.
[La thérapie génique] « est une option thérapeutique efficace pour les enfants âgés de 6 mois ou plus atteints d’AS, qu’ils aient déjà reçu un traitement de fond ou non. »
Le Dr Servais a qualifié de « cliniquement significative » la hausse minimale de 4 points que la majorité des enfants plus âgés ont obtenue à l’échelle CHOP INTEND. Il a trouvé ces données rassurantes compte tenu du manque de connaissances sur l’emploi de la thérapie génique chez les enfants plus vieux.
« L’onasemnogène est une option thérapeutique efficace pour les enfants âgés de 6 mois ou plus atteints d’AS, qu’ils aient déjà reçu un traitement de fond ou non », a-t-il affirmé en ajoutant que son bilan d’innocuité « cadre » avec l’innocuité et la tolérabilité rapportées antérieurement dans les essais déterminants.
Moins grande utilisation des ressources de soins de santé (URSS) chez les enfants plus vieux
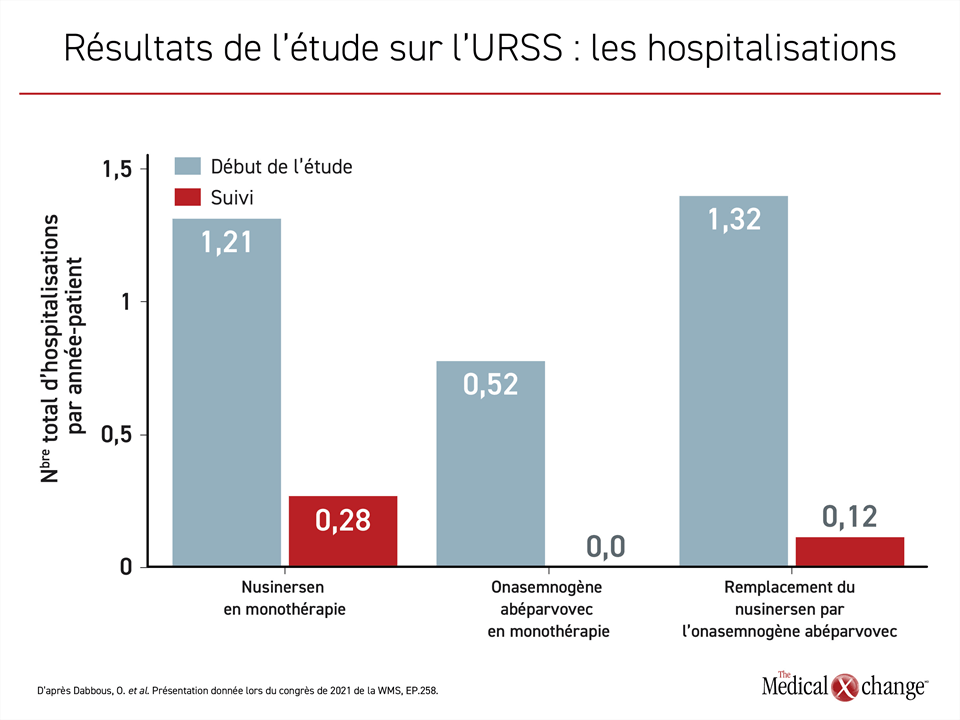
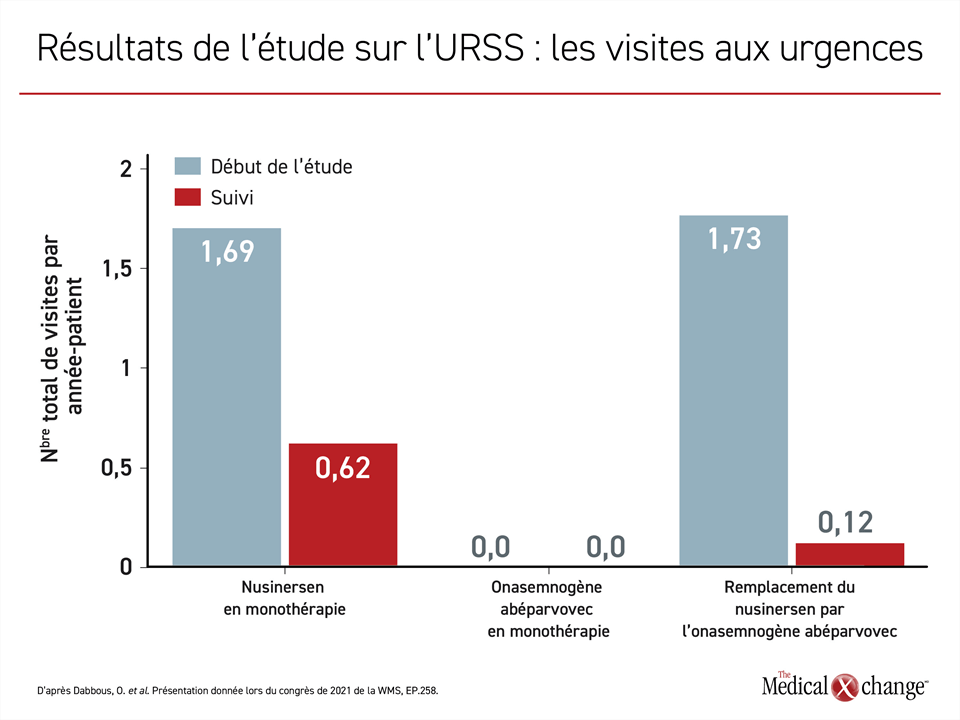
L’étude sur l’URSS menée à partir d’un examen rétrospectif des dossiers médicaux a indirectement étayé cette conclusion. Elle a servi à comparer l’utilisation des ressources chez les enfants âgés de 6 mois ou plus ayant reçu du nusinersen en monothérapie, de l’onasemnogène abéparvovec en monothérapie ou de l’onasemnogène abéparvovec après un traitement par le nusinersen. Les paramètres d’évaluation principaux étaient l’hospitalisation et les visites aux Urgences avant et après l’administration du traitement.
Le recours à l’onasemnogène abéparvovec en remplacement du nusinersen en monothérapie a été suivi d’une moins grande utilisation des ressources associées à ces deux paramètres d’évaluation. Or l’emploi de la thérapie génique en première intention chez les enfants plus vieux s’est révélé supérieur aux deux autres stratégies thérapeutiques. Aucun des enfants traités d’emblée par la thérapie génique n’a été hospitalisé ou n’a été conduit aux Urgences après avoir reçu ce traitement (Figure 2 et Figure 3).
La thérapie génique a donné lieu à moins de consultations médicales
Les consultations médicales motivées par l’AS baissaient quand l’onasemnogène abéparvovec était utilisé d’emblée (3,79 vs 4,95) ou après un traitement par le nusinersen (4,14 vs 7,83). En revanche, elles ont presque doublé une fois le traitement amorcé par le nusinersen (6,93 vs 3,64).
« L’utilisation des ressources de soins de santé pour cause d’AS a été plus faible chez les patients traités par l’onasemnogène abéparvovec seulement et chez ceux qui y sont passés après avoir reçu du nusinersen », a rapporté le Dr Eric Q. Wu, économiste de la santé et chercheur chez Analysis Group, à Boston, au Massachusetts.
Selon le Dr Wu, il s’agit de la première étude qui ait servi à comparer l’URSS après l’amorce de divers traitements de fond contre l’AS. Il a précisé que les 20 patients dont les dossiers ont été étudiés n’avaient jamais participé à un essai clinique. Environ la moitié d’entre eux étaient atteints d’AS de type 1 et la plupart des autres, du type 2. Huit patients ont été traités par le nusinersen en monothérapie, 4 avec l’onasemnogène abéparvovec en monothérapie et 8 avec l’onasemnogène abéparvovec en remplacement du nusinersen.
L’URSS a baissé même après le remplacement du traitement
« L’AS est une maladie qui s’accompagne d’une lourde charge de morbidité. L’URSS est donc conséquente », a affirmé le Dr Wu, citant des publications portant à croire que les coûts générés par l’AS de type 1 restent élevés même après le traitement par le nusinersen. Même s’il ne s’est pas penché directement sur les coûts spécifiques, il est convaincu que la réduction relative des hospitalisations et des visites aux Urgences après la thérapie génique qui s’administre une seule fois est appréciable.
Franchissement plus rapide des étapes du développement après un dépistage néonatal
Les essais déterminants menés sur l’onasemnogène abéparvovec, comme les essais STR1VE-US, STR1VE-EU et SPR1NT, ont établi un lien entre cet agent et le franchissement des grandes étapes de développement chez la majorité des enfants aux prises avec l’AS de type 1 traités pendant leurs premières semaines de vie. Comme certains des enfants recrutés dans les premiers essais cliniques fonctionnent normalement 5 ans après leur traitement, les praticiens sont nombreux à préconiser le dépistage des nouveau-nés.
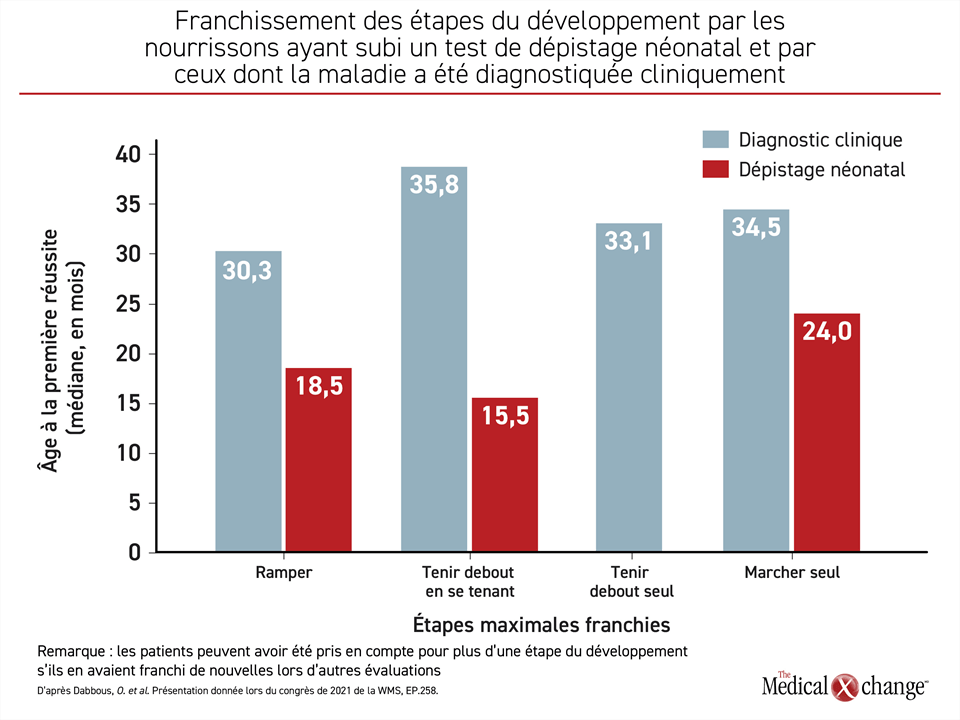
Une deuxième série de données tirées du registre RESTORE présentée au congrès de la WMS appuie cette démarche. Dans cette analyse, 13 patients dont l’AS a été diagnostiquée grâce à un test de dépistage néonatal ont été comparés à 42 enfants dont le diagnostic a été posé cliniquement. Le sort des enfants deux ans environ après le diagnostic plaide fortement en faveur du dépistage et s’expliquerait vraisemblablement par la réduction de la perte permanente de neurones que permet l’amorce plus rapide d’un traitement efficace.
« Les enfants dont la maladie a été décelée à la naissance ont généralement franchi les étapes du développement moteur à un plus jeune âge que ceux chez lesquels elle a été diagnostiquée cliniquement et une plus forte proportion d’entre eux ont affiché une hausse minimale de 4 points sur l’échelle CHOP INTEND pendant la période d’observation », a déclaré le Dr Servais, qui a présenté ces données.
Comparativement aux enfants ayant subi un dépistage néonatal, ceux dont la maladie a été diagnostiquée cliniquement avaient 3,2 mois en moyenne au moment du diagnostic par rapport à 0,8 mois (p < 0,0001), et ils avaient 4,9 mois par rapport à 1,7 mois (p < 0,0001) lorsqu’ils ont reçu leur premier traitement. Bien que la différence entre les délais écoulés entre le diagnostic et le premier traitement (1,2 vs 1,3 mois; p = 0,08) n’aie pas été significative, les enfants ayant subi un dépistage néonatal étaient moins susceptibles de recevoir plus de un traitement de fond (53,9 % vs 90,4 %; p = 0,012). Encore là, l’administration rapide du traitement le plus efficace pourrait expliquer l’avantage conféré par le dépistage néonatal pour de nombreuses étapes du développement (Figure 4).
Les patients ayant subi un test de dépistage néonatal ont réussi pour la première fois à s’asseoir sans aide pendant au moins 30 secondes (échelle III de Bayley) à un âge médian de 12 mois, alors que ceux dont l’AS a été diagnostiquée cliniquement y sont parvenus à 23,5 mois », a rapporté le Dr Servais.
Il a ajouté que des programmes de dépistage ont été créés dans plusieurs établissements maintenant que des traitements plus efficaces contre l’AS, notamment pour prévenir le décès des enfants atteints d’AS de type 1, sont offerts. Il a ajouté que la création de tels programmes uniformisés se justifie au vu des données toujours plus abondantes, dont celles issues du registre RESTORE.
« Notre étude a montré que nous devons mieux cerner et surmonter les obstacles qui empêchent la mise en place de programmes de dépistage néonatal, mais aussi découvrir les raisons des retards dans l’amorce du traitement une fois qu’un diagnostic est posé », a affirmé le Dr Servais.
Conclusion
Au cours des dernières années, les progrès rapides réalisés dans la compréhension et le traitement des causes physiopathologiques sous-jacentes de l’AS ont permis de sauver des vies et d’atténuer l’invalidité qu’elle provoque. Le recours rapide à la thérapie génique, qui s’administre une seule fois, permet un développement moteur normal chez une forte proportion de patients, y compris ceux atteints du type 1 de la maladie, qui leur serait autrement fatale. De nouvelles données nous ont également appris que la thérapie génique exerce des effets positifs majeurs même chez les enfants symptomatiques traités après l’âge de 6 mois. Cela dit, c’est en instaurant le traitement le plus efficace avant l’apparition des symptômes qu’on obtient les meilleurs résultats, d’où l’importance du dépistage néonatal. Certains des patients ayant reçu la thérapie génique tôt après leur naissance et suivis depuis plus de 5 ans affichent des fonctions motrices et un développement normaux.