Rhumatologie
Rhumatisme psoriasique : revue d'experts et commentaires tirés de la littérature
Nouvelles recommandations thérapeutiques du GRAPPA concernant le RPso
Marie-Anaïs Rémillard, M.D., FRCP(C)
Institut de rhumatologie de Montréal
Montréal (Québec)
Caylib Durand, Ph.D., M.D., FRCP(C)
Division de rhumatologie, Université de Calgary
Clinique médicale Peak
Calgary (Alberta)
Le GRAPPA (Group for Research and Assessment of Psoriasis and Psoriatic Arthritis) publiera sous peu ses nouvelles recommandations thérapeutiques factuelles pour le rhumatisme psoriasique (RPso). La liste des agents de première ligne pour les principaux domaines d’expression de cette affection a changé par rapport à la version de 2016. À la lumière d’essais comparatifs, deux classes de médicaments, soit les inhibiteurs du facteur de nécrose tumorale (iTNF) et les inhibiteurs de l’interleukine-17 (iIL-17), sont désormais recommandés en première ligne contre les formes modérées ou grave des six domaines d’expression du RPso. Selon un premier aperçu de ces recommandations donné par un de leurs auteurs lors de la réunion annuelle de la Ligue européenne contre le rhumatisme (EULAR) de 2021, ces essais ont aussi entraîné l’ajout d’agents ciblés, comme les inhibiteurs de Janus kinase (iJAK), quoique leurs indications pour les divers domaines pathologiques soient plus restreintes.
Contexte
Environ le tiers des patients atteints de psoriasis seront atteints également de RPso1. L’atteinte articulaire suit l’atteinte cutanée d’une dizaine d’années en moyenne, mais pas toujours. Chez environ 15 % des patients, les manifestations cutanées et articulaires apparaissent selon une temporalité similaire1. On reconnaît que le RPso s’exprime dans six domaines; en plus du psoriasis lui-même, on compte l’arthrite périphérique, la spondylarthrite axiale, l’enthésite, la dactylite et les manifestations unguéales2. Au terme d’une étude populationnelle réalisée en 2015 chez des adultes ontariens (≥ 20 ans), les auteurs ont établi la prévalence du psoriasis et du RPso à 2,32 % et à 0,15 %3 et le rapport entre hommes et femmes à 1:1, des valeurs qu’ils ont jugées voisines de celles observées aux États-Unis et en Europe.
Pour une entrevue exclusive avec la Dre Marie-Anaïs Rémillard couvrant l’impact sur la pratique clinique, cliquez ici
Le RPso est une maladie inflammatoire auto-immune qui a surtout été prise en charge, et qui l’est encore, à l’aide de médicaments agissant sur l’activité du système immunitaire4. Les manifestations cutanées et articulaires ont un trait en commun : l’intervention de plusieurs voies interdépendantes dans la libération de cytokines et de lymphocytes activés. L’activité pathologique du RPso dans ses six domaines d’expression peut être très différente chez un même patient. La gravité des symptômes dans un domaine donné, qui est probablement influencée par des facteurs génétiques et environnementaux, n’est pas forcément la même dans les autres, et l’activité pathologique peut être intense dans certains domaines et faible dans d’autres, voire nulle. De plus, les patients ne supportent pas tous aussi bien une activité d’une intensité similaire dans un domaine donné. L’optimisation du traitement dépend donc de l’évaluation de l’activité pathologique dans chacun des domaines et de la réponse au traitement d’après des paramètres objectifs et le vécu du patient, y compris des mesures subjectives de la maîtrise de la douleur, du fonctionnement et de la satisfaction et de la qualité de vie du patient.
Bien des antirhumatismaux de fond classiques employés dans le traitement d’autres maladies auto-immunes touchant les articulations, tels que les anti-inflammatoires non stéroïdiens (AINS), les corticostéroïdes, le méthotrexate et les agents biologiques, sont efficaces contre le RPso5. Comme ce fut le cas dans la version de 20167, les nouvelles recommandations du GRAPPA définissent la séquence des traitements à suivre pour chacun des domaines d’expression du RPso6. S’inscrivant dans la continuité de la version antérieure, les modifications apportées aux schémas thérapeutiques s’appuient sur des données factuelles publiées depuis 2016 et tirées d’études déterminantes ayant porté sur des agents nouvellement homologués et sur de nouvelles données probantes comparatives sur des agents biologiques déjà offerts sur le marché au moment de la publication des recommandations précédentes.
Cela dit, les principes directeurs sur lesquels reposent les objectifs thérapeutiques sont les mêmes, c’est-à-dire la maîtrise de la douleur, la prévention de l’atteinte structurale, l’optimisation de la capacité fonctionnelle et l’obtention d’une qualité de vie acceptable. Les nouvelles recommandations, à l’instar de la version précédente, exhortent à l’évaluation et au traitement des maladies qui accompagnent souvent le RPso. La maîtrise de ces maladies concomitantes, notamment d’autres maladies auto-immunes, l’obésité, le syndrome métabolique, le diabète, des hépatopathies, des maladies cardiovasculaires, l’uvéite et les troubles de l’humeur, favorise l’optimisation de la capacité fonctionnelle et de la qualité de vie. Compte tenu des impératifs imposés par les symptômes et les maladies multisystémiques concomitantes, les recommandations thérapeutiques préconisent une prise en charge multidisciplinaire de la RPso.
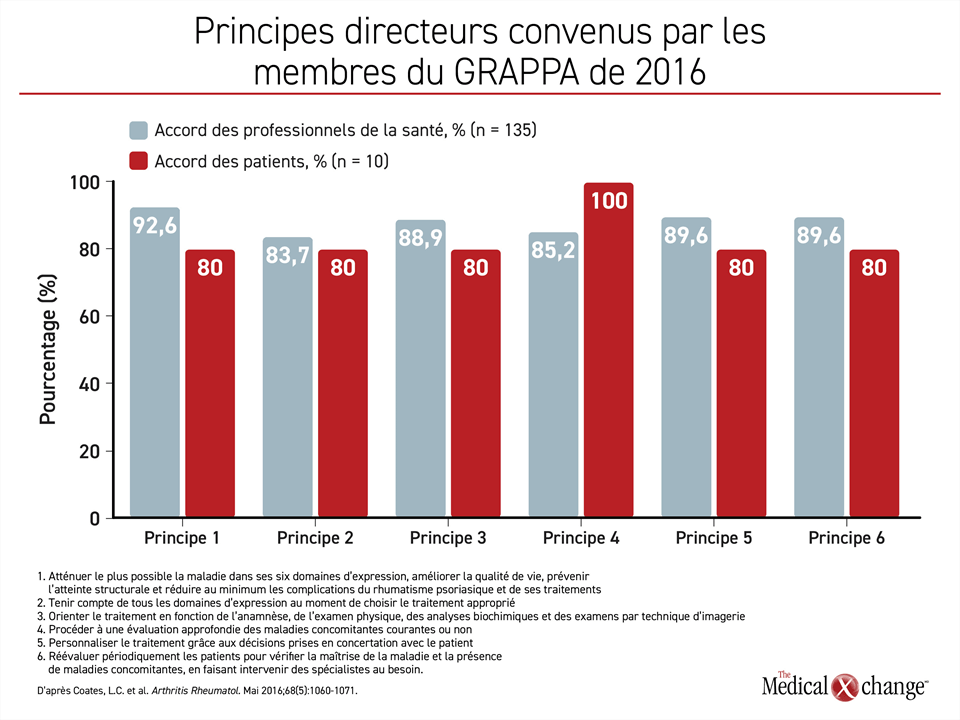
Les professionnels de la santé et les représentants des patients ont adopté une démarche globale pour s’entendre sur les principes directeurs qui orienteraient la formulation des recommandations thérapeutiques de 2016 (Figure 1).
Les nouvelles recommandations thérapeutiques du GRAPPA : déplacer l’attention vers les cas modérés ou graves
Selon le comité de rédaction du GRAPPA, la refonte des recommandations était devenue nécessaire au vu des essais et des études publiés au cours des 5 dernières années, qui ont transformé la pratique6. Le comité formé de dermatologues, de rhumatologues, de défenseurs des patients et de spécialistes des maladies concomitantes tels que des gastro-entérologues et des ophtalmologues, s’est servi de la méthode GRADE (Grading of Recommendations, Assessment, Development, and Evaluation) pour analyser la littérature publiée sur le RPso pendant cette période et pour produire ses nouvelles recommandations thérapeutiques. Les membres du comité se sont regroupés en fonction de leur spécialité respective afin d’établir la prise en charge clinique optimale de chacun des domaines d’expression du RPso. La décision concertée de tous les membres a abouti à la rédaction de recommandations qualifiées de « fortes » ou de « conditionnelles » d’après la qualité des données.
Les stratégies visant à maîtriser les symptômes légers de chacun des six domaines n’ont pas changé comparativement aux recommandations de 2016. Chez les patients atteints de spondylarthrite axiale, d’enthésite et de dactylite, les AINS restent une bonne option en première ligne. Quant à l’arthrite périphérique, les antirhumatismaux de fond synthétiques classiques, comme le méthotrexate, sont privilégiés. Pour ce qui est des lésions cutanées bénignes, les médicaments topiques, tels que les corticostéroïdes, devraient être utilisés en premier. Dans les cas bénins d’atteinte unguéale, il est recommandé d’avoir recours à des préparations topiques à base de corticostéroïdes, d’acitrétine et d’inhibiteurs de JAK en plus des antirhumatismaux de fond synthétiques classiques et de la thérapie laser à colorant pulsé. Quoi qu’il en soit, la réponse et la tolérance du patient au traitement en détermineront toujours l’adéquation.
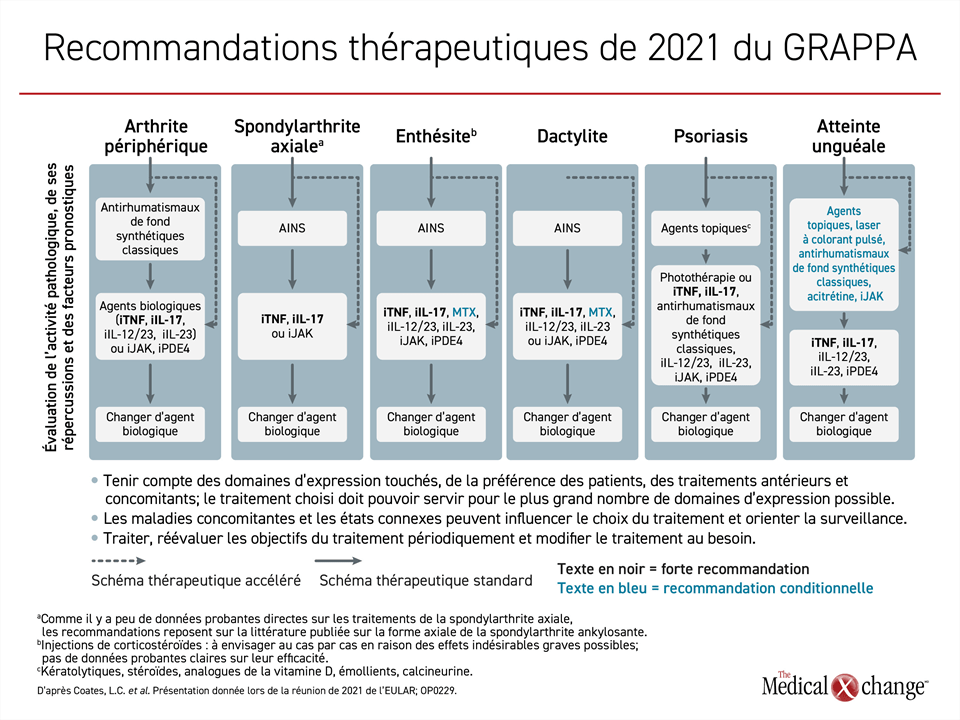
La refonte est donc axée sur la prise en charge des symptômes modérés ou graves. Elle tient compte des nouveaux agents homologués contre le RPso à la lumière d’essais comparatifs, mais aussi de la multiplication des indications des agents dont il avait déjà été question dans les recommandations de 2016. Contrairement à la version de 2016, les agents biologiques ou les agents ciblés sont désormais fortement recommandés pour la prise en charge des symptômes modérés ou graves des six domaines d’expression de la maladie. Toutefois, les agents biologiques et les agents ciblés qui conviennent à chacun d’eux varient.
Chaque fois que des agents biologiques étaient recommandés en première ligne dans la version de 2016, des inhibiteurs du TNF, de l’IL-17 ou de l’IL-12 et de l’IL-23 en faisaient partie. Dans la nouvelle version, les inhibiteurs du TNF et de l’IL-17 font toujours partie des traitements conseillés en première ligne pour les domaines pour lesquels des agents biologiques étaient déjà recommandés en 2016 et ils sont les seuls agents qui le sont pour les six domaines. Seule différence : d’autres agents biologiques et agents ciblés les ont rejoints dans chacun des domaines. Cela dit, ils sont les seuls qui soient désormais « fortement » recommandés pour tous les domaines (Figure 2).
La grande efficacité des inhibiteurs du TNF et de l’IL-17 contre le RPso est un facteur qui pèse lourd dans le choix d’un médicament, puisqu’un des principes directeurs des recommandations thérapeutiques du GRAPPA veut que les médicaments choisis permettent de traiter le plus de domaines d’expression possible. Autre avantage pour les patients très malades, les médicaments qui agissent contre plusieurs domaines d’expression du RPso permettent d’alléger le fardeau thérapeutique. Dans la nouvelle version des recommandations du GRAPPA, l’inhibiteur de l’IL-12 et de l’IL-23 a été ajouté aux options de traitement dans les cas d’atteinte cutanée mal maîtrisée au moyen de préparations topiques. Il ne fait pas partie des options à employer en première ligne contre les formes modérées ou graves de spondylarthrite axiale, une différence par rapport à la version de 2016. Les inhibiteurs de la phosphodiestérase-4 (iPDE-4), qui, en 2016, étaient vus comme des options acceptables pour quatre domaines d’expression des formes modérées ou graves du RPso, sont maintenant recommandés pour cinq.
Au moment où la version antérieure était publiée, aucun des agents ciblés de la classe des inhibiteurs de JAK n’était homologué contre le RPso. Le tofacitinib, qui s’est montré efficace lors d’un essai déterminant de phase III mené chez des patients n’ayant pas répondu de manière satisfaisante à des inhibiteurs du TNF8, a été homologué en 2017. Les essais cliniques réalisés par la suite avec d’autres inhibiteurs de JAK, dont le baricitinib et l’upadacitinib9,10, ont montré que ces agents étaient dotés d’activité contre le RPso, mais leur homologation varie d’un pays à l’autre. Les inhibiteurs de JAK sont considérés comme des options de traitement pour cinq domaines d’expression des formes modérées ou graves de RPso.
La version de 2016 ne mentionnait aucun inhibiteur sélectif de l’IL-23. Le premier de ces agents à avoir été homologué contre le RPso est le guselkumab, qui se lie à la sous-unité p19 de cette cytokine. Il s’est révélé efficace dans le cadre d’un essai déterminant de phase III publié en 2020. Y ont été recrutés des patients déjà traités par des anti-TNF et d’autres n’ayant jamais reçus d’agents biologiques11. Dans les recommandations du GRAPPA publiées prochainement, cet agent, tout comme l’inhibiteur de l’IL-12 et de l’IL-23, a été ajouté à la liste des options de traitement dirigées contre les formes modérées ou graves de la maladie dans cinq de ses six domaines d’expression, mais il ne conviendrait pas au traitement de la spondylarthrite axiale.
Pour choisir l’agent biologique à privilégier, il faut soupeser les options
Les inhibiteurs du TNF, qui sont indiqués contre des maladies inflammatoires auto-immunes multisystémiques, ont donné une vocation aux agents biologiques ciblant des voies de signalisation du système immunitaire. C’est un fait établi que les agents biologiques ciblant des cytokines et les agents ciblés qui atténuent les symptômes en bloquant les voies inflammatoires qui subissent une régulation positive pathologique exercent des effets favorables dans les cas de RPso et d’autres maladies provoquées par un dérèglement du système immunitaire. À la lumière des données probantes disponibles et malgré le fait que ces traitements aient peu été comparés les uns aux autres, ils ne sont pas considérés comme interchangeables pour l’un ou l’autre des domaines d’expression de la maladie en particulier, et ce dans la nouvelle comme dans l’ancienne version des recommandations du GRAPPA. Rien n’illustre mieux leurs différences relatives que la comparaison des inhibiteurs du TNF et des inhibiteurs de l’IL-17, les deux seules classes de médicaments recommandées pour tous les domaines d’expression du RPso. Les agents de ces deux classes ont fait la preuve de leur efficacité, mais les agents biologiques et les agents ciblés se distinguent par leur bilan d’innocuité et leur tableau d’activité.
Par exemple, selon les recommandations actualisées de 2019 de l’EULAR, les inhibiteurs de l’IL-17 pourraient être préférables aux inhibiteurs du TNF pour atténuer les symptômes articulaires du RPso chez les patients aux prises avec une atteinte cutanée étendue, des données probantes ayant révélé que les agents de cette classe sont plus efficaces contre ces deux domaines d’expression de la maladie12. En revanche, ces mêmes recommandations précisent que les inhibiteurs du TNF pourraient être préférables chez les patients également atteints d’une maladie inflammatoire chronique de l’intestin (MICI) ou d’uvéite. Les nouvelles recommandations du GRAPPA ne privilégient aucun traitement en particulier pour l’uvéite concomitante, mais mettent en garde contre l’emploi des inhibiteurs de l’IL-17 dans les cas de MICI. La prévalence des cas de MICI sur fond de RPso est faible, puisqu’elle est inférieure à 1,5 % tant pour la colite ulcéreuse que pour la maladie de Crohn13.
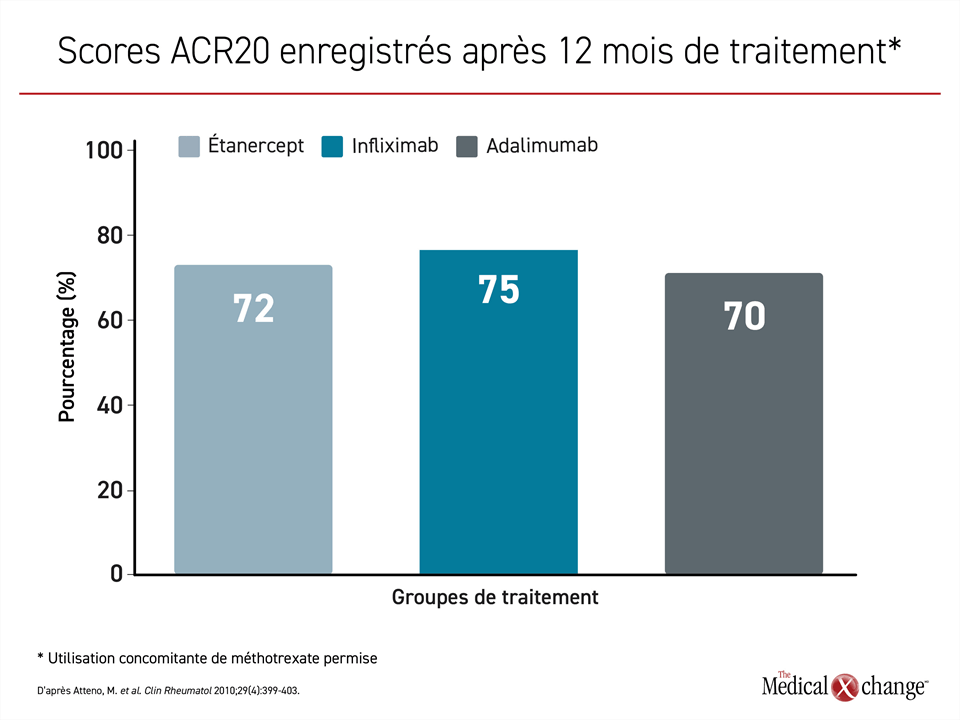
L’étanercept, le premier inhibiteur du TNF qui ait été homologué contre le RPso, est sur le marché depuis près de 20 ans14. L’infliximab et l’adalimumab, qui l’ont rejoint en 2005, semblent dotés d’une efficacité similaire15. En effet, aucune différence d’importance n’est ressortie d’une comparaison directe de ces agents au chapitre des taux de réponse ACR20 enregistrés à 12 mois (Figure 3)16. Cette même étude a donné des résultats semblables pour les réponses PASI et la qualité de vie mesurée au moyen du Questionnaire d’évaluation de l’état de santé.
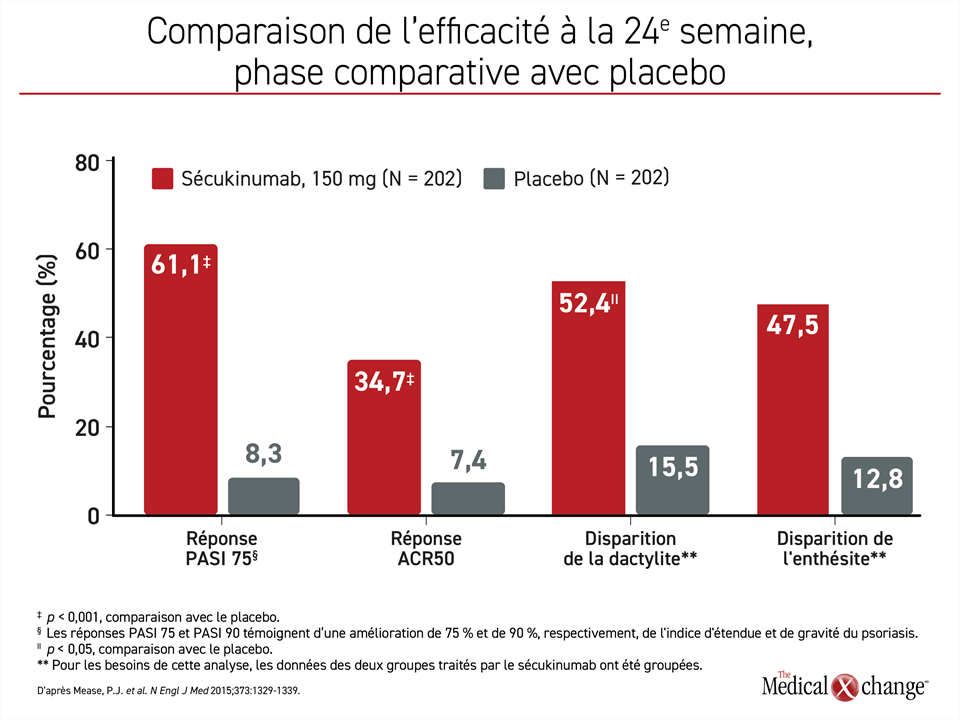
En 2015, le sécukinumab a été le premier inhibiteur de l’IL-17 homologué contre le RPso à la lumière des résultats de l’étude de phase III intitulée FUTURE 117. Cette étude visait avant tout à obtenir une atténuation soutenue de l’atteinte articulaire qui serait objectivée au moyen des critères de l’ACR. D’autres résultats ont étayé l’efficacité du sécukinumab pour plusieurs paramètres d’évaluation du RPso (Figure 4). Des études réalisées par la suite ont également confirmé les effets positifs de cet agent sur l’atteinte cutanée18, l’enthésite19 et la dactylite20. Un article publié récemment à propos d’une étude multicentrique ayant servi à comparer directement l’adalimumab au sécukinumab chez des patients atteints de RPso nous apprend que ce dernier a permis d’observer une atténuation des symptômes articulaires numériquement supérieure d’après le taux de réponses ACR20 obtenu (76,4 % vs 68,3 %; p = 0,175) et une disparition complète des lésions cutanées statistiquement significative selon le taux de réponses PASI 100 enregistré (39,1 % vs 23,8 %; p = 0,013)21.
L’IL-17 est la principale cytokine effectrice dans la pathogenèse du psoriasis et du RPso, selon une analyse récente de cette cible22. L’IL-17A, la cytokine à laquelle le sécukinumab se lie, est produite par un large éventail de cellules immunitaires, dont les lymphocytes T et les mastocytes. Lorsqu’elle subit une régulation positive, elle agit sur les kératinocytes, les granulocytes neutrophiles, les ostéoclastes, les chondrocytes et les cellules épithéliales. Tandis que le sécukinumab a été rejoint par d’autres agents biologiques exerçant leur action sur cette voie, on attribue à cet inhibiteur de l’IL-17A le crédit d’améliorations substantielles dans tous les domaines d’expression du RPso22.
Le comportement physiopathologique du RPso sur le plan moléculaire, comme celui d’autres maladies auto-immunes, est le résultat complexe d’un dérèglement des cellules du système immunitaire inné et d’une perturbation de l’expression des cytokines impliquant de nombreuses voies23. Des études cliniques ont prouvé qu’il est possible d’agir sur l’expression et l’évolution pathologiques en inhibant plusieurs de ces voies, mais le nombre croissant d’agents biologiques et d’agents ciblés opposés aux formes modérées ou graves de la maladie ne doit pas nuire aux décisions cliniques. Compte tenu de l’incertitude à savoir quelles voies dominent dans les différents domaines d’expression du RPso, le choix des traitements reposera sur des données empiriques. Il ne s’agit pas uniquement de preuves d’une efficacité durable, mais aussi de la démonstration d’une innocuité soutenue, ce qui a une importance particulière dans le cas des agents ciblant des voies immunitaires.
Par exemple, des inhibiteurs de JAK ont été les premiers agents ciblés à prise orale qui aient été homologués pour le traitement du RPso. Les patients peuvent voir un avantage à ce mode d’administration, quoique les doses quotidiennes nécessaires puissent soulever des inquiétudes quant au respect du traitement à long terme. Empiriquement parlant, rien n’indique de façon convaincante que les inhibiteurs de JAK puissent améliorer le sort des patients à long terme et les risques qu’ils pourraient comporter à long terme, comme une réactivation virale, l’apparition de lymphomes et la thromboembolie veineuse, inquiètent24. En outre, même si le guselkumab, un inhibiteur sélectif de l’IL‑23, s’est montré relativement bien toléré au cours d’études de courte durée25, son efficacité n’a pas été établie dans tous les domaines d’expression du RPso et son innocuité à long terme reste à définir.
La variabilité de certains conseils prodigués dans les nouvelles recommandations thérapeutiques du GRAPPA à propos des formes modérées ou graves de la maladie dans les six domaines d’expression du RPso s’explique en partie par la disparité des données probantes disponibles. Cela dit, la forte recommandation dont jouissent les inhibiteurs du TNF et ceux de l’IL-17 pour ces six domaines ne s’appuie pas uniquement sur des paramètres d’évaluation concrets de l’efficacité et de l’innocuité comme c’est le cas dans les essais cliniques. Les traitements privilégiés ont plutôt été sélectionnés en raison de leur effet indésirable minime, voire nul, sur les maladies concomitantes et de leur effet favorable sur les paramètres témoignant du vécu des patients comme l’amélioration de la qualité de vie, ce qu’ont endossé les représentants des patients membres du comité de rédaction du GRAPPA.
Résumé
Les recommandations thérapeutiques du GRAPPA qui sont en voie d’être publiées se veulent une mise à jour de celles de 2016. Aucun changement majeur n’a été apporté à la liste des agents à utiliser contre les formes légères de la maladie dans les six domaines d’expression du RPso, contrairement aux recommandations relatives aux formes modérées ou graves qui ont été refondues. Dans la nouvelle version, les agents biologiques, les médicaments ciblés ou ces deux types de produits, sont maintenant recommandés en première ligne dans les cas modérés ou graves de la maladie dans les six domaines d’expression du RPso. Les seuls parmi eux qui soient privilégiés pour chacun de ces six domaines sont les inhibiteurs du facteur de nécrose tumorale et les inhibiteurs de l’IL-17.
Les inhibiteurs de l’IL-12 et de l’IL-23, tels que l’ustékinumab, ou l’inhibiteur sélectif de l’IL-23 qu’est le guselkumab, qui font partie des options thérapeutiques dirigées contre le RPso depuis 2016, ne sont pas recommandés contre la spondylarthrite axiale imputable au RPso dans la nouvelle version des recommandations thérapeutiques du GRAPPA. Cette différence n’est pas importante seulement pour les patients affligés de symptômes axiaux prononcés; elle s’inscrit dans le principe thérapeutique plus large défendu par le GRAPPA qui veut que le traitement à privilégier permette de soigner le plus de domaines d’expression possible. Parallèlement aux inhibiteurs du TNF et à ceux de l’IL-17, la mise à disposition d’autres agents biologiques et médicaments ciblés est importante pour les patients dont les symptômes ne sont pas suffisamment maîtrisés à l’aide de ces agents de première ligne.
Références
1. Ritchlin CT, Colbert RA et Gladman DD. Psoriatic Arthritis. N Engl J Med 2017;376(10):957-970. DOI: 10.1056/NEJMra1505557.
2. Taylor W, Gladman D, Helliwell P, et al. Classification criteria for psoriatic arthritis: development of new criteria from a large international study. Arthritis Rheum 2006;54(8):2665-2673. DOI: 10.1002/art.21972.
3. Eder L, Widdifield J, Rosen CF, et al. Trends in the Prevalence and Incidence of Psoriasis and Psoriatic Arthritis in Ontario, Canada: A Population-Based Study. Arthritis Care Res (Hoboken) 2019;71(8):1084-1091. DOI: 10.1002/acr.23743.
4. FitzGerald O, Ogdie A, Chandran V, et al. Psoriatic arthritis. Nat Rev Dis Primers 2021;7(1):59. DOI: 10.1038/s41572-021-00293-y.
5. Coates LC et Helliwell PS. Psoriatic arthritis: state of the art review. Clin Med (Lond) 2017;17(1):65-70. DOI: 10.7861/clinmedicine.17-1-65.
6. Coates LC, Soriano E et Corp N, H. B. The Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA) treatment recommendations 2021. European League Against Rheumatism (EULAR) 2021; réunion en ligne de 2021.
7. Coates LC, Kavanaugh A, Mease PJ, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis 2015 Treatment Recommendations for Psoriatic Arthritis. Arthritis Rheumatol 2016;68(5):1060-1071. DOI: 10.1002/art.39573.
8. Gladman D, Rigby W, Azevedo VF, et al. Tofacitinib for Psoriatic Arthritis in Patients with an Inadequate Response to TNF Inhibitors. N Engl J Med 2017;377(16):1525-1536. DOI: 10.1056/NEJMoa1615977.
9. Papp K, Gordon K, Thaci D, et al. Phase 2 Trial of Selective Tyrosine Kinase 2 Inhibition in Psoriasis. N Engl J Med 2018;379(14):1313-1321. DOI: 10.1056/NEJMoa1806382.
10. McInnes IB, Anderson JK, Magrey M, et al. Trial of Upadacitinib and Adalimumab for Psoriatic Arthritis. N Engl J Med 2021;384(13):1227-1239. DOI: 10.1056/NEJMoa2022516.
11. Deodhar A, Helliwell PS, Boehncke WH, et al. Guselkumab in patients with active psoriatic arthritis who were biologic-naive or had previously received TNFalpha inhibitor treatment (DISCOVER-1): a double-blind, randomised, placebo-controlled phase 3 trial. Lancet 2020;395(10230):1115-1125. DOI: 10.1016/S0140-6736(20)30265-8.
12. Gossec L, Baraliakos X, Kerschbaumer A, et al. EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2019 update. Ann Rheum Dis 2020;79(6):700-712. DOI: 10.1136/annrheumdis-2020-217159.
13. Shah K, Paris M, Mellars L, Changolkar A et Mease PJ. Real-world burden of comorbidities in US patients with psoriatic arthritis. RMD Open 2017;3(2):e000588. DOI: 10.1136/rmdopen-2017-000588.
14. Mantravadi S, Ogdie A et Kraft WK. Tumor necrosis factor inhibitors in psoriatic arthritis. Expert Rev Clin Pharmacol 2017;10(8):899-910. DOI: 10.1080/17512433.2017.1329009.
15. Gladman DD. Adalimumab, etanercept and infliximab are equally effective treatments for patients with psoriatic arthritis. Nat Clin Pract Rheumatol 2008;4(10):510-511. DOI: 10.1038/ncprheum0880.
16. Atteno M, Peluso R, Costa L, et al. Comparison of effectiveness and safety of infliximab, etanercept, and adalimumab in psoriatic arthritis patients who experienced an inadequate response to previous disease-modifying antirheumatic drugs. Clin Rheumatol 2010;29(4):399-403. DOI: 10.1007/s10067-009-1340-7.
17. Mease PJ, McInnes IB, Kirkham B, et al. Secukinumab Inhibition of Interleukin-17A in Patients with Psoriatic Arthritis. N Engl J Med 2015;373(14):1329-1339. DOI: 10.1056/NEJMoa1412679.
18. McInnes IB, Mease PJ, Ritchlin CT, et al. Secukinumab sustains improvement in signs and symptoms of psoriatic arthritis: 2 year results from the phase 3 FUTURE 2 study. Rheumatology (Oxford) 2017;56(11):1993-2003. DOI: 10.1093/rheumatology/kex301.
19. Coates LC, Wallman JK, McGonagle D, et al. Secukinumab efficacy on resolution of enthesitis in psoriatic arthritis: pooled analysis of two phase 3 studies. Arthritis Res Ther 2019;21(1):266. DOI: 10.1186/s13075-019-2055-z.
20. Garcia-Montoya L et Marzo-Ortega H. The role of secukinumab in the treatment of psoriatic arthritis and ankylosing spondylitis. Ther Adv Musculoskelet Dis 2018;10(9):169-180. DOI: 10.1177/1759720X18787766.
21. Gottlieb AB, Merola JF, Reich K et Behrens F. Efficacy of secukinumab and adalimumab in patients with psoriatic arthritis and concomitant moderate-to-severe plaque psoriasis: results from EXCEED, a randomized double-blind head-to-head monotherapy study. Br J Dermatol, 29 avril 2021.
22. Blauvelt A et Chiricozzi A. The Immunologic Role of IL-17 in Psoriasis and Psoriatic Arthritis Pathogenesis. Clin Rev Allergy Immunol 2018;55(3):379-390. DOI: 10.1007/s12016-018-8702-3.
23. Carvalho AL et Hedrich CM. The Molecular Pathophysiology of Psoriatic Arthritis-The Complex Interplay Between Genetic Predisposition, Epigenetics Factors, and the Microbiome. Front Mol Biosci 2021;8:662047. DOI: 10.3389/fmolb.2021.662047.
24. Cohen SB, Tanaka Y, Mariette X, et al. Long-term safety of tofacitinib up to 9.5 years: a comprehensive integrated analysis of the rheumatoid arthritis clinical development programme. RMD Open 2020;6(3). DOI: 10.1136/rmdopen-2020-001395.
25. McHugh J. IL-23 inhibitor guselkumab shows promise for PsA. Nat Rev Rheumatol 2020;16(5):247. DOI: 10.1038/s41584-020-0420-6.