Nephrologie
Hyperphosphatémie : revue d'experts et commentaires tirés de la littérature
Hyperphosphatémie en dialyse : stratégies pour maintenir les taux sériques cibles de phosphate
Normand Proulx, M.D., FRCPC
Néphrologue
CISSS de l’Outaouais
Conférencier, Université McGill
Gatineau, Québec
Robert Ting, M.D., FRCPC, FACP
Néphrologue
Réseau de santé Scarborough (Scarborough Health Network, SHN)
Directeur médical, Cliniques de gestion de la dialyse
Toronto, Ontario
Les lignes directrices pour la prise en charge de la néphropathie chronique avancée, y compris la dialyse, appuient un contrôle intensif des taux élevés de phosphate en raison d’un large éventail de complications. Ces complications comprennent une augmentation du risque d’hyperparathyroïdie secondaire, d’événements cardiovasculaires (CV) et de décès. Malgré les lignes directrices, le contrôle de l’hyperphosphatémie chez les patients atteints d’une néphropathie chronique est systématiquement médiocre. Dans certaines études, moins de 30 % des patients sous dialyse se situaient dans la plage cible. Les chélateurs de phosphore ainsi que le régime alimentaire constituent la pierre angulaire des stratégies thérapeutiques. Une posologie simple est pertinente à l’égard des soins aux patients. En raison de la complexité de la néphropathie chronique et de ses nombreuses comorbidités, les chélateurs de phosphore dont le fardeau de la médication est faible sont une variable importante en ce qui a trait à l’adhésion et l’atteinte des objectifs thérapeutiques.
Contexte
Alors que la diminution de la fonction rénale approche puis chute sous 30 mL/min/1,73 m2, le risque d’hyperphosphatémie augmente.4 Une des raisons est que l’homéostasie du phosphate dépend de l’excrétion urinaire, une fonction clé des reins.5. Ainsi, il s’ensuit que les patients anuriques sous dialyse courent le plus grand risque d’hyperphosphatémie. De plus, le rein participe à l’équilibre de la parathormone (PTH), du facteur de croissance des fibroblastes (FGF23), de la vitamine D et d’autres facteurs biochimiques qui régissent le métabolisme phosphorique.6 Pour définir la physiopathologie de l’hyperphosphatémie, les lignes directrices des résultats globaux améliorant la maladie rénale (Kidney Disease Improving Global Outcomes, KDIGO) sur les troubles minéraux et osseux liés à la néphropathie chronique ont mis l’accent sur la corrélation entre les taux élevés de phosphate, calcium, et PTH de la néphropathie chronique.1 Parmi plusieurs boucles entraînant une hyperphosphatémie, la diminution de la synthèse rénale de la vitamine D provoque une diminution de l’absorption gastro-intestinale du calcium, ce qui peut à son tour stimuler une plus grande production de PTH résultant en une plus grande libération de phosphore provenant de l’os.5 Cependant, lorsque le DFGe chute sous 20 à 25 mL/min/1,73 m2, la réabsorption du phosphore est supprimée de façon maximale, et l’excrétion urinaire compensatoire de phosphate pourraient ne plus suivre l’apport de phosphore et sa libération par les os, entraînant une hyperphosphatémie.
Pour une entrevue exclusive avec le Dr Normand Proulx couvrant l’impact sur la pratique clinique, cliquez ici
L’alimentation et les chélateurs de phosphore sont les pierres angulaires du traitement de l’hyperphosphatémie, mais les lignes directrices de prise en charge encouragent que l’attention soit portée sur la corrélation entre les autres troubles métaboliques associés. Bien que presque tous les patients atteints d’une maladie rénale avancée aient besoin de chélateurs de phosphore pour atteindre les valeurs cibles des lignes directrices, des stratégies visant à corriger d’autres déséquilibres métaboliques, comme les taux de vitamine D, de calcium et de PTH, sont souvent nécessaires.
L’hyperphosphatémie peut être associée à des crampes musculaires, de la tétanie, un engourdissement péribuccal ou des picotements, mais le degré auquel ces symptômes sont causés par des taux élevés de phosphate sérique ou des troubles métaboliques qui l’accompagnent n’est pas clair. Les patients atteints d’hyperphosphatémie peuvent également développer des douleurs osseuses et articulaires, un prurit et une éruption cutanée. Pour le diagnostic, un suivi de routine du phosphate sérique, ainsi que du calcium sérique, de la PTH et de la phosphatase alcaline, est conseillée une fois que les patients ont une néphropathie chronique de stade 3a ou plus, selon les lignes directrices de KDIGO.1 La néphropathie chronique de stade 3a est définie comme un débit de filtration glomérulaire estimé (DFGe) de 45 à 59 mL/min/1,73 m2. Au moment où l’insuffisance rénale atteint le stade 3b (DFGe de 30 à 44 mL/min/1,73 m2) ou une gravité plus élevée, les lignes directrices recommandent de surveiller le taux sérique de phosphate et de calcium au moins tous les trois mois.
La définition du taux sérique normal de phosphate varie.7 Les valeurs de 0,9 à 1,5 mmol/L sont typiques chez les personnes en bonne santé, bien que des analyses rétrospectives suggèrent que le risque de progression de la néphropathie chronique est observé à des niveaux inférieurs à 1,5 mmol/L. Dans des études observationnelles, l’augmentation des concentrations sériques de phosphate, qui sont souvent accompagnées d’élévations de taux PTH, FGF23, calcium et produit phosphocalcique (CaxP), est associée à un risque accru de calcification valvulaire, d’hypertrophie ventriculaire gauche, d’insuffisance cardiaque, de décès d’origine CV et de décès toutes causes confondues.8 Dans plusieurs études comportant le traitement de liaison au phosphate, y compris une revue et une méta-analyse systémiques, des réductions du phosphate sérique associées à une amélioration de la survie ont été observées. 9-11 Sur la base du vaste corpus de données associant des taux élevés de phosphate sérique avec une augmentation de la mortalité et les données probantes rétrospectives associant des réductions de phosphate sérique avec un avantage de survie, la cible de phosphate sérique est définie dans les lignes directrices de KDIGO comme étant la « plage normale ». Les essais prospectifs randomisés et contrôlés qui vérifient et quantifient les bienfaits du traitement de l’hyperphosphatémie n’ont pas encore été terminés, mais sont actuellement en cours.
Les maladies CV, qui représentent plus de 50 % des décès chez les patients atteints de néphropathie chronique,12 sont considérées comme la cause la plus courante de décès lié à des taux élevés de phosphate sérique. La calcification vasculaire, qui survient en association avec les perturbations métaboliques interreliées qui comprennent l’hyperphosphatémie, est impliquée dans les événements ischémiques. Les calcifications vasculaires sont également une cause soupçonnée d’altération de la fonction CV qui entraîne une insuffisance cardiaque, une mort cardiaque subite et une maladie artérielle périphérique.11,13
Il existe des mécanismes autres que la calcification vasculaire par lesquels l’hyperphosphatémie contribue directement ou indirectement à un risque accru de morbidité et de mortalité. En raison de son effet exacerbant sur le métabolisme du calcium, l’hyperphosphatémie augmente directement ou indirectement le risque de douleur osseuse et de fracture osseuse liées à une altération du métabolisme osseux.4,11 Il est également associé à un prurit invalidant,14 et augmente le risque de calciphylaxie, une complication rare, mais potentiellement mortelle.15 L’hyperparathyroïdie secondaire, caractérisée par une hyperplasie de la glande parathyroïde, est un facteur apparenté, mais potentiellement indépendant, qui contribue au risque de maladies CV et osseuses.16
Prise en charge
La plupart des patients atteints d’une néphropathie chronique avancée et essentiellement tous les patients sous dialyse ont une hyperphosphatémie.14 En raison des risques associés à un taux élevé de phosphate sérique, les lignes directrices de KDIGO recommandent des interventions actives pour abaisser le taux de phosphate vers des valeurs normales chez les patients atteints d’une néphropathie chronique de stade 3a ou plus.1 Bien que le phosphore soit le minéral essentiel utilisé par les cellules dans tout le corps, le phosphate, qui représente une liaison de l’oxygène au phosphore qui est utilisé par tous les systèmes biologiques, est la cible typique de l’évaluation.6
Il existe actuellement trois approches pour abaisser les taux de phosphate chez les patients atteints de néphropathie chronique :
1. Restriction alimentaire de l’apport en phosphate
L’intervention active comprend la restriction alimentaire des aliments riches en phosphate qui peuvent provenir de diverses sources. Le phosphate organique est dérivé soit de protéines animales, soit de sources végétales, tandis que le phosphate inorganique est présent dans les boissons gazeuses et est utilisé comme additif pour prolonger la durée de conservation des aliments emballés. La biodisponibilité du phosphate dans le sérum dépend de la source, le phosphate inorganique des aliments emballés et des boissons gazeuses ayant la biodisponibilité la plus élevée (80 à 100 %3). Il faut donc éviter les sources de phosphate inorganique chez les patients atteints de la néphropathie chronique. Alors que la biodisponibilité du phosphore dans des sources inorganiques, comme les aliments préparés ou emballés et les boissons gazeuses, est estimée à 80 à 100 %,17 la biodisponibilité du phosphore dans les sources végétales, comme les céréales, légumineuses, ou noix, varie de 20 à 40 %.18,19 La biodisponibilité des protéines animales, comme la viande, le poisson, les œufs ou le lait, varie de 40 à 60 %.17 Les lignes directrices nutritionnelles émises par l’Initiative sur la qualité des mesures relatives aux maladies rénales (Kidney Disease Outcomes Quality Initiative, KDOQI) de la National Kidney Foundation comprennent des renseignements sur l’identification des aliments riches en phosphates et des stratégies pour concevoir des régimes à faible teneur en phosphate.20 Bien que le régime alimentaire puisse procurer une réduction importante des taux sériques de phosphate, certaines études indiquent que moins de la moitié des patients continuent à suivre un régime alimentaire à faible teneur en phosphate.19 Chez les patients suivant un régime à faible teneur en phosphate, une surveillance étroite de l’état nutritionnel est appropriée en raison du risque du manque en protéine ou d’autres aliments essentiels. Les initiatives réussies nécessiteront probablement une éducation du patient et des membres de sa famille, ainsi que des conseils nutritionnels adaptés au mode de vie et à la culture du patient.19
2. Élimination du phosphate par dialyse
Le phosphate est éliminé par hémodialyse, bien qu’il dépende de variables comme le débit et les caractéristiques de la membrane du dialyseur. Cependant, l’hémodialyse ne peut éliminer efficacement le phosphate du sérum que pendant une dialyse type de 4 heures, qui élimine environ 900 mg de phosphate.18 Une explication de cette clairance limitée est que la plus grande partie de la charge en phosphate chez un patient atteint de néphropathie chronique se trouve dans l’espace intracellulaire plutôt que dans le sang et que le débit de transfert des solutés intracellulaire à extracellulaire est lent.21 Deux études ont démontré qu’il est possible d’éliminer plus de phosphate avec des séances de dialyse nocturnes de plus longue durée.22,23 Des séances de dialyse plus typiques sont utiles pour réduire les taux sériques de phosphate, mais doivent demeurer inférieures à l’apport quotidien de phosphate, qui se produit à un taux de 1 000 mg par jour, même avec des régimes à faible teneur en phosphate. Dans les régimes alimentaires plus typiques, l’apport peut être plus de deux fois plus élevé avec des taux d’absorption estimés à environ 60 %.24,25
3. Réduction de l’absorption intestinale du phosphate
En raison des limites du régime alimentaire et de la dialyse dans la réduction de l’hyperphosphatémie, les chélateurs de phosphore doivent être envisagés chez la plupart ou tous les patients atteints d’une néphropathie chronique tardive et demeurent une norme de soins chez les patients sous dialyse et dialyse péritonéale. Dans le tractus gastro-intestinal, ces chélateurs de phosphore échangent un anion de phosphate présent dans les aliments avec un cation, comme le carbonate, l’acétate ou le citrate, pour former un composé non absorbable excrété dans les selles.18 Par conséquent, le mode d’action des chélateurs explique pourquoi ils doivent être pris avec les repas afin d’être efficaces. Même si les chélateurs autorisés sont efficaces, ils utilisent plusieurs mécanismes différents. Les différences entre les agents sont potentiellement significatives pour définir l’efficacité et l’innocuité relatives, ainsi que les considérations pratiques, en particulier le fardeau quotidien de la médication.
Ce dernier problème est pertinent pour l’adhésion thérapeutique essentielle à des réductions soutenues du phosphate sérique. Même si le fardeau de la médication n’est que l’un des nombreux obstacles pour les patients suivant un traitement à long terme, il s’agit d’une étape fondamentale vers l’atteinte de l’objectif visant à baisser les taux de phosphate afin de réduire les risques associés. Dans les études cliniques, la non-adhésion aux chélateurs de phosphore a largement varié, mais il existe plusieurs études suggérant que seulement environ la moitié des patients continuent d’y adhérer pendant de longues périodes.26
Mettre en œuvre une approche globale du traitement
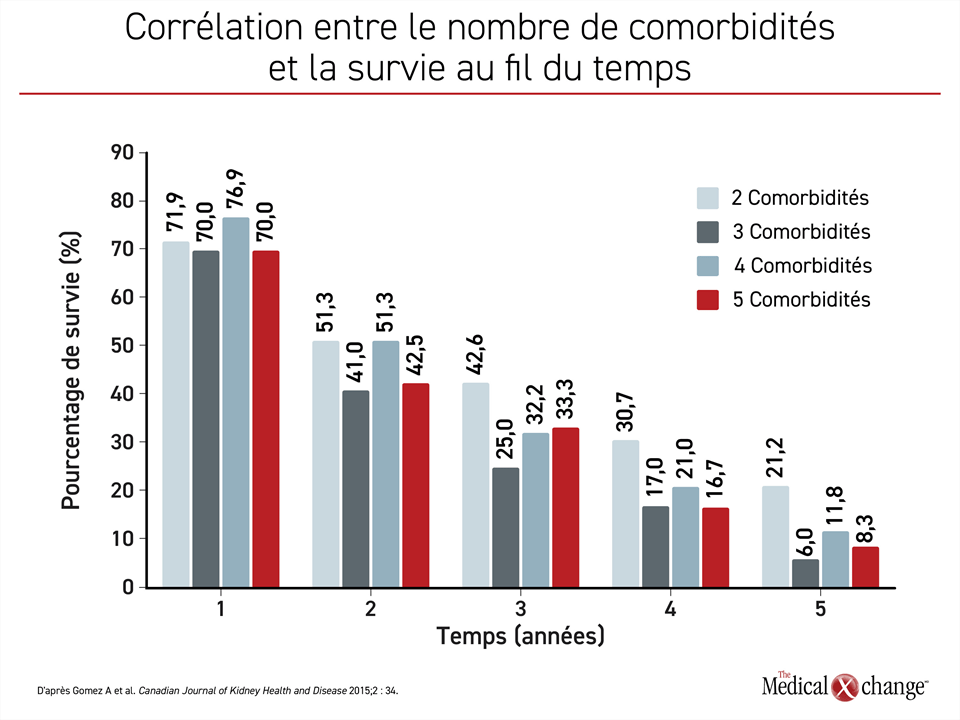
L’hyperphosphatémie et la néphropathie chronique surviennent généralement dans le contexte de multiples morbidités, y compris le diabète sucré, l’anémie, et les maladies CV ou les facteurs de risque de maladie CV, comme l’hypertension, nécessitant tous un traitement.27 Un obstacle à l’adhésion à la maîtrise pharmacologique de l’hyperphosphatémie est le nombre considérable de traitements pharmacologiques requis dans cette population complexe. En raison de cette complexité, il y a un intérêt croissant concernant le développement d’équipes multidisciplinaires qui peuvent répondre aux multiples problèmes de santé auxquels font face les patients atteints de néphropathie chronique avancée ou qui ont déjà progressé à la dialyse. Il y a des preuves que cela est efficace. Dans une méta-analyse de 21 études portant sur plus de 10 000 patients, des modèles de soins multidisciplinaires pour la néphropathie chronique, définis comme des équipes composées de néphrologues, de cardiologues, de pharmaciens et de diététistes, ont été associés à une progression plus lente de déclin du DFGe et des taux plus faibles de mortalité.28 Ce type d’approche globale du traitement est justifié. La forte corrélation entre le nombre de comorbidités et la survie au fil du temps appuie une approche ciblée qui comprend une adhésion optimale aux traitements ralentissant la progression de la maladie29 (Figure 1).
Chélateurs de phosphore : choisir le traitement approprié
Des chélateurs de phosphore sont nécessaires chez la plupart des patients atteints de la néphropathie chronique avancée afin d’améliorer les taux sériques de phosphate. Selon les lignes directrices de KDIGO, la cible est une plage acceptable, définie comme étant 1,13 à 1,78 mmol/L, bien qu’il n’y ait pas de niveau clairement défini au-dessus duquel les niveaux de phosphate imposent des risques. Jusqu’à présent, il n’existe aucune preuve prospective d’un avantage sur le plan de la mortalité chez les personnes atteignant un taux cible de phosphate sérique donné, mais deux essais contrôlés randomisés, HiLo et PHOSPHATE,30,31 sont en cours afin de répondre à cette question. Compte tenu de la plausibilité des bienfaits et des données rétrospectives appuyant une réduction de la mortalité attribuable au traitement des taux élevés de phosphate sérique, les chélateurs de phosphore demeurent une norme de soins.
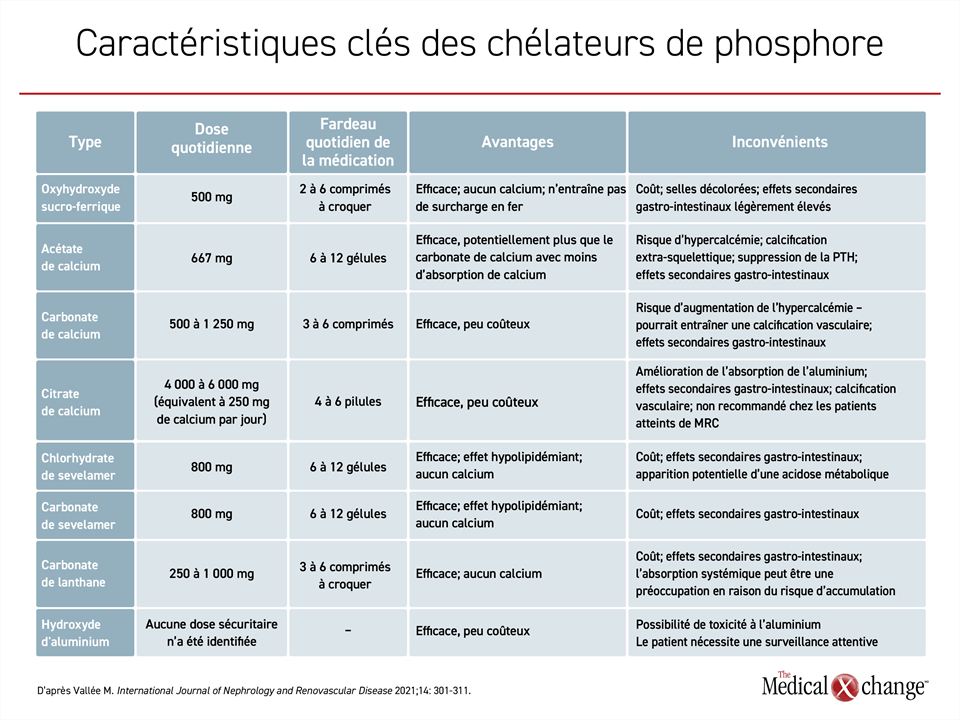
L’introduction de chélateurs de phosphore dans la prise en charge de la néphropathie chronique avancée est une étape relativement simple, mais ces agents ne sont pas interchangeables en raison de nombreuses caractéristiques potentiellement significatives, y compris leurs mécanismes, leur risque d’effets indésirables, leur coût et leur fardeau de la médication. Même si l’hydroxyde d’aluminium a en grande partie été laissé de côté en raison du risque de toxicité, il existe trois chélateurs de phosphore contenant du calcium, deux chélateurs qui comprennent le sevelamer, un qui contient du lanthane, et l’oxyhydroxyde sucro-ferrique, un nouvel agent et le plus récemment approuvé (Tableau 1).
Il y a peu d’essais cliniques contrôlés comparant ces options. Les chélateurs à base de calcium, le carbonate de calcium, l’acétate de calcium et le citrate de calcium sont largement utilisés, mais ne sont pas particulièrement bons pour lier le phosphate et des études ont soulevé des inquiétudes en associant ces chélateurs à une augmentation de la charge en calcium avec la progression de la calcification vasculaire.32 Le risque peut être réduit en limitant le nombre de comprimés utilisés, mais cela ne permettrait pas d’atteindre les cibles de taux de phosphore chez la plupart des patients en raison de la capacité réduite de chélation.33
Les deux chélateurs de phosphate contenant du sevelamer, le chlorhydrate de sevelamer et le carbonate de sevelamer, sont également couramment utilisés. Dans des études contrôlées, ils ont été associés à des réductions soutenues du phosphate sérique chez les patients sous dialyse ou dialyse péritonéale. Ils ne sont pas associés à un risque de taux élevé de calcium.34 Cependant, le sevelamer a des effets hors cible sur le tractus gastro-intestinal qui comprennent des saignements, des nausées et de la constipation.35 Dans certains cas, des effets secondaires comme la dysphagie et l’obstruction intestinale ont entraîné une hospitalisation et une intervention chirurgicale.36 D’un point de vue quotidien des patients, la capacité relativement faible de liaison au phosphate représente probablement le plus grand inconvénient. Les deux variétés de sevelamer nécessitent jusqu’à 12 pilules par jour afin d’atteindre les valeurs cibles de traitement. De plus, les pilules de sevelamer sont grosses et doivent être avalées dans leur ensemble, ce qui rend l’expérience du patient moins agréable.
Le carbonate de lanthane, comme les médicaments contenant du sevelamer, ne contient pas de calcium, mais il est associé à des effets secondaires, y compris ceux touchant le tractus gastro-intestinal ainsi que des symptômes musculaires.37 Pour une posologie typique, le carbonate de lanthane ne nécessite que 3 à 6 pilules par jour afin d’atteindre les taux cibles de phosphate, mais il existe un risque d’accumulation substantielle de ce chélateur dans les os.38 Les conséquences cliniques de cette accumulation sont incertaines, mais cette caractéristique, ainsi que son coût, pourrait expliquer son utilisation limitée. Les comprimés de lanthane ne peuvent pas être avalés en entier pour être efficaces et en raison de leur consistance dure, de nombreux patients doivent écraser le comprimé avant de prendre le chélateur avec un repas. De plus, la palatabilité est moins agréable en raison de la texture crayeuse.
L’oxyhydroxyde sucro-ferrique, le chélateur de phosphore le plus récemment approuvé, est un comprimé à croquer pris trois fois par jour, avec des repas. Lorsque ces comprimés sont mâchés, les patients rapportent souvent un goût semblable à celui des baies, ce qui rend l’expérience plus agréable que les autres chélateurs. Il s’est également révélé efficace chez les patients atteints d’insuffisance rénale au stade terminal, y compris chez ceux sous dialyse. Lors d’une comparaison directe avec le chlorhydrate de sevelamer, l’un des chélateurs de phosphore les plus largement prescrits, il s’est avéré non inférieur en ce qui concerne le contrôle du phosphate. Cependant, il avait des avantages, y compris un fardeau quotidien beaucoup plus faible en comprimés (3,1 comprimés à croquer vs 8,1 comprimés non à croquer pour atteindre des taux de phosphate similaires) et un profil d’innocuité plus favorable.39 Plus précisément, alors que les effets indésirables gastro-intestinaux sont survenus dans les deux groupes de l’étude, ils sont survenus à un taux plus faible avec l’oxyhydroxide sucro-ferrique (33,6 vs 45,1 %).
Dans une autre étude, les résultats des patients maintenus sous oxyhydroxyde sucro-ferrique ont été comparés à ceux commencés sous oxyhydroxyde sucro-ferrique, mais qui sont passés à un autre chélateur de phosphate à 90 jours.40 À 2 ans, les patients traités par oxyhydroxyde sucro-ferrique d’entretien étaient plus susceptibles d’atteindre un taux de phosphate ≤ 1,78 mmol/L, avaient des taux d’hospitalisations annuelles plus faibles et prenaient 50 % moins de pilules. Dans l’étude VERIFIE récemment publiée, les taux sériques de phosphore sont passés de 2,03 à 1,71 mmol/L avec l’oxyhydroxyde sucro-ferrique à une dose quotidienne moyenne de 2,3 pilules.41 De plus, la proportion de patients ayant des taux sériques de phosphore < 1,78 mmol/L est passée de 29,9 % à l’inclusion dans l’étude à 63,0 % à la fin du suivi.
Les selles molles sont l’effet secondaire gastro-intestinal le plus souvent signalé avec l’oxyhydroxyde sucro-ferrique. Ces effets sont légers à modérés et tendaient à disparaître tôt dans le traitement sans traitements spécifiques ou changements thérapeutiques.39 L’expérience clinique a mené à la suggestion d’instaurer l’oxyhydroxyde sucro-ferrique à une dose plus faible de 500 mg par jour à mâcher avec le plus gros repas de la journée afin de minimiser le risque de selles molles. Par la suite, la dose peut être augmentée par 500 mg (une pilule) toutes les 2 à 4 semaines jusqu’à ce que le taux cible de phosphate soit atteint. La dose quotidienne maximale recommandée est de 3 000 mg (6 pilules) par jour. En raison de la teneur en fer des selles d’oxyhydroxyde sucro-ferrique, les selles deviennent souvent foncées et décolorées et les patients doivent en être informés. Il est à noter que des études n’ont signalé qu’une légère absorption systémique de fer avec ce chélateur.42,43
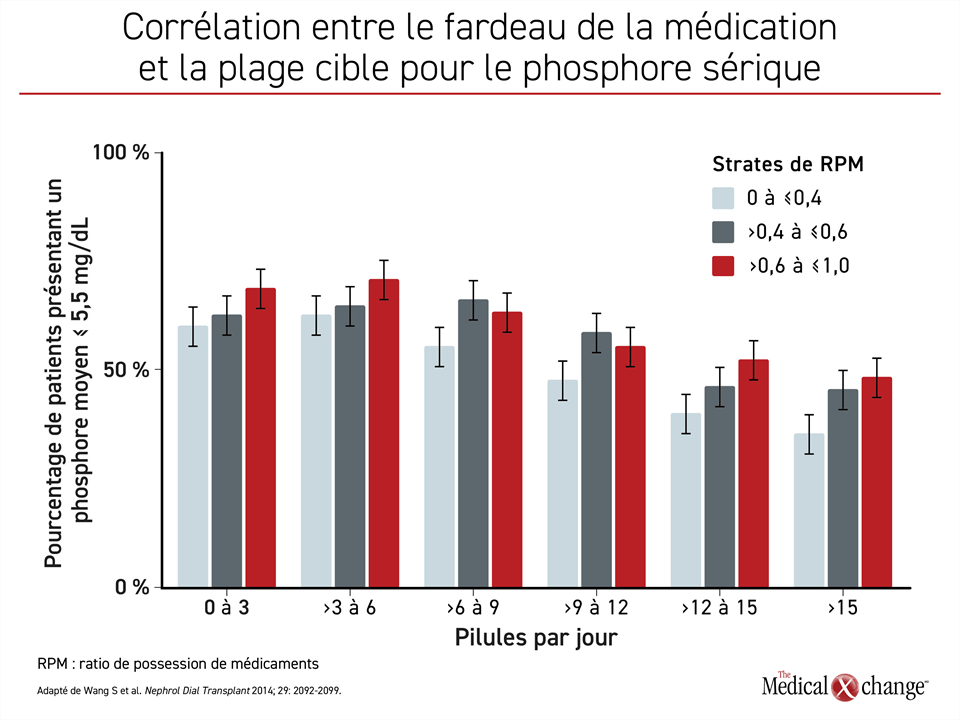
On a estimé que les chélateurs de phosphore représentent environ la moitié des pilules requises par les patients dialysés.33 Dans une étude évaluant le lien entre le fardeau de la médication et l’adhésion, un plus grand nombre de pilules quotidiennes stratifiées par < 3 pilules, 3 à 6 pilules, > 12 à 15 pilules, et > 15 pilules ont été associées à une augmentation progressive des taux sériques de phosphore. 44 Menée avec 8 616 patients, l’étude a également révélé une corrélation entre plus de pilules et moins de patients dans la plage cible pour le phosphore sérique (Figure 2).
Il existe de nombreux agents efficaces se liant au phosphate pour l’excrétion fécale, mais les options peuvent être réduites par les objectifs thérapeutiques, y compris l’évitement des agents susceptibles d’augmenter le taux de calcium, et le choix des agents qui sont très probablement compatibles avec une adhésion soutenue. En général, la tolérabilité relative, la simplicité de la posologie et la puissance sont des avantages cliniques relatifs, mais elles sont particulièrement pertinentes chez les patients atteints de néphropathie chronique et présentant de multiples comorbidités.
Résumé
Les lignes directrices actuelles pour la prise en charge de l’hyperphosphatémie chez les patients atteints d’une néphropathie chronique avancée ont été tirées d’études rétrospectives corrélant une augmentation des taux sériques de phosphate avec un risque accru de mortalité. D’autres essais sont en cours, mais les données disponibles associant des taux sériques de phosphate plus faibles à une meilleure survie chez les patients atteints d’une néphropathie chronique avec hyperphosphatémie, en particulier ceux sous dialyse, sont convaincantes. Ces données ont servi de base aux lignes directrices actuelles qui prévoient que les cibles de phosphate sérique se situent dans les valeurs normales.
Pour atteindre cette cible sans exacerber les anomalies métaboliques coexistantes, y compris le risque de surcharge de calcium induit par les chélateurs de phosphore à base de calcium qui est lié à un risque élevé d’événements CV, les chélateurs de phosphore sans calcium sont une pierre angulaire de la prise en charge de l’hyperphosphatémie. Parmi les multiples agents de différentes classes chimiques disponibles, la plupart, mais pas tous, imposent un lourd fardeau de la médication, ce qui est pertinent pour l’adhésion du traitement. Les options les plus simples ne nécessitent que trois pilules par jour ou moins de la moitié des solutions de rechange nécessitant le plus grand nombre de pilules par jour.
Pour obtenir des résultats optimaux chez les patients atteints d’une néphropathie chronique avancée, une équipe multidisciplinaire qui gère les multiples risques couramment partagés dans cette population est recommandée par les lignes directrices. Le traitement de l’hyperphosphatémie ne peut être isolé d’autres anomalies métaboliques rencontrées alors que la fonction rénale décline.
Références
1. Ketteler M, Block GA, Evenepoel P, et al. Executive summary of the 2017 KDIGO Chronic Kidney Disease-Mineral and Bone Disorder (CKD-MBD) Guideline Update: what’s changed and why it matters. Kidney Int 2017;92(1):26-36. DOI : 10.1016/j.kint.2017.04.006.
2. Farrand KF, Copley JB, Heise J, Fridman M, Keith MS, Poole L. Analysis of serum phosphate control and phosphate binder utilization in incident hemodialysis patients. Int J Nephrol Renovasc Dis 2014;7:261-669. DOI : 10.2147/IJNRD.S58037.
3. Young EW, Akiba T, Albert JM et al. Magnitude and impact of abnormal mineral metabolism in hemodialysis patients in the Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis 2004;44(5 Suppl 2):34-38. DOI : 10.1053/j.ajkd.2004.08.009.
4. Kestenbaum B, Sampson JN, Rudser KD et al. Serum phosphate levels and mortality risk among people with chronic kidney disease. J Am Soc Nephrol 2005;16(2):520-528. DOI : 10.1681/ASN.2004070602.
5. Cupisti A, Gallieni M. Urinary Phosphorus Excretion: Not What We Have Believed It to Be? Clin J Am Soc Nephrol 2018;13(7):973-974. DOI : 10.2215/JJN.06260518.
6. Rastogi A, Bhatt N, Rossetti S, Beto J. Management of Hyperphosphatemia in End-Stage Renal Disease: A New Paradigm. J Ren Nutr 2021;31(1):21-34. DOI : 10.1053/j.jrn.2020.02.003.
7. Chang WX, Xu N, Kumagai T et al. The Impact of Normal Range of Serum Phosphorus on the Incidence of End-Stage Renal Disease by A Propensity Score Analysis. PLoS One 2016;11(4):e0154469. DOI : 10.1371/journal.pone.0154469.
8. Da J, Xie X, Wolf M et al. Serum Phosphorus and Progression of CKD and Mortality: A Meta-analysis of Cohort Studies. Am J Kidney Dis 2015;66(2):258-265. DOI : 10.1053/j.ajkd.2015.01.009.
9. Jamal SA, Vandermeer B, Raggi P et al. Effect of calcium-based versus non-calcium-based phosphate binders on mortality in patients with chronic kidney disease: an updated systematic review and meta-analysis. Lancet 2013;382(9900):1268-1277. DOI : 10.1016/S0140-6736(13)60897-1.
10. Tentori F, Blayney MJ, Albert JM et al. Mortality risk for dialysis patients with different levels of serum calcium, phosphorus, and PTH: the Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis 2008;52(3):519-530. DOI : 10.1053/j.ajkd.2008.03.020.
11. Block GA, Klassen PS, Lazarus JM, Ofsthun N, Lowrie EG, Chertow GM. Mineral metabolism, mortality, and morbidity in maintenance hemodialysis. J Am Soc Nephrol 2004;15(8):2208-2218. DOI : 10.1097/01.ASN.0000133041.27682.A2.
12. Giachelli, CM. Mécanismes de calcification vasculaire. J Am Soc Nephrol 2004;15(12):2959-2964. DOI : 10.1097/01.ASN.0000145894.57533.C4.
13. Askar AM. Hyperphosphatemia. The hidden killer in chronic kidney disease. Saudi Med J 2015;36(1):13-19. DOI : 10.15537/smj.2015.1.9843.
14. Germain MJ. Uremic Pruritus: An Itch with Ominous Consequences. Am J Nephrol 2017;46(6):448-449. DOI : 10.1159/000484572.
15. Nigwekar SU, Kroshinsky D, Nazarian RM et al. Calciphylaxis: risk factors, diagnosis, and treatment. Am J Kidney Dis 2015;66(1):133-46. DOI : 10.1053/j.ajkd.2015.01.034.
16. Friedman EA. Consequences and management of hyperphosphatemia in patients with renal insufficiency. Kidney Int Suppl 2005(95):S1-7. DOI : 10.1111/j.1523-1755.2005.09500.x.
17. Calvo MS, Moshfegh AJ, Tucker KL. Assessing the health impact of phosphorus in the food supply: issues and considerations. Adv Nutr 2014;5(1):104-13. DOI : 10.3945/an.113.004861.
18. Barreto FC, Barreto DV, Massy ZA, Drueke TB. Strategies for Phosphate Control in Patients With CKD. Kidney Int Rep 2019;4(8):1043-1056. DOI : 10.1016/j.ekir.2019.06.002.
19. Umeukeje EM, Mixon AS, Cavanaugh KL. Phosphate-control adherence in hemodialysis patients: current perspectives. Patient Prefer Adherence 2018;12:1175-1191. DOI : 10.2147/PPA. S145648.
20. Ikizler TA, Burrowes JD, Byham-Gray LD et al. KDOQI Clinical Practice Guideline for Nutrition in CKD: 2020 Update. Am J Kidney Dis 2020;76(3 Suppl 1):S1-S107. DOI : 10.1053/j.ajkd.2020.05.006.
21. Achinger SG, Ayus JC. The role of daily dialysis in the control of hyperphosphatemia. Kidney Int Suppl 2005(95):S28-32. DOI : 10.1111/j.1523-1755.2005.09504.x.
22. Pierratos A, Ouwendyk M, Francoeur R et al. Nocturnal hemodialysis: three-year experience. J Am Soc Nephrol 1998;9(5):859-68. DOI : 10.1681/ASN.V95859.
23. Mucsi I, Hercz G, Uldall R, Ouwendyk M, Francoeur R, Pierratos A. Control of serum phosphate without any phosphate binders in patients treated with nocturnal hemodialysis. Kidney Int 1998;53(5):1399-404. DOI : 10.1046/j.1523-1755.1998.00875.x.
24. Gutzwiller JP, Schneditz D, Huber AR, Schindler C, Gutzwiller F, Zehnder CE. Estimating phosphate removal in haemodialysis: an additional tool to quantify dialysis dose. Nephrol Dial Transplant 2002;17(6):1037-1044. DOI : 10.1093/ndt/17,6.1037.
25. Kalantar-Zadeh K. Patient education for phosphorus management in chronic kidney disease. Patient Prefer Adherence 2013;7:379-90. DOI : 10.2147/PPA.S43486.
26. Arenas MD, Malek T, Gil MT, Moledous A, Alvarez-Ude F, Reig-Ferrer A. Challenge of phosphor control in hemodialysis patients: a problem of adherence? J Nephrol 2010;23(5):525-534. (https://www.ncbi.nlm.nih.gov/pubmed/20119931).
27. Vadakedath S, Kandi V. Dialysis: A Review of the Mechanisms Underlying Complications in the Management of Chronic Renal Failure. Cureus 2017;9(8):e1603. DOI : 10.7759/cureus.1603.
28. Shi Y, Xiong J, Chen Y et al. The effectiveness of multidisciplinary care models for patients with chronic kidney disease: a systematic review and meta-analysis. Int Urol Nephrol 2018;50(2):301-312. DOI : 10.1007/s11255-017-1679-7.
29. Gomez AT, Kiberd BA, Royston JP, et al. Comorbidity burden at dialysis initiation and mortality: A cohort study. Can J Kidney Health Dis 2015;2:34. DOI : 10.1186/s40697-015-0068-3.
30. Edmonston DL, Isakova T, Dember LM et al. Design and Rationale of HiLo: A Pragmatic, Randomized Trial of Phosphate Management for Patients Receiving Maintenance Hemodialysis. Am J Kidney Dis 2021;77(6):920-930 e1. DOI : 10.1053/j.ajkd.2020.10.008.
31. clinicaltrials.gov. Pragmatic randomized trial of high or standard PHosphAte Targets in End-stage Kidney Disease (PHOSPHATE).
32. London GM, Marchais SJ, Guerin AP, Boutouyrie P, Metivier F, de Vernejoul MC. Association of bone activity, calcium load, aortic stiffness, and calcifications in ESRD. J Am Soc Nephrol 2008;19(9):1827-35. DOI : 10.1681/ASN.2007050622.
33. Chiu YW, Teitelbaum I, Misra M, de Leon EM, Adzize T, Mehrotra R. Pill burden, adherence, hyperphosphatemia, and quality of life in maintenance dialysis patients. Clin J Am Soc Nephrol 2009;4(6):1089-96. DOI : 10.2215/JJN.00290109.
34. Chertow GM, Burke SK, Raggi P, Treat to Goal Working G. Sevelamer attenuates the progression of coronary and aortic calcification in hemodialysis patients. Kidney Int 2002;62(1):245-52. DOI : 10.1046/j.1523-1755.2002.00434.x.
35. Madan P, Bhayana S, Chandra P, Hughes JI. Lower gastrointestinal bleeding: association with Sevelamer use. World J Gastroenterol 2008;14(16):2615-6. DOI : 10.3748/wjg.14.2615.
36. Vallee M, Weinstein J, Battistella M, Papineau R, Moseley D, Wong G. Multidisciplinary Perspectives of Current Approaches and Clinical Gaps in the Management of Hyperphosphatemia. Int J Nephrol Renovasc Dis 2021;14:301-311. DOI : 10.2147/IJNRD.S318593.
37. Zhang C, Wen J, Li Z, Fan J. Efficacy and safety of lanthanum carbonate on chronic kidney disease-mineral and bone disorder in dialysis patients: a systematic review. BMC Nephrol 2013;14:226. DOI : 10.1186/1471-2369-14-226.
38. Spasovski GB, Sikole A, Gelev S et al. Evolution of bone and plasma concentration of lanthanum in dialysis patients before, during 1 year of treatment with lanthanum carbonate and after 2 years of follow-up. Nephrol Dial Transplant 2006;21(8):2217-2224. DOI : 10.1093/ndt/gfl146.
39. Floege J, Covic AC, Ketteler M et al. A phase III study of the efficacy and safety of a novel iron-based phosphate binder in dialysis patients. Kidney Int 2014;86(3):638-47. DOI : 10.1038/ki.2014.58.
40. Coyne DW, Ficociello LH, Parameswaran V et al. Sucroferric Oxyhydroxide in Maintenance Hemodialysis: A Retrospective, Comparative Cohort Study. Kidney Med 2020;2(3):307-316. DOI : 10.1016/j.xkme.2020.01.009.
41. Vervloet MG, Boletis IN, de Francisco ALM et al. Real-world safety and effectiveness of sucroferric oxyhydroxide for treatment of hyperphosphataemia in dialysis patients: a prospective observational study. Clin Kidney J 2021;14(7):1770-1779. DOI : 10.1093/ckj/sfaa211.
42. Floege J, Covic AC, Ketteler M et al. Iron-related parameters in dialysis patients treated with sucroferric oxyhydroxide. Nephrol Dial Transplant 2017;32(8):1330-1338. DOI : 10.1093/ndt/gfw242.
43. Sprague SM, Floege J. Sucroferric oxyhydroxide for the treatment of hyperphosphatemia. Expert Opin Pharmacother 2018;19(10):1137-1148. DOI : 10.1080/14656566.2018.1491548.
44. Wang S, Alfieri T, Ramakrishnan K, Braunhofer P, Newsome BA. Serum phosphorus levels and pill burden are inversely associated with adherence in patients on hemodialysis. Nephrol Dial Transplant 2014;29(11):2092-9. DOI : 10.1093/ndt/gft280.