Dermatologie
Psoriasis vulgaire : revue d'experts et commentaires tirés de la littérature
Registre PURE : effet de l’inhibition de l’IL-17 sur le psoriasis vulgaire
Simon Nigen, M.D., FRCP(C)
Professeur adjoint de clinique de dermatologie
Hôpital de Verdun, Université de Montréal
CIUSSS du Centre-Sud-de-l’île-de-Montréal
Directeur de la Clinique de dermatologie Sima
Montréal (Québec)
Melinda Gooderham, M.Sc, M.D., FRCPC
Directrice médicale, Centre de dermatologie SKiN
Clinicienne-chercheure principale, Probity Medical Research
Professeure adjointe, Département de médecine, Université Queen’s
Médecin consultante, Centre de santé régional de Peterborough
Peterborough (Ontario)
L’arrivée des agents biologiques iI y a près de 20 ans s’est révélée une avancée majeure dans le traitement du psoriasis modéré ou grave. Les inhibiteurs du facteur de nécrose tumorale (TNF), première classe de ces agents, ont aujourd’hui été rejoints par les inhibiteurs de l’interleukine 17 (IL-17) et des interleukines 12 et 23 (IL-12/23). Depuis la publication des essais de phase III internationaux il y a près de 8 ans, l’expérience déjà vaste acquise avec le sécukinumab, un inhibiteur de l’IL-17, s’est enrichie de données plus élaborées du registre PURE où sont inscrits des patients atteints de psoriasis du Canada et d’Amérique latine. Ces données récentes montrent que les lésions psoriasiques de la tête et du tronc traitées par le sécukinumab guérissent plus vite que celles des membres, mais que toutes les zones du corps en viennent à bénéficier de la même maîtrise de la maladie avec le temps. Elles montrent aussi que sur une période de 42 mois, les traitements se sont poursuivis plus longtemps avec que ceux traités par l’ixékizumab, un autre inhibiteur de l’IL-17. De plus, la maîtrise plus marquée de la maladie, s’améliorait encore au bout de 2 ans et se maintenait toujours à 42 mois, concordait avec une meilleure qualité de vie.
Contexte
Le psoriasis est une maladie de la peau inflammatoire chronique d’origine auto-immune à forte prédisposition génétique1. De toutes les formes de psoriasis (p. ex., en gouttes, pustuleux, érythrodermique), le psoriasis vulgaire est le plus répandu, puisqu’il est incriminé dans 90 % des cas2. Selon une étude populationnelle, cette affection toucherait 2,54 % des adultes ontariens3, sans prédilection particulière pour les hommes ou les femmes, un taux qui correspond à ceux rapportés dans d’autres pays occidentaux1.
Pour une entrevue exclusive avec le Dr Simon Nigen couvrant l’impact sur la pratique clinique, cliquez ici
Le psoriasis est une maladie chronique qui exige souvent un traitement d’une durée indéterminée et dont l’intensité varie au moment où elle se déclare, et aussi en cours d’évolution. À preuve, au terme d’une période de suivi de 10 ans, l’activité pathologique était minime chez 20 % des 500 sujets d’un essai, alors qu’elle était forte chez à peu près le même pourcentage des autres4. Le reste des sujets, soit la majorité, étaient aux prises avec une atteinte cutanée modérée ou grave, quoique leurs symptômes aient fluctué au cours de ces 10 années.
La gravité du psoriasis se détermine habituellement à l’aide de paramètres objectifs comme la surface corporelle touchée, mais ils ne permettent pas toujours de prendre la mesure du fardeau pathologique. Les malaises et les conséquences esthétiques imputables aux lésions cutanées, surtout celles situées dans des endroits visibles, peuvent nuire considérablement au sentiment de bien-être et à l’estime de soi5. Or la qualité de vie n’est pas la seule à en pâtir; le psoriasis est aussi relié à une baisse du niveau d’emploi et des revenus6.
Avant l’arrivée des agents biologiques, le psoriasis modéré ou grave n’était pas bien maîtrisé. Selon un sondage mené en 2005, juste avant que les inhibiteurs du TNF ne deviennent très accessibles, moins de 40 % des 1000 patients interrogés affirmaient que leur traitement à action générale donnait des résultats satisfaisants7.
Vers la maîtrise de la maladie grâce aux agents biologiques
Avec l’arrivée des agents de la classe des inhibiteurs du TNF, les taux de maîtrise de la maladie ont bondi. À la 12e semaine d’un essai déterminant sur l’étanercept, un inhibiteur du TNF, 49 % des sujets affichaient une réponse PASI 758, ce qui se voyait alors chez moins de 20 % seulement des patients traités par le méthotrexate9. Il était toutefois évident dès le départ qu’il fallait trouver d’autres agents au sein de cette classe et d’autres classes d’agents biologiques. Certes, les inhibiteurs du TNF sont efficaces, mais les patients n’y réagissent pas tous favorablement et leurs effets finissent par s’épuiser chez un fort pourcentage des autres.
Dans l’ensemble, 20 % des patients sont réfractaires à un premier inhibiteur du TNF10. Même si beaucoup d’entre eux répondront à un inhibiteur du TNF différent, il sera généralement moins efficace. Une analyse a révélé que le score PASI maximal observé avec un deuxième inhibiteur du TNF, qu’il ait remplacé le premier pour cause d’une réponse insuffisante ou d’épuisement de l’effet thérapeutique, est environ 25 % plus faible que celui obtenu avec le premier (51,4 % vs 67,7 %)11. De plus, la maîtrise de la maladie s’affaiblit avec le temps, jusqu’à 32 % des patients ayant affiché une réponse PASI 75 ne répondant plus aussi bien au traitement à l’intérieur d’une année selon certaines études12.
Le sécukinumab a été homologué il y a 5 ans à peu près. Le sécukinumab est l’agent biologique contre le psoriasis pour lequel les données de suivi sont les plus abondantes grâce aux phases de prolongation des essais de phase III menés sur cette maladie et aux essais ayant porté sur le rhumatisme psoriasique et la spondylarthrite ankylosante13. Les données les plus récentes ont été fournies par le programme du registre PURE14, dont la période de suivi s’étend maintenant sur 36 mois.
Résultats à long terme obtenus avec un inhibiteur de l’IL-17A
Le sécukinumab cible l’IL-17A, une cytokine pro-inflammatoire sur laquelle il est possible d’agir dans bien des maladies auto-immunes comme le rhumatisme psoriasique et la spondylarthrite ankylosante15. À la suite des résultats positifs de deux essais de phase II16,17, ceux des essais de phase III ERASURE et FIXTURE ont fait l’objet du même article en 201418. Lors de l’essai ERASURE, 738 patients ont été aléatoirement affectés au sécukinumab administré par voie sous-cutanée ou à un placebo. Pendant l’essai FIXTURE, 1306 patients ont été affectés au sécukinumab, à un placebo ou à l’étanercept, un inhibiteur du TNF. Exception faite de l’étanercept qui était administré 2 fois par semaine pendant 12 semaines, puis 1 fois par semaine, tous les agents étaient administrés 1 fois par semaine pendant 5 semaines, puis toutes les 4 semaines.
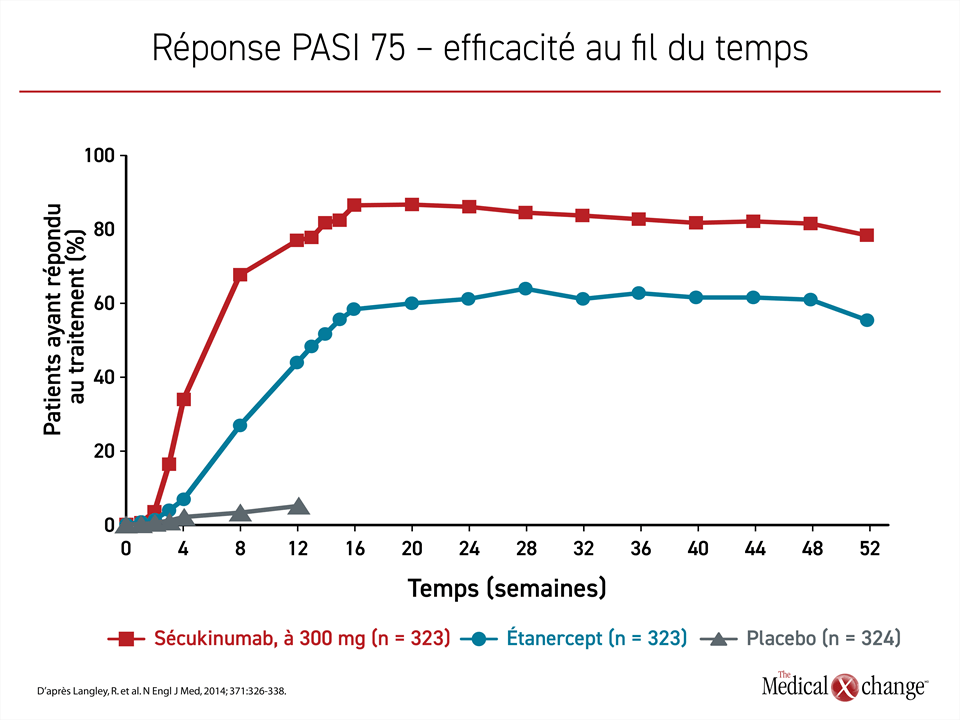
À la dose recommandée de 300 mg, le sécukinumab a produit une réponse PASI 75 chez un peu plus de 80 % des sujets de l’essai ERASURE et un peu moins de 80 % de ceux de l’essai FIXTURE, alors que celui observé avec le placebo était inférieur à 5 % dans les deux essais. Lors de l’essai FIXTURE, 44 % des sujets traités par l’étanercept ont obtenu une réponse PASI 75. Le maintien de la réponse au sécukinumab observée sur 52 semaines ne s’est pas retrouvée dans le groupe étanercept (Figure 1).
Des gains aussi persistants ont été notés durant l’essai de suivi à long terme SCULPTURE sur le sécukinumab19. À preuve, 88,9 % des 168 sujets évalués à 1 an affichaient une réponse PASI 75 et à 5 ans, 88,5 % des 126 sujets toujours évaluables montraient une telle réponse. Aux deux intervalles de mesure, une réponse PASI 100, signe de la résolution complète des lésions cutanées, a été observée chez plus de 40 % des sujets.
Le registre PURE : une maladie de mieux en mieux maîtrisée au fil du temps
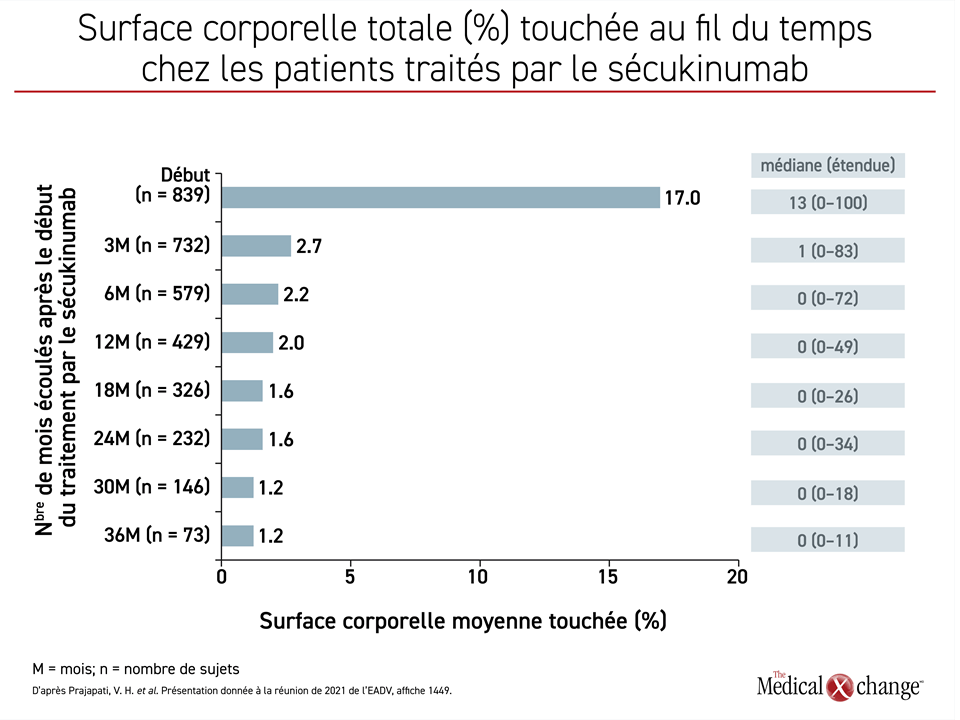
Les données récemment actualisées du registre PURE, auquel sont inscrits 2462 adultes atteints de psoriasis de 89 établissements au Canada (89 %) et en Amérique latine (11 %), montrent que les 848 sujets traités par le sécukinumab, soit 34,5 % de l’effectif, ont bénéficié de la même efficacité soutenue20. Leurs valeurs enregistrées au départ pour toutes les mesures de l’atteinte psoriasique ont en effet baissé énormément et les gains se sont accumulés avec le temps. La baisse de la surface corporelle totale touchée en 36 mois témoignait de ces gains graduels (Figure 2).
Les scores PASI attribués aux squames, à l’érythème et à l’épaisseur des plaques à 3, 6, 12, 18, 24 et 36 mois ont suivi le même scénario : ils ont beaucoup diminué au début du traitement, puis ont continué de baisser graduellement avec le temps. Ces améliorations se sont reflétées dans les scores donnés par les patients sur la desquamation, le fendillement, la douleur, la sensation de brûlure, le prurit et la coloration de la peau sur l’échelle d’évaluation (de 0 à 10) du Psoriasis Symptom Diary (PSD). L’atténuation des symptômes s’est traduite par une grande amélioration de plusieurs aspects de la qualité de vie, notamment la gêne dont le score est passé de 5,6 qu’il était au départ, à 1,2 à 6 mois, à 1,0 à 24 mois et à 0,8 à 36 mois.
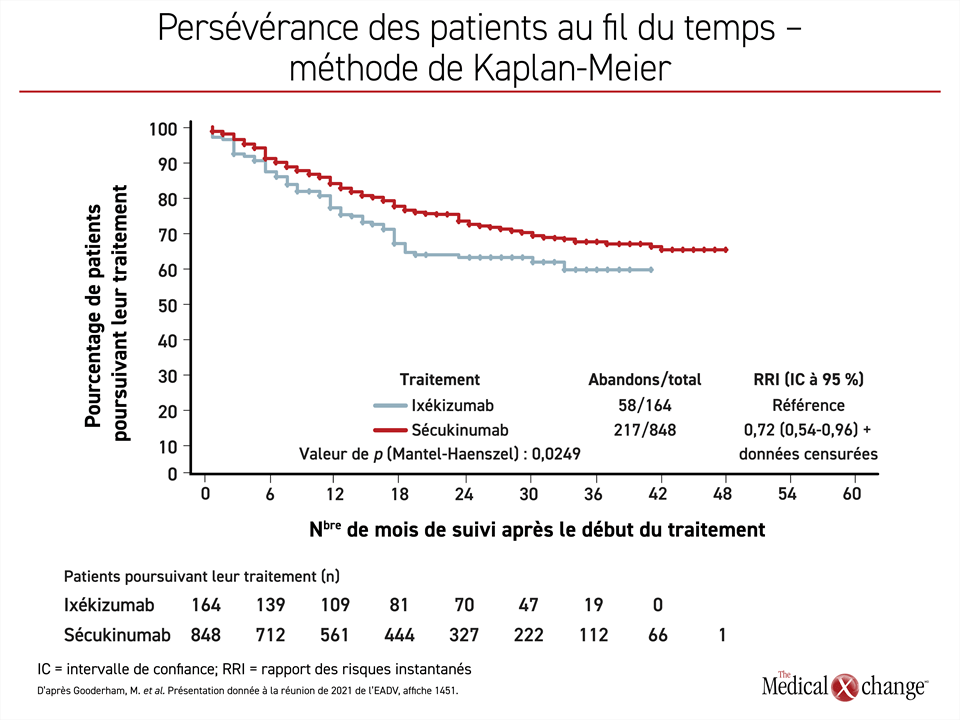
Le registre PURE sert également à comparer le maintien du traitement des patients selon qu’ils sont traités par le sécukinumab ou par l’ixékizumab en pratique clinique21. Ce maintien ne témoigne pas seulement de l’efficacité d’un médicament, mais aussi de sa tolérance, de sa simplicité d’emploi et d’autres variables favorisant la poursuite du traitement. Les 848 patients traités par le sécukinumab et les 165 patients traités par l’ixékizumab ont été suivis pendant 48 et 42 mois respectivement. Or le maintien des patients traités par l’ixékizumab s’est effritée davantage avec le temps que celles des patients ayant reçu le sécukinumab, même si la dose d’ixékizumab a été rehaussée chez une plus forte proportion de patients que la dose de sécukinumab (36,4 % vs 24,4 %) (Figure 3). Le motif le plus souvent invoqué pour justifier l’abandon du traitement était la perte d’efficacité thérapeutique.
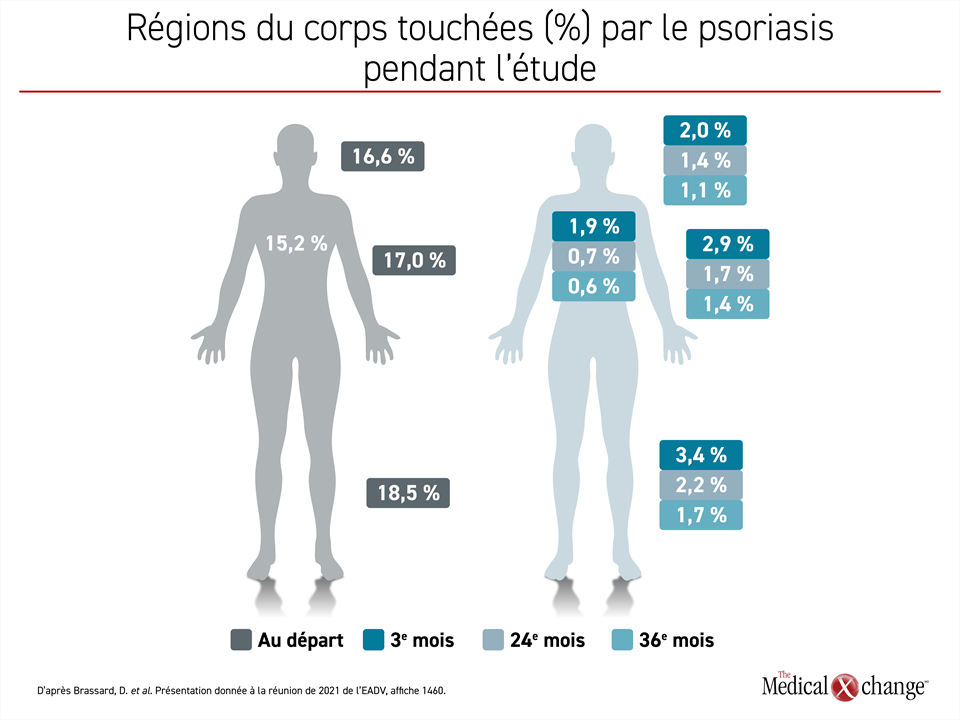
Le plus important message qui ressort probablement des données actualisées des patients traités en pratique clinique du registre PURE, c’est que les différentes régions du corps ne disparaissent pas toutes au même rythme22. Les lésions psoriasiques du tronc, de la tête et du cou ont en effet disparu plus vite que celles des membres (Figure 4). Par exemple, les scores PASI attribués aux lésions de la tête et du cou se chiffraient à 2 % ou moins à 3 mois, une amélioration que les lésions des bras n’ont pas atteinte avant le 18e mois. D’autres scores, comme ceux attribués à l’érythème et aux squames, ont suivi le même scénario et avaient énormément baissé au 36e mois, quoique pas au même rythme.
Les patients doivent savoir que le registre PURE nous a appris que les signes et les symptômes du psoriasis traité en pratique clinique diminuent nettement et rapidement dès le début du traitement, mais qu’ils continuent de s’atténuer encore pendant 3 ans, ce qui cadre avec les données tirées des études de suivi à long terme ayant mis au jour des taux élevés de maîtrise durable de la maladie chez des sujets suivis pendant 5 ans ou plus. Cela dit, les patients doivent aussi comprendre que les lésions guérissent plus ou moins vite selon l’endroit du corps où elles sont situées.
La logique derrière l’inhibition de l’IL-17 dans le psoriasis vulgaire
Le mode d’action du sécukinumab avait permis de prédire les taux élevés d’efficacité de cet agent documentés dans de nombreuses études cliniques menées en près de 10 ans, puisqu’il inhibe l’IL-17A, une cible plus intimement liée au psoriasis que celle visée par les agents biologiques plus anciens. Principal effecteur des cellules Th1723, l’IL-17 est libérée par plusieurs types de cellules impliquées dans la formation des lésions psoriasiques, dont les neutrophiles et les lymphocytes T. L’IL-17 circulante est un médiateur et un orchestrateur important des phénomènes survenant en aval et qui sont caractéristiques de l’inflammation psoriasique24,25. On a démontré que l’IL-17 est une cytokine qui joue un rôle majeur dans le psoriasis18, qu’elle est impliquée dans d’autres maladies auto-immunes, dont le rhumatisme psoriasique26, et qu’elle peut être ciblée. Il faudra mener plus d’études pour comparer directement les agents biologiques dans le traitement du psoriasis, mais les données accumulées jusqu’à maintenant montrent que les inhibiteurs de l’IL-17 en général et le sécukinumab en particulier sont efficaces et bien tolérés. Auparavant vu comme un agent biologique à utiliser en deuxième intention, le sécukinumab est aujourd’hui recommandé comme monothérapie de première intention chez les adultes atteints de psoriasis modéré ou grave27.
Résumé
Les essais multicentriques de phase III menés à double insu jouent un rôle crucial dans l’homologation des médicaments, mais les données tirées des études de suivi à long terme et des registres sont aussi essentielles pour confirmer leur efficacité et leur innocuité à long terme et pour évaluer le maintien de leur traitement dans le temps, un autre facteur intervenant dans la durabilité de la maîtrise de la maladie. À 42 mois, les données du registre PURE établissent un lien entre le sécukinumab et une maladie de mieux en mieux maîtrisée au fil du temps une fois la réponse immédiate obtenue et confirment le taux élevé de persévérance envers le traitement. Le sécukinumab permet de maîtriser la maladie dans toutes les zones du corps touchées, même si les lésions ne disparaissent pas au même rythme partout.
Références
1. Nestle FO, Kaplan DH et Barker J. Psoriasis. N Engl J Med 2009;361(5):496-509. DOI: 10.1056/NEJMra0804595.
2. Rendon A et Schakel K. Psoriasis Pathogenesis and Treatment. Int J Mol Sci 2019;20(6). DOI: 10.3390/ijms20061475.
3. Eder L, Widdifield J, Rosen CF, et al. Trends in the Prevalence and Incidence of Psoriasis and Psoriatic Arthritis in Ontario, Canada: A Population-Based Study. Arthritis Care Res (Hoboken) 2019;71(8):1084-1091. DOI: 10.1002/acr.23743.
4. Svedbom A, Mallbris L, Larsson P, et al. Long-term Outcomes and Prognosis in New-Onset Psoriasis. JAMA Dermatol 2021. DOI: 10.1001/jamadermatol.2021.0734.
5. Gelfand JM, Feldman SR, Stern RS, Thomas J, Rolstad T et Margolis DJ. Determinants of quality of life in patients with psoriasis: a study from the US population. J Am Acad Dermatol 2004;51(5):704-8. DOI: 10.1016/j.jaad.2004.04.014.
6. Horn EJ, Fox KM, Patel V, Chiou CF, Dann F et Lebwohl M. Association of patient-reported psoriasis severity with income and employment. J Am Acad Dermatol 2007;57(6):963-71. DOI: 10.1016/j.jaad.2007.07.023.
7. Nijsten T, Margolis DJ, Feldman SR, Rolstad T et Stern RS. Traditional systemic treatments have not fully met the needs of psoriasis patients: results from a national survey. J Am Acad Dermatol 2005;52(3 Pt 1):434-44. DOI: 10.1016/j.jaad.2004.10.862.
8. Leonardi CL, Powers JL, Matheson RT, et al. Etanercept as monotherapy in patients with psoriasis. N Engl J Med 2003;349(21):2014-22. DOI: 10.1056/NEJMoa030409.
9. Drach M, Papageorgiou K, Maul JT, et al. Effectiveness of methotrexate in moderate to severe psoriasis patients: real-world registry data from the Swiss Dermatology Network for Targeted Therapies (SDNTT). Arch Dermatol Res 2019;311(10):753-760. DOI: 10.1007/s00403-019-01945-6.
10. Yamauchi PS, Bissonnette R, Teixeira HD et Valdecantos WC. Systematic review of efficacy of anti-tumor necrosis factor (TNF) therapy in patients with psoriasis previously treated with a different anti-TNF agent. J Am Acad Dermatol 2016;75(3):612-618 e6. DOI: 10.1016/j.jaad.2016.02.1221.
11. Ozkur E, Kivanc Altunay I, Oguz Topal I, et al. Switching Biologics in the Treatment of Psoriasis: A Multicenter Experience. Dermatology 2021;237(1):22-30. DOI: 10.1159/000504839.
12. Levin EC, Gupta R, Brown G, Malakouti M, Koo J. Biologic fatigue in psoriasis. J Dermatolog Treat 2014;25(1):78-82. DOI: 10.3109/09546634.2013.826341.
13. Deodhar A, Mease PJ, McInnes IB, et al. Long-term safety of secukinumab in patients with moderate-to-severe plaque psoriasis, psoriatic arthritis, and ankylosing spondylitis: integrated pooled clinical trial and post-marketing surveillance data. Arthritis Res Ther 2019;21(1):111. DOI: 10.1186/s13075-019-1882-2.
14. Papp KA, Gooderham M, Beecker J, et al. Rationale, objectives and design of PURE, a prospective registry of patients with moderate to severe chronic plaque psoriasis in Canada and Latin America. BMC Dermatol 2019;19(1):9. DOI: 10.1186/s12895-019-0087-3.
15. Kuwabara T, Ishikawa F, Kondo M et Kakiuchi T. The Role of IL-17 and Related Cytokines in Inflammatory Autoimmune Diseases. Mediators Inflamm 2017;2017:3908061. DOI: 10.1155/2017/3908061.
16. Papp KA, Langley RG, Sigurgeirsson B, et al. Efficacy and safety of secukinumab in the treatment of moderate-to-severe plaque psoriasis: a randomized, double-blind, placebo-controlled phase II dose-ranging study. Br J Dermatol 2013;168(2):412-21. DOI: 10.1111/bjd.12110.
17. Rich P, Sigurgeirsson B, Thaci D, et al. Secukinumab induction and maintenance therapy in moderate-to-severe plaque psoriasis: a randomized, double-blind, placebo-controlled, phase II regimen-finding study. Br J Dermatol 2013;168(2):402-11. DOI: 10.1111/bjd.12112.
18. Langley RG, Elewski BE, Lebwohl M, et al. Secukinumab in plaque psoriasis–results of two phase 3 trials. N Engl J Med 2014;371(4):326-38. DOI: 10.1056/NEJMoa1314258.
19. Bissonnette R, Luger T, Thaci D, et al. Secukinumab demonstrates high sustained efficacy and a favourable safety profile in patients with moderate-to-severe psoriasis through 5 years of treatment (SCULPTURE Extension Study). J Eur Acad Dermatol Venereol 2018;32(9):1507-1514. DOI: 10.1111/jdv.14878.
20. Prajapati VH, Gooderham M et Beecker J, C. T. Secukinumab treatment results in improvement of erythema, thickening, and scaling in patients with moderate to severe plaque psoriasis: 365-month results from the PURE registry. European Association of Dermatology and Venerology 2021; résumé P1499.
21. Gooderham M, Lynde CW, Deforme I et Langley RG. Treatment persistence of secukinumab and ixekizumab in patients with moderate to severe psoriasis: results from the PURE Registry. European Association of Dermatology and Venerology 2021;P1451.
22. Brassard D, Papp K, Albrecht L et Maiolino M. Secukinumab treatment shows effectiveness in the treatment of different body regions in patients with moderate to severe psoriasis: 36-month results from the PURE study. European Association of Dermatology and Venerology 2021;P1460.
23. Onishi RM et Gaffen SL. Interleukin-17 and its target genes: mechanisms of interleukin-17 function in disease. Immunology 2010;129(3):311-21. DOI: 10.1111/j.1365-2567.2009.03240.x.
24. Harper EG, Guo C, Rizzo H, et al. Th17 cytokines stimulate CCL20 expression in keratinocytes in vitro and in vivo: implications for psoriasis pathogenesis. J Invest Dermatol 2009;129(9):2175-83. DOI: 10.1038/jid.2009.65.
25. Martin DA, Towne JE, Kricorian G, et al. The emerging role of IL-17 in the pathogenesis of psoriasis: preclinical and clinical findings. J Invest Dermatol 2013;133(1):17-26. DOI: 10.1038/jid.2012.194.
26. van der Heijde D, Mease PJ, Landewe RBM, et al. Secukinumab provides sustained low rates of radiographic progression in psoriatic arthritis: 52-week results from a phase 3 study, FUTURE 5. Rheumatology (Oxford) 2020;59(6):1325-1334. DOI: 10.1093/rheumatology/kez420.
27. Menter A, Strober BE, Kaplan DH, et al. Joint AAD-NPF guidelines of care for the management and treatment of psoriasis with biologics. J Am Acad Dermatol 2019;80(4):1029-1072. DOI: 10.1016/j.jaad.2018.11.057.