neurologie
SP progressive : revue d'experts et commentaires tirés de la littérature
De la physiopathologie à l’intérêt thérapeutique dans la SP progressive
V. Wee Yong, Ph.D., MACSS, MSRC
Hotchkiss Brain Institute et Département des neurosciences cliniques
École de médecine Cumming
Université de Calgary
Calgary (Alberta)
Une compréhension plus fine des caractéristiques neuropathologiques de la sclérose en plaques (SP) progressive permet de découvrir de nouvelles cibles et stratégies pour maîtriser cette maladie. Bien que la SP progressive et la sclérose en plaques cyclique soient en grande partie induites par une atrophie cérébrale globale, des lésions s’étendant peu à peu et de l’inflammation, les traits dominants de la première diffèrent de ceux de la seconde, notamment par le rôle plus déterminant de l’activation des microglies, du stress oxydatif et de l’intervention des lymphocytes T et des lymphocytes B compartimentalisés au-delà de la barrière hémato-encéphalique (BHE). L’effet relatif des médicaments axés sur ces traits et l’ampleur de leur pénétration dans le parenchyme du système nerveux central (SNC) visant à atténuer l’activité inflammatoire et d’autres causes de neurodégénérescence sont sans doute essentiels pour s’opposer à la SP progressive. Ces différences pourraient expliquer pourquoi certains agents actuels, comme le siponimod, sont actifs contre cette maladie, alors que d’autres agents dotés de propriétés anti-inflammatoires, tels que le tériflunomide, ne le sont peut-être pas. Les connaissances actuelles sur les caractéristiques neuropathologiques de la SP progressive portent à croire que les possibilités d’agir sur cette maladie sont plus grandes si le traitement est entrepris dès les premières agressions au SNC. Elles fournissent aussi une structure permettant de prédire lesquels parmi les médicaments expérimentaux offrent les meilleures chances de la maîtriser.
Contexte
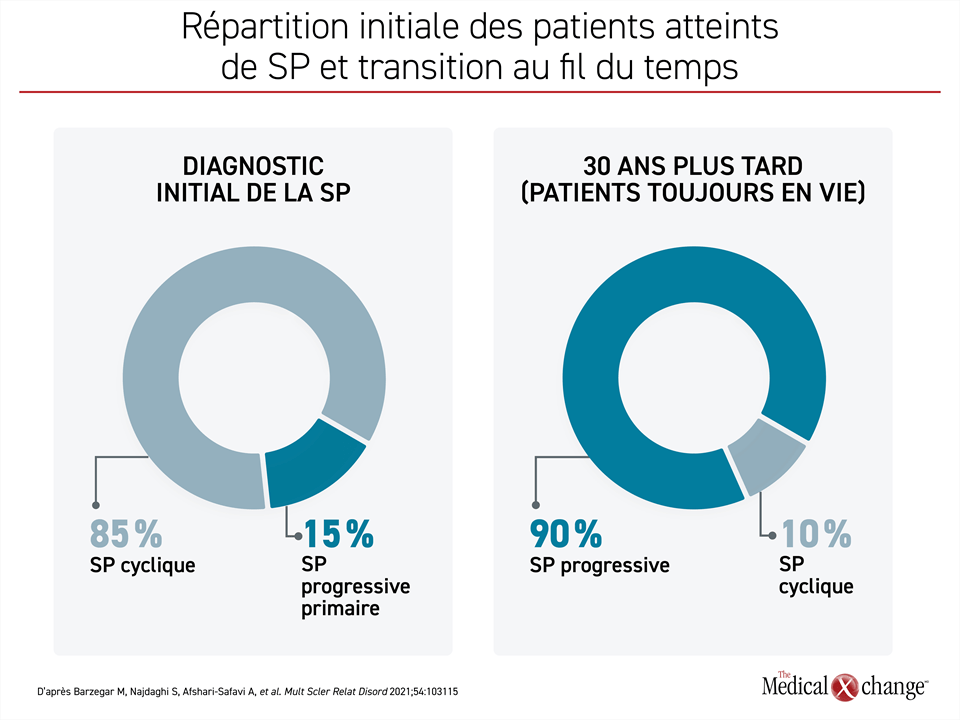
On reconnaît généralement trois phénotypes principaux à la sclérose en plaques (SP), la SP cyclique constituant le diagnostic initial chez environ 85 % des patients1. Les études sur l’histoire naturelle de la SP cyclique montrent qu’elle évolue vers la sclérose en plaques progressive secondaire (SPPS) en une vingtaine d’années chez la plupart des patients. Cela dit, un petit sous-groupe de patients ne connaîtra jamais cette transition, alors qu’elle se produira après moins de 1 an chez d’autres2. Au moment du diagnostic, la SP est en phase évolutive chez environ 15 % des patients. C’est la SP progressive primaire (SPPP) (Figure 1)1. Aucun biomarqueur, critère clinique ou d’imagerie n’est universellement accepté pour définir la SP progressive, qu’elle soit primaire ou secondaire, mais une perte fonctionnelle soutenue accompagnée de quelques symptômes régressifs ou non rémittents pointe vers un diagnostic de SP progressive que le patient en soit au début de la maladie ou à la fin de la phase de SP cyclique.
Pour une entrevue exclusive avec le Dr V. Wee Yong couvrant l’impact sur la pratique clinique, cliquez ici
La SP progressive et la SP cyclique se distinguant l’une de l’autre par leur évolution, l’hypothèse voulant qu’il s’agisse de deux maladies différentes persiste depuis des décennies3,4. Cela dit, il ressort clairement de la comparaison des phénotypes progressifs et de la forme cyclique que leurs manifestations neuropathologiques dans le SNC varient quant à leur étendue, plutôt que de façon absolue ou binaire4-6. Ces différences pourraient expliquer pourquoi la plupart des agents homologués pour le traitement de la SP cyclique ne sont pas vraiment efficaces contre la SP progressive. Ce constat nous amène à formuler le postulat selon lequel les cibles exploitables en vue d’agir sur le comportement pathologique responsable des symptômes et de l’évolution de la SP cyclique et de la SP progressive ne seront pas les mêmes.
Par exemple, même si l’infiltration lymphocytaire est une caractéristique majeure de la SP cyclique, elle a tendance à se limiter à des agrégats périvasculaires7,8. Cette inflammation vasculaire perturbe la BHE, ce qui pourrait favoriser la transition vers la SP progressive9. Dans les formes progressives de la SP, les lymphocytes ont tendance à se répartir diffusément dans le parenchyme du SNC et la BHE est relativement intacte6,8. Résultat : la compartimentalisation des lymphocytes dans le parenchyme du SNC8 et la séquestration de ces cellules qui échappent ainsi aux médicaments qui ne traversent pas la BHE. De plus, l’inflammation dont la médiation est surtout assurée par les microglies et les macrophages dans le parenchyme du SNC a souvent été mise en opposition avec l’infiltration lymphocytaire substantielle qui caractérise la SP cyclique7.
Le comportement neuropathologique de la SP progressive et de la SP cyclique montre d’autres différences quantitatives plutôt qu’absolues6. La compartimentalisation des lymphocytes en est une qui explique bien pourquoi les agents dirigés contre la SP cyclique ne sont pas forcément efficaces contre la SP progressive.
Traitements actuels et activité contre la SP progressive
Les interférons bêta et l’acétate de glatiramère ont longtemps été seuls médicaments homologués pour le traitement de la SP cyclique. Or au cours des 15 dernières années, près de 20 agents de fond se sont ajoutés à l’arsenal thérapeutique offert au Canada. La multiplication des médicaments opposés à la SP cyclique a confirmé l’intérêt de nombreuses cibles, telles que les lymphocytes B et les facteurs de transcription, pour atténuer les lésions causées au SNC pendant la phase cyclique de la maladie. Par contre, seulement deux médicaments sont homologués au Canada pour le traitement des phénotypes de la SP progressive. Leur homologation est récente, mais il faut comprendre que les progrès réalisés en thérapeutique suivent les avancées effectuées dans la caractérisation du comportement neuropathologique de cette maladie. Ces deux agents permettent de comprendre comment le cours de la maladie peut être influencé et orientent la création d’une nouvelle génération de médicaments.
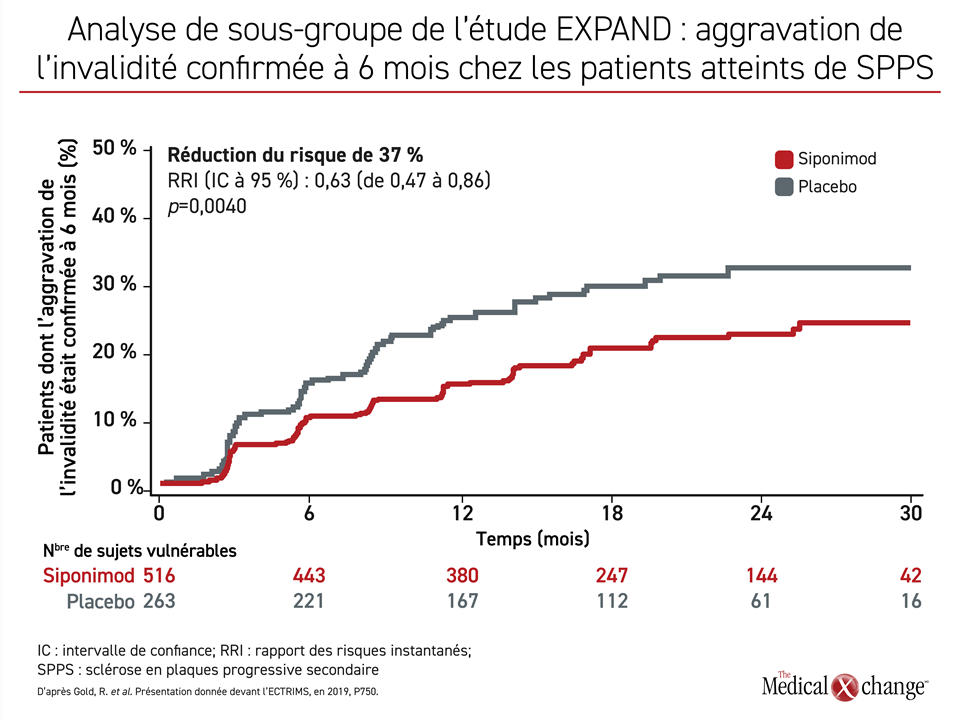
Le siponimod, un modulateur sélectif des récepteurs de la sphingosine-1-phosphate (S1P), est un médicament homologué au Canada pour le traitement de la SPPS. L’ocrélizumab, un anticorps monoclonal anti-CD20, est homologué pour le traitement de la SPPP. L’homologation du siponimod repose sur les résultats de l’essai de phase III multicentrique EXPAND qui a permis d’établir à 12 semaines un lien entre l’emploi de cet agent et une baisse de 21 % (p = 0,013) du risque d’aggravation de l’invalidité confirmée par rapport au placebo10. La cinquième année de la phase de prolongation menée en mode ouvert, le risque d’aggravation de l’invalidité confirmée à 6 mois affichait une baisse de 37 % (p = 0,004) (Figure 2)11. La régulation de la recirculation des lymphocytes n’est pas la seule activité du modulateur sélectif des récepteurs de la S1P qu’est le siponimod. Il possède aussi d’autres caractéristiques objectivées dans des modèles cliniques ou expérimentaux, qui expliquent probablement son activité contre la SP progressive : il traverse la BHE12, atténue la microgliose et l’astrogliose13, et réduit le stress oxydatif et la dégradation mitochondriale14.
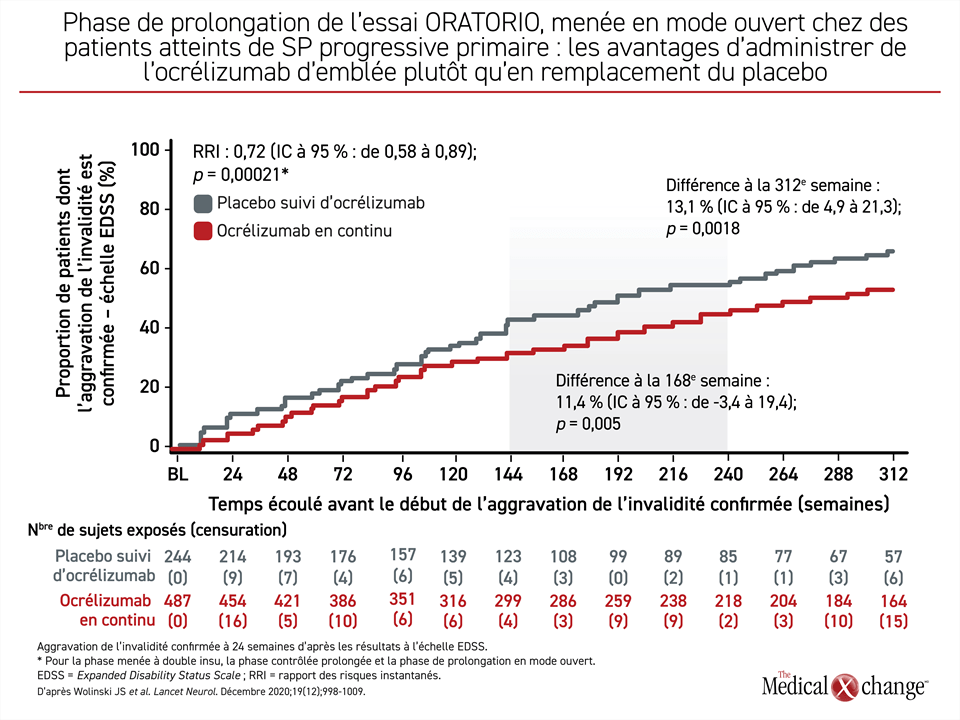
L’homologation conditionnelle de l’ocrélizumab pour le traitement de la SP progressive a été accordée à la lumière des résultats de l’essai de phase III multicentrique ORATORIO, qui ont fait état à 12 semaines d’une baisse de 25 % de l’aggravation de l’invalidité confirmée par rapport au placebo15. Après plus de 5 années de suivi dans le cadre d’une phase de prolongation menée en mode ouvert, la proportion de patients montrant une aggravation de l’invalidité confirmée à 6 mois avait baissé de 13 % (p = 0,0018)16 (Figure 3). Même si l’essai ORATORIO a mis au jour des effets cliniques salutaires, il est à prévoir que la taille moléculaire volumineuse des anticorps monoclonaux empêche ces derniers de bien traverser la BHE17, un inconvénient qui jette un doute sur la durabilité de l’effet obtenu.
Comportement neuropathologique de la SP progressive : six critères ayant une incidence sur les stratégies thérapeutiques
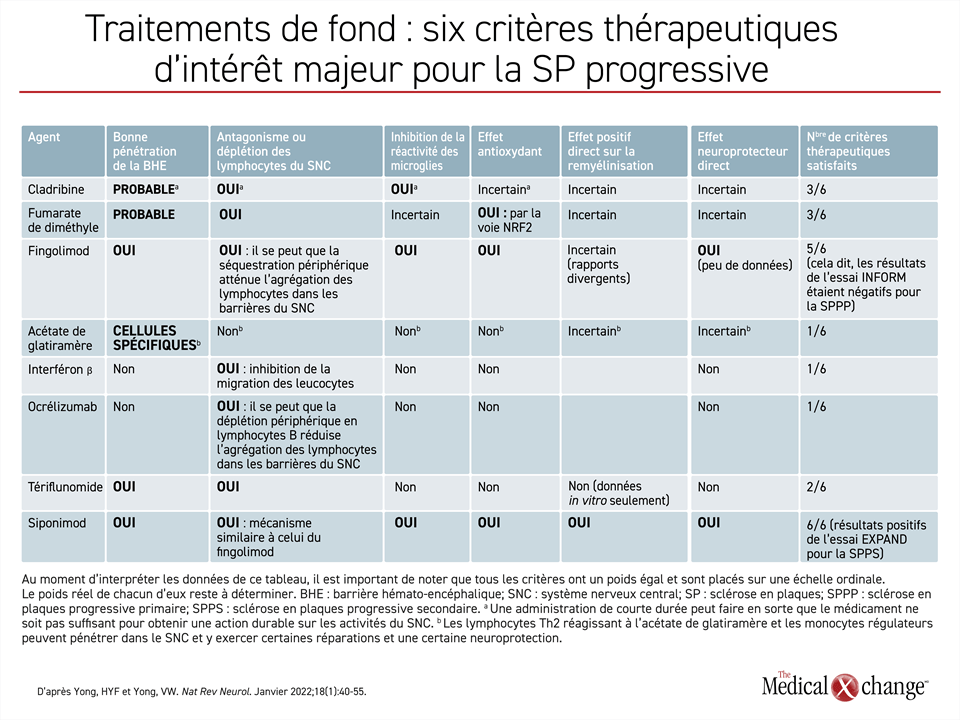
Quand il est question de prédire quels agents sont susceptibles d’inhiber l’activité pathologique de la SP progressive, il est raisonnable de considérer la faculté relative de chacun d’eux à traverser la BHE comme une caractéristique essentielle pour tout médicament ayant le pouvoir d’agir sur le cours de la maladie, mais elle n’est pas la seule. Un article publié récemment sur le comportement neuropathologique de la SP progressive répertorie 6 critères comme autant de facteurs de prédiction d’un effet favorable. Aucun d’eux n’est une preuve de l’efficacité d’un médicament, mais, tout comme la faculté de traverser la BHE, ils sont valables compte tenu du comportement neuropathologique de la SP progressive6.
Il ressort de l’établissement des différences entre la SP cyclique et la SP progressive que le processus pathologique accéléré de cette dernière fait écho à l’aggravation de l’invalidité sur les clichés d’imagerie et dans les analyses histochimiques. Comparativement à celle attribuable à la SP cyclique, la perte neuro-axonale imputable à la SP progressive est plus importante par unité de volume lésionnel18. Les lésions à croissance lente (LCL) semblables à des plaques qui sont typiques de la SP progressive, mais moins prédominantes dans les cas de SP cyclique, s’étendent de façon radiaire dans la substance blanche, ce qui favorise l’atrophie qui est sans doute pour quelque chose dans le dysfonctionnement neurologique. Fait important à noter, on connaît mieux les forces agissantes des LCL, et plusieurs d’entre elles pourraient bien servir de cibles.
Plus précisément, des données probantes indiquent que, dans le cadre du processus neurodégénératif compartimentalisé qui caractérise la SP progressive, le stress oxydatif, le dysfonctionnement mitochondrial et la toxicité ferreuse, qui sont moins bien décryptés dans le cas de la SP cyclique, sont tous d’importants facteurs favorisant les phénotypes de la SP progressive6. Bien que presque tous ces facteurs puissent être décelés dès les premiers stades de la maladie, ils jouent un plus grand rôle dans la SP progressive, lorsque les microglies notamment troquent leur rôle réparateur comprenant entre autres la phagocytose des débris de myéline pour une participation à la neurodégénérescence19.
Compte tenu de ces caractéristiques pathologiques, les agents dirigés contre la SP progressive présenteraient un grand intérêt si, en plus de traverser la BHE, ils inhibaient l’activité lymphocytaire, notamment l’activité cytotoxique des lymphocytes B dans le SNC20, atténuaient la réactivité microgliale21,22, réduisaient le stress oxydatif grâce à leurs effets antioxydants23, favorisaient la remyélinisation24 et exerçaient un effet neuroprotecteur6.
Certaines de ces cibles, sinon toutes, pourraient aussi avoir de l’importance pour pouvoir agir sur le cours de la SP cyclique, mais on peut soutenir que la plupart d’entre elles, voire toutes, sont nécessaires pour agir contre la SP progressive. Les processus inflammatoires davantage circonscrits dans le parenchyme du SNC, le plus grand pouvoir pathologique du stress oxydatif et de la toxicité ferreuse, la plus forte réactivité microgliale et la perte plus marquée de myéline montrent que l’évolution de la maladie est alimentée par de nombreux phénomènes6. Théoriquement parlant, les effets favorables exercés sur ces cibles laissent entrevoir un affaiblissement de ces processus pathologiques, mais ils correspondent également aux caractéristiques des médicaments qui se sont révélés efficaces contre la SP progressive.
La plupart des agents actuellement homologués pour le traitement de la SP cyclique affichent au moins une de ces caractéristiques, mais peu d’entre eux en possèdent 3 ou plus. La cladribine fait exception, puisqu’elle traverse probablement la BHE, réduit le nombre de lymphocytes dans le SNC et inhibe la réactivité des microglies. Cela dit, on a des doutes sur son effet antioxydant. Le fumarate de diméthyle, qui traverse lui aussi la BHE, a aussi été relié à une déplétion lymphocytaire et exerce un effet antioxydant, mais son effet sur la réactivité microgliale reste à préciser (Tableau 1).
Exception faite du siponimod, qui satisfait les six critères, le fingolimod est le seul agent présentement homologué qui réponde à plus de trois d’entre eux, soit cinq critères. Tout comme le siponimod, le fingolimod est un modulateur sélectif des récepteurs 1 de la S1P, mais sa sélectivité est moins grande, de sorte qu’il bloque aussi l’activité des récepteurs 3, 4 et 5 de la S1P. Le siponimod s’en distingue aussi par ses caractéristiques pharmacocinétiques dans le SNC; par ailleurs, il n’est pas un promédicament. Le lien entre le fingolimod et une éventuelle remyélinisation directe n’est pas clair, les conclusions tirées des études ayant été contradictoires à ce sujet. En outre, aucun essai majeur n’a confirmé que le fingolimod, contrairement au siponimod, pouvait agir sur le cours de la SP progressive. Lors d’une étude de phase III menée chez des patients atteints de SPPP, le fingolimod n’a pas conféré une protection marquée contre l’aggravation de l’invalidité25.
Cibles exploitables pour agir sur le cours de la SP progressive
À ses débuts, la SP est une maladie caractérisée par la régulation positive de médiateurs de l’inflammation, mais une interaction beaucoup plus complexe de divers facteurs se soldant par des lésions au SNC semble intervenir dans les cas de SPPP et la transition de la SP cyclique vers la SPPS. L’inhibition des acteurs classiques de la réaction inflammatoire, tels que les lymphocytes T et les lymphocytes B, est, semble-t-il, importante, quoiqu’insuffisante lorsque la perte neuronale s’aggrave dans les formes progressives de la SP. Comme le portent à croire l’activation des microglies et des macrophages, les lésions neuronales exacerbées par le stress oxydatif et les dépôts de fer, et le dysfonctionnement croissant des mitochondries, un traitement sera efficace dans la mesure où il pourra agir contre plusieurs cibles.
Beaucoup de nouveaux médicaments sont à l’étude. Par exemple, l’acide alpha-lipoïque (AAL), un antioxydant endogène qui traverse aisément la BHE et qui a déjà été mis à l’épreuve dans un essai comparatif ayant porté sur la SPPS, a exercé un effet protecteur contre la perte de volume cérébral et a eu tendance à protéger les sujets contre l’invalidité26. Les inhibiteurs de la tyrosine kinase de Bruton (BTK), qui semblent des médiateurs de l’activité microgliale, ont un effet antioxydant et inhibent l’activité des lymphocytes B. Pendant que certains de ces agents font l’objet de plusieurs essais chez des patients atteints de SP cyclique, des patients atteints de SP progressive sont actuellement recrutés dans des essais de phase III sur le tolébrutinib, le rémibrutinib et le fénébrutinib selon le site Web clinicaltrials.gov. De même, lors des premiers essais réalisés sur la SPPP réalisés avec l’ibudilast, un inhibiteur de phosphodiestérases et médiateur de l’activité microgliale, cet agent a exercé des effets plus encourageants sur le cours de cette maladie que sur celui de la SPPS, ce qui porte à croire que les cibles à privilégier pour ces deux phénotypes de la SP progressive pourraient ne pas être les mêmes27.
Les effets salutaires que laissent entrevoir ces traitements expérimentaux sont encourageants. Au Canada, l’ocrélizumab a été le premier médicament homologué contre la SP progressive en 2018. Il a été suivi du siponimod en 2020. Ces agents servent de tremplin à la recherche de nouvelles stratégies pour contrer les mécanismes pathologiques de la SP progressive. On peut raisonnablement présumer que les effets salutaires les plus importants obtenus en agissant sur le cours de la maladie se seront produits avant que des lésions irréversibles ne se forment dans le SNC. Advenant qu’il devienne possible de s’opposer aux causes sous-jacentes de la SP progressive, un traitement précoce pourrait empêcher la transition de la SP cyclique vers la SPPS ou du moins agir sur les substrats nerveux de l’évolution de la maladie. Des données probantes indiquant que certaines manifestations pathologiques la SPPS sont déjà présentes pendant la SP cyclique, une meilleure compréhension de la SPPS pourrait paver la voie à de nouvelles possibilités de préservation des fonctions neurologiques.
Résumé
L’étude neuropathologique de la SP progressive a permis de répertorier six critères que les agents les plus susceptibles d’inhiber l’évolution de la maladie doivent satisfaire. Le respect de la plupart, voire de tous ces critères, dont la pénétration de la BHE, l’inhibition de l’activité lymphocytaire, l’inhibition de la réactivité microgliale, la réduction du stress oxydatif, la stimulation de la remyélinisation et la neuroprotection, vise à restaurer ou à tout le moins à préserver le fonctionnement du SNC, d’où la prévention de l’invalidité. Non seulement l’efficacité du siponimod, qui répond à ces critères, confirme-t-elle indirectement la validité de ces cibles, mais elle oriente également la recherche d’autres médicaments de fond dirigés contre la SP progressive.
Références
1. Barzegar M, Najdaghi S, Afshari-Safavi A, et al. Mult Scler Relat Disord 2021;54:103115. DOI: 10.1016/j.msard.2021.103115
2. Cree BAC, Arnold DL, Chataway J, et al. Secondary Progressive Multiple Sclerosis: New Insights. Neurology 2021;97(8):378-388. DOI: 10.1212/WNL.0000000000012323.
3. Olerup O, Hillert J, Fredrikson S, et al. Primarily chronic progressive and relapsing/remitting multiple sclerosis: two immunogenetically distinct disease entities. Proc Natl Acad Sci U S A 1989;86(18):7113-7117. DOI: 10.1073/pnas.86.18.7113.
4. Antel J, Antel S, Caramanos Z, Arnold DL et Kuhlmann T. Primary progressive multiple sclerosis: part of the MS disease spectrum or separate disease entity? Acta Neuropathol 2012;123(5):627-638. DOI: 10.1007/s00401-012-0953-0.
5. Lassmann H. Pathogenic Mechanisms Associated With Different Clinical Courses of Multiple Sclerosis. Front Immunol 2018;9:3116. DOI: 10.3389/fimmu.2018.03116.
6. Yong HYF et Yong VW. Mechanism-based criteria to improve therapeutic outcomes in progressive multiple sclerosis. Nat Rev Neurol 2022;18(1):40-55. DOI: 10.1038/s41582-021-00581-x.
7. Weiner HL. A shift from adaptive to innate immunity: a potential mechanism of disease progression in multiple sclerosis. J Neurol 2008;255 Suppl 1:3-11. DOI: 10.1007/s00415-008-1002-8.
8. Lassmann H, van Horssen J et Mahad D. Progressive multiple sclerosis: pathology and pathogenesis. Nat Rev Neurol 2012;8(11):647-656. DOI: 10.1038/nrneurol.2012.168.
9. Ortiz GG, Pacheco-Moises FP, Macias-Islas MA, et al. Role of the blood-brain barrier in multiple sclerosis. Arch Med Res 2014;45(8):687-697. DOI: 10.1016/j.arcmed.2014.11.013.
10. Kappos L, Bar-Or A, Cree BAC, et al. Siponimod versus placebo in secondary progressive multiple sclerosis (EXPAND): a double-blind, randomised, phase 3 study. Lancet 2018;391(10127):1263-1273. DOI: 10.1016/S0140-6736(18)30475-6.
11. Gold R, Kappos L, Bar-Or A, et al. Efficacy of Siponimod in Secondary Progressive Multiple Sclerosis Patients With Active Disease: The EXPAND Study Subgroup Analysis. P750. 35th Congress of the European Committee for Treatment and Research in Multiple Sclerosis, September 2019.
12. Scott LJ. Siponimod: A Review in Secondary Progressive Multiple Sclerosis. CNS Drugs 2020;34(11):1191-1200. DOI: 10.1007/s40263-020-00771-z.
13. Gentile A, Musella A, Bullitta S, et al. Siponimod (BAF312) prevents synaptic neurodegeneration in experimental multiple sclerosis. J Neuroinflammation 2016;13(1):207. DOI: 10.1186/s12974-016-0686-4.
14. Ward LA, Lee DS, Sharma A, et al. Siponimod therapy implicates Th17 cells in a preclinical model of subpial cortical injury. JCI Insight 2020;5(1). DOI: 10.1172/jci.insight.132522.
15. Montalban X, Hauser SL, Kappos L, et al. Ocrelizumab versus Placebo in Primary Progressive Multiple Sclerosis. N Engl J Med 2017;376(3):209-220. DOI: 10.1056/NEJMoa1606468.
16. Wolinsky JS, Arnold DL, Brochet B, et al. Long-term follow-up from the ORATORIO trial of ocrelizumab for primary progressive multiple sclerosis: a post-hoc analysis from the ongoing open-label extension of the randomised, placebo-controlled, phase 3 trial. Lancet Neurol 2020;19(12):998-1009. DOI: 10.1016/S1474-4422(20)30342-2.
17. Banks WA. Characteristics of compounds that cross the blood-brain barrier. BMC Neurol 2009;9 Suppl. 1:S3. DOI: 10.1186/1471-2377-9-S1-S3.
18. Matthews PM, Pioro E, Narayanan S, et al. Assessment of lesion pathology in multiple sclerosis using quantitative MRI morphometry and magnetic resonance spectroscopy. Brain 1996;119 ( Pt 3):715-722. DOI: 10.1093/brain/119.3.715.
19. Jackle K, Zeis T, Schaeren-Wiemers N, et al. Molecular signature of slowly expanding lesions in progressive multiple sclerosis. Brain 2020;143(7):2073-2088. DOI: 10.1093/brain/awaa158.
20. Lisak RP, Nedelkoska L, Benjamins JA, et al. B cells from patients with multiple sclerosis induce cell death via apoptosis in neurons in vitro. J Neuroimmunol 2017;309:88-99. DOI: 10.1016/j.jneuroim.2017.05.004.
21. Prineas JW, Kwon EE, Cho ES, et al. Immunopathology of secondary-progressive multiple sclerosis. Ann Neurol 2001;50(5):646-657. DOI: 10.1002/ana.1255.
22. Singh S, Metz I, Amor S, van der Valk P, Stadelmann C et Bruck W. Microglial nodules in early multiple sclerosis white matter are associated with degenerating axons. Acta Neuropathol 2013;125(4):595-608. DOI: 10.1007/s00401-013-1082-0.
23. Plemel JR, Liu WQ et Yong VW. Remyelination therapies: a new direction and challenge in multiple sclerosis. Nat Rev Drug Discov 2017;16(9):617-634. DOI: 10.1038/nrd.2017.115.
24. Fischer MT, Wimmer I, Hoftberger R, et al. Disease-specific molecular events in cortical multiple sclerosis lesions. Brain 2013;136(Pt 6):1799-1815. DOI: 10.1093/brain/awt110.
25. Lublin F, Miller DH, Freedman MS, et al. Oral fingolimod in primary progressive multiple sclerosis (INFORMS): a phase 3, randomised, double-blind, placebo-controlled trial. Lancet 2016;387(10023):1075-1084. DOI: 10.1016/S0140-6736(15)01314-8.
26. Spain R, Powers K, Murchison C, et al. Lipoic acid in secondary progressive MS: A randomized controlled pilot trial. Neurol Neuroimmunol Neuroinflamm 2017;4(5):e374. DOI: 10.1212/NXI.0000000000000374.
27. Fox RJ, Coffey CS, Conwit R, et al. Phase 2 Trial of Ibudilast in Progressive Multiple Sclerosis. N Engl J Med 2018;379(9):846-855. DOI: 10.1056/NEJMoa1803583.