oncologie
Cancer du sein : revue d'experts et commentaires tirés de la littérature
Essai MONALEESA-2 : nouveau jalon pour la survie dans le cancer du sein RH+/HER2- avancé
Nathaniel Bouganim, M.D., FRCPC
Chercheur, IR du CUSM, Programme de recherche sur le cancer du campus Glen,
Centre de médecine novatrice
Professeur adjoint, Département d’oncologie Gerald Bronfman,
Faculté de médecine et des sciences de la santé, université McGill
Département de médecine, Division de l’oncologie médicale, CUSM
Montréal (Québec)
Karen A. Gelmon, M.D., FRCPC
Professeure de médecine, Université de Colombie-Britannique
Oncologue médicale, BC Cancer
Présidente, Comité d’éthique de la recherche sur le cancer de l’UBC et de BC Cancer
Vancouver (Colombie-Britannique)
Un nouvel essai intitulé MONALEESA-2 pose un nouveau jalon en matière de survie médiane chez les femmes ménopausées atteintes d’un cancer du sein avancé ou métastatique exprimant des récepteurs hormonaux (RH+), mais pas le récepteur 2 du facteur de croissance épidermique humain (HER2-). Les patientes affectées à l’association formée de ribociclib, un inhibiteur des enzymes CDK4 et CDK6, et de létrozole, un inhibiteur de l’aromatase, ont affiché une survie globale (SG) médiane supérieure à 5 ans, soit environ une année de plus que les témoins traités par hormonothérapie seulement. L’association à prise orale et généralement bien tolérée formée d’un inhibiteur des kinases dépendantes des cyclines (CDK) 4 et 6 et d’un agent employé en endocrinothérapie avait certes permis d’améliorer la SG de femmes en préménopause atteintes d’un cancer du sein avancé RH+/HER2 , mais il s’agit ici du seul traitement de première intention qui permette de marquer des points du côté de la SG des femmes ménopausées. L’essai MONALEESA-2 fixe donc une nouvelle norme thérapeutique dans cette population.
Contexte
Malgré les progrès réalisés dans la guérison du cancer du sein peu avancé, la survie à long terme semblait inaccessible dans les cas de maladie avancée ou métastatique. Il y a 4 ans à peine, moins de 30 % des femmes atteintes d’un cancer du sein métastatique étaient toujours en vie 5 ans après avoir reçu leur diagnostic1. L’arrivée des agents endocriniens, tels que le tamoxifène, un inhibiteur de l’activation des récepteurs œstrogéniques2, et des inhibiteurs de l’aromatase, qui abaissent les concentrations d’œstrogènes circulants3, a permis de ralentir considérablement l’évolution du cancer du sein RH+/HER2‑ avancé, mais les cas de survie prolongée restent rares4. Jumelés à une endocrinothérapie, les inhibiteurs de CDK4 et de CDK6 ont permis de franchir un grand pas de plus vers la maîtrise de la maladie5.
Les tumeurs RH+/HER2- comptent parmi les formes les plus répandues de cancer du sein. Environ 75 % de tous les cancers du sein sont RH+, une caractéristique définie d’après l’expression des récepteurs des œstrogènes, des récepteurs de la progestérone ou des deux types de récepteurs6. Selon une analyse de 2014 du registre étatsunien SEER (Surveillance, Epidemiology and End Results), la plupart étaient HER2-, la faible production de protéine HER2 étant déterminée au moyen du score H ou par hybridation in situ en fluorescence (FISH)7. Seulement 4,6 % étaient RH- et HER2+. Pour les autres, 12,2 % étaient des triples négatifs et la situation quant aux récepteurs RH/HER2 était inconnue pour 12 % d’entre eux. Les agents employés en hormonothérapie que sont le tamoxifène, les inhibiteurs de l’aromatase et le fulvestrant modifient l’action des œstrogènes8. Ils ont été pour beaucoup dans l’amélioration de l’issue des cancers RH+9, mais la durée médiane de la réponse reste limitée dans les formes métastatiques et il y a un risque élevé de résistance à ces agents10.
Les inhibiteurs de CDK4 et de CDK6, qui interrompent les signaux hormonaux intracellulaires et mitogéniques stimulant la prolifération des cellules malignes5, se sont montrés très efficaces dans de nombreux essais pour traiter le cancer du sein RH+ en première ou en deuxième intention11. Ils ciblent le dérèglement de la cascade de signalisation D1-CDK4/6-Rb de la cycline, un mécanisme important dans la prolifération des cellules cancéreuses du sein12. Même si une résistance aux inhibiteurs de CDK 4 et de CDK6 et aux agents employés en endocrinothérapie peut se manifester, un effet synergique semble préserver l’efficacité de ces deux classes d’agents thérapeutiques lorsqu’elles sont utilisées ensemble13.
Le palbociclib a été le premier inhibiteur de CDK4 et de CDK6 homologué par la Food and Drug Administration des États-Unis en 2015. Trois de ces agents à prise orale sont homologués au Canada. Le ribociclib et le palbociclib sont indiqués en association avec une endocrinothérapie comme traitement de première ou de deuxième intention du cancer du sein RH+/HER2- avancé ou métastatique. L’abémaciclib possède les mêmes indications, mais il est aussi homologué en monothérapie dans les cas où la maladie évolue à la suite d’une endocrinothérapie et d’au moins 2 schémas de chimiothérapie.
Résultats de l’essai MONALEESA-2 et leurs implications
Si le ribociclib est homologué pour le traitement de première intention du cancer du sein RH+/HER2- avancé ou métastatique, c’est grâce à la prolongation majeure de la survie sans progression (SSP) objectivée pendant l’essai de phase III MONALEESA-214 au cours duquel 668 patientes ont été réparties aléatoirement de façon à recevoir du ribociclib et du létrozole ou un placebo et du létrozole. La SSP enregistrée dans le groupe témoin a été de 14,7 mois. Or elle n’avait toujours pas été atteinte dans le groupe expérimental lorsque les résultats ont été publiés. Le rapport des risques instantanés (RRI) rend compte d’une baisse de 44 % du risque de progression pour l’association médicamenteuse par rapport au placebo jumelé au létrozole (RRI : 0,56; p = 3,29 x 10-6). Le ribociclib a été bien toléré; les seuls effets indésirables de grade 3 ou plus ont été des cytopénies.
Les essais PALOMA-2 et MONARCH-3 ont servi à évaluer des inhibiteurs de CDK4 et de CDK6 dans le traitement de première intention du cancer du sein RH+/HER2- avancé ou métastatique postménopausique.
Pendant l’essai PALOMA-2, le palbociclib et le létrozole ont été comparés à un placebo jumelé à du létrozole15. D’après l’évaluation des cliniciens chercheurs, le palbociclib a réduit le risque d’évolution de la maladie de 35 % (RRI : 0,65; p < 0,001). Durant l’essai MONARCH-3, l’abémaciclib associé à un inhibiteur de l’aromatase (de l’anastrozole ou du létrozole) a été comparé à un placebo allié à ces agents d’endocrinothérapie16. L’avantage qu’a eu l’abémaciclib pour la SSP pendant cet essai était à hauteur de 46 % (RRI : 0,54; p = 0,000021).
Comme ce fut le cas pendant l’essai MONALEESA-2, les inhibiteurs de la CDK4 et de la CDK6 utilisés avec une endocrinothérapie ont généralement été bien tolérés et les deux essais ont abouti à leur homologation pour ces indications.
Ces trois inhibiteurs de la CDK4 et de la CDK6 sont aujourd’hui d’usage courant pour le traitement de première intention du cancer du sein RH+/HER2- avancé ou métastatique chez les femmes ménopausées. Les trois essais comportaient la SG comme paramètre d’évaluation secondaire, mais l’essai MONALEESA-2 était le seul des trois où elle était un des principaux paramètres d’évaluation secondaires prévus dans le plan original. Les périodes de suivi des essais PALOMA-2 et MONALEESA-2 étaient comparables, alors que celle de l’essai MONARCH-3 a été à peine plus courte. Cela dit, la période de suivi de l’essai MONALEESA-2 est la seule des trois qui ait fait ressortir un gain au chapitre de la SG jusqu’à maintenant.
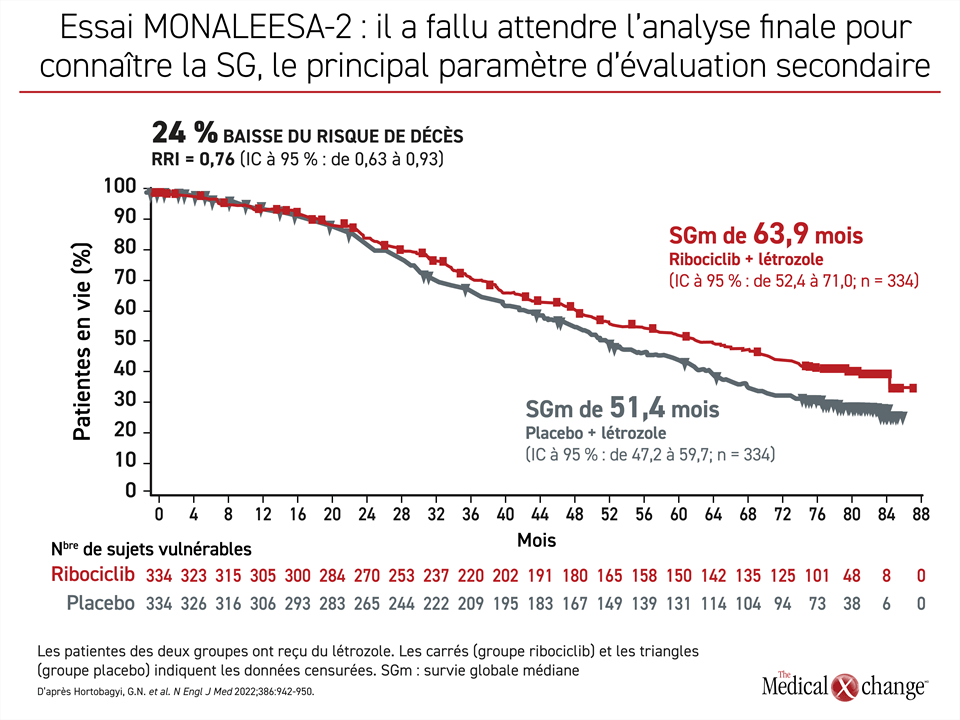
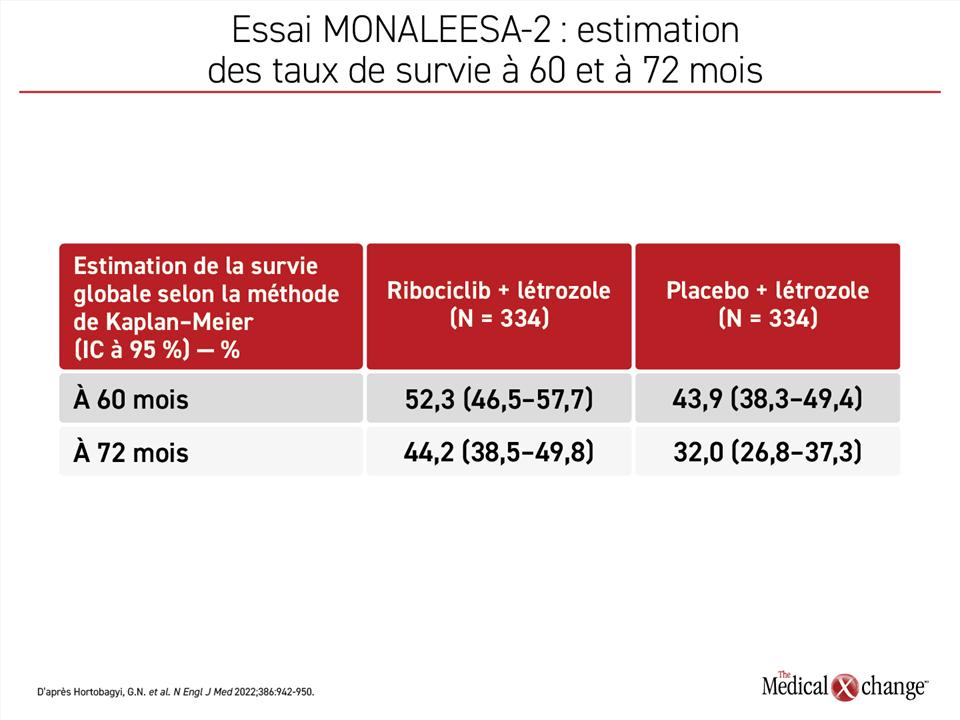
Le gain observé pour la survie, qui est habituellement employé pour définir les normes de soins en oncologie, a été obtenu malgré l’administration subséquente de traitements de deuxième intention. Au terme de 5 années de suivi, 52,3 % des patientes ayant amorcé leur traitement à l’aide de ribociclib et de létrozole en première intention étaient toujours en vie par rapport à 43,9 % de celles l’ayant entrepris avec du létrozole seulement. La SG médiane enregistrée dans le groupe ribociclib se chiffrait à 63,9 mois, ce qui correspond à un peu plus de 1 an de plus que la survie médiane de 51,4 mois obtenue dans le groupe létrozole en monothérapie, d’où une réduction de 24 % (RRI : 0,765; p = 0,004) du risque de décès à l’avantage de l’ajout du ribociclib (Figure 1).
Lors de l’essai MONALEESA-2, les courbes de la survie ont commencé à se séparer à 2 ans environ, puis l’écart s’est creusé graduellement en donnant l’avantage au ribociclib jumelé au létrozole, au point où l’avantage relatif de cette association est passé de 17 % au moment de l’analyse réalisée à 60 mois à 44 % (44,2 % vs 32,0 %) après 72 mois de suivi (Figure 2).
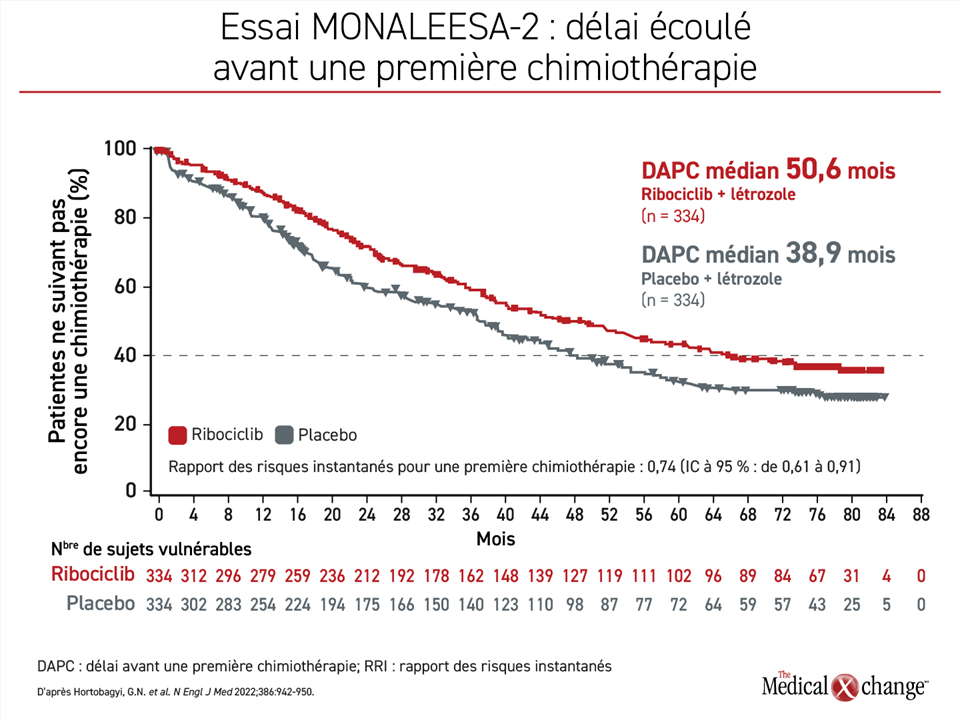
La prolongation de la survie s’accompagnait d’une plus longue maîtrise de la maladie, mais le plus important, c’est que la survie médiane sans chimiothérapie était de 39,9 mois chez les patientes traitées au moyen de l’association et de 30,1 mois chez celles ayant amorcé leur traitement à l’aide de létrozole seulement, ce qui correspond à un délai écoulé avant le recours à la chimiothérapie de 25 % inférieur (RRI : 0,74). Vu sous un autre angle, le délai médian écoulé avant une première chimiothérapie était de plus de 4 ans chez les patientes affectées au ribociclib allié au létrozole (50,6 mois) contre à peine plus de 3 ans (38,9 mois) dans le groupe traité par du létrozole seulement (Figure 3).
La stratification des patientes en fonction du nombre de foyers métastatiques, de la positivité à l’égard des récepteurs de la progestérone et de la présence ou de l’absence d’antécédents d’endocrinothérapie a confirmé la constance des gains enregistrés pour la SG.
L’essai MONALEESA-2 a mis au jour le gain majeur que le ribociclib jumelé au létrozole a permis d’obtenir pour la survie par rapport à l’endocrinothérapie utilisée seule dans le traitement du cancer du sein RH+/HER2- avancé ou métastatique chez les femmes ménopausées. Résultat : la barre de la survie s’en trouve rehaussée dans cette population. La tolérabilité du ribociclib et le délai de plus de 1 an avant le recours aux traitements de deuxième intention sont des facteurs importants pour la préservation d’une bonne qualité de vie durant une survie de plus longue durée.
Le gain enregistré pour la SG avec l’association ribociclib-endocrinothérapie pendant l’essai MONALEESA-2 chez des femmes ménopausées atteintes d’un cancer du sein RH+/HER2- avancé jamais traité auparavant cadre avec celui qui avait été rapporté lors de l’essai MONALEESA-317. Cet essai de phase III a été mené chez des femmes ménopausées atteintes d’un cancer du sein RH+/HER2- ayant récidivé 12 mois ou plus après qu’elles aient entrepris une endocrinothérapie adjuvante ou néoadjuvante ou qui n’avaient pas reçu plus d’une endocrinothérapie contre leur maladie avancée. Après un suivi médian de 39 mois, la survie médiane s’élevait à 53,7 mois chez les patientes affectées au ribociclib allié au fulvestrant contre 41,5 mois chez celles traitées par du fulvestrant seulement, soit une réduction du risque de 28 % (RRI : 0,7255; p = 0,00455).
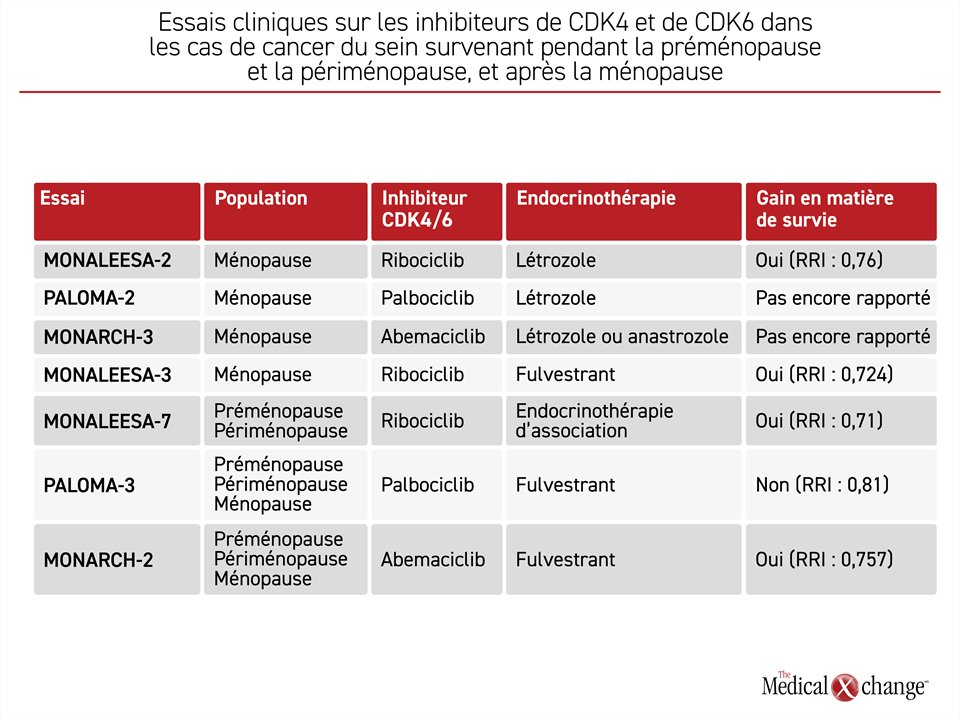
Les inhibiteurs de CDK4 et de CDK6 dans les cas de cancer du sein chez les femmes en préménopause, en périménopause ou ménopausées
L’intérêt d’allier des inhibiteurs de CDK4 et de CDK6 à une endocrinothérapie a également été démontré chez les femmes en préménopause atteintes d’un cancer du sein RH+/HER2- et dans le cadre d’études où les femmes recrutées étaient en préménopause, en périménopause ou ménopausées, sans distinction. L’essai MONALEESA-7 a été le seul essai d’où les femmes ménopausées étaient écartées. Or 17 % des femmes recrutées dans l’essai MONARCH-2 et 21 % de celles de l’essai PALOMA-3 étaient en préménopause ou en périménopause. Dans chacun de ces essais, l’inhibiteur de CDK4 et de CDK6 jumelé à une endocrinothérapie était comparé à un placebo allié à la même endocrinothérapie. Même si la comparaison des essais les uns avec les autres est un exercice complexe en raison des variations potentielles dans leur conception et leur recrutement, leurs résultats sont suffisamment différents pour soulever la possibilité que ces inhibiteurs de CDK4 et de CDK6 ne soient pas interchangeables.
Lors de l’essai MONALEESA-7, 672 patientes ont été affectées aléatoirement au ribociclib, un inhibiteur de CDK4 et de CDK6, ou à un placebo. Les patientes des deux groupes ont aussi pris de la goséréline et soit un inhibiteur de l’aromatase non stéroïdien soit du tamoxifène17. Les 525 patientes de l’essai PALOMA-3 ont été réparties aléatoirement selon un rapport de 1:118, alors que les 669 patientes de l’essai MONARCH-2 l’ont été selon un rapport de 2:119.
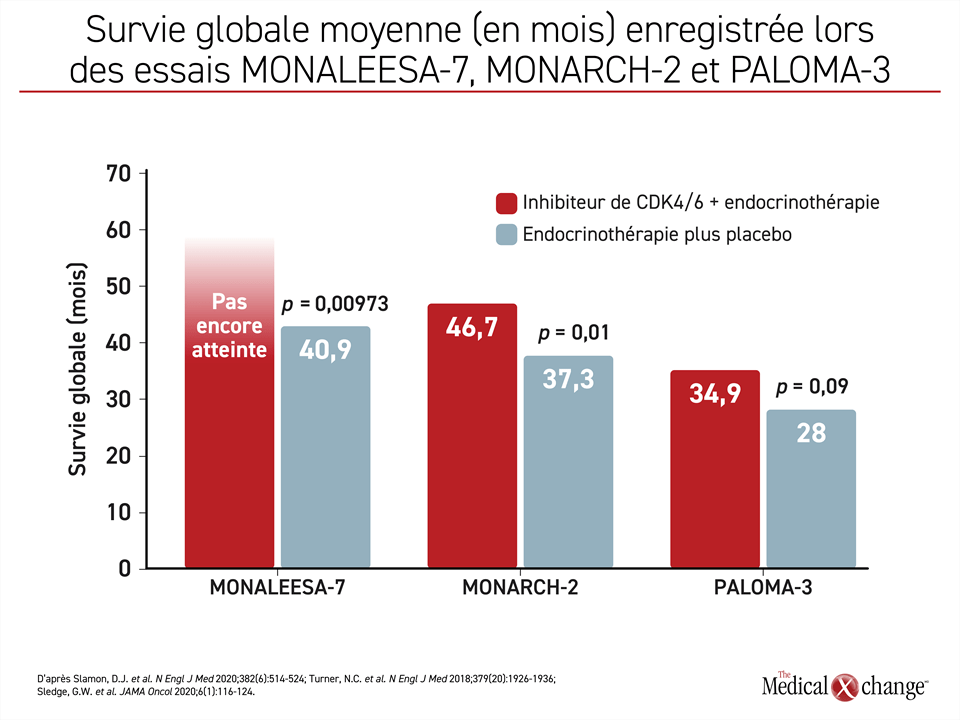
La SG a marqué des gains quand l’inhibiteur de CDK4 et de CDK6 était ajouté à une endocrinothérapie dans les essais MONALEESA-7 et MONARCH-2, mais pas dans l’essai PALOMA-3.
Les chercheurs de l’essai MONALEESA-7 ont estimé qu’après un suivi médian de 42 mois, la SG s’élevait à 70,2 % dans le groupe ribociclib et à 46,0 % dans le groupe témoin, d’où une réduction du risque de décès de 29 % (RRI : 0,71; p = 0,000973). La SG médiane se chiffrait à 40,9 mois dans le groupe témoin, mais n’était toujours pas atteinte dans le groupe ribociclib. Les courbes de survie de l’essai MONALEESA-7 ont commencé à s’éloigner l’une de l’autre au bout de 28 mois de suivi environ et l’écart continuait de se creuser au moment de la publication.
La SG médiane enregistrée pendant l’essai MONARCH-2 s’élevait à 46,7 mois dans le groupe traité par l’abémaciclib allié au fulvestrant et à 37,3 mois dans le groupe recevant du fulvestrant seulement (p = 0,01). Comme ce fut le cas lors de l’essai MONALEESA-7, les effets positifs de l’inhibiteur de CDK4 et de CDK6 étaient constants, peu importe les facteurs de stratification examinés.
La SG médiane observée pendant l’essai PALOMA-3 était de 34,9 mois dans le groupe traité par le palbociclib jumelé au fulvestrant et de 28,0 mois dans le groupe recevant uniquement du fulvestrant. Le rapport des risques instantanés de 0,81 plaidant en faveur du palbociclib n’a pas franchi le seuil de la signification statistique (p = 0,09) (Figure 4).
Bien que les essais aient été menés selon des plans semblables, l’admissibilité des femmes ménopausées aux essais MONARCH-2 et PALOMA‑3 n’était pas la seule différence qui ressortait de leurs effectifs de sujets. Par exemple, les patientes recrutées dans l’essai PALOMA-3 pouvaient avoir subi un traitement de chimiothérapie contre une maladie avancée ainsi qu’un certain nombre d’endocrinothérapies; son effectif était donc composé dès le départ de patientes plus lourdement traitées. C’est pourquoi, même si le même agent d’endocrinothérapie a été utilisé comme élément de comparaison dans les essais MONARCH-2 et PALOMA-3, on ne peut qu’avancer des hypothèses sur les raisons expliquant la diversité de leurs résultats. Elle pourrait avoir un lien avec l’effectif de sujets ou avec des différences propres aux médicaments. Dans l’ensemble, les résultats vont dans le même sens et plaident en faveur des inhibiteurs de CDK4 et de CDK6 au détriment du traitement normalement utilisé contre le cancer du sein RH+/HER2- chez les femmes jeunes ou moins jeunes, quoiqu’encore là, les gains absolus enregistrés varient d’un essai à l’autre (Tableau 1).
Il est toutefois clair qu’une association formée d’un inhibiteur de CDK4 et de CDK6, et d’une endocrinothérapie est très efficace contre le cancer du sein RH+/HER2- avancé, que les femmes soient ménopausées ou non. Pendant l’essai PALOMA-2 par exemple, le délai écoulé avant d’avoir recours à une première chimiothérapie marquait un écart de près de 10 mois (17,6 vs 8,8 mois; p < 0,001) entre le palbociclib et l’endocrinothérapie en monothérapie, même si le gain enregistré pour la SG n’était pas statistiquement significatif. Ce report relatif de l’évolution pathologique, qui était encore plus prononcé dans les essais MONALEESA-7 et MONARCH-2, a un retentissement important pour le bien-être et la qualité de vie des patientes. Comparativement à l’association à prise orale formée d’un inhibiteur de CDK4 et de CDK6 et d’une endocrinothérapie, les traitements de deuxième intention, plusieurs s’administrant par voie intraveineuse et s’accompagnant d’un lourd fardeau d’effets indésirables, signent l’évolution de la maladie. Le facteur temps devient donc une considération majeure pour qui veut faire d’un cancer du sein avancé une maladie maîtrisable.
Résumé
Le message important à retenir de la publication récente de l’essai MONALEESA-2 mené chez des femmes ménopausées atteintes d’un cancer du sein RH+/HER2- avancé ou métastatique, c’est que la survie médiane de cette maladie évolutive et par ailleurs mortelle dépasse maintenant 5 ans lorsqu’un traitement par le ribociclib et le létrozole est entrepris en première intention. L’association médicamenteuse à prise orale qui permet d’obtenir cette prolongation de la survie est simple à suivre et bien tolérée. La plupart des patientes qui amorcent leur traitement par du ribociclib et du létrozole n’auront pas besoin d’une chimiothérapie avant plus de 4 ans en moyenne. Les rémissions encore plus longues que connaissent une forte proportion des patientes donnent à penser que la quête d’une maîtrise d’une durée indéfinie de la maladie progresse. Ce gain est important pour les personnes atteintes d’un cancer du sein avancé exprimant des récepteurs hormonaux, mais HER2-.
Références
1. El Sayed R, El Jamal L, El Iskandarani S, Kort J, Abdel Salam M et Assi H. Endocrine and Targeted Therapy for Hormone-Receptor-Positive, HER2-Negative Advanced Breast Cancer: Insights to Sequencing Treatment and Overcoming Resistance Based on Clinical Trials. Front Oncol 2019;9:510. DOI: 10.3389/fonc.2019.00510.
2. Yao J, Deng K, Huang J, Zeng R et Zuo J. Progress in the Understanding of the Mechanism of Tamoxifen Resistance in Breast Cancer. Front Pharmacol 2020;11:592912. DOI: 10.3389/fphar.2020.592912.
3. Smith IE et Dowsett M. Aromatase inhibitors in breast cancer. N Engl J Med 2003;348(24):2431-2442. DOI: 10.1056/NEJMra023246.
4. Kaklamani VG et Gradishar WJ. Endocrine Therapy in the Current Management of Postmenopausal Estrogen Receptor-Positive Metastatic Breast Cancer. Oncologist 2017;22(5):507-517. DOI: 10.1634/theoncologist.2015-0464.
5. Scott SC, Lee SS et Abraham J. Mechanisms of therapeutic CDK4/6 inhibition in breast cancer. Semin Oncol 2017;44(6):385-394. DOI: 10.1053/j.seminoncol.2018.01.006.
6. Kohler BA, Sherman RL, Howlader N, et al. Annual Report to the Nation on the Status of Cancer, 1975-2011, Featuring Incidence of Breast Cancer Subtypes by Race/Ethnicity, Poverty, and State. J Natl Cancer Inst 2015;107(6):djv048. DOI: 10.1093/jnci/djv048.
7. Howlader N, Altekruse SF, Li CI, et al. US incidence of breast cancer subtypes defined by joint hormone receptor and HER2 status. J Natl Cancer Inst 2014;106(5). DOI: 10.1093/jnci/dju055.
8. Rasha F, Sharma M et Pruitt K. Mechanisms of endocrine therapy resistance in breast cancer. Mol Cell Endocrinol 2021;532:111322. DOI: 10.1016/j.mce.2021.111322.
9. Muss HB. Endocrine therapy for advanced breast cancer: a review. Breast Cancer Res Treat 1992;21(1):15-26. DOI: 10.1007/BF01811960.
10. Nicholson RI et Johnston SR. Endocrine therapy–current benefits and limitations. Breast Cancer Res Treat 2005;93 Suppl. 1:S3-S10. DOI: 10.1007/s10549-005-9036-4.
11. Spring LM, Wander SA, Zangardi M et Bardia A. CDK 4/6 Inhibitors in Breast Cancer: Current Controversies and Future Directions. Curr Oncol Rep 2019;21(3):25. DOI: 10.1007/s11912-019-0769-3.
12. An HX, Beckmann MW, Reifenberger G, Bender HG et Niederacher D. Gene amplification and overexpression of CDK4 in sporadic breast carcinomas is associated with high tumor cell proliferation. Am J Pathol 1999;154(1):113-118. DOI: 10.1016/S0002-9440(10)65257-1.
13. Lei JT, Anurag M, Haricharan S, Gou X et Ellis MJ. Endocrine therapy resistance: new insights. Breast 2019;48 Suppl. 1:S26-S30. DOI: 10.1016/S0960-9776(19)31118-X.
14. Hortobagyi GN, Stemmer SM, Burris HA, et al. Ribociclib as First-Line Therapy for HR-Positive, Advanced Breast Cancer. N Engl J Med 2016;375(18):1738-1748. DOI: 10.1056/NEJMoa1609709.
15. Finn RS, Martin M, Rugo HS, et al. Palbociclib and Letrozole in Advanced Breast Cancer. N Engl J Med 2016;375(20):1925-1936. DOI: 10.1056/NEJMoa1607303.
16. Goetz MP, Toi M, Campone M, et al. MONARCH 3: Abemaciclib As Initial Therapy for Advanced Breast Cancer. J Clin Oncol 2017;35(32):3638-3646. DOI: 10.1200/JCO.2017.75.6155.
17. Slamon DJ, Neven P, Chia S, et al. Overall Survival with Ribociclib plus Fulvestrant in Advanced Breast Cancer. N Engl J Med 2020;382(6):514-524. DOI: 10.1056/NEJMoa1911149.
18. Turner NC, Slamon DJ, Ro J, et al. Overall Survival with Palbociclib and Fulvestrant in Advanced Breast Cancer. N Engl J Med 2018;379(20):1926-1936. DOI: 10.1056/NEJMoa1810527.
19. Sledge GW, Jr., Toi M, Neven P, et al. The Effect of Abemaciclib Plus Fulvestrant on Overall Survival in Hormone Receptor-Positive, ERBB2-Negative Breast Cancer That Progressed on Endocrine Therapy-MONARCH 2: A Randomized Clinical Trial. JAMA Oncol 2020;6(1):116-124. DOI: 10.1001/jamaoncol.2019.4782.