hématologie
Réunion annuelle de 2022 de l’American Society of Clinical Oncology (ASCO)
Essai ASPEN : la durabilité des avantages d’un inhibiteur de la BTK récent contre la maladie de Waldenström se confirme
Chicago – L’avantage conféré par un inhibiteur de la tyrosine kinase de Bruton de nouvelle génération contre la macroglobulinémie de Waldenström (MW) s’est confirmé et consolidé pendant la période de suivi prolongée. Il y a deux ans, la première analyse des données de l’essai de phase III ASPEN a établi qu’un inhibiteur de la BTK de nouvelle génération s’était révélé plus efficace et plus sûr qu’un autre, de première génération celui-là. Aujourd’hui, au terme d’un suivi de plus longue durée, cet écart s’est élargi. Comme il en a été question lors du réunion annuelle de 2022 de l’ASCO, le traitement ininterrompu par cet agent a permis d’obtenir des réponses toujours plus marquées et de réduire l’apparition de plusieurs effets indésirables au fil du temps comparativement à l’inhibiteur de la BTK de première génération, dont des effets cardiotoxiques et d’autres effets collatéraux (off target) commandant l’arrêt du traitement. Les courbes de la survie sans progression (SSP) continuent de s’éloigner l’une de l’autre, l’avantage allant à l’inhibiteur de la BTK de nouvelle génération.
Les données à long terme issues de l’étude de phase III ASPEN, qui a servi à comparer le zanubrutinib, un inhibiteur de la BTK de nouvelle génération, à l’ibrutinib, un inhibiteur de la BTK de première génération dans le traitement de la MW, ont révélé que l’avantage que le zanubrutinib avait sur l’ibrutinib a augmenté avec le temps. Au moment de la publication des premiers résultats, le zanubrutinib avait été relié à une plus faible toxicité et avait tendance à se montrer plus efficace que l’ibrutinib comme en témoignaient plusieurs mesures (Tam, S.C. et al. Blood 2020;136:2038-2050). Or ces écarts ont augmentés durant la période de suivi prolongée.
Pour une entrevue exclusive avec le Dr Rayan Kaedbey couvrant l’impact sur la pratique clinique, cliquez ici
RECRUTEMENT DE PATIENTS JAMAIS TRAITÉS OU ATTEINTS D’UNE FORME RÉFRACTAIRE OU RÉCIDIVANTE DE LA MW
La MW est une hémopathie maligne caractérisée par une infiltration de la moelle épinière par des lymphoplasmocytes sécrétant des immunoglobulines (IgM), source de complications. La plupart des patients atteints de la MW sont porteurs d’une mutation du facteur de différenciation myéloïde 88 (MYD88). La réponse des patients porteurs d’un gène MYD88 de type sauvage (MYD88WT) a été moins marquée lors des études menées sur l’ibrutinib. Les mutations du gène CXCR4, dont environ 30 % des patients sont porteurs, sont aussi le signe d’un pronostic sombre en raison d’une plus grande résistance au traitement. Or le zanubrutinib a donné de bons résultats dans toutes ces sous-populations pendant la période de suivi prolongée.
Lors de l’essai ASPEN, des patients atteints d’une MW symptomatique et porteurs d’un gène MYD88 muté ont été recrutés dans 58 établissements participants. Les patients jamais traités contre leur MW y étaient admissibles si l’immunochimiothérapie ne leur convenait pas. Ceux atteints d’une forme réfractaire ou récidivante de la MW devaient avoir subi au moins un traitement. Sur les 201 patients recrutés, 164 étaient atteints d’une forme réfractaire ou récidivante de la maladie et les 37 autres n’avaient jamais été traités auparavant. Les sujets affectés aléatoirement à l’ibrutinib en ont reçu 420 mg une fois par jour et ceux affectés au zanubrutinib, 160 mg deux fois par jour. Le traitement ne devait cesser que si leur maladie progressait ou que les effets indésirables devenaient intolérables. Un autre groupe de sujets exclusivement composé de patients atteints de la MW et porteurs d’un gène MYD88WT a été créé à des fins exploratoires. Ils ont tous reçu 160 mg de zanubrutinib deux fois par jour jusqu’à la progression de leur maladie et n’ont pas été comparés à un groupe témoin, puisque les études antérieures avaient démontré que l’ibrutinib était peu efficace chez ces patients.
Au moment de la publication des premiers résultats de l’essai ASPEN, la proportion de patients ayant obtenu une très bonne réponse partielle (TBRP) était 50 % plus élevée environ chez les sujets affectés aléatoirement au zanubrutinib que chez ceux affectés à l’ibrutinib (28 % vs 19 %), une tendance très forte (p = 0,09). Aucun patient n’avait obtenu une réponse complète (RC) au moment de cette première analyse.
« Une tendance vers l’obtention plus rapide d’une RC et d’une TBRP plus prononcée et plus durable s’est dessinée à la longue »
« Bien que la différence n’ait pas franchi le seuil de la signification statistique lors de la première analyse, une tendance vers l’obtention plus rapide d’une RC et d’une TBRP plus prononcée et plus durable s’est dessinée à la longue », a rapporté le Dr Constantine S. Tam, Directeur du Service d’hématologie de l’Hôpital Saint-Vincent, de Melbourne, en Australie.
UN AVANTAGE TOUJOURS GRANDISSANT AU FIL DU TEMPS
Lorsque l’analyse la plus récente a commencé après un suivi médian de 44,4 mois, les taux de réponse majeure (TRM) avaient augmenté dans les deux groupes, mais l’avantage relatif en faveur du zanubrutinib se creusait comme en témoignaient les courbes de la SSP en s’éloignant toujours plus.
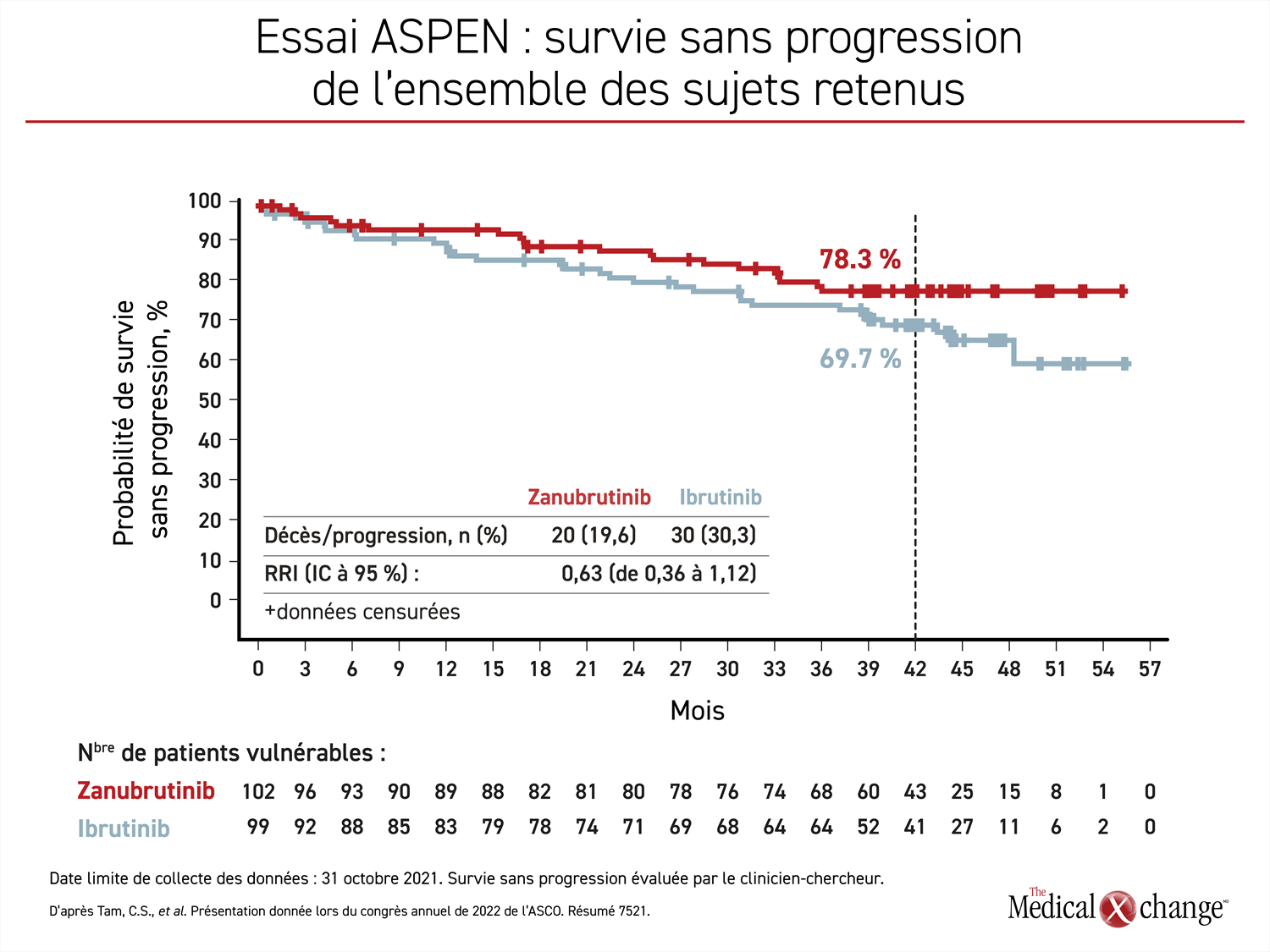
Chez les porteurs d’un gène MYD88 muté, l’écart toujours grandissant entre les courbes de la SSP favorisant le zanubrutinib s’est amorcé vers le 12e mois et s’est accentué par la suite (Figure 1). À 42 mois, la SSP se chiffrait à 78,3 % et à 69,7 % pour le zanubrutinib et l’ibrutinib. Le rapport des risques instantanés (RRI) était en corrélation avec une tendance de 37 % vers une réduction des cas de décès et d’évolution de la maladie (RRI : 0,63; IC à 95 % : de 0,36 à 1,12).
Après 42 mois de suivi, le zanubrutinib marquait un mince avantage numérique non significatif pour la survie globale (SG; 87,5 % vs 85,2 %). La réduction de 25 % du risque (RRI : 0,75; IC à 95 % : de 0,36 à 1,59) enregistré lors du dernier suivi n’a pas franchi le seuil de la signification statistique, mais les courbes tracées pour les sujets suivis plus longtemps que la moyenne semblent continuer de s’éloigner.
Les taux de réponse objective, mais aussi la rapidité de la réponse, ont fait écho à l’activité plus marquée du zanubrutinib. Le délai médian écoulé avant l’obtention d’une TBRP était de 6,7 mois dans le groupe zanubrutinib comparativement à 16,6 mois dans le groupe ibrutinib. La TBRP s’est également révélée plus durable avec le zanubrutinib. À 24 mois, 90,6 % des sujets traités par le zanubrutinib qui avaient affiché une RC ou une TBRP n’avaient toujours pas connu d’incident par rapport à 79,3 % des sujets du groupe ibrutinib.
UNE RÉPONSE QUI S’AMPLIFIE AVEC LE TEMPS CHEZ LES PORTEURS D’UN GÈNE MYD88WT
Après 44,4 mois de suivi, le taux de TBRP était pratiquement 45 % plus élevé chez les sujets porteurs d’un gène MYD88 muté qui recevaient du zanubrutinib (36,3 % vs 25,3 %). Comme on le sait, le groupe de sujets porteurs d’un gène MYD88WT formé sans répartition aléatoire et traité par le zanubrutinib n’a pas été comparé à un groupe témoin recevant de l’ibrutinib. Mentionnons toutefois que 3,8 % d’entre eux ont obtenu une RC, 26,9 %, une TBRP et 34,6 % une réponse partielle (RP).
« À 42 mois, la SSP sans incident et la SG enregistrées dans le groupe de sujets porteurs d’un gène MYD88WT s’élevaient à 53,8 % et à 83,9 %, respectivement », a déclaré le Dr Tam, soulignant ainsi l’efficacité de cet inhibiteur de la BTK de nouvelle génération contre la MW peu importe la situation mutationnelle du gène MYD88.
OBTENTION DE BIENFAITS INDÉPENDAMMENT DE LA SITUATION MUTATIONELLE DU GÈNE CXCR4
Chez les patients stratifiés en fonction de la situation mutationnelle du gène CXCR4, les cliniciens-chercheurs ont aussi noté une TBRP donnant constamment l’avantage au zanubrutinib au détriment de l’ibrutinib, que ce gène soit muté (21,2 % vs 10,0 %) ou de type sauvage (44,6 % vs 30,6 %).
D’après le Dr Tam, tous ces avantages du zanubrutinib s’expliquent probablement par sa plus forte sélectivité pour la BTK et par son occupation plus importante de ses récepteurs. Il souligne que les premiers résultats publiés avaient déjà relié le zanubrutinib à des baisses plus marquées et soutenues des concentrations d’IgM, un paramètre antérieurement reconnu pour mesurer l’activité pathologique de la MW. La surproduction d’IgM est l’une des caractéristiques de la MW et pourrait jouer un rôle dans son comportement physiopathologique. La sélectivité plus grande du zanubrutinib pour sa cible, la BTK, par rapport à celle de l’ibrutinib a aussi un lien avec son innocuité.
UN RAPPORT FAVORABLE ENTRE LES BIENFAITS EXERCÉS ET LES RISQUES ENCOURUS
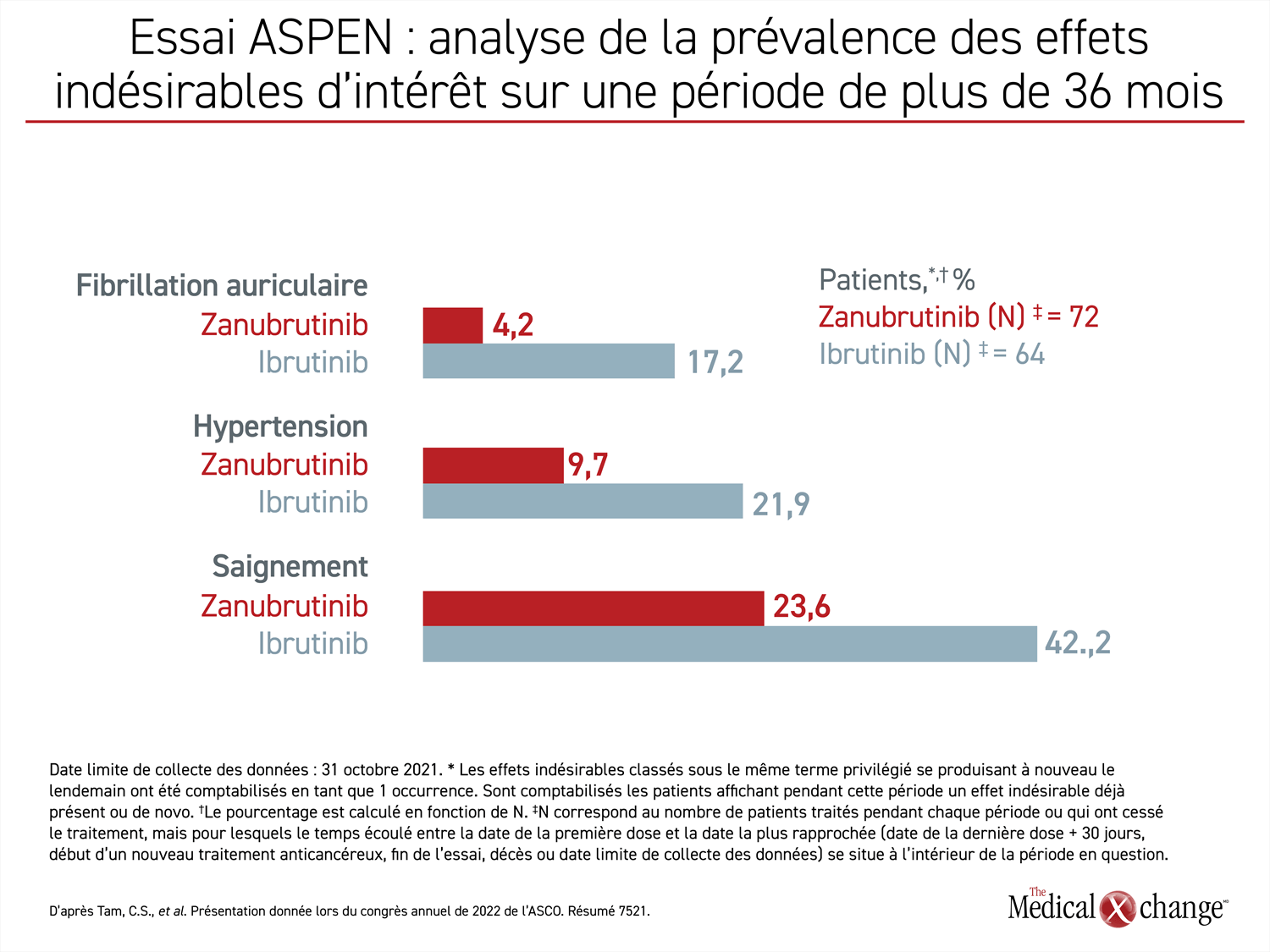
L’avantage constant du zanubrutinib en matière d’innocuité est un aspect tout aussi important. Au moment de la publication des premiers résultats, les cliniciens-chercheurs avaient établi un parallèle entre le zanubrutinib et une incidence plus faible de fibrillation auriculaire (p = 0,005) et d’hémorragie (p = 0,04), notamment. Or l’analyse des données à long terme a révélé la persistance relative de ces avantages, cette différence étant susceptible d’expliquer l’obtention d’une rémission plus durable de la maladie.
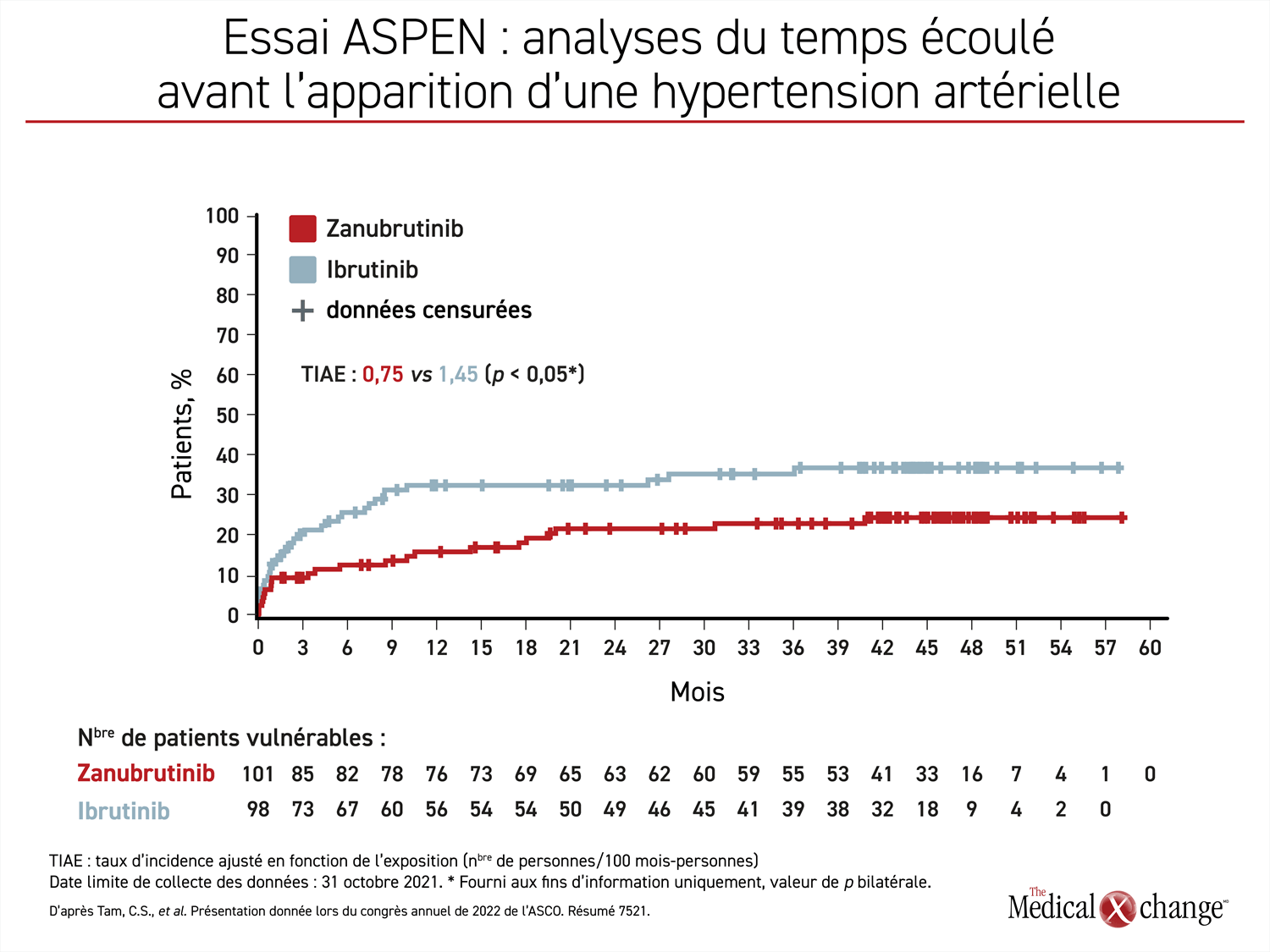
Déjà plus élevée, l’incidence des effets indésirables cardiovasculaires observés avec l’ibrutinib a continué d’augmenter. À preuve, chez les patients traités par l’ibrutinib pendant plus de 36 mois et suivis durant tout ce temps, les taux absolus de fibrillation auriculaire étaient trois fois plus élevés, les taux d’hypertension artérielle avaient plus que doublé et les taux d’hémorragie étaient environ 70 % plus élevés (Figure 2).
Chacune de ces différences, y compris celle concernant l’hypertension artérielle, était statistiquement significative et peut s’expliquer par les effets collatéraux de l’ibrutinib sur les voies enzymatiques autres que celles de la BTK. Par exemple, la hausse du risque de fibrillation auriculaire a été reliée à l’inhibition de la kinase C‑terminale Src (Csk) (Xiao, L. et al. Circulation 2020;142:2443-2455).
« Les effets indésirables motivant l’abandon du traitement étaient moins nombreux »
Les autres effets indésirables rapportés plus souvent avec l’ibrutinib qu’avec le zanubrutinib dans la première analyse, comme la diarrhée (34,7 % vs 22,8 %), les spasmes musculaires (28,6 % vs 11,9 %) et la pneumonie (18,4 % vs 5,0 %), ont persisté pendant la période de suivi prolongée. Les taux de neutropénie étaient plus faibles avec l’ibrutinib (20,4 % vs 34,7 %), mais une plus forte proportion de patients traités par cet agent ont été aux prises avec une infection de grade 3 ou plus (27,6 % vs 21,8 %).
BAISSE DU RISQUE DE CARDIOTOXICITÉ
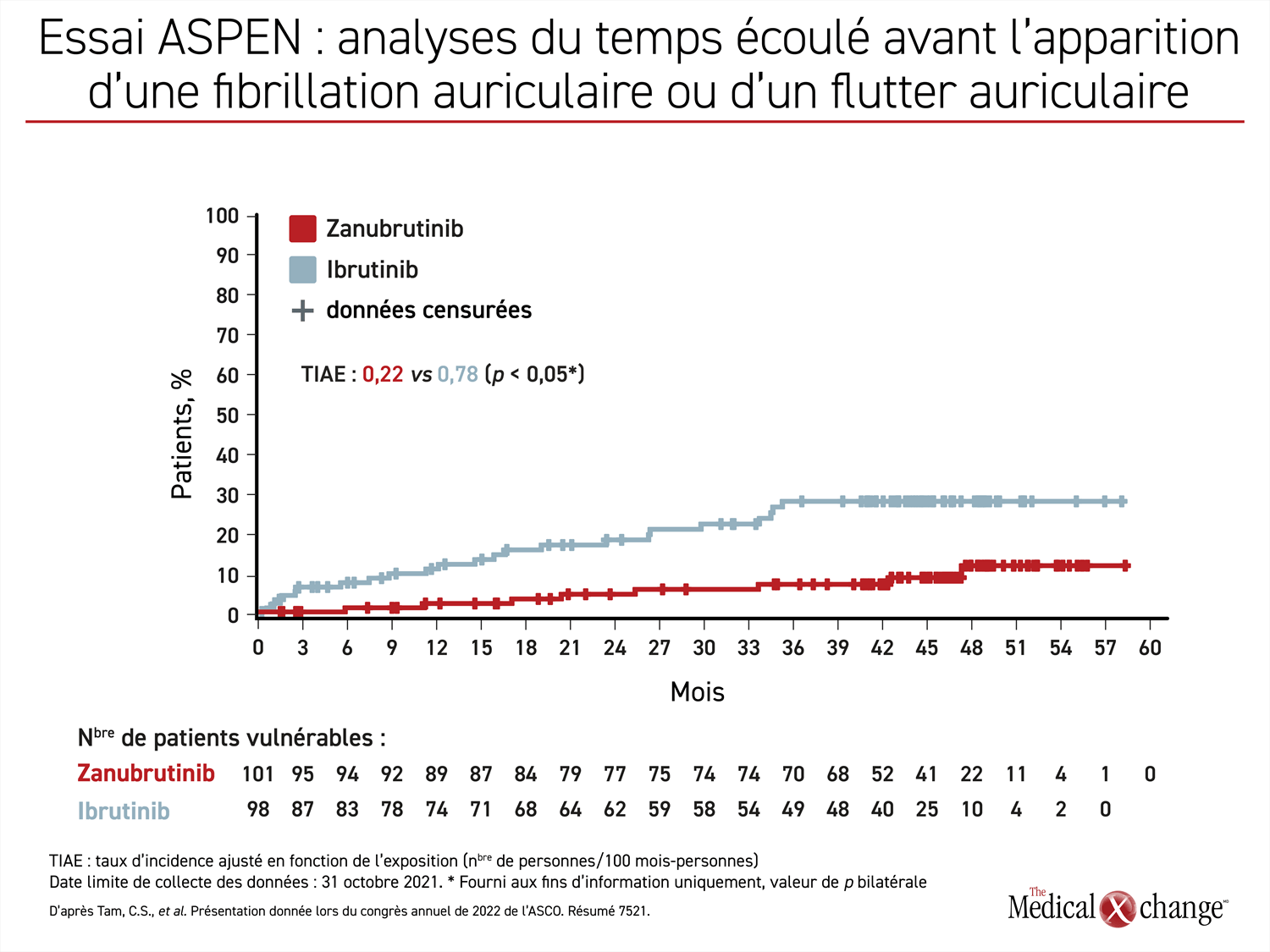
Les résultats à long terme de l’essai ASPEN montrent que le risque de fibrillation auriculaire qui est déjà élevé chez les patients qui atteignent l’âge auquel la MW est plus répandue augmente encore plus au fil du temps avec l’ibrutinib. Il est vrai qu’à la longue, les taux de fibrillation auriculaire ont augmenté peu à peu avec le zanubrutinib, mais ils sont restés nettement inférieurs à ceux enregistrés avec l’ibrutinib pendant toute la période de suivi (Figure 3).
Se fondant sur l’expérience acquise avec l’ibrutinib dans le traitement d’autres cancers hématologiques et de la MW, le Dr Tam a noté : « La fibrillation auriculaire est une complication bien connue du traitement par l’ibrutinib et, comparativement à une population de témoins appariés en fonction de l’âge, les patients qui en suivent un y semblent constamment plus exposés ».
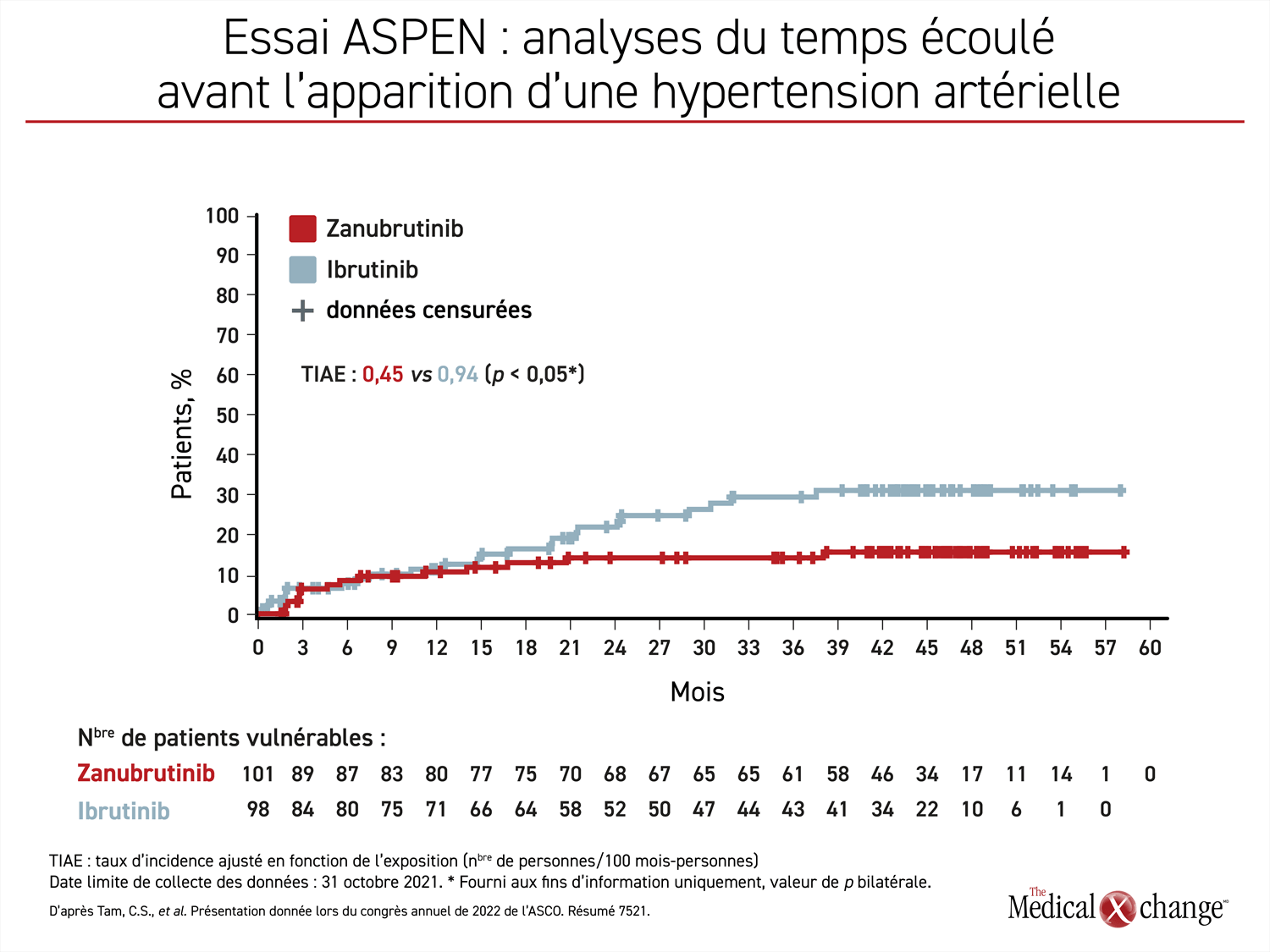
LES EFFETS INDÉSIRABLES MOTIVANT UNE RÉDUCTION DE LA DOSE OU L’ABANDON DU TRAITEMENT ÉTAIENT MOINS NOMBREUX
Le taux d’effets indésirables mortels a été faible dans les deux groupes de sujets; il n’empêche qu’il était un peu plus élevé dans le groupe ibrutinib (5,1 % vs 3,0 %). Cela dit, les effets indésirables motivant une réduction de la dose ont été 65 % plus fréquents dans le groupe ibrutinib (26,5 % vs 15,8 %) et ceux exigeant l’abandon du traitement l’ont été plus de deux fois plus (20,4 % vs 8,9 %) (Figure 4).
Au fil du temps, « les effets indésirables mortels ou commandant une réduction de la dose ou l’arrêt du traitement ont été moins nombreux dans le groupe zanubrutinib », a affirmé le Dr Tam.
PRISE EN CHARGE DES QUESTIONS PRATIQUES
À la lumière des résultats de l’essai ASPEN, le National Comprehensive Cancer Network (NCCN) a actualisé ses plus récentes lignes directrices de façon que le zanubrutinib y soit préconisé comme l’inhibiteur de la BTK à privilégier contre la MW. Si cette recommandation fait écho à un rapport plus favorable entre les bienfaits exercés par le zanubrutinib et les risques qu’il comporte, il n’en demeure pas moins que cet agent offre certains avantages concrets et utiles en matière de soins prodigués au quotidien. Sa posologie variable est l’un d’eux. Santé Canada, la Food and Drug Administration des États-Unis et d’autres organismes de réglementation permettent l’administration de ce médicament à raison de 160 mg deux fois par jour ou de 320 mg une fois par jour, selon ce qui convient le mieux au mode de vie du patient.
La fréquence d’administration est aussi un problème concret. L’administration biquotidienne est acceptable aux yeux de bien des patients, surtout ceux qui prennent déjà d’autres médicaments deux fois par jour, mais les schémas posologiques plus simples sont souvent préférables et mieux respectés. Chez les patients atteints d’une maladie grave qui doivent suivre un traitement chronique, un médicament bien toléré assorti d’un schéma posologique adaptable leur permet de vaquer à leurs activités quotidiennes qui ne leur rappellera pas constamment qu’ils ont le cancer, un facteur qui, d’après certaines études, est important pour la qualité de vie.
Le zanubrutinib provoque moins d’interactions avec les médicaments d’usage courant que certains autres inhibiteurs de la BTK, surtout ceux utilisés chez les personnes âgées qui sont d’ailleurs les plus susceptibles d’être atteintes de la MW. Une étude sur les interactions médicamenteuses a révélé que le zanubrutinib a un effet nul sur le comportement pharmacocinétique des agents biotransformés par l’isoenzyme CYP2C9 (Ou, Y.C. et al. Br J Clin Pharmacol 2021;87:2926-2936). Elle nous a aussi appris que le zanubrutinib avait abaissé l’exposition générale aux médicaments biotransformés par la CYP3A, mais que cela n’avait aucune répercussion lorsqu’il était employé avec des inhibiteurs de la pompe à protons ou d’autres antiacides, ou avec des agents antithrombotiques.
CONCLUSION
Une des grandes conclusions tirées du suivi prolongé réalisé dans le cadre de l’essai ASPEN sur le traitement de la MW, c’est qu’à la longue, les bienfaits cliniques du zanubrutinib s’accumulent et que sa supériorité sur l’ibrutinib se confirme, ce qui est particulièrement important dans le cas d’une maladie indolente. La SG médiane après qu’un diagnostic de MW est posé est d’une quinzaine d’années. Si la sélectivité plus forte pour la BTK joue probablement un rôle dans l’amplification de la réponse au fil du temps, il est tout aussi important de tenir compte de l’innocuité du traitement chez ces patients pouvant jouir d’une bonne qualité de vie malgré la maladie.
Les résultats à long terme de l’essai de phase III ASPEN, qui a hissé le zanubrutinib au rang de traitement à privilégier contre le MW dans les lignes directrices du NCCN, montrent que l’avantage de cet inhibiteur de la BTK de nouvelle génération sur l’ibrutinib tant sur le plan de l’efficacité que sur celui de l’innocuité est proportionnel à la durée de l’exposition à cet agent. Au terme de presque 4 années de suivi, on constate que les réponses se sont manifestées plus rapidement et plus intensément chez les patients traités par le zanubrutinib que chez ceux ayant reçu l’ibrutinib, sans compter la réduction relative encore plus marquée du risque d’effet cardiotoxique, notamment d’une fibrillation auriculaire de novo. Ces résultats confirment l’importance de la sélectivité relative sur la cible, la BTK, et établissent les normes de soins à opposer à la MW.