oncologie
Cancer des voies biliaires : revue d'expert et commentaires tirés de la littérature
La promesse d’un réel changement dans le traitement de première intention du cancer des voies biliaires
Dr Vincent Tam, BSc(Hon), M.D., FRCPC
Oncologue médical, Centre de cancérologie Tom Baker
Professeur agrégé de clinique, Département d’oncologie
École de médecine Cumming, Université de Calgary
Calgary (Alberta)
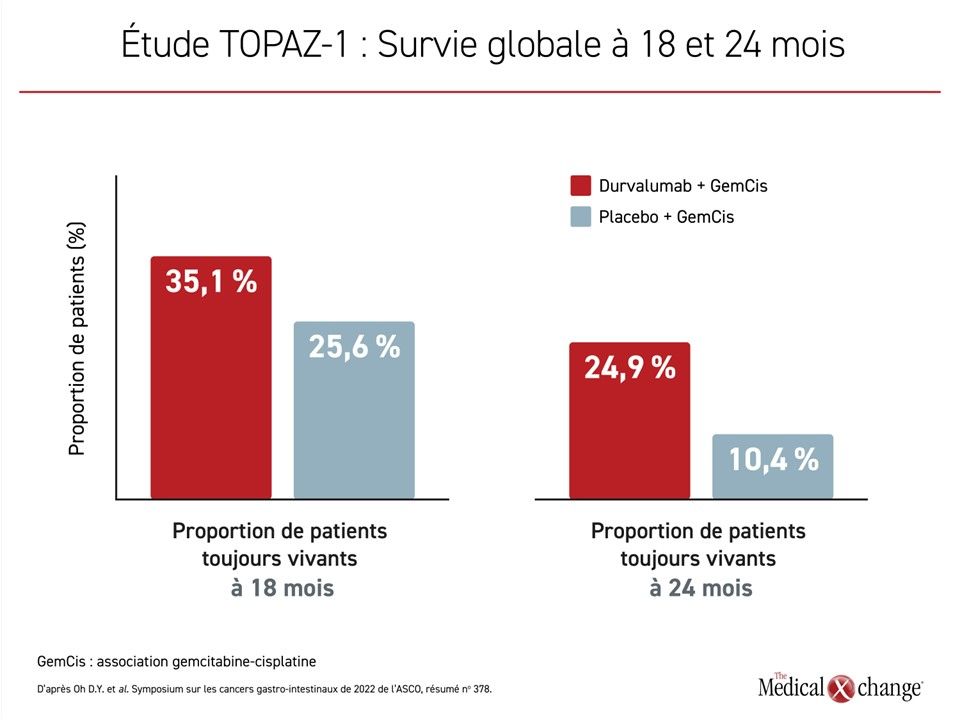
Le traitement type utilisé en première intention contre des formes avancées et inopérables de cancer des voies biliaires (CVB) est appelé à changer compte tenu des résultats de l’étude de phase III TOPAZ-1 qui a pris fin récemment. Cette étude a servi à comparer un schéma chimiothérapique alliant la gemcitabine et le cisplatine (GemCis) au même schéma auquel on a associé du durvalumab, un inhibiteur de points de contrôle (IPC). L’ajout du durvalumab s’est traduit par une amélioration statistiquement significative de la survie globale (SG) et a été bien toléré. Aucune différence entre la qualité de vie des patients affectés aléatoirement au schéma GemCis allié au durvalumab et celle des patients ayant suivi le schéma GemCis seulement n’est ressortie d’une sous-analyse récente des résultats rapportés par les patients. Il y a plus de 10 ans, lorsque l’association composée de cisplatine et de gemcitabine a supplanté la gemcitabine en monothérapie comme traitement de première intention du CVB avancé, la SG médiane avait augmenté de 40 % environ, ce qui l’avait portée à près de 1 an. Or les chercheurs de l’étude TOPAZ-1 ont noté chez les sujets ayant reçu le traitement expérimental une réduction supplémentaire de 20 % du risque de décès (RRI : 0,80; p = 0,21), la SG médiane dépassant maintenant 1 année. Cet avantage relatif a graduellement augmenté au point où la proportion de survivants était plus de 2 fois plus élevée à 24 mois (24,9 % vs 10,4 %).
Contexte
Un CVB, souvent de nature intrahépatique, périhilaire ou extrahépatique, peut apparaître n’importe où dans l’épithélium des voies biliaires1. Presque tous les CVB sont des cholangiocarcinomes, mais il en existe d’autres types comme le sarcome. Le CVB, et tout particulièrement le cholangiocarcinome, est un cancer hétérogène tant sur le plan génomique, épigénétique que moléculaire2. Il est plus ou moins fréquent d’un pays à l’autre, mais il est peu répandu dans l’ensemble des pays occidentaux3. Selon les estimations tirées d’une enquête canadienne, le CVB toucherait environ 4 personnes sur 100 000 chaque année4. Ce cancer à évolution agressive est habituellement diagnostiqué alors qu’il est déjà avancé, ce qui en fait une maladie particulièrement mortelle.
Pour une entrevue exclusive avec le Dr Vincent Tam couvrant l’impact sur la pratique clinique, cliquez ici
Le CVB est probablement le résultat d’une interaction complexe entre des facteurs liée à la génétique, au mode de vie et à l’environnement. Bien que les infestations parasitaires, la cholangite sclérosante primitive et l’exposition à des toxines, telles que le tabac, comptent parmi les causes de lésions aux canaux biliaires soupçonnées de déclencher une cancérisation5, plus de la moitié des patients affligés d’un CVB ne présentent aucun facteur de risque reconnaissable6, Les variations géographiques de l’incidence et de la prévalence du CVB seraient le fait de facteurs environnementaux.
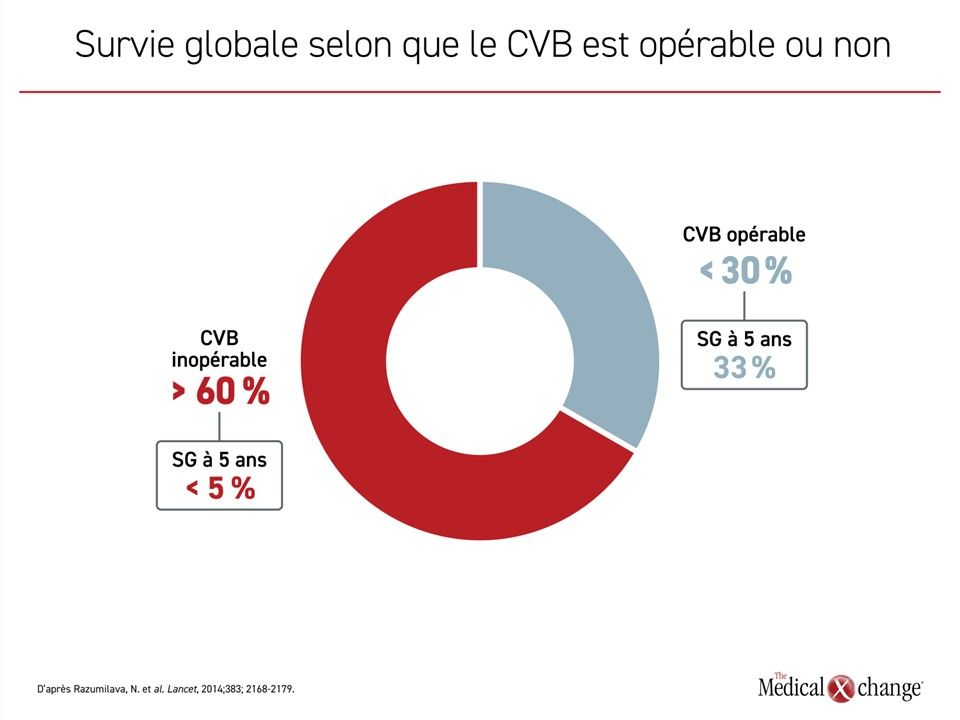
La chirurgie peut parfois guérir le CVB7, mais la maladie est inopérable ou a déjà produit des métastases chez plus de 60 % des patients lorsqu’elle est diagnostiquée1. Même quand la chirurgie est une réussite, les récidives sont monnaie courante. Les chercheurs d’une étude ont rapporté un taux de guérison de moins de 15 % 9,5 ans après la chirurgie8. Le taux de SG à 5 ans est généralement estimé à 33 % chez les patients opérables, mais à moins de 5 % chez ceux qui ne le sont pas (Figure 1)9. Sans traitement à action générale, la SG médiane des cas de CVB pris en charge au moyen des meilleurs soins de soutien est inférieure à 6 mois10.
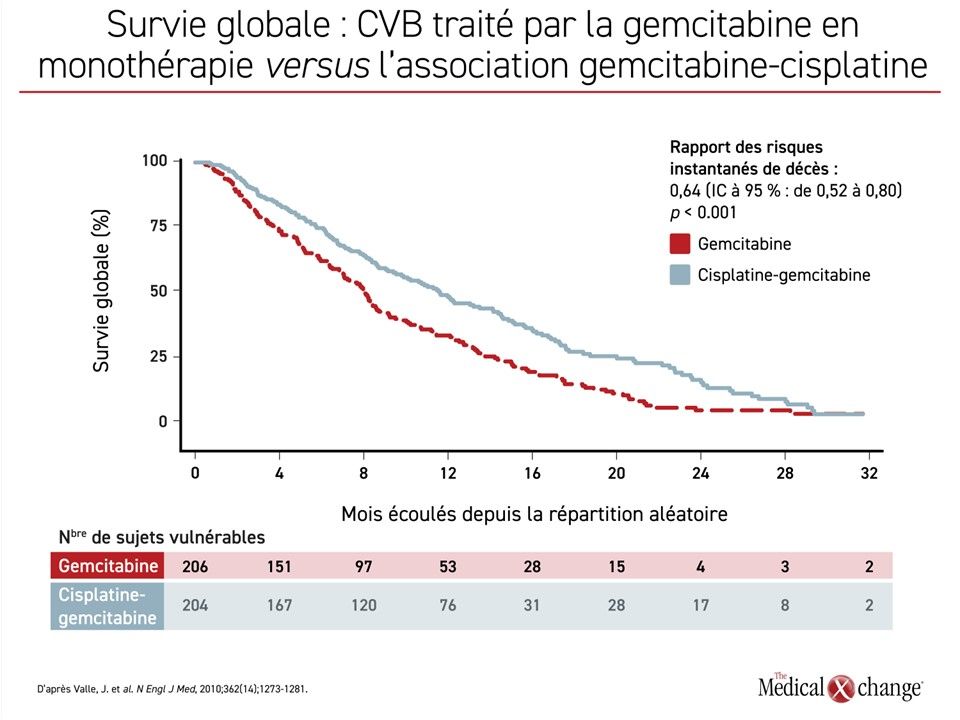
Depuis plus de 10 ans, le schéma GemCis est le traitement type utilisé en première intention pour lutter contre le CVB inopérable, récidivant ou métastatique, conséquence des résultats de l’étude ABC-02 qui avait établi un lien entre l’ajout de cisplatine à la gemcitabine et une baisse du risque de décès extrêmement significative par rapport à la gemcitabine employée seule (RRI : 0,64; p < 0,001)11. Au cours de cette étude, la SG médiane se chiffrait à 8,1 mois dans le groupe traité par la gemcitabine uniquement alors qu’elle était de 11,7 mois dans le groupe ayant suivi le schéma GemCis (Figure 2). La survie sans progression (SSP) médiane quant à elle était passée de 5,0 à 8,0 mois (p < 0,001). Les cas de neutropénie ont été plus fréquents avec l’association médicamenteuse, mais pas les infections liées à cette anomalie. Les effets indésirables étaient semblables dans les deux groupes.
Évolution du rôle des inhibiteurs de points de contrôle dans le traitement du CVB
Le et ses collègues ont recruté dans leur étude des patients atteints de tumeurs dites MSI-H (microsatellite instability-high), qu’ils ont traités avec un inhibiteur de points de contrôle (IPC) en monothérapie. Les cas de CVB y étaient peu nombreux12. Au bout de 12,5 mois de suivi, la SSP et la SG médianes n’étaient toujours pas établies. Une minorité de patients a obtenu une réponse complète (RC), mais quelques-uns d’entre eux étaient toujours en rémission au moment de la publication des résultats même si leur traitement avait pris fin.
Des études portant expressément sur l’emploi d’IPC dans des cas de CVB ont suivi. Elles ont majoritairement été menées chez des patients dont la maladie avait récidivé en dépit d’un traitement antérieur13,14 et elles ont bien souvent servi à évaluer une monothérapie. Ont été recrutés dans beaucoup de ces études des patients ayant des biomarqueurs susceptibles de favoriser une réponse aux IPC, tels que des tumeurs MSI-H, des erreurs de réparation des mésappariements de l’ADN (MMR), des tumeurs hypermutées ou un point de contrôle cible fortement exprimé à la surface de cellules immunitaires (p. ex. PD-1). D’après le taux de réponse objective (TRO), qui était souvent le paramètre d’évaluation principal, la réponse aux IPC utilisés seuls était généralement modeste, quoique parfois durable15,16.
Pour ce qui est du traitement de première intention du CVB, la tendance allait vers des études portant sur l’emploi d’IPC en association avec d’autres agents actifs, comme un agent cytotoxique ou plus ou des agents ciblés14. Le CVB a des caractéristiques qui font de l’immunothérapie une option attrayante. Par exemple, dans bien des cas, les patients sont porteurs d’au moins un biomarqueur associé à une réponse aux IPC, tel que l’expression du point de contrôle cible, des tumeurs hypermutées ou une déficience du système MMR14. Autre exemple : l’activité des cellules immunitaires intratumorales relative mesurée entre autres d’après la présence de lymphocytes infiltrant les tumeurs est une variable qui semble influencer l’issue du CVB17. Tandis qu’une activité inflammatoire est impliquée dans l’apparition du CVB18, la réponse aux IPC est probablement liée à la possibilité de réactiver les réponses immunitaires anticancéreuses déprimées. Une fois que les points de contrôle sont inhibés, il y a plus de chances qu’une activité antitumorale cliniquement importante s’exerce grâce à la présence de cellules du système immunitaire acquis dans le micro-environnement du CVB.
Cela dit, le rôle joué par les facteurs susceptibles d’influencer la réponse aux IPC n’a pas été examiné en profondeur dans des études cliniques portant sur le CVB. En fait, la présence de biomarqueurs ne faisait pas partie des critères d’admissibilité de la plupart des études, y compris ceux d’une étude de phase II visant à évaluer des associations médicamenteuses renfermant un IPC, qui était dirigée par le Dr Do-Youn Oh, de la Division d’oncologie médicale, de l’Hôpital universitaire national de Séoul, en Corée du Sud et chercheur principal de l’étude de phase III TOPAZ‑1 qui a suivi19.
Le plan initial de cette étude prévoyait que tous les sujets reçoivent un cycle du schéma GemCis. À partir du deuxième cycle, on y adjoignait du durvalumab seulement ou du durvalumab allié à du trémélimumab, un inhibiteur de points de contrôle ciblant la protéine CTLA-4. Toutefois, le protocole a été considérablement modifié par la suite de façon que les patients reçoivent les inhibiteurs de points de contrôle en plus de la chimiothérapie dès le premier jour du premier cycle. Sur les 128 patients traités, 32 l’ont été avant que cette modification soit apportée au protocole; 49 des 96 autres ont reçu du durvalumab et la chimiothérapie pendant le premier cycle et 47 restants ont reçu la chimiothérapie en plus du durvalumab et du trémélimumab.
Le TRO était de 50 % chez les patients traités avant la modification du protocole. Quant à ceux traités par après, il s’établissait respectivement à 72 % et à 70 % dans le groupe chimiothérapie plus durvalumab et dans le groupe chimiothérapie plus durvalumab et trémélimumab. La tolérabilité des deux schémas thérapeutiques a été acceptable. Les effets indésirables de grade 3 ou plus les plus répandus ont été de nature hématologique (neutropénie : 53 %; anémie : 40 %). L’efficacité objectivée dans les deux groupes ayant été similaire, les chercheurs ont prévu une étude de phase III où le seul IPC ajouté serait le durvalumab.
Plan et résultats de l’étude TOPAZ-1
L’étude de phase III TOPAZ-1, qui a été présentée pour la première fois lors du Symposium sur les cancers gastro-intestinaux de 2022 de l’American Society of Clinical Oncology (ASCO), est la première étude comparative multinationale visant à évaluer l’emploi d’un IPC dans le traitement de première intention du CVB20. Le durvalumab, un inhibiteur du ligand de PD-1 (PD-L1), y a été comparé à un placebo, les deux produits étant jumelés au schéma GemCis classique.
Au terme du processus de répartition aléatoire, 685 patients atteints d’un CVB inopérable, localement avancé, récidivant ou métastatique jamais traité ont tous reçu 1000 mg/m2 de gemcitabine et 25 mg/m2 de cisplatine les 1er et 8e jours de cycles de 3 semaines. Du durvalumab ou un placebo leur a aussi été administré par perfusion toutes les 3 semaines. La chimiothérapie d’association GemCis s’est poursuivie pendant un maximum de 8 cycles au bout desquels les patients ont continué de recevoir du durvalumab ou le placebo seulement jusqu’à ce que leur maladie évolue ou que les effets toxiques deviennent inacceptables.
La SG faisait office de paramètre d’évaluation principal, les paramètres secondaires étant le TRO, la SSP et l’innocuité. L’âge médian des patients était de 64 ans dans les deux groupes et environ la moitié d’entre eux étaient des femmes. Au début de l’étude, leur indice fonctionnel de l’ECOG ne montrait pas de différence significative.
Au bout d’un suivi médian de 16 mois environ, la SG médiane observée dans le groupe GemCis-durvalumab et dans le groupe traité par le schéma GemCis seulement s’élevait à 12,8 mois et à 11,5 mois. L’ajout de l’IPC s’est traduit par une baisse du risque de décès de 20 % (RRI : 0,80; p = 0,021). Pour ce qui est de la SG, l’avantage relatif qu’a eu le schéma GemCis allié au durvalumab sur la chimiothérapie utilisée seule a bel et bien été démontré, même après que le suivi ait été prolongé à 2 ans (Figure 3). La SSP médiane se chiffrait à 5,7 mois dans le groupe témoin traité par le schéma GemCis et de 7,2 mois dans le groupe GemCis-durvalumab, ce qui représente une réduction du risque de 25 % (RRI : 0,75; p = 0,001). Les TRO s’élevaient respectivement à 26,7 % et à 18,7 %.
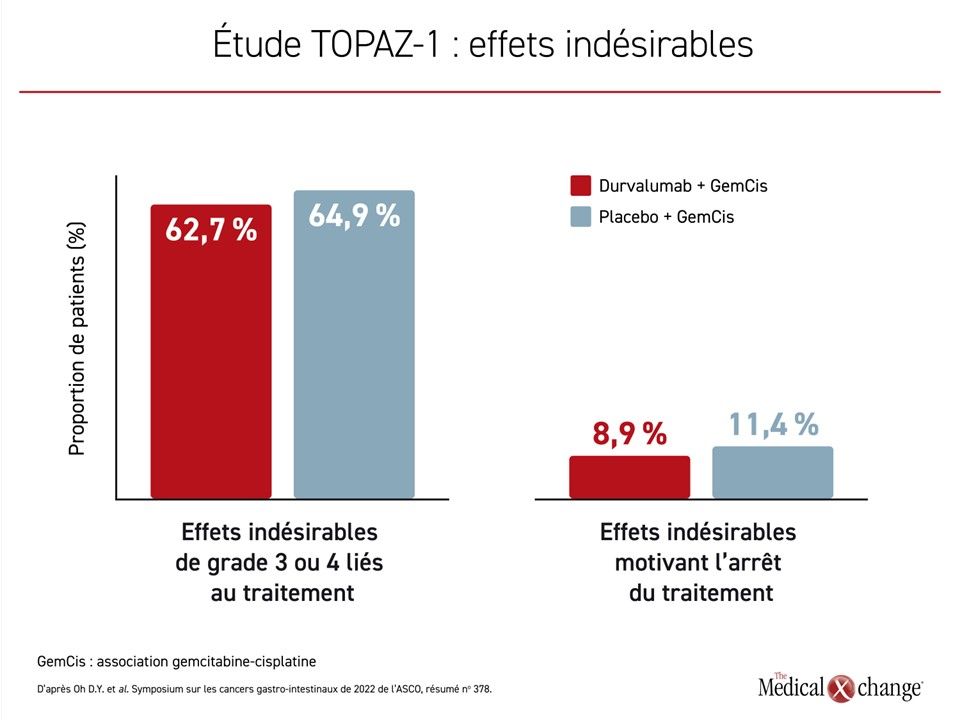
Des effets indésirables de grade 3 ou 4 ont été observés chez 62,7 % des patients affectés au groupe expérimental et chez 64,9 % des témoins recevant la chimiothérapie et le placebo. Ces effets indésirables ont majoritairement pris la forme de cytopénies ou de résultats anormaux aux épreuves fonctionnelles hépatiques. La fatigue a été l’effet indésirable symptomatique de grade 3 ou plus le plus répandu, mais elle a touché moins de 20 % des patients des deux groupes. La plupart des autres effets indésirables symptomatiques, y compris les nausées et l’alopécie, sont survenus chez moins de 10 % des sujets. Par ailleurs, 8,9 % des patients traités par le durvalumab jumelé à la chimiothérapie et 11,4 % des témoins recevant la chimiothérapie et le placebo ont mis fin à leur traitement pour cause d’effets indésirables (Figure 4).
Une sous-analyse des données de l’étude TOPAZ-1 prévue au protocole, qui a été présentée lors du congrès annuel de 2022 de l’ASCO, n’a fait ressortir aucune différence significative pour ce qui est des paramètres de la qualité de vie (QdV) évalués par les patients, qu’ils aient été traités par le schéma GemCis jumelé au durvalumab ou au placebo. D’après les réponses au questionnaire EORTC QLQ-C30, le temps écoulé avant la détérioration (TÉD) de la QdV a eu tendance à être plus long dans le groupe durvalumab-GemCis21. Selon le questionnaire EORTC QLQ-C30 et le module à 21 domaines préalablement validé, la discipline dont les patients ont fait preuve pour remplir ces questionnaires était élevée (81 %) pendant le premier cycle et l’est restée (> 70 %) jusqu’à la fin de l’étude, celle-ci ayant pu durer pendant 28 cycles.
Le gain enregistré pour la SG avec le durvalumab en l’absence de toute hausse notable du risque d’effets indésirables justifie que l’on considère désormais le schéma GemCis jumelé au durvalumab comme un nouveau traitement de référence. Les analyses de la qualité de vie et le bilan de tolérabilité effectués au cours de cette étude à répartition aléatoire confirment l’hypothèse voulant qu’il soit possible de prolonger la survie des patients tout en les exposant à un risque d’effets indésirables graves à la fois similairement faible et suffisamment bas pour être acceptable.
Résumé
Il existe un besoin criant de nouvelles options thérapeutiques à opposer au CVB inopérable. Le schéma GemCis est un traitement utilisé depuis plus de 10 ans en première intention, mais la SG médiane reste inférieure à 1 an. Or l’ajout de durvalumab, un IPC, à ce schéma au cours de l’étude de phase III TOPAZ-1 lui a permis de franchir ce seuil, une plus forte proportion de patients étant encore en vie au bout de 2 ans. Il convient de noter que tout au long du traitement, l’ajout du durvalumab au schéma GemCis a été bien toléré et que la hausse de la SG n’a pas été obtenue au prix d’une amplification des effets toxiques. D’ici à ce que le traitement du CVB connaisse de nouveaux progrès, le nombre absolu de patients qui y survivent restera limité. La maximisation de la survie sur fond de réduction au minimum des effets toxiques liés au traitement et de préservation de la qualité de vie est un objectif particulièrement important.
Références
1. Manne, A., Woods, E., Tsung, A. et Mittra, A. Biliary Tract Cancers: Treatment Updates and Future Directions in the Era of Precision Medicine and Immuno-Oncology. Front Oncol 2021;11:768009. DOI: 10.3389/fonc.2021.768009.
2. Tariq, N.U., McNamara, M.G. et Valle, J.W. Biliary tract cancers: current knowledge, clinical candidates and future challenges. Cancer Manag Res 2019;11:2623-2642. DOI: 10.2147/CMAR.S157092.
3. Banales, J.M., Marin, J.J.G., Lamarca, A., et al. Cholangiocarcinoma 2020: the next horizon in mechanisms and management. Nat Rev Gastroenterol Hepatol 2020;17(9):557-588. DOI: 10.1038/s41575-020-0310-z.
4. Xiao, Y., Cattelan, L., Lagacé, F., et al. Epidemiologic trends and geographic distribution of patients with gallbladder and extrahepatic biliary tract cancers in Canada. HPB (Oxford) 2021;23(10):1541-1549. DOI: 10.1016/j.hpb.2021.03.007.
5. Tyson, G.L. et El-Serag, H.B. Risk factors for cholangiocarcinoma. Hepatology 2011;54(1):173-184. DOI: 10.1002/hep.24351.
6. Khan, S.A., Tavolari, S. et Brandi, G. Cholangiocarcinoma: Epidemiology and risk factors. Liver Int 2019;39 suppl. 1:19-31. DOI: 10.1111/liv.14095.
7. Radtke, A. et Konigsrainer, A. Surgical Therapy of Cholangiocarcinoma. Visc Med 2016;32(6):422-426. DOI: 10.1159/000452921.
8. Dhanasekaran, R., Hemming, A.W., Zendejas, I., et al. Treatment outcomes and prognostic factors of intrahepatic cholangiocarcinoma. Oncol Rep 2013;29(4):1259-1267. DOI: 10.3892/or.2013.2290.
9. Song, W., Miao, D.L. et Chen, L. Survival rates are higher in married patients with biliary tract cancer: a population-based study. Oncotarget 2018;9(10):9531-9539. DOI: 10.18632/oncotarget.24170.
10. Sharma, A., Dwary, A.D., Mohanti, B.K., et al. Best supportive care compared with chemotherapy for unresectable gall bladder cancer: a randomized controlled study. J Clin Oncol 2010;28(30):4581-4586. DOI: 10.1200/JCO.2010.29.3605.
11. Valle, J., Wasan, H., Palmer, D.H., et al. Cisplatin plus gemcitabine versus gemcitabine for biliary tract cancer. N Engl J Med 2010;362(14):1273-1281. DOI: 10.1056/NEJMoa0908721.
12. Le, D.T., Durham, J.N., Smith, K.N., et al. Mismatch repair deficiency predicts response of solid tumors to PD-1 blockade. Science 2017;357(6349):409-413. DOI: 10.1126/science.aan6733.
13. Taghizadeh, H. et Prager, G.W. Immune Checkpoint Inhibitors for Advanced Biliary Tract Cancer. Curr Cancer Drug Targets 2022. DOI: 10.2174/1568009622666220215144235.
14. Jakubowski, C.D. et Azad, N.S. Immune checkpoint inhibitor therapy in biliary tract cancer (cholangiocarcinoma). Chin Clin Oncol 2020;9(1):2. DOI: 10.21037/cco.2019.12.10.
15. Bang, J.H., Ueno, M. et Malka D., H.C. C. Pembrolizumab for advanced biliary adenocarcinoma: results from the KEYNOTE-028 (N+KN028) and KEYNOTE-158 (KN158) basket studies. Congrès annuel de 2019 de l’American Society of Clinical Oncology; résumé 4079.
16. Kimm, R.D., Kimm, D.W. et Alesem, O.B. A phase II study of nivolumab in patients with advanced refractory biliary tract cancers. Congrès annuel de 2019 de l’American Society of Clinical Oncology; résumé 4097.
17. Goeppert, B., Frauenschuh, L., Zucknick, M., et al. Prognostic impact of tumour-infiltrating immune cells on biliary tract cancer. Br J Cancer 2013;109(10):2665-2674. DOI: 10.1038/bjc.2013.610.
18. Augustine, M.M. et Fong, Y. Epidemiology and risk factors of biliary tract and primary liver tumors. Surg Oncol Clin N Am 2014;23(2):171-188. DOI: 10.1016/j.soc.2013.10.001.
19. Oh, D.Y., Lee, K.H., Lee, D.W., et al. Gemcitabine and cisplatin plus durvalumab with or without tremelimumab in chemotherapy-naive patients with advanced biliary tract cancer: an open-label, single-centre, phase 2 study. Lancet Gastroenterol Hepatol 2022;7(6):522-532. DOI: 10.1016/S2468-1253(22)00043-7.
20. Oh, D.Y., He, A.R., Qin, S. et Chen, L. A phase 3 randomized, double-blind, placebo-controlled study of durvalumab in combination with gemcitabine plus cisplatin in patients with advanced biliary tract cancer: TOPAZ-1. Symposium sur les cancers gastro-intestinaux de 2022 de l’ASCO; résumé 378.
21. Burris, H.A., Okusaka, T., Vogel, A., Lee, M.A. et Takahashi, H. Patient-reported outcomes for the phase 3 TOPAZ-1 study of durvalumumab plus gemcitatbine and cisplatin in advanced biliary tract cancer. Symposium sur les cancers gastro-intestinaux de 2020 de l’American Society of Clinical Oncology (ASCO) à San Francisco.