Dermatologie
Congrès 2022 de l’European Academy of Dermatology and Venereology (EADV)
Les études de phase 3 promettent une option hautement efficace pour l’hidradénite suppurée
Milan – Deux études de phase 3 de conception similaire ont associé un agent biologique ciblant l’interleukine-17A (IL-17A) à une efficacité peu courante pour la maîtrise de l’hidradénite suppurée (HS). Les études, appelées SUNSHINE et SUNRISE, forment ensemble le plus grand ensemble de données de phase 3 sur cette maladie jamais rassemblé. Parmi les personnes exposées à l’inhibiteur de l’IL-17A, plus de 40 % des patients des deux études ont atteint le résultat principal d’une réduction significative dans l’échelle HiSCR (Hidradenitis Suppurativa Clinical Response).
Selon les progrès que ces données représentent pour l’HS, « Je pense que nous allons considérer cela comme un point important vers les progrès réalisés dans le traitement de cette maladie incroyablement invalidante », a déclaré la Dre Alexa B. Kimball, professeure de dermatologie, Harvard Medical School, Boston, Massachusetts. Affiliée au service de dermatologie du Beth Israel Deaconess Medical Center, la Dre Kimball était chercheuse principale de ce programme de phase 3 et coauteure des lignes directrices nord-américaines sur le traitement de l’HS publiées en 2019.
Pour une entrevue exclusive avec la Dre Catherine Maari couvrant l’impact sur la pratique clinique, cliquez ici.
Le médicament à l’étude pour les études SUNSHINE et SUNRISE était le sécukinumab, un inhibiteur de l’IL-17A administré par injection sous-cutanée. Les deux études ont été conçues de façon identique et planifiées pour une analyse groupée. Les données rapportées proviennent des 16 premières semaines de suivi des études de 52 semaines. L’inscription était limitée aux patients atteints d’une maladie modérée ou grave établie depuis longtemps. Dans cette population difficile, environ 45 % des patients recevant le traitement actif ont atteint le critère d’évaluation principal, contre un peu plus de 30 % des patients recevant le placebo.
Avantage relatif réalisé en 2 semaines
« Une réponse rapide et précoce a été observée après environ 2 semaines, avec des avantages qui augmentent considérablement jusqu’à environ 4 semaines, puis qui ont continué tout au long de la période de suivi de 16 semaines », a déclaré la Dre Kimball (figure 1). En tant que spécialise dans le traitement de l’HS qui reconnaît la difficulté d’atteindre un niveau de maîtrise soutenu chez une proportion substantielle de patients, la Dre Kimball a ajouté : « Je ne pouvais pas être plus heureuse de présenter ces résultats. »
« On a observé une réponse précoce rapide après environ 2 semaines, avec un avantage qui augmente considérablement à environ 4 semaines. »
L’étude SUNSHINE comptait 541 patients atteints d’HS et l’étude SUNRISE comptait 543 patients. Dans chaque cas, les patients ont été répartis de manière aléatoire selon un rapport 1:1:1 pour recevoir 300 mg de sécukinumab toutes les 2 semaines (T2), 300 mg de sécukinumab toutes les 4 semaines (T4) ou un placebo. Le critère d’évaluation principal d’une réponse clinique selon le score HiSCR était défini comme une réduction ≥ 50 % du nombre de lésions inflammatoires sans augmentation du nombre d’abcès ou de fistules de drainage. De plus, les patients dont l’indice de douleur à l’échelle d’évaluation numérique (EEN) de référence était ≥ 3 (sur une échelle de 0 à 10) devaient obtenir une réduction de la douleur ≥ 30 % par rapport à la référence.
Les taux de réponse avec les doses T2 et T4 sont similaires
Les quatre groupes de traitement actif des deux études ont obtenu un taux de réponse ≥ 40 %. Pour le taux de réponse de 45 % dans le groupe T2 (p = 0,007) de SUNSHINE et le taux de réponse de 46,1 % dans le groupe T4 de SUNRISE (p = 0,002), les différences par rapport au placebo étaient très significatives sur le plan statistique. La réponse dans le groupe T2 de SUNRISE a également atteint la signification statistique (p = 0,0149). Dans le groupe T4 (p = 0,418), l’avantage du sécukinumab par rapport au placebo était juste en deçà d’un niveau de signification prédéfini à 16 semaines, mais la Dre Kimball a indiqué des déséquilibres dans la gravité de référence qui pourraient avoir joué un rôle. Nous en saurons davantage à mesure que les réponses sont suivies au cours des 36 semaines restantes de l’étude.
Bien que les données complètes des 52 semaines soient en cours d’analyse et ne soient pas encore prêtes pour la présentation, la Dre Kimball a fourni un aperçu en disant : « les résultats continuent de s’améliorer et nous sommes très enthousiastes ».
L’efficacité du sécukinumab contre l’HS a été reflétée dans tous les critères d’évaluation secondaires, y compris une réduction substantielle des lésions et de la douleur cutanées caractéristiques. Ces effets favorables expliqueront probablement l’avantage du sécukinumab pour les mesures de la qualité de vie à 16 semaines.
Réduction des poussées, des nodules et des abcès
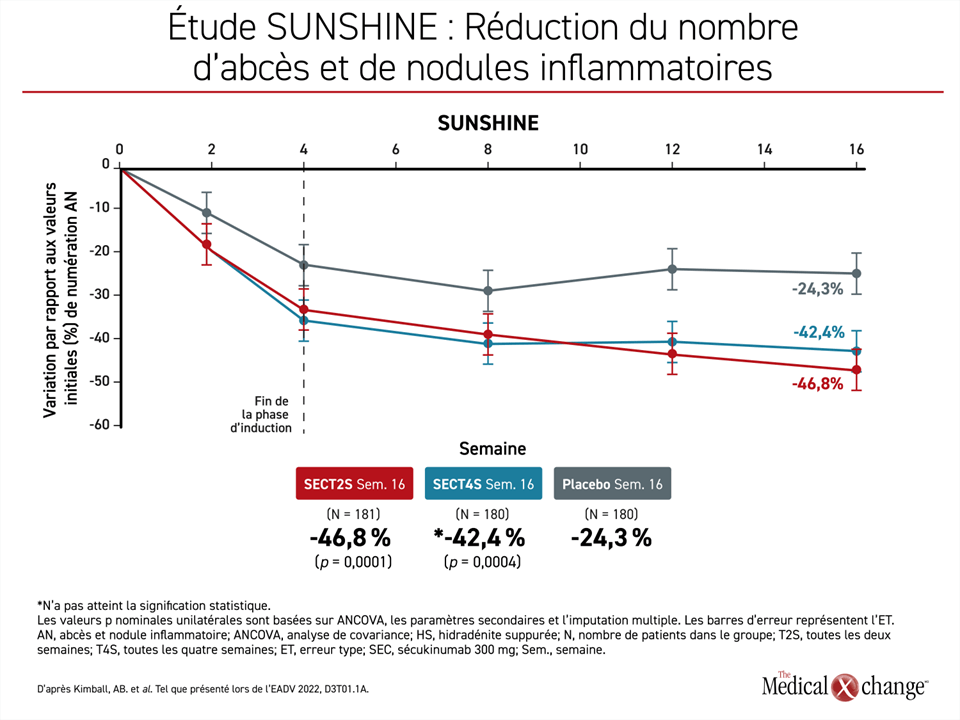
« Dans les deux études, la proportion de patients ayant présenté des poussées était plus faible avec le sécukinumab qu’avec le placebo à tous les points temporels entre la semaine 2 et la semaine 16 », a indiqué la Dre Kimball. De même, la réduction des abcès et du nombre de nodules inflammatoires dans les deux études a été observée presque immédiatement, atteignant la signification après 2 semaines dans les deux groupes de traitement actif par rapport au placebo. Les courbes de ces résultats ont continué de se séparer au cours du suivi avec des réductions globales environ deux fois plus importantes dans tout groupe recevant le sécukinumab que dans le groupe recevant le placebo à la semaine 16 (les valeurs p variaient de = 0,0051 à < 0,0001).
Le même type de schéma a été observé dans les courbes qui suivent les taux de poussées. Une séparation des courbes dans les deux études pour les groupes de traitement actif par rapport au placebo a été observée à la semaine 2, puis a augmenté avec le temps. À 16 semaines, la dose T2 par rapport au placebo était la plus efficace pour supprimer les poussées (15,4 % vs 29,0 % avec le placebo) dans l’étude SUNSHINE (figure 2). Bien que la dose T4 ait été la plus efficace (15,6 % contre 27,0 %) dans l’étude SUNRISE, les deux autres doses ont également réduit significativement le risque de poussées par rapport au placebo.
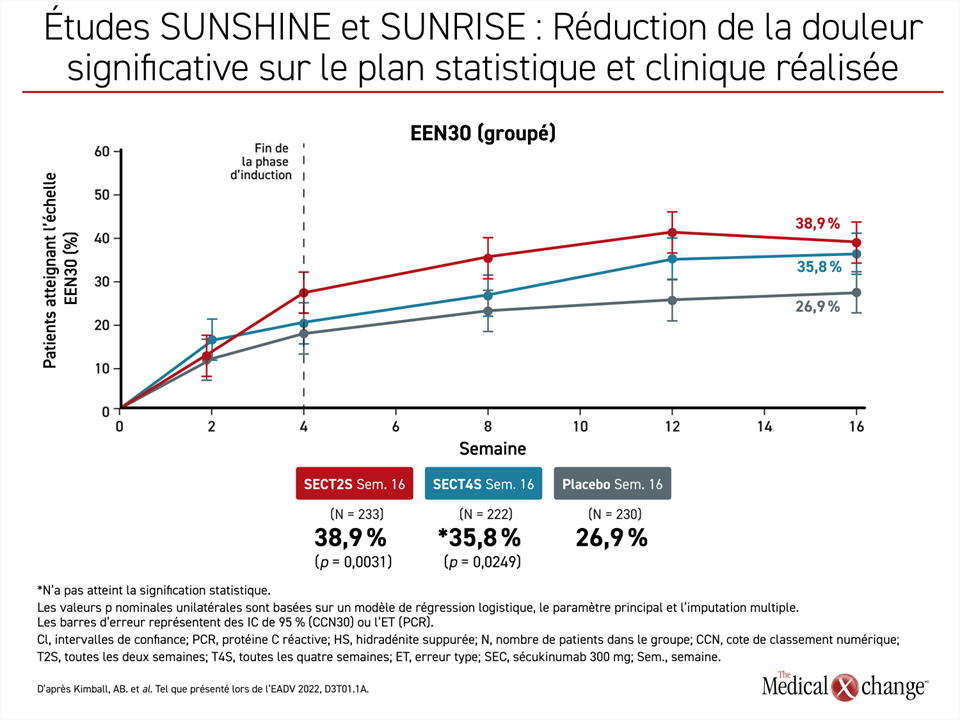
Réduction de la douleur observée dans les 2 semaines
En ce qui concerne la maîtrise de la douleur, la dose T2 (p = 0,0031) et la dose T4 (p = 0,0249) étaient significativement plus efficaces lorsqu’il s’agit d’une réduction ≥ 2 unités dans l’outil validé de l’évaluation globale de la douleur cutanée (Global Assessment of Skin Pain, GASP). Lorsqu’elle a été représentée sur le graphique, la différence dans l’analyse regroupée était apparente à la semaine 2, et un avantage supplémentaire était obtenu à la fin de la période de 16 semaines (figure 3).
« Je voudrais souligner cet avantage », a déclaré la Dre Kimball. « La douleur est un critère d’évaluation difficile à satisfaire dans les études cliniques, et nous avons constaté une réduction significative à la fois sur le plan statistique et clinique avec le sécukinumab. »
« La douleur est un critère d’évaluation difficile à satisfaire dans les études cliniques, et nous avons constaté une réduction significative sur le plan statistique et clinique. »
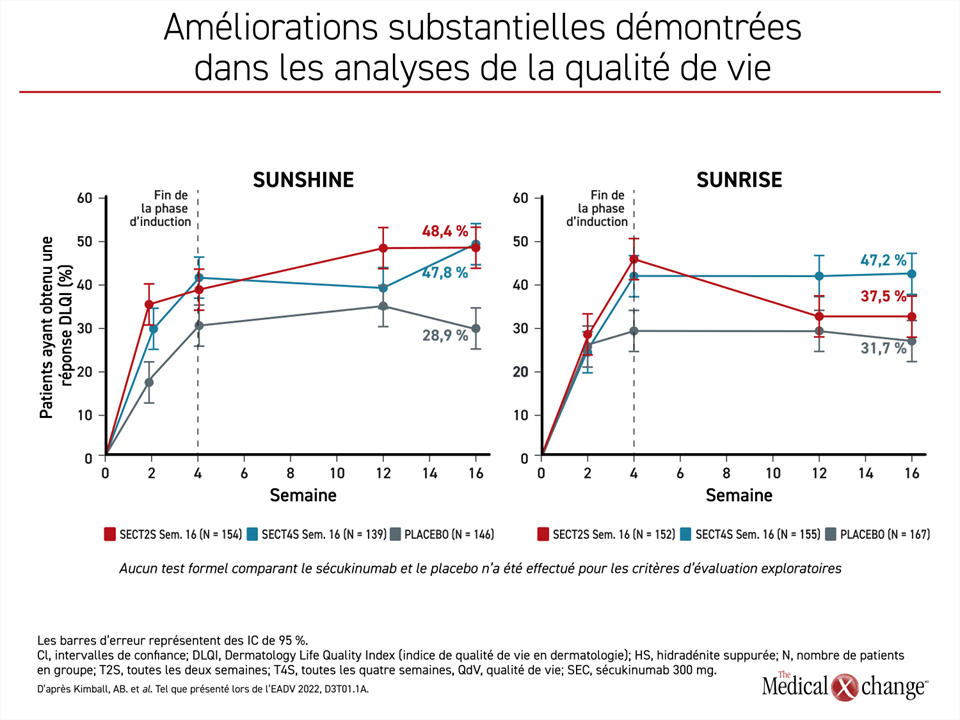
La réduction du fardeau de la maladie a été reflétée dans les analyses de qualité de vie réalisées avec l’indice de qualité de vie en dermatologie (DLQI, Dermatology Life Quality Index). Pour une amélioration significative du score DLQI sur le plan clinique, définie comme une réduction de ≥ 5 points, les scores étaient déjà nettement plus élevés dans les deux groupes de traitement actif par rapport au placebo de 2 semaines dans les deux études. Même si l’augmentation additionnelle à la semaine 4 a généralement été maintenue dans les deux groupes de l’étude SUNRISE, les scores de qualité de vie ont augmenté davantage à la semaine 16 par rapport à la semaine 4 de l’étude SUNSHINE (figure 4).
Population représentative inscrite
Les données démographiques initiales des études SUNSHINE et SUNRISE suggèrent que la population étudiée était représentative. Bien que la représentation féminine (56,3 %) ait été un peu plus faible que celle rapportée dans d’autres études et sondages sur l’HS, l’âge moyen de 36,2 ans est généralement cohérent avec l’âge maximal de l’activité. Environ 60 % des participants présentaient le stade 2 de Hurley au moment de leur admission, et le reste présentait le stade 3 de Hurley. Environ 10 à 15 % des patients recevaient des antibiotiques à action générale au moment de leur inscription. L’expérience antérieure avec les produits biologiques était permise et a été signalée par environ 25 % des patients. Le poids corporel moyen des personnes inscrites était supérieur à 90 kg, ce qui reflète la représentation importante des patients en surpoids et obèses.
Les antécédents d’HS depuis plus d’un an constituaient un critère d’admission, mais comme c’est le cas pour la population atteinte d’HS, la plupart des patients ont signalé que l’apparition des symptômes avait eu lieu au moins sept ans avant l’étude, malgré le fait que l’affection n’avait pas été diagnostiquée dans la plupart des cas jusqu’à récemment.
« Le retard de diagnostic est un problème fréquent lié à l’HS, et les données de cette étude à cet égard sont réellement encourageantes », a déclaré la Dre Kimball. Dans les études qu’elle a menées précédemment, le délai de diagnostic est généralement de 10 ans ou plus, ce qui suggère que nous commençons à mieux faire attention à ce trouble. »
Ajout des données sur l’HS au dossier d’innocuité du médicament à l’étude
Conformément à l’expérience acquise dans le cadre d’autres traitements contre la maladie par le sécukinumab, qui est indiqué pour le psoriasis et plusieurs formes d’arthrite, le médicament a été bien toléré.
« Il n’y a eu aucune surprise en matière d’innocuité. Nous en savons beaucoup sur le sécukinumab grâce aux études antérieures sur d’autres maladies, et le profil d’innocuité est très net dans l’ensemble », a déclaré la Dre Kimball.
« Il n’y a eu aucune surprise en matière d’innocuité. Nous en savons beaucoup sur le sécukinumab grâce aux études précédentes sur d’autres maladies. »
Alors que les événements indésirables globaux et les événements indésirables d’intérêt particulier ont été généralement cohérents entre les personnes réparties de manière aléatoire pour recevoir la dose de sécukinumab ou de placebo, cela a également été reflété dans les taux d’interruption. Le taux de rétention de l’étude était de 93 %, ce que la Dre Kimball a qualifié de « remarquable » si on prend en considération le fait que l’étude a été menée pendant la pandémie de COVID-19. Le taux d’interruption en raison des événements indésirables était inférieur à 3 % dans tous les groupes de l’étude.
Bien qu’il n’y ait eu aucune différence globale quant aux infections, « le taux de candidose n’était pas vraiment différent de celui observé avec le placebo, même chez les femmes relativement jeunes qui présentent un risque élevé de candidose vaginale », a affirmé la Dre Kimball.
Par rapport à de nombreuses maladies, un taux de réponse de 40 à 45 % pour le paramètre principal d’amélioration significative de la maladie peut sembler modeste, mais il est impressionnant dans le cas de l’HS, selon la Dre Kimball. Les plus récentes lignes directrices (Alikhan A. et al. J Am Acad Dermatol 2019;81:91-101) comprennent une longue liste de traitements potentiels, ce qui est nécessaire parce que les taux de réponse à un traitement donné sont généralement faibles. L’hétérogénéité de la réponse aux traitements contre l’HS est attribuable à des différences individuelles dans la physiopathologie contributive, qui comprennent les processus inflammatoires et les perturbations hormonales. La sensibilité génétique est susceptible de jouer un rôle chez au moins certains patients, mais il est maintenant considéré qu’il n’existe pas de traitement optimal pour tous les patients.
Les produits biologiques sont la pierre angulaire du traitement de l’HS
« Il y a une attention croissante aux phénotypes pour diriger le traitement, en particulier aux stades précoces ou lorsque les symptômes demeurent légers », a déclaré la Dre Kimball. Cependant, elle accepte les lignes directrices publiées, qui identifient les produits biologiques « comme la pierre angulaire du traitement de l’HS modérée à grave ».
Si ces données de l’étude de phase 3 mènent à l’approbation du sécukinumab pour l’HS, cet agent ciblant l’IL-17A rejoindra l’adalimumab, un inhibiteur du facteur de nécrose tumorale (TNF), en tant que deuxième agent biologique approuvé pour cette maladie. On ne peut pas déterminer à partir des données de SUNSHINE et de SUNRISE si l’IL-17A est une meilleure cible que le TNF pour maîtriser l’inflammation liée à l’HS, mais ces nouvelles données confirment qu’il s’agit d’une cible efficace. D’autres traitements pour cette maladie sont nécessaires de toute urgence, en particulier ceux qui présentent des manifestations modérées à graves.
« L’HS est devenue un domaine incroyablement actif en ce qui concerne la compréhension de la biologie sous-jacente », a affirmé la Dre Kimball. En validant une nouvelle cible pour la maîtrise de la maladie, elle considère que les études SUNSHINE et SUNRISE constituent un élément essentiel pour améliorer la maîtrise des symptômes.
Conclusion
Deux études multicentriques de phase 3 avec répartition aléatoire ont confirmé que l’IL-17A constituait une cible thérapeutique importante chez les patients atteints d’HS. Dans deux études de conception similaire, SUNSHINE et SUNRISE, le sécukinumab, un inhibiteur de l’IL-17A administré toutes les 2 ou 4 semaines par voie sous-cutanée, a réduit significativement l’atteinte cutanée et la douleur, et a amélioré globalement l’activité de l’HS à la fin des 16 semaines comparativement au placebo. Les résultats finaux à 52 semaines ne sont pas encore disponibles, mais on s’attend à ce que les avantages soient maintenus. Même en 16 semaines, l’effet du sécukinumab, qui a été bien toléré, s’est traduit par une meilleure qualité de vie.