Rhumatologie
Conférence Convergence de l’American College of Rheumatology (ACR) de 2022
Des agents biologiques freinent la progression radiographique de la spondylarthrite axiale pendant 2 ans
Philadelphie – Les nouvelles données probantes tirées de l’étude de phase III SURPASS, une étude terminée récemment et présentée lors de la conférence Convergence de 2022 de l’ACR, montrent que deux agents biologiques, soit un inhibiteur de l’IL-17 (iIL-17) et un inhibiteur du facteur de nécrose tumorale (iTNF), freinent la détérioration structurale imputable à la spondylarthrite axiale (SpAax). Au terme de 2 années de surveillance radiologique, les chercheurs n’auraient en effet observé aucune évolution de la maladie chez la plupart des patients, qu’ils aient reçu l’un ou l’autre de ces deux agents. L’étude ne comportait pas de groupe placebo, mais cette absence d’évolution rompt avec l’histoire naturelle de la SpAax. Même dans les quelques cas où la radiographie témoignait d’une progression, elle était toujours faible.
L’étude de phase III SURPASS a servi à comparer le sécukinumab, un iIL-17, à un biosimilaire à l’adalimumab, un iTNF (SDZ-ADL), chez des patients atteints de SpAax évolutive jamais traitée par un agent biologique. Pour y être admis, leurs clichés radiographiques devaient montrer une atteinte structurale (SpAax‑r). Lors d’études de phase III antérieures sur le sécukinumab et le médicament original, l’adalimumab, ces deux agents avaient exercé des effets cliniques positifs importants dans des cas de SpAax. C’est pourquoi ils sont déjà vus comme des traitements de première intention dans les principales lignes directrices, dont celles publiées conjointement par l’Assessment of SpondyloArthritis International Society et l’European League Against Rheumatism (ASAS/EULAR).
Pour une entrevue exclusive avec le Dr Louis Bessette couvrant l’impact sur la pratique clinique, cliquez ici.
Première comparaison directe d’agents biologiques opposés à la SpAax
« L’étude SURPASS est la première étude visant à comparer l’effet relatif de deux agents biologiques sur l’évolution de la SpAax-r visible à la radiographie spinale », a rapporté le chercheur principal, le Dr Xenofon Baraliakos, directeur médical du Centre de rhumatologie de l’Université de la Ruhr, à Bochum, en Allemagne.
« L’étude SURPASS est la première étude qui ait servi à comparer l’emploi de deux agents biologiques dans la prévention de la progression radiographique chez des patients atteints de SpAax-r. »
En l’absence de données issues d’études comparatives ou de longue durée sur des agents biologiques opposés à la SpAax, ces nouvelles données confirment que les deux agents empêchent la maladie d’évoluer. Fait important à noter, elles sont appuyées par des études de prolongation menées antérieurement avec de tels agents, dont une étude de phase III contrôlée par placebo sur le sécukinumab, qui a pris fin il y a plusieurs années au terme d’une longue période de suivi.
Pas de progression chez ~80 % des patients pendant une étude de prolongation
Une étude de prolongation menée chez des participants à l’étude MEASURE 1, puis suivis pendant 4 ans, a aussi révélé un ralentissement de la progression de la SpAax au fil de temps (Braun, J. et al. Rheumatology 2019;58:859-868). L’absence de progression y était définie comme une variation de moins de 2 points du score mSASSS (modified Stoke Ankylosing Spondylitis Spinal Score) enregistré au départ. Or, à 208 semaines, aucune progression radiographique n’a été observée chez 79 % des patients. La variation moyenne du score mSASSS pendant cette période de suivi a été de 1,8 et 1,2 point dans les groupes sécukinumab à 75 et à 150 mg (administré toutes les 4 semaines). En regard d’un examen de l’utilité clinique du score mSASSS (van der Heijde, D. et al. Rheumatology 2019;58:388-400), ce sont là des taux d’évolution faibles.
Lors de l’étude SURPASS, 859 patients atteints de SpAax-r jamais traitée par un agent biologique ont été affectés aléatoirement à l’une des deux doses de sécukinumab (150 mg ou 300 mg) ou à du SDZ-ADL à 40 mg. Pour y être admis, ils devaient afficher un indice BASDAI (Bath Ankylosing Spondylitis Disease Activity Index) de 4 ou plus, un score minimal de 4 sur une échelle de 0 à 10 pour la douleur rachidienne et un score total de 40 mm ou plus sur une échelle de 0 à 100 mm pour la dorsalgie. De plus, ils devaient déjà être très exposés à une progression radiographique de leur maladie, ce dont témoignaient leur taux de protéine C-réactive (hsCRP) d’au moins 5 mg/L mesuré par une méthode très sensible ou la présence d’au moins un syndesmophyte décelé à la radiographie.
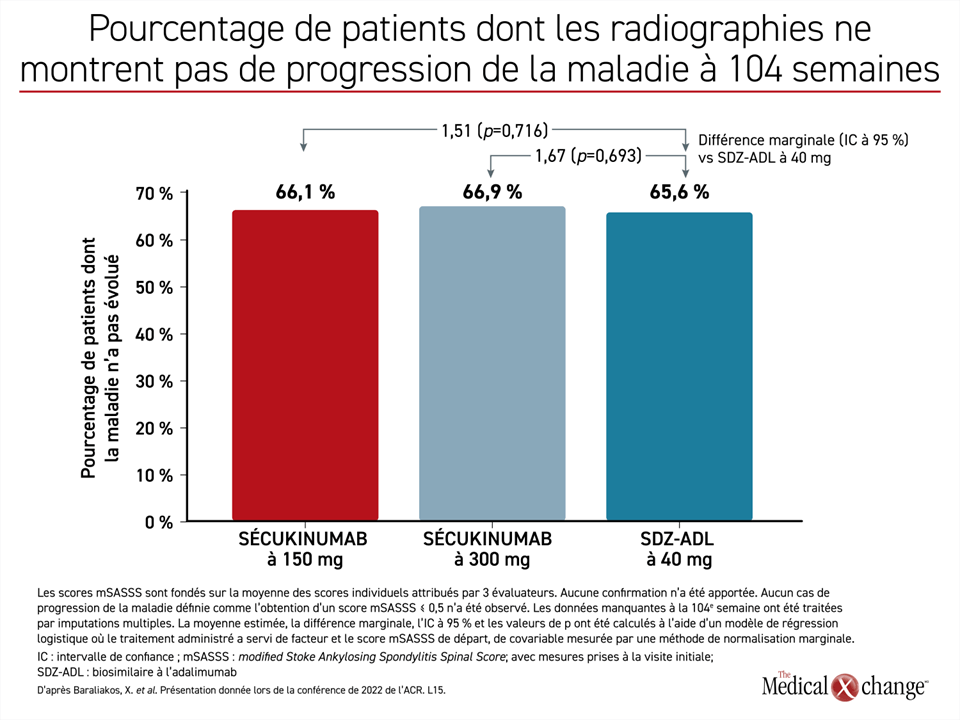
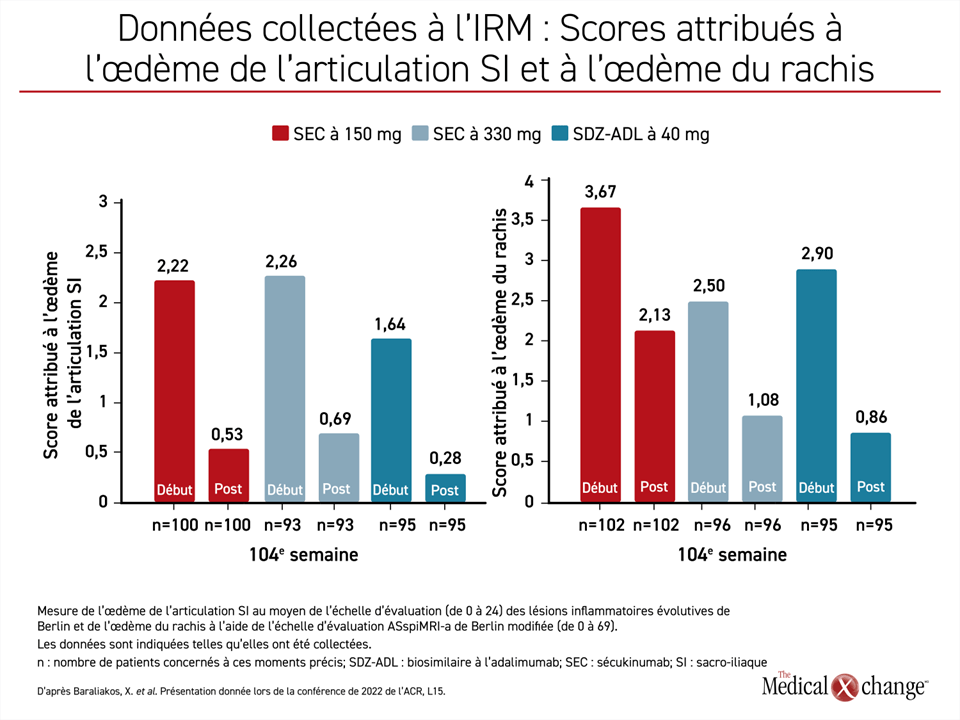
L’absence de progression radiographique, qui était définie comme l’obtention d’un score mSASSS maximal de 0,5 à 104 semaines, faisait office de paramètre d’évaluation principal. Son analyse a été confiée à trois évaluateurs indépendants centralisés travaillant à l’insu. La variation du score mSASSS chez les patients qui présentaient d’emblée au moins un syndesmophyte faisait partie des paramètres d’évaluation secondaires. Étaient également prévues au protocole l’analyse de la variation de l’indice de Berlin pour l’articulation sacro-iliaque (SI) mesuré par IRM et celle du score ASspiMRI-a (AS Spine MRI-activity) qui permet de quantifier les lésions vertébrales inflammatoires.
Un avantage numérique pour l’iIL-17
La proportion de patients ayant reçu l’une ou l’autre des doses de sécukinumab, dont la maladie n’avait pas progressé après 104 semaines, était numériquement plus élevée que celle du groupe traité par le biosimilaire à l’adalimumab, mais les différences marginales de 1,51 et de 1,67 calculées pour les doses de 150 mg et de 300 mg n’étaient pas statistiquement significatives (figure 1).
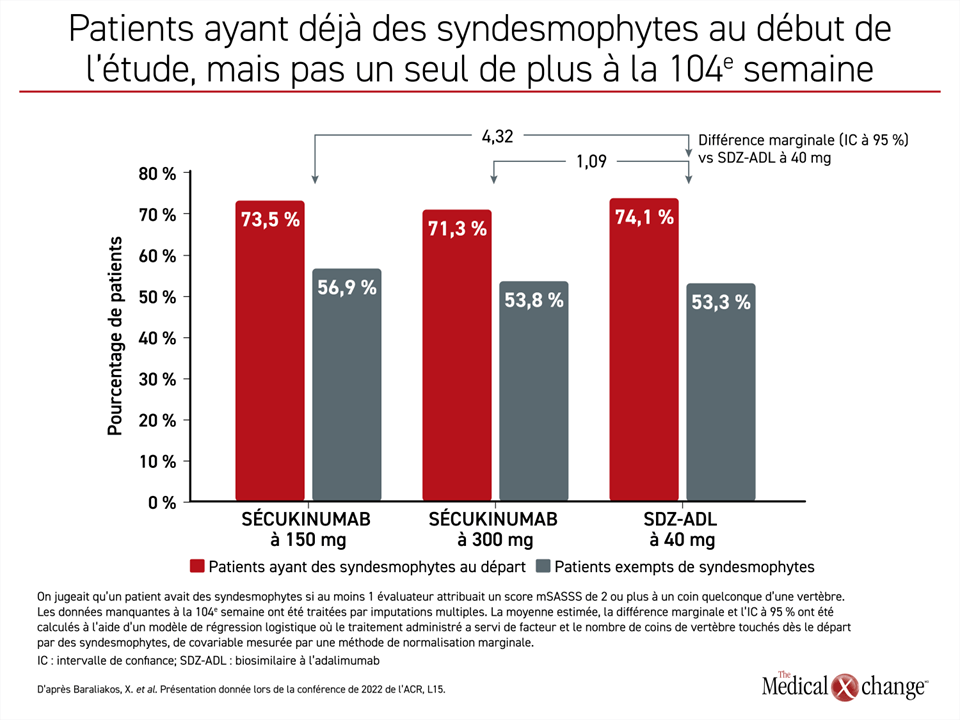
Dans le sous-groupe de patients ayant déjà des syndesmophytes au début de l’étude (73 %), la proportion de ceux qui étaient exempts de nouveaux syndesmophytes à la 104e semaine était numériquement plus élevée chez les sujets traités par l’une ou l’autre des doses de sécukinumab que chez ceux ayant reçu le SDZ-ADL. En outre, les différences marginales, qui étaient à l’avantage des doses de sécukinumab par rapport au biosimilaire à l’adalimumab, étaient non significatives (figure 2).
Au début de l’étude, les principales caractéristiques des 3 groupes de sujets se ressemblaient toutes. L’âge médian y était de 42 ans environ, près de 80 % des sujets étaient des hommes et l’indice de masse corporelle médian s’élevait à 27 à peu près. De plus, le score mSASSS médian (16,6) et le nombre médian de syndesmophytes (7,0) étaient similaires dans les 3 groupes. Les scores BASFI (6,6) et BASDAI (7,1) médians, également semblables au début de l’étude, rendaient compte d’une maladie modérée ou grave. Le taux de hsCRP médian se chiffrait à 20,4 mg/L et un peu plus de 80 % des sujets ont eu un résultat positif au dépistage du HLA-B27.
Les fortes baisses des scores attribués à l’œdème de l’articulation SI et à l’œdème du rachis par rapport aux valeurs initiales témoignent de l’effet anti-inflammatoire marqué et soutenu des agents biologiques (figure 3). Elles n’ont pas été directement corrélées aux faibles taux d’évolution de la maladie obtenus avec le sécukinumab ou le biosimilaire à l’adalimumab, mais elles sont logiques compte tenu du rôle joué par une inflammation persistante dans la détérioration des articulations et l’évolution de la maladie.
« Les fortes baisses des scores attribués à l’œdème de l’articulation sacro-iliaque et à l’œdème du rachis par rapport aux valeurs initiales témoignent de l’effet anti-inflammatoire marqué et soutenu des agents biologiques. »
Des données sur l’innocuité qui cadrent avec les bilans d’innocuité bien établis
La nature et la fréquence des effets indésirables objectivés pendant l’étude SURPASS cadraient avec les bilans d’innocuité et de tolérabilité dressés pour ces agents. La rhinopharyngite, qui a été signalée chez 16,4 %, 14,0 % et 15,4 % des sujets traités respectivement par le sécukinumab à 150 mg et à 300 mg, et par le SDZ-ADL, a été l’effet indésirable rapporté le plus souvent. L’incidence d’effets indésirables graves était faible et semblable d’un groupe à l’autre.
Au bout de 2 ans, la maladie a évolué chez seulement le tiers environ des sujets traités par les agents biologiques de l’étude SURPASS, mais il est aussi important de noter que cette évolution, lorsqu’elle était décelée, était légère et moins prononcée que celle escomptée chez des patients non traités ou recevant des antirhumatismaux de fond classiques. Donc, indépendamment donc du faible taux moyen de progression de la maladie, « dans l’ensemble, la progression radiographique a été de faible ampleur », a déclaré le Dr Baraliakos.
« Dans l’ensemble, la progression radiographique a été de faible ampleur ».
L’étude visait à vérifier l’hypothèse selon laquelle le sécukinumab offrirait au fil du temps une protection nettement plus grande contre l’atteinte structurale que le biosimilaire à l’adalimumab, ce qui ne s’est pas confirmé, mais elle a démontré que les deux agents biologiques avaient permis de prévenir efficacement la détérioration graduelle des articulations pendant 104 semaines. Il se peut qu’une période de suivi plus longue permette de constater qu’ils exercent des bienfaits relatifs semblables, ou pas. Cela dit, les données tirées de l’étude de prolongation de l’étude MEASURE 1, qui a duré 4 ans et dont le Dr Baraliakos était un des auteurs, donnent un bon aperçu de la trajectoire de la SpAax chez des patients suivant un traitement d’entretien par un iIL-17 pendant plus de 2 ans.
Résultat de l’étude de prolongation de 4 ans : la progression est lente
Quelque 274 des sujets de l’étude MEASURE 1 ont participé à l’étude de prolongation jusqu’à la fin des 208 semaines de suivi, fournissant ainsi des données à long terme sur environ 90 % des sujets recrutés dans les groupes traités par le sécukinumab à 75 ou à 150 mg lors de l’étude de phase III menée à l’insu. Au terme des 208 semaines, la maladie n’avait pas évolué chez 78,6 % et 78,9 % des patients ayant suivi un traitement d’entretien à 75 mg ou à 150 mg. Les évaluations réalisées à 104 et à 208 semaines ont fait ressortir des variations numériquement plus faibles des scores mSASSS dans le groupe à 150 mg.
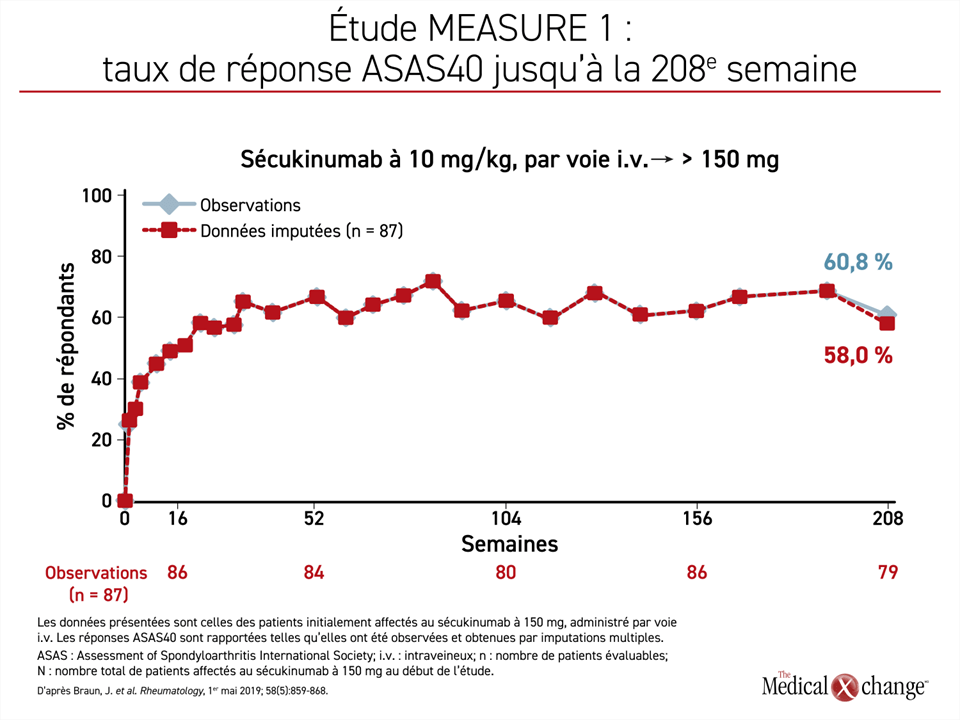
Ce suivi de longue durée a aussi permis de confirmer des gains soutenus pour les autres critères de jugement, dont le paramètre principal de l’étude MEASURE 1, la réponse ASAS20, qui rend compte d’une amélioration clinique minimale de 20 % d’au moins 3 des 4 domaines de résultat dans les cas de SpAax (fonctionnement physique, évaluation globale de la raideur rachidienne par le patient et mobilité rachidienne). À la publication des résultats, 61 %, 60 % et 29 % des sujets affectés aléatoirement au sécukinumab à 150 mg, au sécukinumab à 75 mg et au placebo affichaient une réponse ASAS20.
L’évaluation menée à 208 semaines a montré que le pourcentage de sujets affichant une réponse ASAS20 ne s’était pas seulement maintenu, mais qu’il avait légèrement augmenté, passant à 79,7 %. Pour ce qui est de l’objectif plus ambitieux qu’est la réponse ASAS40, les données collectées à 16 semaines révèlent que les taux ont aussi augmenté rapidement et qu’ils ont poursuivi sur leur lancée pendant plus d’une année de traitement au terme de laquelle on n’a plus enregistré de gains, mais pas de déclin majeur non plus pendant le reste du suivi (figure 4). À la 208e semaine, 60,8 % des sujets avaient obtenu une réponse ASAS40, soit à peu près le même pourcentage que celui enregistré à la 104e semaine.
Des résultats en concordance avec les lignes directrices actualisées
La possibilité de prévenir la progression de la maladie à 4 ans pendant l’étude de prolongation de l’étude MEASURE 1 constitue une rupture importante avec les études antérieures menées chez des patients atteints de SpAax traités par un iTNF pendant 2 ans. Lorsque la progression radiographique observée chez ces patients a été comparée à celle de témoins historiques dans le cadre de ces études, les résultats ont le plus souvent indiqué qu’il n’y avait eu aucune protection relative contre ce type d’évolution. Seule exception : une étude sur le certolizumab, un autre iTNF, qui a été relié à de faibles taux de progression de la SpAax à 4 ans.
Les faibles taux d’évolution observés à 4 ans avec le sécukinumab au cours de l’étude de prolongation de l’étude MEASURE 1 ont jeté les bases de l’étude SURPASS. Même si elle n’a pas confirmé que le sécukinumab protège mieux les patients contre les lésions visibles à la radiographie que l’iTNF, l’agent auquel il était comparé, il demeure qu’elle a confirmé que ces agents biologiques agissent sur le cours de la maladie. Dans leurs lignes directrices actuelles, l’ASAS et l’EULAR jugent que les iIL-17 et les iTNF peuvent être utilisés indifféremment aux fins de maîtrise immédiate de la SpAax chez la plupart des patients, mais ces organismes reconnaissent que les iIL‑17 sont privilégiés chez les patients qui sont aussi atteints de psoriasis ou d’autres symptômes cutanés et que les iTNF le sont chez ceux aux prises avec une maladie inflammatoire de l’intestin concomitante. Cela dit, la préservation de l’intégrité structurale objectivée sur un long laps de temps constitue un critère décisif sur lequel une norme thérapeutique doit reposer.
Conclusion
![]() L’étude SURPASS est la première étude qui ait directement opposé deux agents biologiques destinés à maîtriser la progression radiographique de la SpAax. Bien que le sécukinumab, un iIL-17, ait marqué un léger avantage numérique pour ce qui est du paramètre d’évaluation principal, comme en témoignaient les scores mSASSS au bout de 2 années de traitement, les différences n’étaient pas statistiquement significatives, d’où la validation de l’utilité des deux agents pour prévenir la détérioration structurale graduelle. Pendant ces 2 années, les chercheurs n’ont noté aucune évolution importante de la maladie sur les radiographies de près des deux tiers des patients, peu importe l’agent biologique auquel ils avaient été affectés aléatoirement. Dans les cas où il y avait progression, elle était faible. Ces données confirment que ces agents biologiques agissent favorablement sur l’histoire naturelle d’une maladie risquant fort d’entraîner une incapacité majeure.
L’étude SURPASS est la première étude qui ait directement opposé deux agents biologiques destinés à maîtriser la progression radiographique de la SpAax. Bien que le sécukinumab, un iIL-17, ait marqué un léger avantage numérique pour ce qui est du paramètre d’évaluation principal, comme en témoignaient les scores mSASSS au bout de 2 années de traitement, les différences n’étaient pas statistiquement significatives, d’où la validation de l’utilité des deux agents pour prévenir la détérioration structurale graduelle. Pendant ces 2 années, les chercheurs n’ont noté aucune évolution importante de la maladie sur les radiographies de près des deux tiers des patients, peu importe l’agent biologique auquel ils avaient été affectés aléatoirement. Dans les cas où il y avait progression, elle était faible. Ces données confirment que ces agents biologiques agissent favorablement sur l’histoire naturelle d’une maladie risquant fort d’entraîner une incapacité majeure.