Hématologie
64e réunion annuelle et exposition de l’American Society of Hematology (ASH)
Étude comparative directe ALPINE : un inhibiteur de la BTK de deuxième génération opposé à la LLC est plus efficace et plus sûr
Nouvelle-Orléans — L’étude ALPINE a permis de confirmer qu’un inhibiteur de la tyrosine kinase de Bruton (iBTK) de deuxième génération fait preuve d’une efficacité et d’une innocuité supérieures à celle d’un iBTK de première génération dans le traitement des formes réfractaires ou récidivantes de la leucémie lymphoïde chronique (LLC) et du lymphome à petits lymphocytes (LPL). Lorsqu’il a été comparé à un iBTK de première génération qui a révolutionné la maîtrise de la LLC, cet iBTK de deuxième génération a permis d’obtenir des taux de réponse encore plus élevés et une survie sans progression (SSP) beaucoup plus longue. Une baisse du risque d’effets indésirables a aussi été attribuée à la sélectivité de cet agent de deuxième génération. Aucune étude n’avait jusqu’alors opposé deux iBTK et démontré la supériorité de l’un sur l’autre en matière d’efficacité clinique.
L’auteure principale de l’étude internationale ALPINE, la Dre Jennifer R. Brown, directrice du Centre de la LLC, à l’Institut du cancer Dana-Farber, de Boston, au Massachusetts, a qualifié de « révolutionnaires » les données qui en ont été tirées et qui ont fait l’objet d’une présentation de dernière heure lors du congrès de 2022 de l’ASH. Parce qu’elle a mis au jour l’augmentation des bienfaits cliniques et la diminution du risque d’effets collatéraux produites par le zanubrutinib, un iBTK de deuxième génération, l’étude ALPINE hisse cet agent au rang de stratégie dominante pour le traitement des formes réfractaires ou récidivantes de la LLC/LPL. Le zanubrutinib a donné de meilleurs résultats que l’ibrutinib, l’iBTK de première génération auquel il était comparé, dans tous les sous-groupes prévus au protocole.
Pour une entrevue exclusive avec le Dr Christopher Lemieux couvrant l’impact sur la pratique clinique, cliquez ici.
Questionnée sur le positionnement possible de l’ibrutinib maintenant que les résultats de l’étude ALPINE sont connus, la Dre Brown a répondu : « Je ne vois pas à quel type de patients (atteints d’une forme réfractaire ou récidivante de la LLC/LPL) j’envisagerais désormais de prescrire de l’ibrutinib plutôt que du zanubrutinib ».
Lors de l’étude ALPINE, 652 patients de 113 établissements participants situés dans 15 pays différents ont été répartis aléatoirement de façon à recevoir 160 mg de zanubrutinib deux fois par jour ou 420 mg d’ibrutinib une fois par jour. Toute utilisation antérieure à un iBTK constituait un motif d’exclusion majeur. Les facteurs de stratification comprenaient : âge, région géographique et caractéristiques définissant une maladie très vulnérante. Tous les patients devaient avoir déjà reçu au moins un traitement et leur adénopathie devait être mesurable.
Les données définitives de l’étude ALPINE témoignent d’une augmentation du taux de réponse global (TRG)
Une analyse intermédiaire présentée précédemment nous a renseignés sur le TRG, le paramètre d’évaluation principal de l’étude ALPINE. À 15 mois, il s’élevait à 78,3 % et à 62,5 % chez les sujets affectés respectivement au zanubrutinib et à l’ibrutinib (p < 0,001). Or l’avantage relatif du zanubrutinib était encore plus grand pour les TRG mesurés dans les sous-groupes de patients aux caractéristiques très vulnérantes, telles que la mutation du gène TP53 et la délétion 17p (83,3 % vs 53,8 %) ou la délétion 11q (83,6 % vs 69,1 %). La présentation de dernière heure des données actualisées recueillies chez tous les patients recrutés a fait état d’un avantage statistique encore plus marqué pour le zanubrutinib à ce chapitre (86,2 % vs 75,7 %; p = 0,0007).
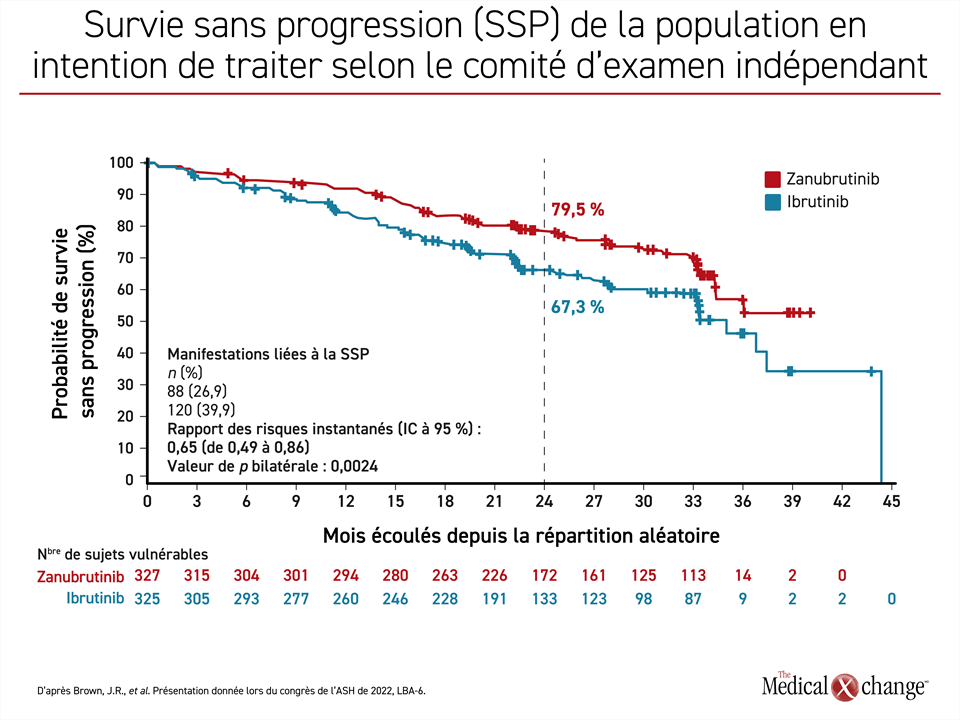
Après un suivi médian de 29,6 mois, la SSP médiane n’est toujours pas atteinte dans le groupe zanubrutinib, alors qu’elle se chiffre à 35 mois dans le groupe ibrutinib, d’où une baisse du risque de progression de la maladie ou de décès de 35 % (RRI : 0,65; p = 0,0024) à l’avantage du zanubrutinib. À 24 mois, 79,5 % et 67,3 % des sujets affectés respectivement au zanubrutinib et à l’ibrutinib étaient toujours en vie et indemnes de toute progression de leur maladie, les chercheurs et les membres du comité d’examen indépendant étant arrivés à un résultat similaire en la matière (figure 1).
Les groupes de sujets plus vulnérables affichent une amélioration encore plus marquée
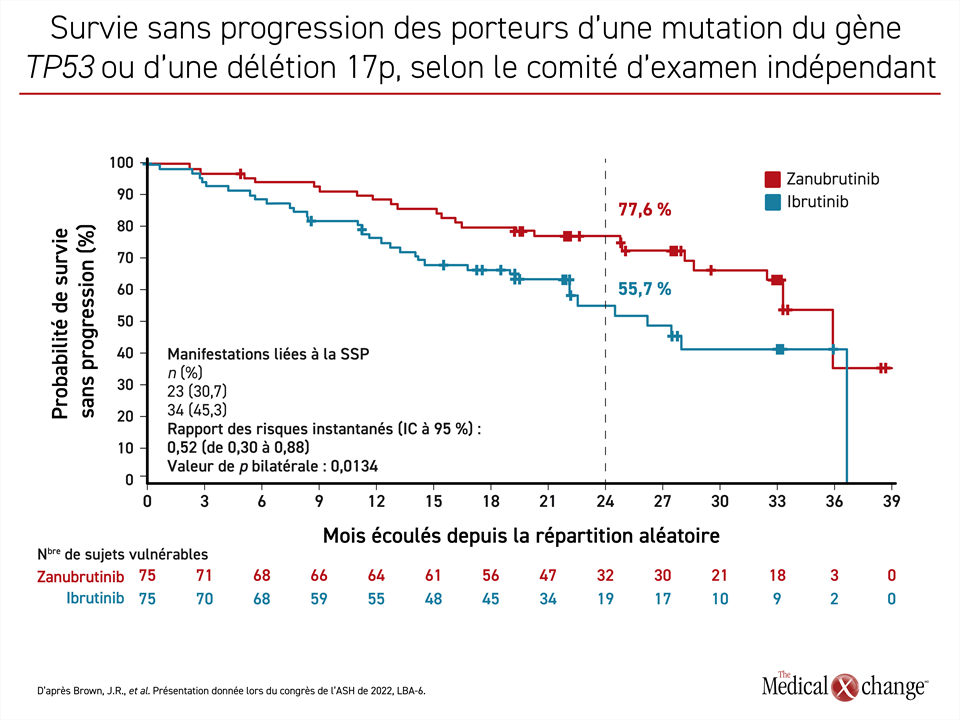
Le zanubrutinib a eu un avantage relatif encore plus marqué dans les groupes de sujets plus vulnérables. Par exemple, la SSP enregistrée à 24 mois chez les porteurs de la délétion 17p ou d’une mutation du gène TP53 traités par le zanubrutinib (77,6 %) avoisinait celle obtenue dans l’ensemble de l’effectif à l’étude, alors que celle observée dans le groupe ibrutinib (55,7 %) était beaucoup plus courte. Résultat : comparativement à l’ibrutinib, le zanubrutinib a offert à ces patients très vulnérables une protection relative contre l’évolution de leur maladie ou leur décès approchant les 50 % (RRI : 0,52; p = 0,0134) (figure 2). En outre, 73 % des patients traités par le zanubrutinib suivent toujours leur traitement contre 58 % de ceux affectés à l’ibrutinib.
La plus grande sélectivité pour la BTK pourrait expliquer le bilan d’innocuité favorable
Selon la Dre Brown, la plus grande sélectivité du zanubrutinib pour la BTK explique probablement les taux de réponse plus élevés et la maîtrise de la maladie plus durable observés pendant l’étude ALPINE, mais aussi son bilan d’innocuité plus favorable, dont un risque de cardiotoxicité nettement plus bas. Il est probable que la plus grande efficacité du zanubrutinib soit aussi imputable à cette innocuité et cette tolérabilité plus marquées, qui sont des traits distinctifs majeurs de cet agent.
« Les taux d’abandons du traitement par l’ibrutinib pour cause d’effets indésirables oscillaient entre 16 et 23 % d’une étude à l’autre », a affirmé la Dre Brown. La sélectivité d’un agent pour la BTK est importante pour quiconque tente de maîtriser la LLC/LPL, puisqu’il s’agit de bloquer une voie de signalisation majeure pour l’expansion et la prolifération des cellules tumorales. Plus la sélectivité pour la voie de signalisation de la BTK est grande, plus faible est l’activité exercée sur les autres voies, celle-ci étant responsable des effets limitant la dose administrée et des effets collatéraux intolérables.
« Les taux d’abandons du traitement par [l’iBTK de première génération] pour cause d’effets indésirables oscillaient entre 16 et 23 % d’une étude à l’autre. »
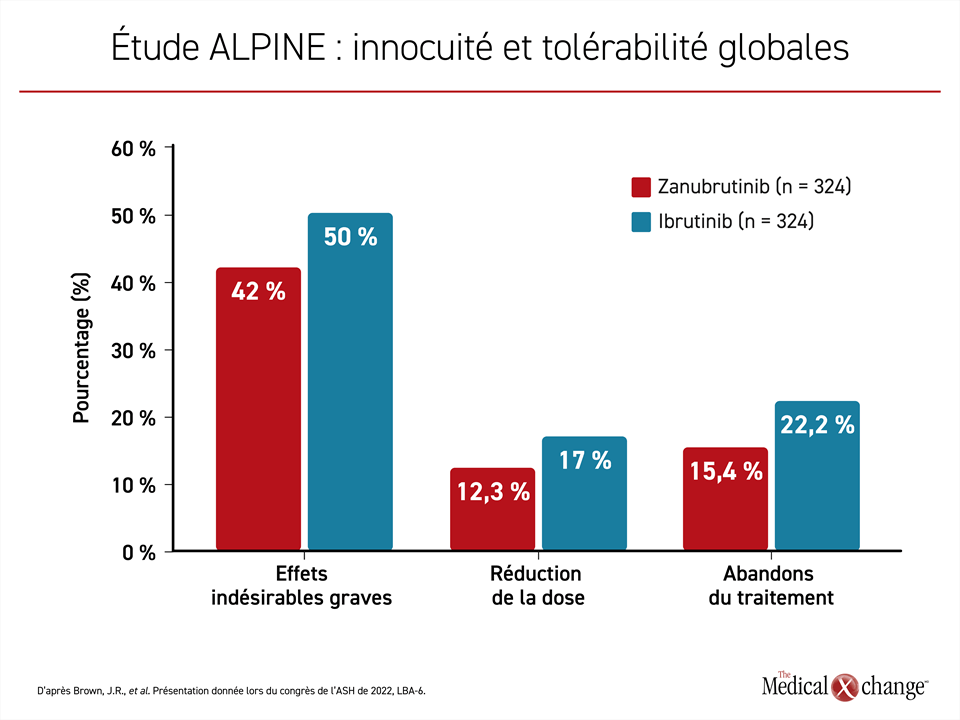
Au terme d’un traitement d’une durée médiane de 28,4 mois dans le groupe zanubrutinib et de 24,3 mois dans le groupe ibrutinib, la proportion de patients aux prises avec des effets indésirables graves (42,0 % vs 50,0 %), des effets indésirables de grade ≥ 3 (67,3 % vs 70,4 %) et des effets indésirables motivant une réduction de la dose (12,3 % vs 17,0 %) était inférieure avec le zanubrutinib, ce qui cadre avec le taux d’abandons plus faible observé avec cet agent (15,4 % vs 22,2 %) (figure 3). Les cas de neutropénie étaient plus répandus avec le zanubrutinib qu’avec l’ibrutinib (28,4 % vs 21,7 %), mais les taux d’infection étaient semblables.
Les incidents cardiaques étaient moins fréquents avec cet inhibiteur de la BTK de deuxième génération
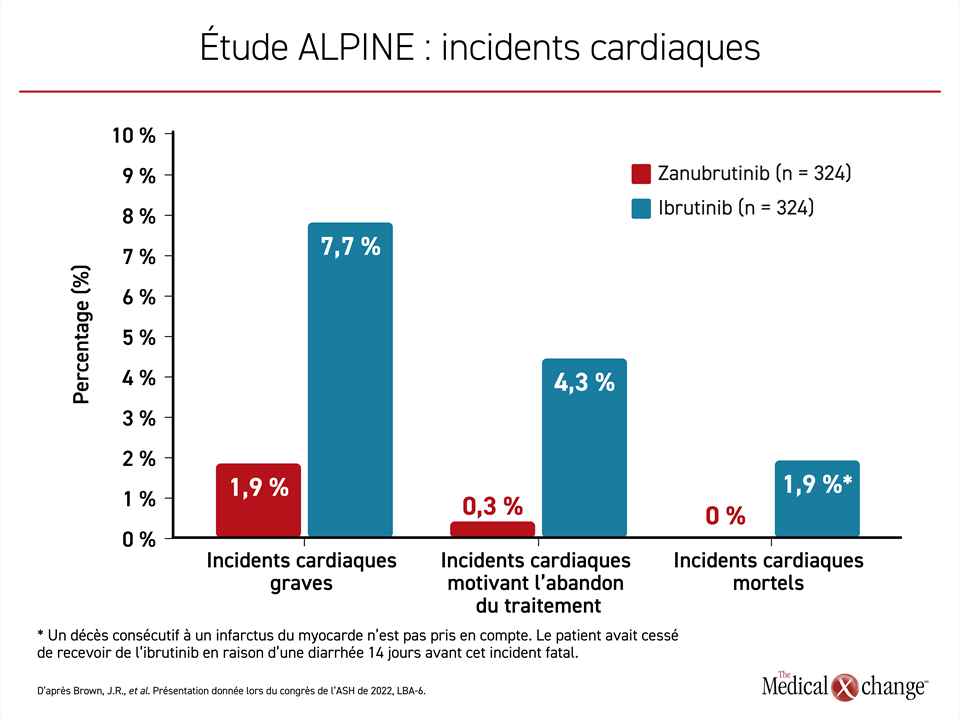
À propos des effets indésirables d’intérêt, il faut savoir que les incidents cardiaques ont été moins répandus dans l’ensemble chez les sujets traités par le zanubrutinib que chez ceux ayant reçu l’ibrutinib (21,3 % vs 29,6 %) et que ceux qui sont survenus avaient tendance à être plus légers. Notons, entre autres, une baisse du risque d’incidents cardiaques graves (1,9 % vs 7,7 %), d’incidents cardiaques menant à l’abandon du traitement (0,3 % vs 4,3 %) et de décès d’origine cardiaque (0 % vs 1,9 %) (figure 4). Dans le groupe ibrutinib, la fibrillation auriculaire, la fibrillation ventriculaire, l’insuffisance cardiaque et l’arrêt cardiaque ont été les incidents justifiant l’abandon du traitement. Dans le groupe zanubrutinib, le seul incident cardiaque ayant mené à l’abandon du traitement a été une extrasystole ventriculaire.
Le zanubrutinib a récemment été homologué en Europe pour le traitement de la LLC/LPL. Au Canada, il est actuellement homologué pour le traitement de la macroglobulinémie de Waldenström, du lymphome de la zone marginale et du lymphome à cellules du manteau. Mentionnant que certains organismes, tels que le National Comprehensive Cancer Network (NCCN), ont déjà intégré les inhibiteurs de deuxième génération aux algorithmes de traitement recommandés dans leurs lignes directrices, la Dre Brown se dit convaincue que l’étude ALPINE entraînera l’homologation de cette indication de chaque côté de la frontière.
Elle a ajouté : « Le zanubrutinib et l’acalabrutinib font partie des agents privilégiés pour le traitement de la LLC/LPL dans les lignes directrices actuelles du NCCN. L’ibrutinib y est désormais vu comme une solution de rechange ».
Les inhibiteurs de la BTK de deuxième génération ne sont pas tous identiques
Tout comme le zanubrutinib, l’acalabrutinib fait preuve d’une grande sélectivité pour la BTK, mais ces deux agents de deuxième génération ne sont pas forcément interchangeables. Lors d’une étude de phase III multinationale intitulée ELEVATE-RR, dont la publication des résultats remonte à près de 2 ans (Byrd, J. et al. J Clin Oncol 2021;39:3441-3452), l’acalabrutinib l’a aussi emporté sur l’ibrutinib pour ce qui est de l’innocuité dans le traitement des formes réfractaires ou récidivantes de la LLC/LPL, mais pas pour la SSP.
Côté innocuité, les abandons du traitement toutes causes confondues (14,7 % vs 21,3 %) et ceux imputables à un incident cardiaque, notamment la fibrillation auriculaire (0 % vs 20,0 %), ont été moins fréquents avec l’acalabrutinib. Quant à la durée médiane de la SSP, un paramètre d’évaluation de cette étude, elle se chiffrait à 38,4 mois dans les deux groupes après un suivi médian de 40,9 mois. Le recrutement des participants à l’étude ELEVATE-RR était réservé aux patients porteurs de la délétion 17p ou de la délétion 11q, alors que la sélection des sujets de l’étude ALPINE ne comportait aucune restriction rattachée à l’ampleur du risque.
« C’est difficile de comparer des médicaments ayant fait l’objet d’études différentes », a déclaré la Dre Brown. Elle a toutefois fait remarquer que les chercheurs de l’étude ALPINE se sont également penchés sur le sous-groupe de sujets très vulnérables, tel qu’il était prévu au protocole. Ils avaient posé comme hypothèse que la plus grande sélectivité de l’iBTK de deuxième génération pour sa cible se traduirait par des bienfaits cliniques plus importants que ceux de l’iBTK de première génération, même si cela n’avait pas été le cas pendant l’étude ELEVATE-RR.
Les CI50 de l’agent de première génération ne sont pas soutenues
Hormis leur sélectivité relative, plusieurs autres traits distinctifs des iBTK peuvent avoir de l’importance, que l’on compare des agents de première et de deuxième génération ou encore des agents de deuxième génération entre eux, notamment leurs caractéristiques pharmacocinétiques, celles-ci ayant un lien avec l’occupation des sites de liaison à la BTK. Pour souligner les différences entre le zanubrutinib et l’ibrutinib, par exemple, la Dre Brown a juxtaposé les graphiques représentant leur concentration inhibitrice à 50 % (CI50). Or la fraction libre plasmatique de l’ibrutinib est inférieure à l’CI50 pendant une bonne partie de la journée, même avec une dose uniquotidienne de 560 mg, une dose supérieure à la normale. En revanche, les concentrations de zanubrutinib mesurées après l’administration d’une dose de 160 mg deux fois par jour, ou même de 320 mg une fois par jour, ne chutent pas sous l’CI50 sur une période de 24 heures.
« Un des problèmes de l’ibrutinib, c’est la continuité de l’exposition à cet agent entre deux doses successives », a déclaré la Dre Brown, qui a ajouté que ce pourrait être problématique compte tenu de l’efficacité inférieure de l’ibrutinib indépendamment de sa sélectivité relative plus faible pour la BTK.
La Dre Brown ne croit pas que l’avantage affiché par le zanubrutinib pendant l’étude ALPINE peut être extrapolé à l’acalabrutinib, même s’il s’agit d’iBTK de deuxième génération dans les deux cas. Elle s’appuie pour dire cela sur les résultats divergents des études ALPINE et ELEVATE-RR de même que sur l’importance que peuvent prendre d’autres différences entre ces agents, comme leur sélectivité relative pour la BTK et leurs caractéristiques pharmacocinétiques. Il n’existe pas de comparaison directe et à grande échelle de ces agents, mais les résultats obtenus pour les interactions médicamenteuses, les taux de certains effets indésirables et d’autres variables d’importance clinique ne sont pas comparables d’une étude à l’autre.
Bien que l’étude ALPINE ait porté sur l’administration de 160 mg de zanubrutinib deux fois par jour, les données pharmacocinétiques autorisent le recours à une dose de 320 mg une fois par jour chez les patients préférant un schéma posologique plus simple, surtout si l’observance du traitement risque de laisser à désirer. De plus, certains types d’interactions médicamenteuses risquent relativement peu de survenir avec le zanubrutinib, notamment celles pouvant se produire avec les inhibiteurs de la pompe à protons ou les anticoagulants, qui compliquent le traitement par certains iBTK. Certes les données sur l’innocuité du zanubrutinib recueillies pendant la période de suivi de l’étude ALPINE sont rassurantes, mais il demeure que le bilan d’innocuité et de tolérabilité de cet agent avait déjà été établi à la suite de son utilisation contre le lymphome à lymphocytes B, une de ses indications actuelles.
Un inhibiteur de la BTK de deuxième génération se révèle efficace en première intention
En Europe, le zanubrutinib a été homologué en première intention et pour les formes réfractaires ou récidivantes de la LLC/LPL à la lumière des résultats de l’étude multinationale de phase III SEQUOIA dont la publication remonte à 6 mois environ (Tam, C.S. et al. Lancet Oncology 20-22;8:1031-1043). Y ont été recrutés 590 patients atteints de LLC, exempts de la délétion 17p et qui ont été affectés aléatoirement au zanubrutinib ou à un schéma thérapeutique type, soit de la bendamustine alliée au rituximab. Après un suivi médian de 26,2 mois, un parallèle a été établi entre le zanubrutinib et une baisse de 58 % du risque d’évolution de la maladie ou de décès (RRI : 0,42; p < 0,0001). De plus, le zanubrutinib a été mieux toléré et a provoqué moins d’effets indésirables graves (37 % vs 50 %).
Conclusion
Une étude ayant servi à comparer directement un inhibiteur de la BTK de première génération à un autre, de deuxième génération celui-là, a pour la première fois fait ressortir une prolongation de la SSP. L’innocuité et l’activité dont avait déjà fait état une analyse intermédiaire et que les résultats finaux de l’étude ALPINE ont confirmées, viennent étayer le rapport avantageux entre les bienfaits cliniques significatifs du zanubrutinib, un iBTK de deuxième génération, et les risques qu’il comporte dans le traitement des formes récidivantes ou réfractaires de la LLC/LPL. Comparativement à l’ibrutinib, le zanubrutinib produit des taux de réponse supérieurs et une SSP de plus longue durée, mais risque moins de provoquer des effets indésirables, notamment des incidents cardiaques graves. Cette étude a permis d’enrichir les données probantes montrant que la plus grande sélectivité du zanubrutinib pour la BTK lui donne l’avantage sur l’ibrutinib, un iBTK de première génération, pour ce qui est de l’innocuité.