Hématologie
Transplantation allogénique de cellules souches : revue d'experts et commentaires
Conditionnement et allogreffe de cellules souches hématopoïétiques : comparaison des stratégies
Mattias Stelljes, M.D.
Professeur de médecine
Chef, Programme d’allogreffes de cellules souches aux adultes
Université de Münster
Münster (Allemagne)
Thomas J. Nevill, M.D.
Professeur clinicien de médecine
Division des leucémies et des greffes de moelle osseuse
Hôpital général de Vancouver
Vancouver (Colombie-Britannique)
Victor Lewis, M.D.
Directeur, Programme d’hématologie et de greffe de moelle osseuse
Hôpital pour enfants de l’Alberta
Calgary (Alberta)
Avant la publication des résultats finaux d’une étude de phase III, beaucoup croyaient qu’il y avait peu de différences d’efficacité et d’innocuité entre les agents de conditionnement que sont le tréosulfan et le busulfan. La première étude maintenant publiée qui les a comparés (MC-FludT.14/L) a été menée chez des adultes devant subir une allogreffe de cellules souches hématopoïétiques (CSH) pour traiter une leucémie myéloïde aiguë (LMA) ou un syndrome myélodysplasique (SMD). Or après 36 mois de suivi, les chercheurs ont fait un lien entre le tréosulfan et une baisse du taux de toxicité et une augmentation du taux de survie globale (SG). Bien que cette étude ait visé à établir la non-infériorité du tréosulfan et du busulfan lorsque chacun d’eux est jumelé à de la fludarabine, une analyse de supériorité a confirmé que le tréosulfan avait eu l’avantage après 36 mois de suivi. Dans la présente analyse, le Dr Stelljes, un de ses co-auteurs, décrit le contexte dans lequel cette étude comparative a eu lieu et le retentissement clinique qu’elle a eu en Allemagne. Les Drs Nevill et Lewis nous expliquent la perspective canadienne sur ces agents de conditionnement pour le traitement des adultes et des enfants, respectivement.
Dr Stelljes : Contexte de l’étude de phase III visant à comparer des schémas de conditionnement
L’allogreffe de CSH est une composante essentielle des traitements à visée curative de nombreux cancers hématologiques. Les schémas de conditionnement jouent un rôle crucial dans la réussite de ces interventions en réduisant le fardeau tumoral et en favorisant la prise de la greffe. Que le conditionnement vise la myéloablation à pleine intensité (MAC) ou à intensité réduite (RIC), la marge thérapeutique est généralement étroite et atteinte après avoir mis en parallèle les objectifs contradictoires que sont la prévention d’une récidive et l’évitement d’une toxicité engageant le pronostic vital. L’intensité optimale des schémas de conditionnement, qui est définie d’après leurs composantes et réglée de façon à demeurer à l’intérieur de la marge thérapeutique en fonction des facteurs propres aux patients et à leur maladie, reste au cœur de la recherche de meilleurs résultats.
Le busulfan, un alkylant bifonctionnel, est utilisé depuis plusieurs décennies en association avec d’autres agents tels que la fludarabine et le cyclophosphamide dans des schémas de conditionnement préalables aux greffes de CSH1. Le tréosulfan, le plus récent de ces deux agents de conditionnement, est un analogue hydrophile du busulfan2. Contrairement au busulfan, le tréosulfan est un promédicament activé in vivo par un processus non enzymatique qui ne relève pas du métabolisme hépatique. En 2004, le tréosulfan a été classé parmi les médicaments orphelins en Allemagne. Par la suite, l’Agence européenne des médicaments a officialisé son indication comme agent de conditionnement préalable à une allogreffe de CSH. Santé Canada a suivi en 2021.
Il est ressorti des études non comparatives que le busulfan et le tréosulfan étaient des options efficaces pour les schémas de conditionnement formés avec d’autres agents cytotoxiques ou jumelés à d’autres techniques telles que la radiothérapie. Au terme de son élaboration, le tréosulfan a été présenté comme un médicament possiblement mieux toléré que le busulfan, mais la majorité des premières études n’étaient pas contrôlées et la composition exacte des schémas utilisés et les caractéristiques des patients variaient d’une étude à l’autre. Résultat : les différences entre les résultats cliniques du busulfan et du tréosulfan sont restées hypothétiques jusqu’à la réalisation de l’étude comparative de phase III.
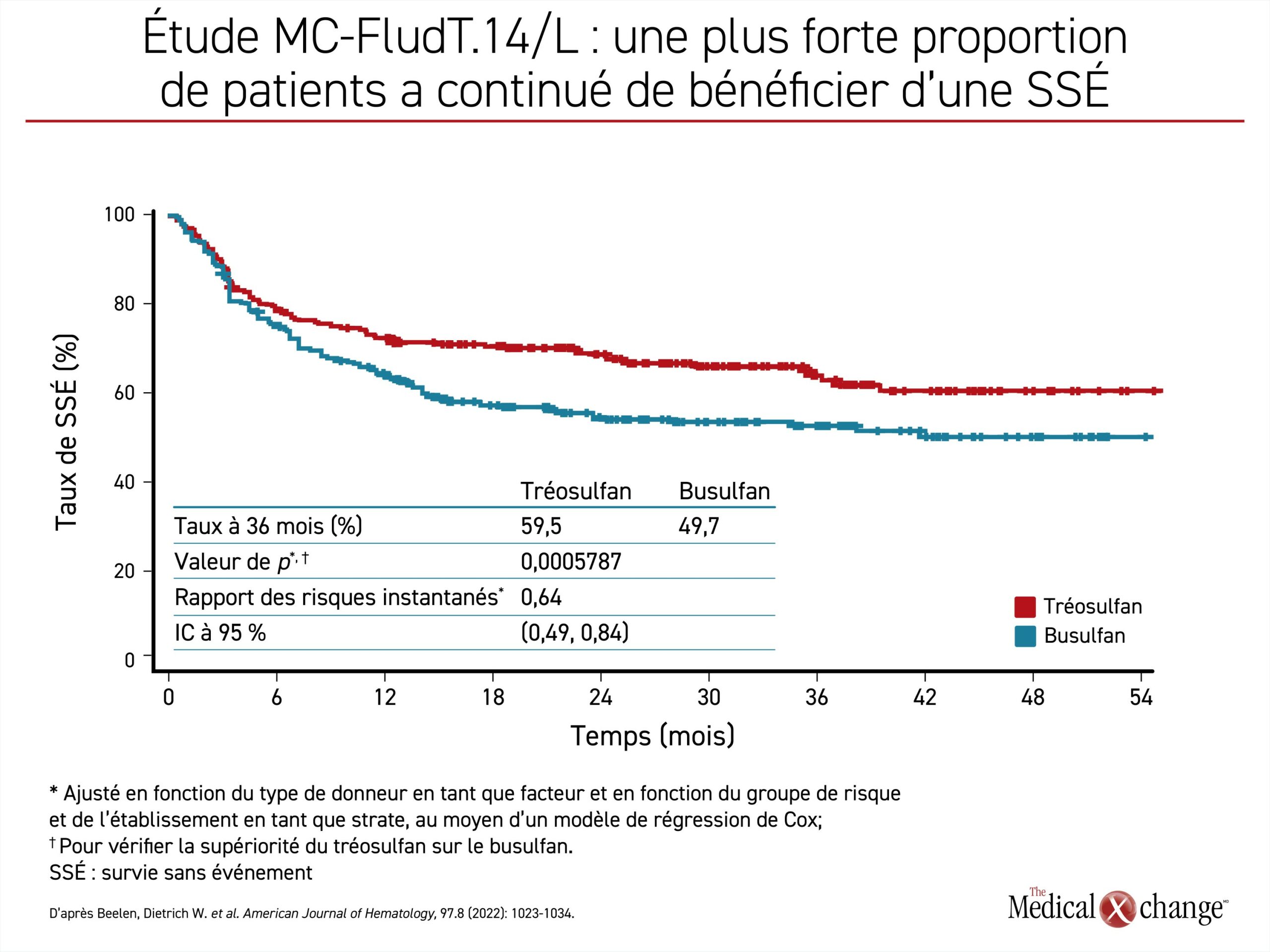
Lors de cette étude multicentrique (MC-FludT.14/L), 570 patients atteints d’une LMA ou d’un SMD qui devaient subir une allogreffe de CSH ont été répartis aléatoirement de façon à recevoir 30 g/m2 de tréosulfan ou 6,4 mg/kg de busulfan. Les deux agents ont été jumelés à des doses types de fludarabine. Les patients âgés de 50 à 70 ans ou ayant moins de 50 ans, mais présentant un indice de comorbidité (HCT-CI) supérieur à 2 et étaient considérés comme inadmissibles à un schéma de conditionnement myéloablatif. L’objectif déclaré de cette étude était de démontrer la non-infériorité du tréosulfan sur le busulfan. Son paramètre d’évaluation principal était la survie sans événement (SSÉ), ces événements étant définis comme la survenue d’une récidive, le rejet du greffon ou le décès toutes causes confondues.
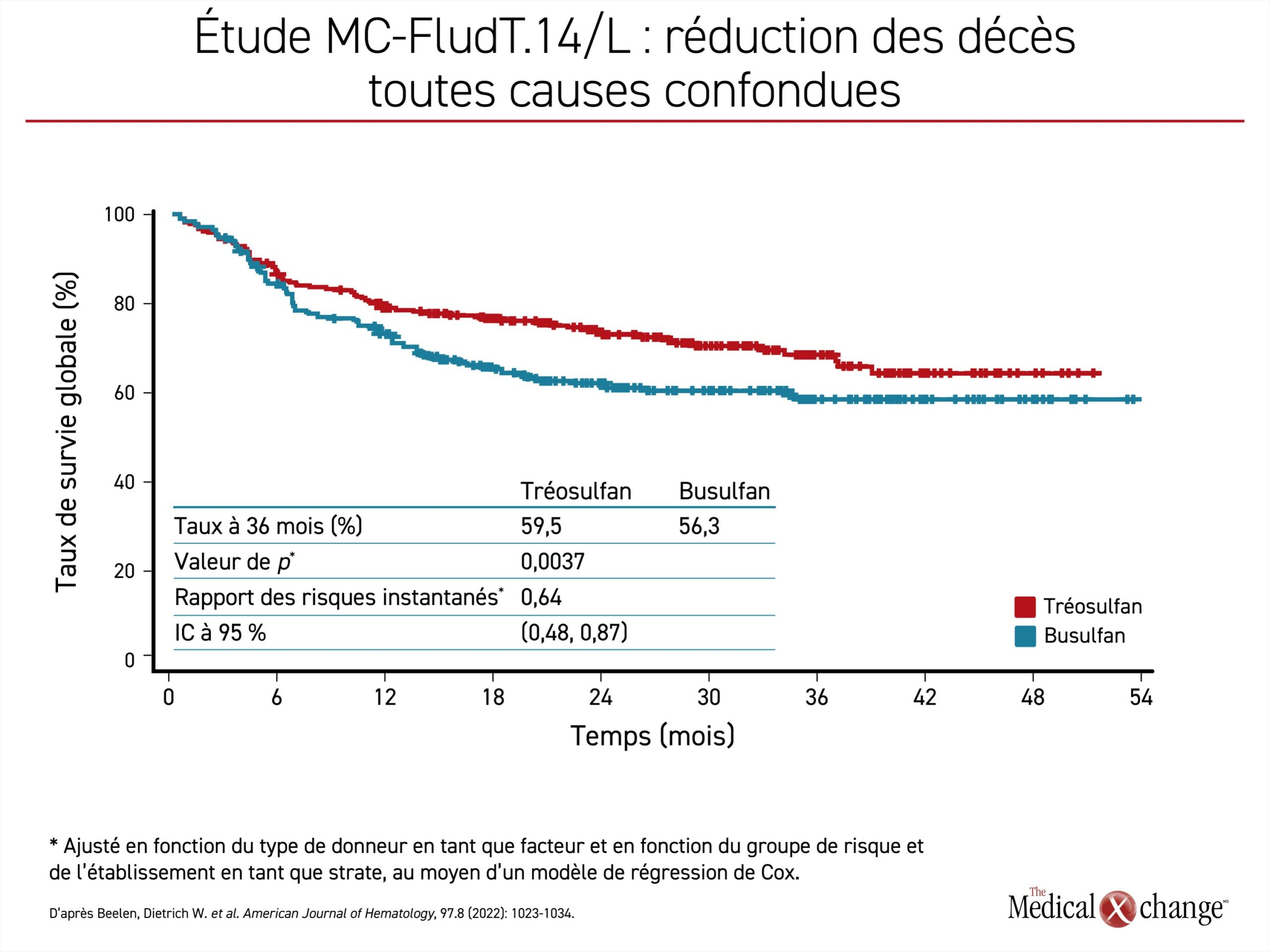
Une analyse intermédiaire remontant à plusieurs années et publiée en 20203 a révélé que le tréosulfan avait satisfait aux critères définissant la non-infériorité, mais que l’avantage qu’il avait eu sur le busulfan pour plusieurs des paramètres d’évaluation principaux, dont la SSÉ, justifiait une vérification de sa supériorité, ce qui a été fait à partir des résultats finaux publiés par la suite. Après un suivi de 36 mois4, la plus forte proportion de patients traités par le tréosulfan qui avaient bénéficié d’une SSÉ ininterrompue (59,5 % vs 49,7 %) s’est traduite par une baisse de 36 % du risque de rejet du greffon, de récidive ou de décès (risque relatif approché [RRA] : 0,64; p = 0,0006) (Figure 1). Le taux de SG à 3 ans (66,8 % vs 56,3 %) a permis de relier le schéma à base de tréosulfan à un avantage similaire en matière de risque relatif pour la survie (RRA : 0,64; p = 0,0037) (Figure 2). Les cas de rejet du greffon ont été rares dans les deux groupes (0,4 % vs 3,2 %), quoique plus nombreux dans le groupe busulfan. L’incidence des formes chroniques de maladie du greffon contre l’hôte et d’effets indésirables survenus pendant le traitement, graves ou non, était comparable dans les deux groupes.
Les gains significatifs observés avec le schéma à base de tréosulfan pour le paramètre d’évaluation principal étaient inattendus. Or avant même la publication des résultats à long terme, ceux de l’analyse intermédiaire avaient déjà amené les établissements participants à changer leur pratique. Le tréosulfan a largement supplanté le busulfan dans ces établissements, y compris le nôtre, pour les patients atteints de LMA et d’un SMD devant subir une allogreffe de CSH. Même si pour l’heure, les schémas à base de tréosulfan ne peuvent être qualifiés de normes en Europe, il n’empêche que le busulfan est moins utilisé dans notre établissement et dans beaucoup d’autres. L’étude de phase III menée chez des patients atteints de LMA et d’un SMD devant subir une allogreffe de CSH à visée curative a montré que le tréosulfan, qui est habituellement mieux toléré que le busulfan, est associé à de meilleurs résultats à long terme.
Lors du congrès annuel de 2022 de l’American Society of Hematology (ASH), nous avons présenté les données recueillies par la suite sur les schémas à base de tréosulfan dans des cas de SMD, y compris celles collectées chez des patients atteints d’une maladie très vulnérante5. En général, les résultats obtenus dans cette analyse effectuée en pratique clinique cadraient avec ceux de l’étude comparative : des faibles taux de récidive (15 %) et de décès sans récidive (10 %) à 2 ans. Même si la SG observée à 2 ans était plus basse dans le sous-groupe de patients atteints d’une maladie extrêmement vulnérante que dans celui des patients aux prises avec une maladie très vulnérante (55 % vs 81 %), l’âge, le type de donneur, l’indice de comorbidité, le pré-conditionnement et le nombre de cellules blastiques de la moelle osseuse n’ont pas eu de répercussion sur leur survie, ce qui nous porte à croire que la survie est liée aux caractéristiques cytogénétiques et moléculaires de la maladie et non pas au fardeau pathologique défini selon le nombre de cellules blastiques dans la moelle osseuse.
Dr Nevill : Évolution des schémas de conditionnement préalables aux allogreffes de CSH chez les adultes canadiens
Contrairement au consensus croissant concernant les options thérapeutiques privilégiées dans les cas d’hémopathies ayant des caractéristiques pronostiques particulières, les opinions varient considérablement quant aux schémas préalables aux allogreffes de CSH, même dans les protocoles myéloablatifs ou à intensité réduite. Nous nous sommes intéressés au tréosulfan en raison de sa tolérabilité possiblement plus grande chez les patients atteints de maladies concomitantes, surtout ceux dont la fonction hépatique est très affaiblie, mais l’emploi de cet agent n’est pas encore la norme au Canada.
Au Canada, le tréosulfan est une solution de rechange relativement nouvelle pour les adultes devant subir un conditionnement à base de busulfan. Comparativement aux pays européens, comme l’Allemagne ou l’Italie, où la majorité des études ont été réalisées, le tréosulfan était un produit expérimental jusqu’à son homologation par Santé Canada il y a deux ans.
L’étude de phase III permet de faire des comparaisons, mais de nombreuses variables entrent en jeu quand vient le temps de personnaliser les schémas de conditionnement. L’équivalence posologique entre le busulfan et le tréosulfan n’est pas nettement définie, de sorte que les doses comparées dans cette étude (6,4 g/m2 vs 30 mg/kg pour le busulfan et le tréosulfan, respectivement) ne correspondent pas forcément à la posologie optimale pour les patients exposés à différents niveaux de risque de toxicité et de récidive. Les doses de tréosulfan employées dans les schémas de conditionnement myéloablatifs ou à intensité réduite ne sont pas si différentes, mais on cherche de plus en plus à les doser de façon à obtenir la myélosuppression recherchée tout en réduisant le risque relatif d’effets indésirables. C’est surtout cela qui nous a amenés à abandonner la radiothérapie comme méthode de conditionnement préalable aux allogreffes de CSH dans les cas de cancers non lymphoïdes.
L’étude de phase III ne permet pas de savoir si les meilleurs résultats obtenus avec le tréosulfan sont attribuables à une plus grande tolérabilité ou à un effet myélosuppressif plus marqué, mais nous ne sommes pas les seuls à utiliser cet agent de plus en plus. Le tréosulfan n’est pas encore la norme. La décision d’avoir recours à un schéma de conditionnement à base de cet agent doit donc être prise au cas par cas, mais nous l’envisageons plus souvent dans notre établissement.
Dr Lewis : Évolution des schémas de conditionnement préalables aux allogreffes de CSH chez les enfants canadiens
Comparativement à ce qui s’est passé pour les adultes, les protocoles de conditionnement élaborés en vue de pratiquer une allogreffe de CSH chez les enfants sont surtout issus d’études indépendantes et de l’empirisme. Nous avons commencé à nous intéresser au tréosulfan en 2010, lorsque nous avons été les premiers à l’importer au Canada. Notre intérêt avait été éveillé par les données collectées en Europe, qui indiquaient que cet agent était moins toxique que le busulfan. À l’époque, nous obtenions de très mauvais résultats chez nos patients immunodéprimés; beaucoup mouraient des suites du traitement. Le tréosulfan était pour nous une solution de rechange impressionnante. Il était mieux toléré et le risque que la greffe ne prenne pas ne semblait pas augmenter.
Le tréosulfan est maintenant la norme chez nous pour le conditionnement préalable aux allogreffes de CSH dans les cas de maladies non malignes. Nous le privilégions également lorsque nous devons pratiquer une greffe haplo-identique chez des patients atteints de telles maladies. Cela dit, le busulfan reste la norme contre les affections malignes. Nous ne disposons pas encore d’assez de données de suivi pour confirmer qu’il n’y aura pas d’augmentation des cas de récidive avec un schéma possiblement moins agressif advenant que nous voulions que le conditionnement préalable à l’allogreffe de CSH serve à éliminer toute maladie résiduelle minime et à améliorer les chances que la greffe prenne. Il faut savoir que c’est le choix qu’a fait notre établissement, ce qui n’exclut pas la possibilité que nous adoptions les schémas à base de tréosulfan pour les allogreffes de CSH pratiquées dans le cadre du traitement de maladies non malignes par une greffe haplo-identique, mais nous avons besoin de plus de données.
En situation non maligne, le grand avantage du tréosulfan, c’est qu’il comporte un risque relatif moins élevé d’effets toxiques importants et de leurs complications. La mucosite en est un exemple. Avec le busulfan, il faut souvent avoir recours à des sondes nasogastriques ou à une alimentation parentérale totale en raison de l’inflammation souvent grave de la bouche et de l’œsophage. Avec le tréosulfan, on voit aussi des cas de mucosite, mais ils sont habituellement moins graves et de plus courte durée. On évite donc souvent le problème de fournir une alimentation adaptée. Nous trouvons également que le séjour à l’hôpital dure moins longtemps quand nous utilisons le tréosulfan pour le conditionnement.
Les avantages du conditionnement à base de tréosulfan sont assez bien reconnus aujourd’hui. Si l’adoption de cet agent a d’abord été lente ailleurs au Canada, il n’empêche que c’est maintenant celui qui est privilégié dans de nombreux centres de greffe pour de nombreuses maladies malignes ou non chez les enfants. Alors qu’auparavant nous devions demander une autorisation pour employer le tréosulfan, il est maintenant inscrit sur notre liste de médicaments et facilement accessible pour traiter des maladies courantes.
Résumé
Les schémas de conditionnement à base de tréosulfan préalables aux allogreffes de CSH ont supplanté ceux à base de busulfan dans beaucoup d’établissements européens, ce changement ayant été motivé par les résultats d’une étude de phase III qui ont établi un parallèle entre cet agent alkylant plus récent et des taux de SG nettement supérieurs au terme de trois années de suivi. Au Canada, où le tréosulfan a été homologué assez récemment, l’expérience acquise chez les adultes est plus restreinte, mais elle prend de l’ampleur. Répétons-le : le tréosulfan semble une solution de rechange mieux tolérée et donnant de meilleurs résultats cliniques que le busulfan chez les patients atteints d’une LMA ou d’un SMD devant subir une allogreffe de CSH. Chez les enfants, le conditionnement à base de tréosulfan a éveillé l’intérêt des cliniciens grâce à sa plus grande tolérabilité. Il est aujourd’hui la norme dans plusieurs établissements, dont l’Université de Calgary où il a été évalué pour la première fois au Canada, comme étape préalable à une allogreffe de CSH opposée à des maladies non malignes.
Références
- Galaup A et Paci A. Pharmacology of dimethanesulfonate alkylating agents: busulfan and treosulfan. Expert Opin Drug Metab Toxicol 2013;9(3):333-347. DOI: 10.1517/17425255.2013.737319.
- Romanski M, Wachowiak J et Glowka FK. Treosulfan Pharmacokinetics and its Variability in Pediatric and Adult Patients Undergoing Conditioning Prior to Hematopoietic Stem Cell Transplantation: Current State of the Art, In-Depth Analysis, and Perspectives. Clin Pharmacokinet 2018;57(10):1255-1265. DOI: 10.1007/s40262-018-0647-4.
- Beelen DW, Trenschel R, Stelljes M, et al. Treosulfan or busulfan plus fludarabine as conditioning treatment before allogeneic haemopoietic stem cell transplantation for older patients with acute myeloid leukaemia or myelodysplastic syndrome (MC-FludT.14/L): a randomised, non-inferiority, phase 3 trial. Lancet Haematol 2020;7(1):e28-e39. DOI: 10.1016/S2352-3026(19)30157-7.
- Beelen DW, Stelljes M, Remenyi P, et al. Treosulfan compared with reduced-intensity busulfan improves allogeneic hematopoietic cell transplantation outcomes of older acute myeloid leukemia and myelodysplastic syndrome patients: Final analysis of a prospective randomized trial. Am J Hematol 2022;97(8):1023-1034. DOI: 10.1002/ajh.26620.
- Floeth M, Beckmann E, Reicherts C, Marx J et Stelljes M. Treosulfan-based conditioning prior to allogeneic hematopoietic cell transplantation (alloHCT) for patients with myelodysplastic syndrome (MDS): promising survival outcome including patients with high-rsk disease. Blood 2022;140:supplément 1:7587-7588.