Néphrologie
Toronto Complement Conference (TCC) de 2024
Nouvelles options de traitement contre la glomérulopathie à dépôts de C3 : combler le vide
Toronto – La glomérulopathie à dépôts de complément 3 (GC3) est une néphropathie évolutive rare causée par une dérégulation de la voie alterne du complément. Aucun traitement ciblant la cause sous-jacente de la GC3 n’est encore offert, mais de nouveaux agents s’attaquant à la voie alterne en sont à l’étape des études cliniques. Présentés plus tôt cette année, les résultats de deux grandes études de phase III ont été contextualisés lors de la TCC. Dans chacune d’elles, un nouvel agent a été relié à une bonne tolérance, à des baisses importantes de la protéinurie et à une stabilisation de la fonction rénale. Des données recueillies à plus longue échéance, comme celles collectées à 12 mois durant l’étude APPEAR-C3G, rendent compte d’une innocuité et de résultats à long terme prometteurs, et suscitent un nouvel espoir contre cette maladie difficile.
Voie alterne et options thérapeutiques actuelles
La GC3, dont l’incidence s’élèverait à 1 ou 2 cas par million par année, est souvent décelée durant l’enfance ou au début de l’âge adulte, même si aucun groupe d’âge n’est épargné. Ses symptômes sont une protéinurie, une hématurie et un affaiblissement de la fonction rénale. De pronostic habituellement sombre, elle évolue vers l’insuffisance rénale en une dizaine d’années chez de 30 à 50 % des patients, d’après la Dre Anne-Laure Lapeyraque, chef de la Néphrologie pédiatrique, au Centre hospitalier universitaire Sainte-Justine, à Montréal (Québec).
Fruit d’un consensus international, la prise en charge actuellement recommandée se résume à un traitement de soutien reposant sur des inhibiteurs du système rénine-angiotensine-aldostérone, la maîtrise de la lipidémie et un régime hyposodé. Autrement, « le traitement reste encore aujourd’hui fondé sur une immunodépression très aspécifique », a déclaré le Dr Christoph Licht, professeur au Département de pédiatrie de l’Université de Toronto et chef de la Division de néphrologie de l’Hôpital pour enfants malades de Toronto. Il a ajouté : « Un très petit sous-groupe de nos patients se rétablit spontanément, mais ceux dont la maladie est grave d’emblée et évolue sont astreints à un traitement par la prednisone et le mycophénolate mofétil ».
Pour une entrevue exclusive avec le Dr Christoph Licht couvrant l’impact sur la pratique clinique, cliquez ici.
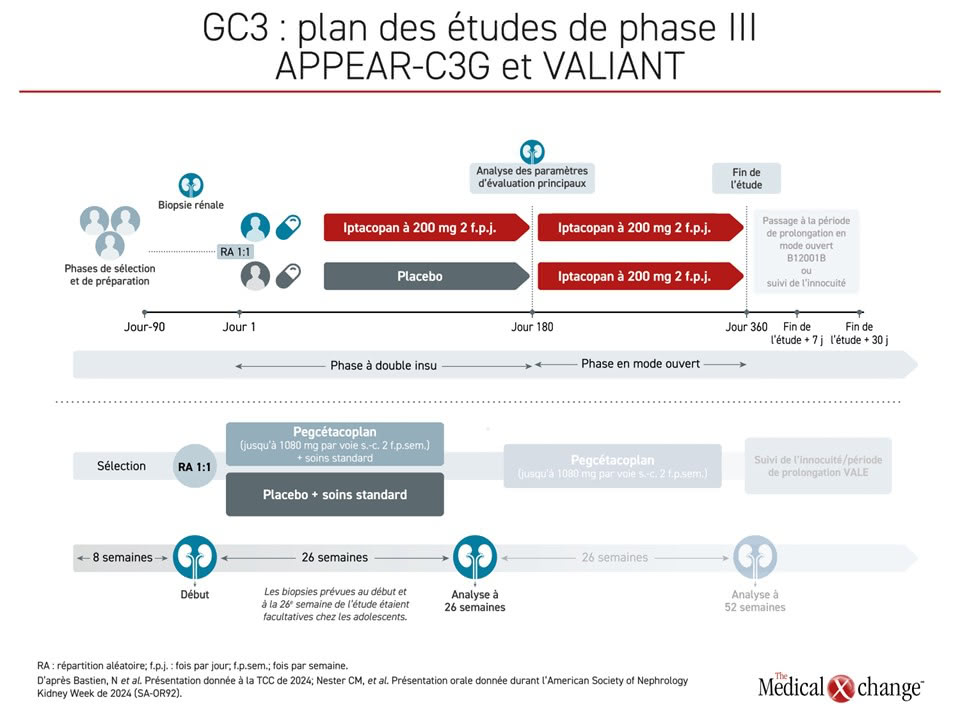
Pour l’heure, un traitement plus spécifique à l’aide d’inhibiteurs du complément est uniquement envisagé comme traitement de sauvetage dans les cas où l’immunodépression n’entraîne pas une rémission complète et dans le cadre d’études cliniques. Comme la GC3 est causée par une dérégulation de la C3 convertase, « nous avons besoin d’agents s’attaquant à cette partie de la cascade, et nous y parvenons », a affirmé le Dr Licht. « Nous n’en sommes qu’à la fin d’études de phase III et les résultats sont déjà encourageants ». Deux grandes études récentes portant sur la C3 convertase, soit l’étude APPEAR-C3G et ses données à 12 mois, et l’étude VALIANT et ses données à 26 semaines, affichaient déjà des résultats positifs lorsqu’ils ont été présentés plus tôt cette année (Figure 1).
Comme la GC3 est causée par une dérégulation de la C3 convertase, « nous avons besoin d’agents s’attaquant à cette partie de la cascade, et nous y parvenons ».
Étude APPEAR-C3G : inhibiteur des voies proximales du complément à prise orale
L’étude déterminante de phase III APPEAR-C3G portait sur l’iptacopan, un inhibiteur des voies proximales du complément à prise orale qui se lie sélectivement au facteur B et inhibe la voie alterne. Il a été homologué par la FDA en 2023 et par l’EMA en 2024 pour le traitement d’une autre maladie rare, l’hémoglobinurie paroxystique nocturne. Il est aussi à l’étude contre un certain nombre d’autres maladies rares, a précisé la Dre Lapeyraque.
Dans cette étude menée à double insu et avec contrôle placebo, 74 adultes atteints de GC3 ont été répartis aléatoirement de façon à recevoir 200 mg d’iptacopan ou un placebo deux fois par jour en plus de soins de soutien. Les patients y étaient admis s’ils avaient subi une biopsie dans les 12 mois précédents, si leur taux de C3 avait baissé et si leur rapport protéines:créatinine urinaire (UPCR) se chiffrait à 1 g/g ou plus. La phase de traitement à double insu de 6 mois a été suivie d’une phase de traitement en mode ouvert ayant duré 6 mois de plus pour tous les patients.
Le principal paramètre d’évaluation de la phase à double insu était la réduction de la protéinurie de référence établie d’après le rapport protéines:créatinine urinaire de 24 heures. Notons que la Dre Lapeyraque a ajouté que les données démographiques initiales montraient un phénotype plus grave chez les patients du groupe iptacopan que chez les témoins.
Données à 6 et à 12 mois : résultats soutenus et bilan d’innocuité favorable
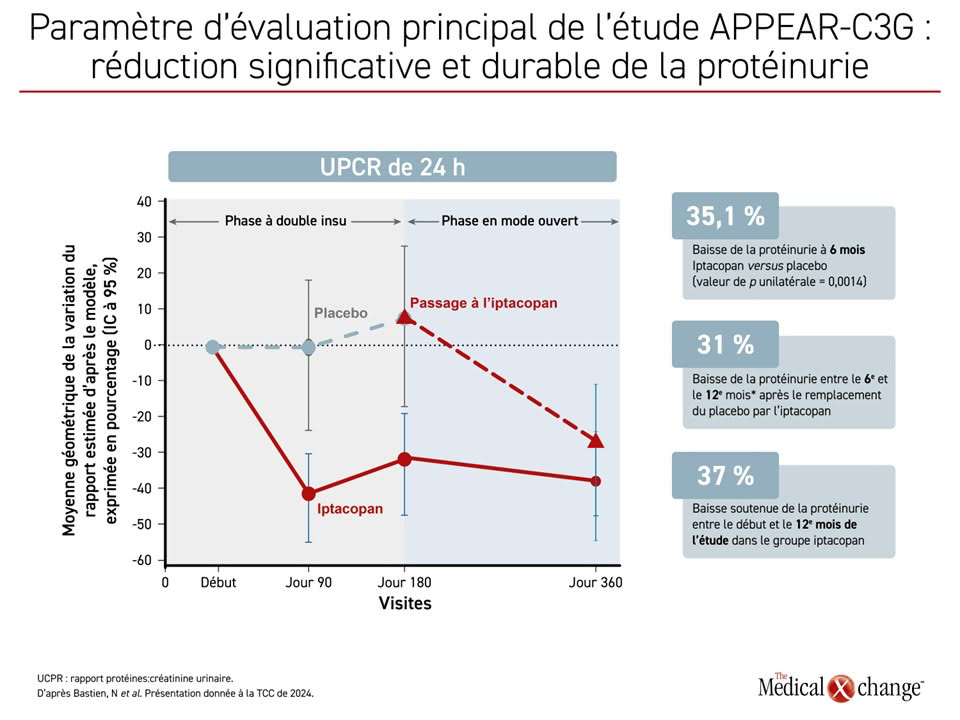
Les principaux résultats à 6 mois, présentés antérieurement au congrès de l’ERA de 2024, ont montré une réduction de l’UPCR de 24 heures de 30,2 % par rapport aux valeurs de référence dans le groupe iptacopan comparativement à une hausse de 7,6 % chez les témoins, soit une réduction relative de 35,1 % et un résultat statistiquement significatif (valeur de p unilatérale = 0,0014).
D’ailleurs, cette réduction marquée a persisté pendant jusqu’à 12 mois, soit jusqu’à la fin de la phase menée en mode ouvert. Chez les patients originalement affectés au placebo, on a noté une réduction de 31 % de la protéinurie entre le 6e et le 12e mois, ainsi qu’une réduction soutenue de 37 % de la protéinurie ayant durée jusqu’à 12 mois chez les patients originalement affectés à l’iptacopan (Figure 2).
Les chercheurs n’ont pas noté de différence significative entre le groupe iptacopan et les témoins pour ce qui est du paramètre d’évaluation secondaire, soit la variation entre le début et la fin de l’étude de l’inflammation glomérulaire mesurée d’après le score total d’activité histologique enregistré à 6 mois; toutefois, une analyse exploratoire des taux de biomarqueurs circulants a révélé une inhibition de la voie alterne par l’iptacopan.
À 12 mois, l’iptacopan avait stabilisé le débit de filtration glomérulaire estimé (DFGe) des patients originalement affectés au placebo et maintenu un DFGe stable chez les patients traités par l’iptacopan dès le départ (+0,84 mL/min/1,73 m2).
Passant ces données en revue, la Dre Lapeyraque a confirmé que le traitement affichait une bonne tolérabilité et un bilan d’innocuité favorable. Avec l’iptacopan, il n’y a pas eu de décès, de cas de méningite ou de septicémie à méningocoques, ni d’abandons du traitement motivés par des effets indésirables survenus pendant le traitement (EIST). Les effets indésirables étaient majoritairement peu ou modérément graves.
Efficacité et innocuité à long terme observées lors d’une période de prolongation de 33 semaines d’une étude de phase II
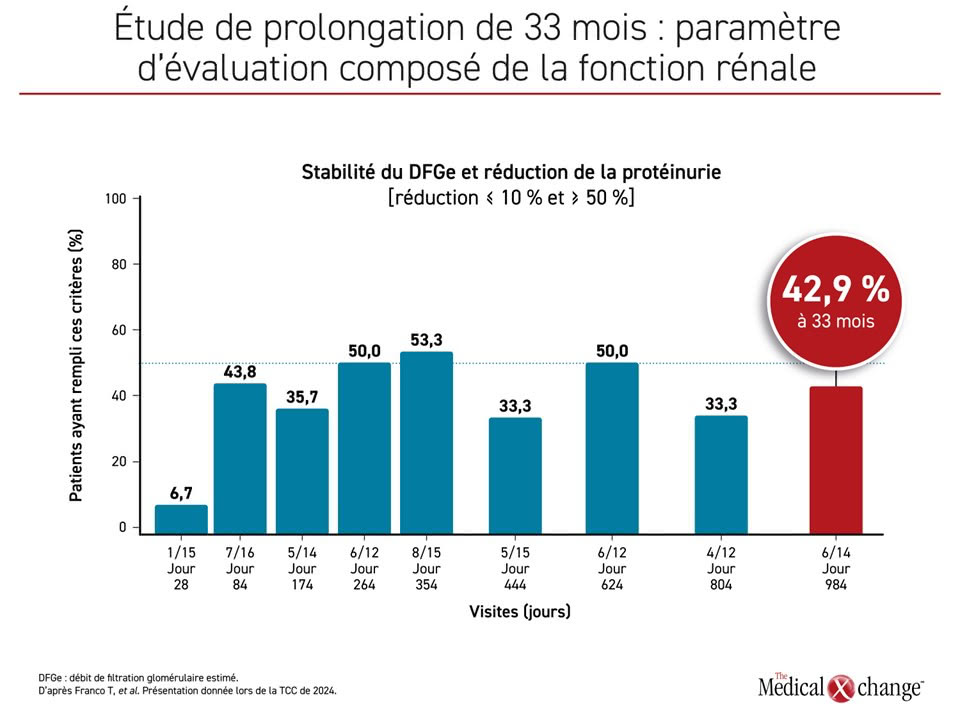
Dans une analyse distincte présentée à la TCC de 2024, les chercheurs ont rapporté les données actualisées d’une période de prolongation de 33 mois menée chez les participants d’une étude de phase II sur l’iptacopan. Sur les 27 sujets de l’étude originale, 26 ont participé à cette période de prolongation et 22 se sont présentés à la dernière visite prévue à 33 semaines.
Les chercheurs ont affirmé avoir relié le traitement prolongé par l’iptacopan à une réduction soutenue de la protéinurie et à une préservation du DFGe chez ces patients (Figure 3). Ils ont établi un parallèle entre ces améliorations et une inhibition « considérable » de la voie alterne, elle-même liée à une normalisation du C3 sérique. Rien de neuf n’a été observé du côté de l’innocuité sur le long terme, notamment chez les patients dont la maladie avait récidivé après une transplantation rénale sur fond de traitement par trois immunodépresseurs. Ces données à long terme sur l’iptacopan, un inhibiteur des voies proximales du complément à prise orale, laissent entrevoir un traitement à venir contre la GC3.
Étude de phase III VALIANT : des données remontant jusqu’à 26 semaines
La deuxième étude, de phase III elle aussi, présentée à la TCC de cette année, portait sur le pegcétacoplan, un inhibiteur de C3/C3b bloquant la formation de la C3 convertase. Y ont participé 124 patients atteints de GC3 ou d’une forme primitive de glomérulonéphrite membranoproliférative (GNMP) médiée par des complexes immuns confirmée à l’histologie, postérieure ou non à une transplantation rénale, caractérisée par une protéinurie de plus de 1 g/jour et par un DFGe supérieur à 30 mL/min/1,73 m2, traitée au moyen de schémas thérapeutiques standard et montrant des signes de néphropathie évolutive à la biopsie.
Les patients ont été répartis aléatoirement en deux groupes de traitement ꟷ pegcétacoplan à 1 080 mg au maximum administré par injection sous-cutanée deux fois par semaine ou placebo ꟷ, puis ont été suivis pendant 26 semaines. Une période de prolongation de 26 autres semaines est prévue, ainsi qu’un suivi de l’innocuité de plus longue durée encore dans le cadre de l’étude VALE.
Le paramètre d’évaluation principal était la variation du logarithme du rapport UPCR entre le début et la 26e semaine de l’étude. Les résultats, d’abord présentés lors de la ASN Kidney Week de 2024, ont révélé une réduction relative statistiquement significative de 68,3 % avec le pegcétacoplan par rapport au placebo (p < 0,0001). Ces réductions ont été observées dans tous les sous-groupes, dont ceux formés en fonction de l’âge, du type de maladie et de la situation quant à la transplantation.
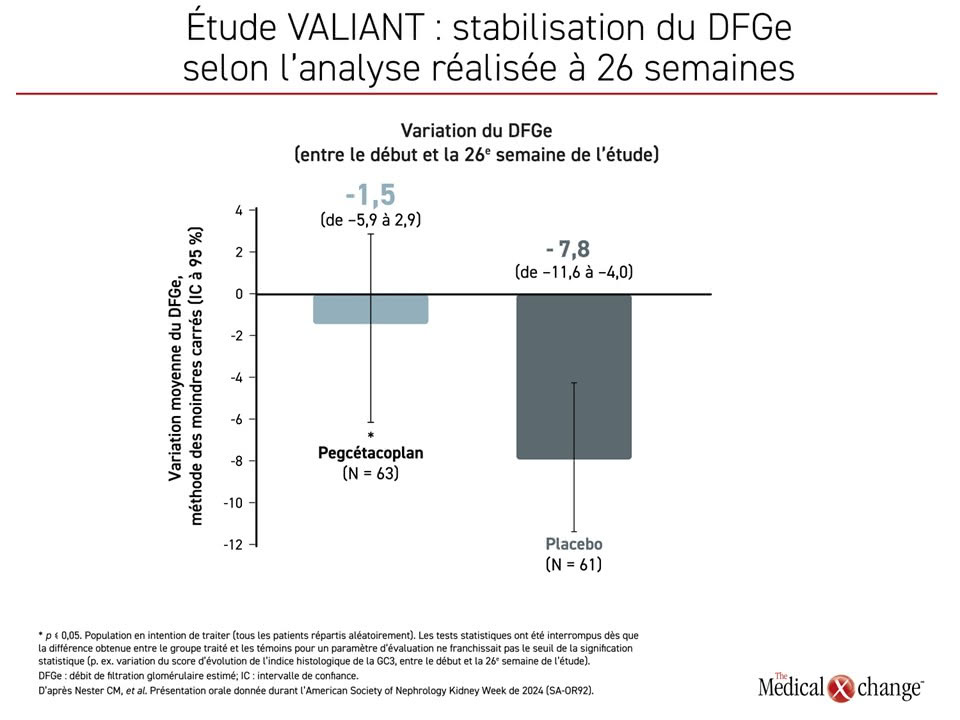
Les patients traités étaient significativement plus susceptibles d’afficher une baisse de leur protéinurie supérieure à 50 %. À preuve, c’était le cas de 60,3 % d’entre eux contre 4,9 % des témoins (p < 0,001). Le pegcétacoplan a significativement mieux stabilisé le DFGe que le placebo, la baisse enregistrée par rapport aux valeurs initiales étant de 1,5 mL/min/1,73 m2 contre 7,8 mL/min/1,73 m2 dans le groupe témoin (p = 0,03) (Figure 4).
Le pegcétacoplan a été bien toléré. La gravité et la fréquence des EIST étaient similaires d’un groupe à l’autre. On a rapporté quatre cas d’infection grave, trois dans le groupe pegcétacoplan et un chez les témoins. Le traitement a été mis hors de cause dans le décès d’un patient du groupe pegcétacoplan des suites d’une pneumonie à COVID-19. Il n’a eu aucun cas d’infection à N. meningitidis.
Les nouveaux agents pourraient mieux convenir aux mécanismes pathologiques modifiables
La Dre Lapeyraque a contextualisé les résultats des études en soulignant que les deux agents ont permis d’abaisser significativement la protéinurie, de préserver le DFGe au fil du temps, de raréfier les dépôts de C3/C3b glomérulaires et d’inhiber considérablement la voie alterne d’après les dosages du C3 et du sC5b-9 en plus d’être considérés comme bien tolérés. Toutefois, si les résultats de l’étude APPEAR-C3G et de la période de prolongation de l’étude de phase II ont confirmé l’efficacité et l’innocuité de l’iptacopan à 12 et à 33 mois, respectivement, il faut noter que les données à 12 mois de la période de prolongation prévue pour l’étude VALIANT sur le pegcétacoplan sont encore inconnues.
Selon le Dr Licht, ces deux agents visent à traiter la cause sous-jacente de la GC3, soit une dérégulation de la voie alterne. Après activation par la convertase C3bBb, le C3 devient du C3b, qui est transformé à son tour en une forme inactive; s’ensuit la synthèse de produits de dégradation. Fabriqués en quantités excessives, ces derniers s’accumulent dans les glomérules, d’où la GC3.
Il a ajouté que l’une des deux causes de cela est l’entrée en jeu d’anticorps dirigés contre des composantes ou des régulateurs du C3bBb. Il s’agit d’un processus auto-immun, mais des mutations dans les gènes codant pour des composantes de ces mêmes cascades peuvent aussi déclencher la même cascade et ses conséquences cliniques.
Gage d’une meilleure maîtrise de la GC3 s’ils sont validés davantage et homologués par les organismes de réglementation, ces agents suscitent beaucoup d’intérêt et d’optimisme. En s’attaquant à la voie du complément plutôt qu’aux symptômes seulement, on espère qu’une maîtrise plus serrée du processus physiopathologique de la GC3 permettra de combler le vide thérapeutique actuellement associé à cette maladie.
« Gages d’une meilleure maîtrise de la GC3 s’ils sont validés davantage et homologués par les organismes de réglementation, ces agents suscitent beaucoup d’intérêt et d’optimisme. »
En route vers la pratique clinique : autres considérations
L’iptacopan, pour lequel on dispose maintenant de données issues d’un suivi médian de 12 mois, et le pegcétacoplan, dont les données remontent à 26 semaines, n’ont pas été comparés directement, mais ils pourraient ne pas être interchangeables. L’iptacopan se prend par voie orale deux fois par jour, alors que le pegcétacoplan s’injecte par voie sous-cutanée deux fois par semaine après son administration initiale en clinique. Advenant qu’ils soient tous les deux homologués contre la GC3, cette différence pourrait avoir de l’importance aux yeux des patients.
D’après la Dre Lapeyraque, les activités de recherche dans ce domaine restent importantes. De nouvelles études pourraient servir à vérifier s’il est possible de bloquer à la fois l’axe C3/C3 convertase et l’axe C5/C5 convertase, ce qui permettrait d’éviter un déséquilibre problématique entre les deux. Elle a aussi parlé d’un autre médicament expérimental contre la GC3, le KP104, un anticomplément conçu à cette fin, qui fait actuellement l’objet d’études de phase II portant sur la néphropathie à IgA et la GC3.
Conclusion
De nouveaux anticompléments prometteurs ciblant la cause sous-jacente de la GC3 en sont à l’étape des études cliniques. Visant à combler le vide thérapeutique critique associé à cette néphropathie évolutive rare, les deux inhibiteurs des voies proximales du complément, l’un à prise orale et l’autre injectable, sont étudiés pour voir s’ils pourraient corriger la dérégulation de la voie alterne du complément. Des améliorations marquées de paramètres cliniques importants sont ressorties de ces études, dont des baisses de la protéinurie et une stabilisation du DFGe, un grand pas vers le ralentissement de l’évolution de cette maladie. Il sera essential de confirmer l’efficacité et l’innocuité à long terme de ces agents pour qu’ils soient intégrés à l’arsenal thérapeutique. Au fil des progrès réalisés, ces agents novateurs pourraient bien métamorphoser les soins prodigués aux patients atteints de GC3 et ultimement le sort de ces derniers.