Neurologie
6e congrès de l’European Academy of Neurology (EAN) 2020
L’évolution de la sclérose en plaques progressive secondaire est toujours freinée après 5 ans
Congrès en ligne – Les patients atteints de sclérose en plaques progressive secondaire (SPPS) traitée à l’aide d’un agent à prise orale peuvent espérer être protégés contre l’invalidité pendant cinq ans au moins, selon de nouvelles données prospectives recueillies pendant l’étude ouverte de prolongation de l’essai EXPAND. Forte des données collectées chez les témoins passés à un agent de comparaison à prise orale, cette étude vient confirmer qu’en thérapeutique, le plus tôt sera le mieux.
À l’étape actuelle du suivi de l’étude ouverte de prolongation de l’essai EXPAND de 5 ans, les sujets affectés d’emblée au siponimod plutôt qu’au placebo jouissent d’un avantage clinique majeur au chapitre de l’incapacité et du déclin des fonctions cognitives. Selon les nouvelles données de la sous-étude menée par imagerie pendant la phase à répartition aléatoire de l’essai EXPAND, la durabilité de ces bienfaits s’expliquerait par le ralentissement prononcé de leur maladie.
Pour une entrevue exclusive avec le Dr Liesly Lee sur l’impact sur la pratique clinique, cliquez ici
Effet soutenu à long terme
« Les données de suivi de l’étude de prolongation nous montrent l’effet soutenu du siponimod à long terme », a déclaré le Dr Ludwig Kappos, titulaire de la Chaire de neurologie de l’Université de Bâle, en Suisse. La protection qu’il a conférée contre l’invalidité par rapport à l’effet obtenu chez les sujets affectés d’emblée au placebo, puis passés au siponimod « illustre l’utilité de traiter la SPPS rapidement. »
« Les données de suivi de l’étude de prolongation nous montrent l’effet soutenu du siponimod à long terme. »
Au début de l’année, Santé Canada homologuait le siponimod pour le traitement de la SPPS en se fondant sur l’essai déterminant EXPAND, l’essai à répartition aléatoire ayant réuni le plus grand effectif de sujets atteints de SPPS jusqu’à maintenant (Kappos et al. Lancet 2018;391:1263-1273).
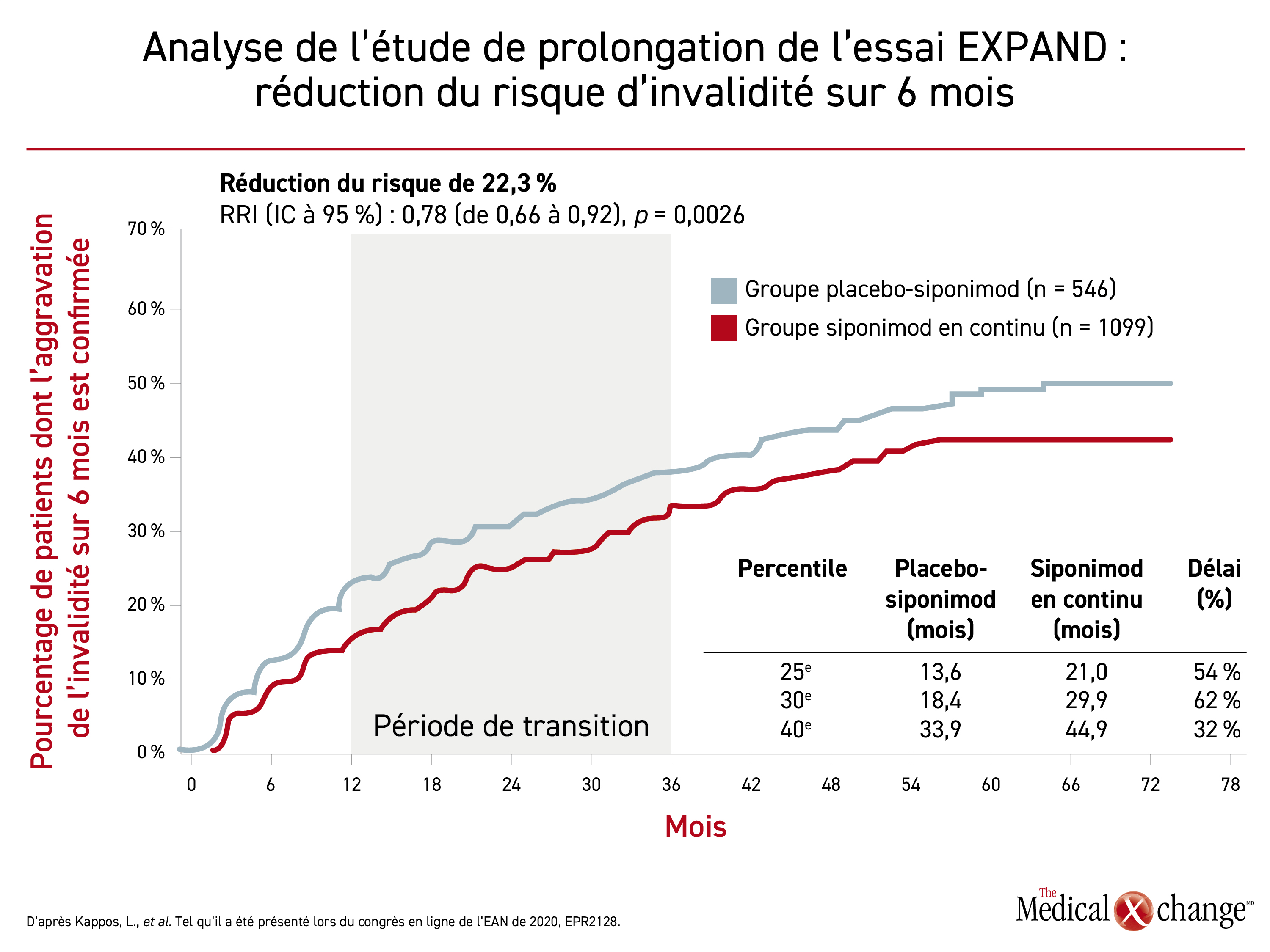
À ce jour, plus de 25 % des sujets de l’étude de prolongation, dont le suivi doit durer 7 ans, ont été exposés au siponimod pendant 5 ans ou plus. La principale issue d’intérêt est la confirmation d’une aggravation soutenue de l’invalidité (ASI) sur 6 mois au moins. Les sujets affectés d’emblée au siponimod lors de l’essai principal ont été comparés à ceux affectés d’emblée au placebo, puis passés au siponimod.
Réduction du risque d’invalidité
Le rapport des risques instantanés (RRI) le plus récent témoigne d’une réduction de 22 % du risque d’ASI sur 6 mois confirmée (RRI : 0,78; p = 0,0026) chez les sujets affectés d’emblée au siponimod plutôt qu’au placebo (Figure 1). Le délai médian écoulé avant l’observation de cette issue était de 51,7 mois chez les témoins, mais n’a pas encore été atteint chez les sujets ayant reçu du siponimod en continu. Après calcul en fonction du délai moyen entre le 25e et le 40e percentile d’évolution, on constate que le siponimod en continu a retardé l’ASI sur 6 mois confirmée de 49,3 % en moyenne.
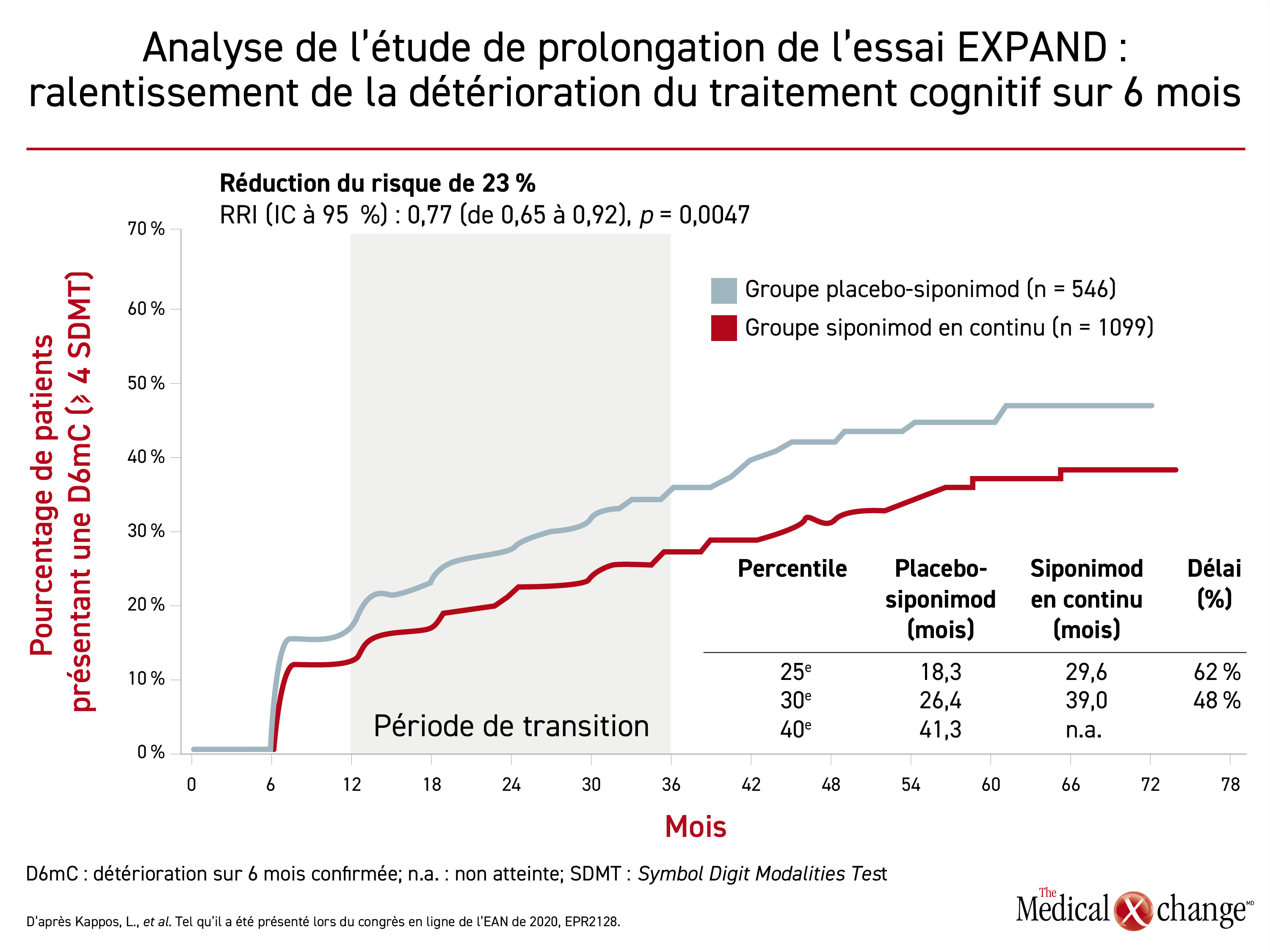
L’avantage relatif obtenu pour la protection contre le déclin des fonctions cognitives en traitant d’emblée les patients par le siponimod au lieu de remplacer le placebo par cet agent était très similaire. Ce critère de jugement a été exprimé en tant que ralentissement soutenu du traitement cognitif sur 6 mois (RRI : 0,77; p = 0,0047) (Figure 2). Or le retard moyen entre les 25e et 30e percentiles était de 55 %.
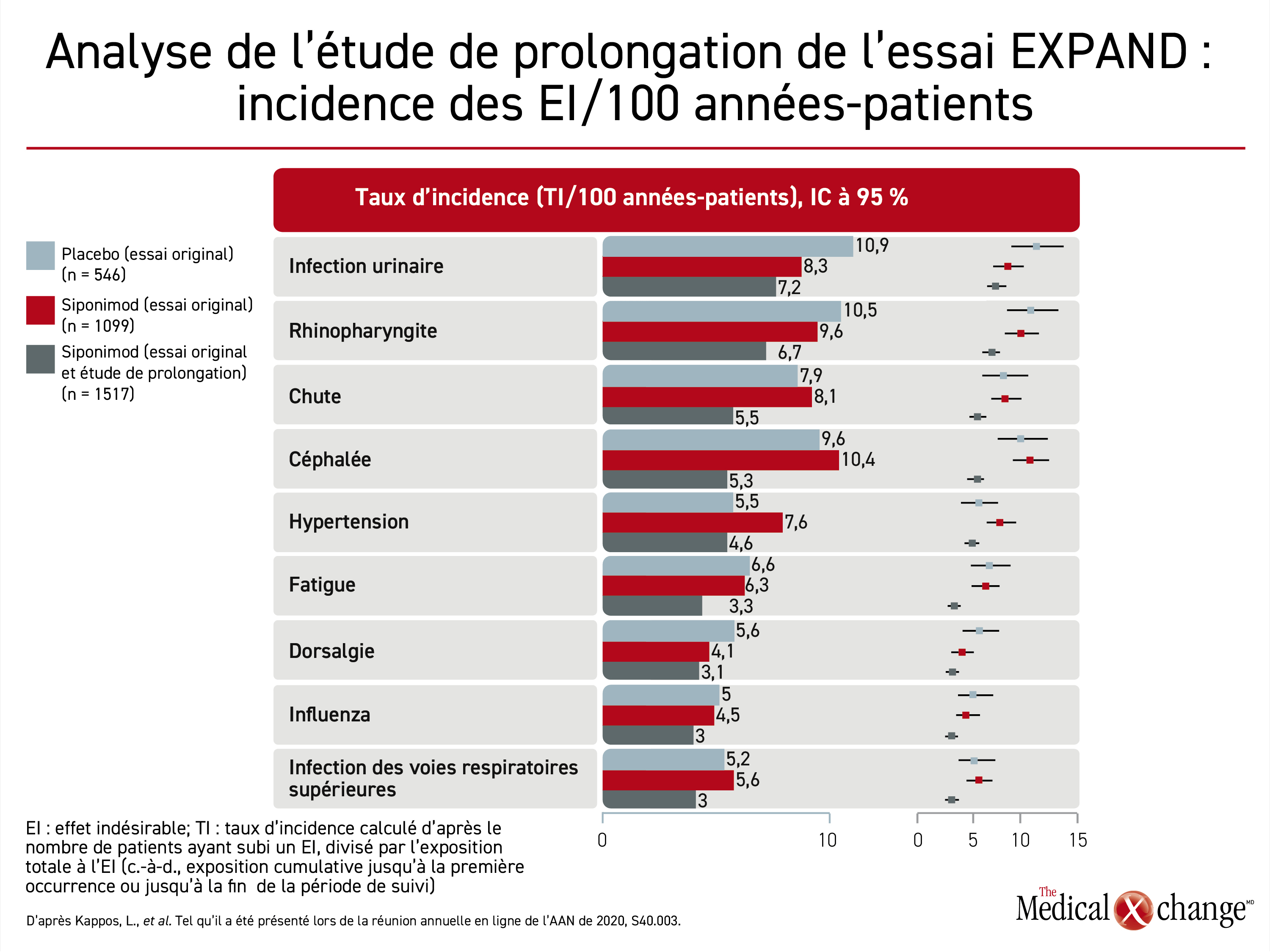
À la réunion en ligne de l’American Academy of Neurology (AAN) tenue la semaine précédente, nous avons appris que durant le plus long suivi de l’étude ouverte de prolongation, aucun effet indésirable nouveau ou inattendu du siponimod ne s’est ajouté à ceux déjà recensés pendant l’essai original. Pendant ce dernier, les écarts entre les taux d’effets indésirables, graves ou non, étaient généralement faibles. Pendant le suivi de l’étude de prolongation, les taux d’effets indésirables d’intérêt particulier, notamment ceux qui étaient légèrement plus fréquents dans le groupe siponimod de l’essai original (p. ex., hypertension et bradycardie), se sont révélés plutôt comparables ou plus faibles que ceux du placebo enregistrés préalablement (Tableau 1). « L’innocuité observée après 5 années de suivi cadre avec celle obtenue pendant l’essai EXPAND », a dit le Dr Kappos lors de la réunion annuelle de l’AAN.
Le premier traitement permettant de prévenir l’invalidité
Avant l’essai EXPAND, aucun traitement ne permettait de ralentir systématiquement l’évolution de la SPPS. Au cours de cet essai, 1651 patients atteints de SPPS ont été affectés aléatoirement au siponimod ou à un placebo (rapport de 2:1). La SP remontait à 10 ans ou plus chez la plupart d’entre eux et il s’était écoulé 3,8 ans en moyenne depuis la transition vers la SPPS.
Selon l’évaluation du critère de jugement principal, soit une ASI depuis 3 mois confirmée, le siponimod a réduit l’invalidité de 21 % (RRI : 0,79; p = 0,013) par rapport au placebo après un délai de médian de 21 mois. Ce gain relatif a été observé même si la SPPS des patients était assez avancée au moment de leur recrutement, à preuve le score médian de 6,0 qu’ils avaient obtenu à l’échelle EDSS (Expanded Disability Status Scale) à ce moment-là.
Le siponimod est un modulateur des récepteurs de la sphingosine-1-phosphate (S1P) qui intervient dans la circulation des lymphocytes. D’après les études précliniques, les effets positifs augmentent lorsque les lymphocytes ne peuvent plus pénétrer dans le système nerveux central et participer à l’activité inflammatoire auto-immune. Or les sous-études EXPAND terminées dernièrement montrent que les tissus cérébraux sont protégés et portent à croire que le siponimod favorise la remyélinisation.
Le RTA permet de mesurer la perte ou la récupération de myéline
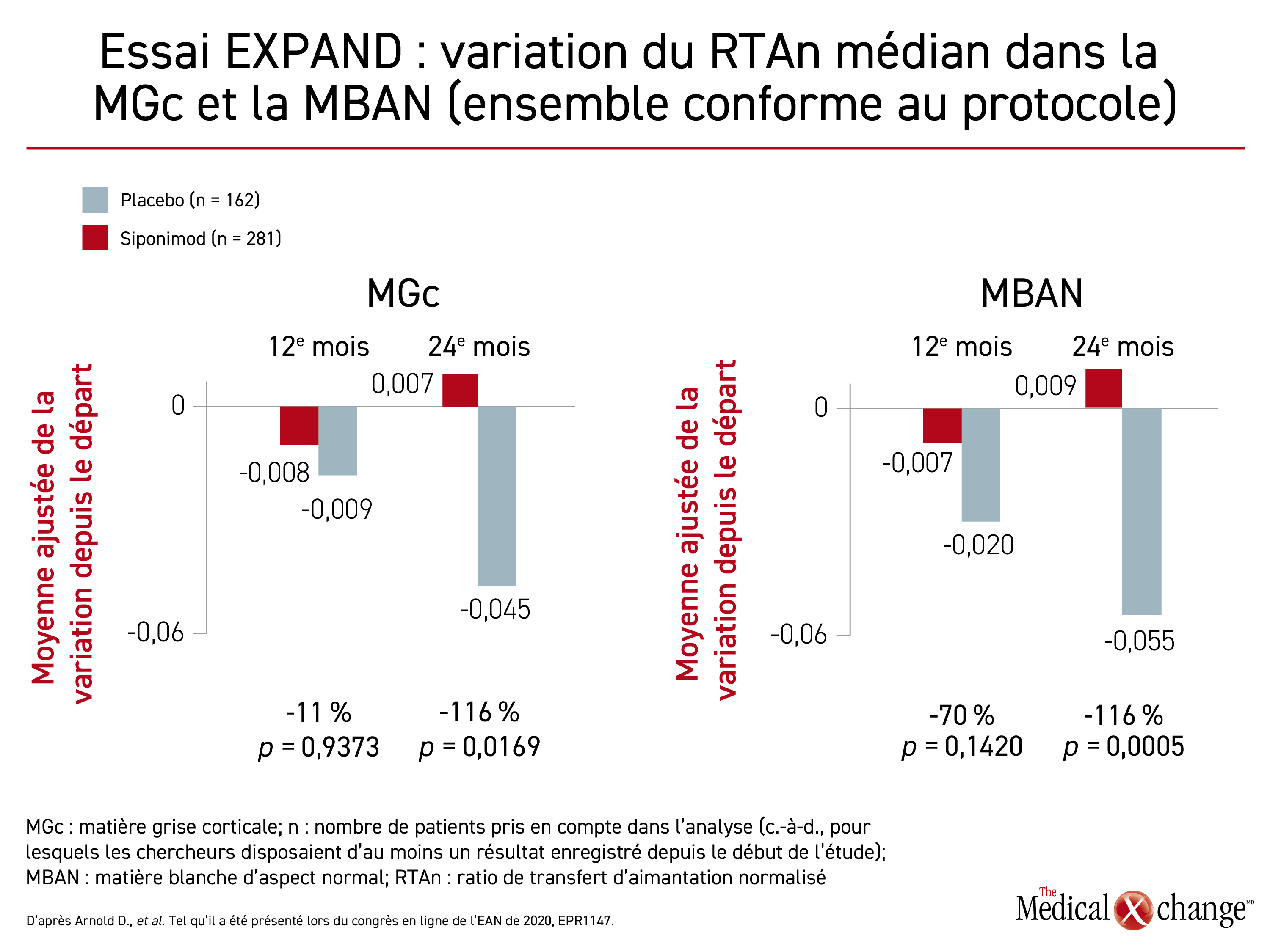
Dans l’une de ces sous-études, 413 patients affectés aléatoirement au siponimod et 226 autres prenant un placebo ont été évalués à l’aide du ratio de transfert d’aimantation (RTA), un outil souvent utilisé pour étudier la SP et d’autres maladies neurodégénératives.
« Le RTA, qui est vu comme un marqueur de la densité de la myéline, témoigne de l’intégrité de la structure tissulaire cérébrale », a expliqué le Dr Douglas L. Arnold, de l’Institut neurologique de Montréal, au Canada. Pendant qu’il présentait ces données à la réunion en ligne de l’EAN de 2020, il a affirmé que les données tirées de l’essai EXPAND avaient déjà relié le siponimod à une protection contre la perte de volume cérébral totale par rapport au placebo, mais que ces données alliées au RTA permettent d’explorer le rétablissement des lésions.
Trois régions cérébrales ont été évaluées : le tissu cérébral d’aspect normal (TCAN), la matière grise corticale (MGc) et la matière blanche d’aspect normal (MBAN). Analysé selon le principe de l’intention de traiter et les prescriptions du protocole, le paramètre d’intérêt était ici la variation du RTA normalisé médian (RTAn), la baisse du RTA indiquant une densification de la myéline pouvant révéler une remyélinisation.
Protection contre la perte de myéline
Il s’est produit la même chose dans les trois régions. La variation du RTA y a laissé entrevoir une perte de myéline plus grande numériquement parlant à 12 mois dans le groupe témoin que dans le groupe siponimod. L’écart n’était pas significatif, mais il convient de noter que la perte de myéline s’est aggravée chez les témoins pendant les 12 mois suivants. Dans le groupe siponimod, la densité de la myéline a été préservée et pourrait avoir augmenté dans deux régions (Figure 3).
Ces données prouvent que le « siponimod favorise le rétablissement des lésions néoformées », a déclaré le Dr Arnold. Le siponimod aurait complètement arrêté la perte de myéline dans les TCAN à 24 mois, tandis que la petite hausse du RTA notée au 24e mois des études sur la MGc et la MBAN indique une remyélinisation. Le Dr Douglas a qualifié ces données de « compatibles avec celles des études précliniques », ce qui confirme que le siponimod peut entraîner la réparation de la myéline.
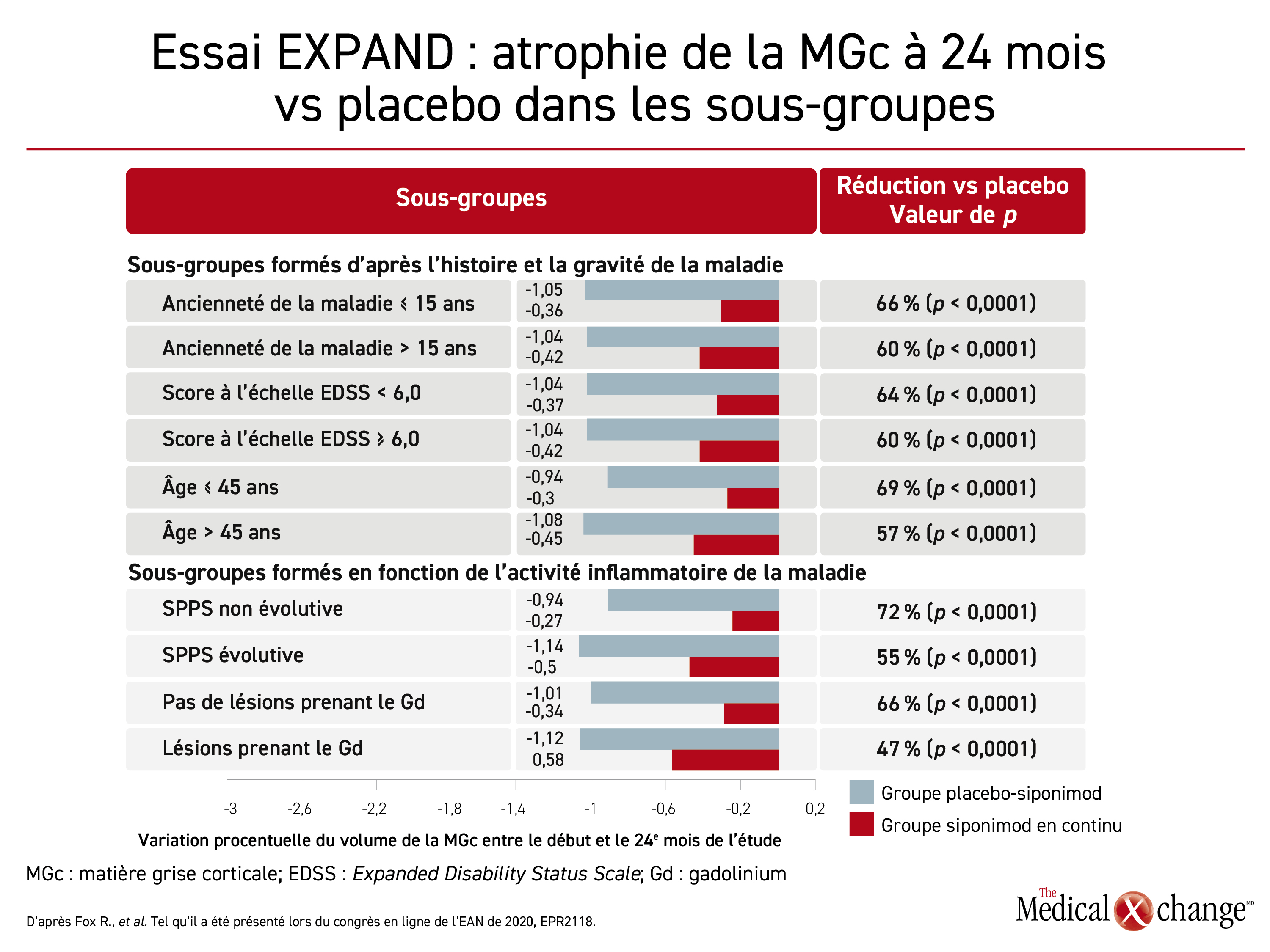
Durant une autre analyse de sous-groupes présentée lors de la réunion de l’EAN, des chercheurs ont calculé la variation procentuelle du volume de MBc pour évaluer a posteriori l’atrophie relative chez les 1560 patients ayant participé à l’essai EXPAND jusqu’à la fin. Leur modèle mixte de mesures répétées leur a permis de comparer les sous-groupes de sujets atteints de SPPS, formés entre autres en fonction de l’âge, de l’ancienneté de la SP ou du score à l’échelle EDSS. Une diminution de l’atrophie de la matière grise avait déjà été rapportée avec le siponimod, mais leur analyse a fourni une évaluation plus fine de la variation du volume de MGc et du volume du thalamus à 24 mois au lieu de 12.
Surveillance du volume de la matière grise
« La SP était considérée comme une maladie touchant surtout la matière blanche, mais nous savons aujourd’hui que l’atrophie de la matière grise a un lien avec une aggravation irréversible de l’invalidité sur le long terme », a expliqué le Dr Ralf Gold, Chef du Département de neurologie, à l’Université de la Ruhr, à Bochum, en Allemagne.
La protection offerte par le siponimod contre la perte de MGc différait peu entre les sous-groupes formés en fonction de l’âge (45 ans ou moins vs plus de 45 ans), de l’ancienneté de la SP (15 ans ou moins vs plus de 15 ans), le score à l’échelle EDSS (moins vs plus de 6,0), de l’évolution ou non de la SPPS et de la présence ou non de lésions prenant le gadolinium (Figure 4). D’un sous-groupe à l’autre, le siponimod a permis d’atténuer l’atrophie de la MGc de 48 % à 116 % à 12 mois par rapport au placebo et cet effet positif était toujours présent à 24 mois. Toutes les différences calculées étaient significatives et la plupart d’entre elles l’étaient amplement (p < 0,0001).
Selon le Dr Gold, l’atrophie du thalamus a aussi diminué, mais l’ampleur de cette réduction variait davantage d’un sous-groupe à l’autre. Par exemple, la protection relative conférée était plus marquée chez les patients jeunes, chez ceux atteints depuis moins longtemps et chez ceux dont la maladie évoluait. La protection relative contre l’atrophie du thalamus n’a pas atteint la signification clinique dans un seul sous-groupe, celui des sujets atteints de SP depuis plus de 15 ans, et ça ne s’est produit qu’à un seul intervalle de mesure, soit celui du 12e mois (p = 0,103). Dans les autres sous-groupes, la protection relative offerte par le siponimod contre l’atrophie du thalamus allait de 30 à 68 % comparativement au placebo (p < 0,05 pour tous).
Selon le Dr Gold, l’uniformité de l’effet et le lien possible entre ces données et les taux réduits d’invalidité et de déclin des fonctions cognitives objectivés pendant l’étude ouverte de prolongation de l’essai EXPAND sont convaincants.
Protection contre l’atrophie dans les cas avancés
Il a ajouté : « La réduction de l’atrophie de la MGc et du thalamus était importante et comparable d’un sous-groupe à l’autre, y compris dans les cas plus avancés. Les résultats de l’étude ouverte de prolongation de l’essai EXPAND montrent qu’il vaut mieux amorcer le traitement plus tôt que tard chez les patients atteints de SPPS, mais ceux des dernières sous-études révèlent que la protection relative contre l’évolution de cette maladie pourrait être comparable qu’il soit entrepris tard au cours de la maladie ou au début. Si l’objectif du traitement de la SPPS reste la préservation de la myéline ou la remyélinisation dans les cas où l’atrophie tissulaire est plus avancée, il demeure que l’effet uniformément positif du siponimod nous renseigne sur un processus pathologique encore mal compris.
« Il n’est jamais trop tôt pour prendre une longueur d’avance sur l’évolution de la sclérose en plaques. »
Commentant les données de l’étude ouverte de prolongation de l’essai EXPAND, le Dr Bruce Cree, Directeur de la recherche clinique à l’Université de Californie, à San Francisco, a fait valoir que l’information la plus importante tirée de cette étude est qu’il existe un traitement contre la SPPS qui permet de prévenir l’aggravation de l’invalidité. Il a précisé que si l’on se fie aux données probantes voulant qu’une détérioration même subtile de l’état physique et des fonctions cognitives laisse entrevoir une issue défavorable, celles tirées de l’essai EXPAND viennent enrichir celles « qui mettent en lumière l’importance cruciale du traitement précoce » pour éviter les effets irréversibles de la maladie.
« Il n’est jamais trop tôt pour prendre une longueur d’avance sur l’évolution de la sclérose en plaques », a affirmé le Dr Cree, renchérissant ainsi sur un des grands messages de l’étude ouverte de prolongation de l’essai EXPAND.
Conclusion
Le long suivi effectué pendant la première étude ayant établi un lien entre un agent pharmacologique et une certaine protection contre l’évolution de la SPPS a révélé que ce bienfait dure cinq ans au moins. Lors de la plus récente évaluation prévue dans le cadre de l’étude ouverte de prolongation de l’essai EXPAND, les diverses mesures objectives de l’invalidité et du déclin des fonctions cognitives prises sur six mois ont mis au jour une protection considérable et significative sur le plan clinique. Les patients ayant été traités le plus longtemps par le siponimod ont bénéficié d’une protection relative plus marquée que les témoins passés à l’agent actif après avoir pris un placebo. Les sous-études des données de l’essai EXPAND original ont établi un parallèle entre le siponimod et une certaine protection contre les lésions du tissu cérébral et une remyélinisation possible.