Neurologie
Sclérose en plaques : revue d'experts et commentaires tirés de la littérature
La sclérose en plaques récurrente-rémittente et les traitements à haute efficacité
Anthony Traboulsee, M.D.
Directeur, Clinique de la SP et Groupe de recherche et d’essais cliniques sur la SP
Centre for Brain Health
Université de la Colombie-Britannique
Vancouver (Colombie-Britannique)
Les patients atteints de sclérose en plaques récurrente-rémittente (SP-RR) que les traitements de première intention ne parviennent pas à maîtriser disposent désormais d’un grand nombre d’options thérapeutiques pour améliorer la maîtrise de cette maladie d’après l’évaluation qu’en donne le taux annualisé de poussées (TAP). Seuls quelques-uns de ces traitements permettent de faire rétrocéder la détérioration fonctionnelle mesurée au moyen de l’échelle EDSS (Expanded Disability Status Scale). Les médicaments qui réduisent le TAP par rapport aux traitements de première génération sont qualifiés d’agents « à haute efficacité », mais il faut savoir que la protection contre la neurodégénérescence représente une mesure plus rigoureuse des bienfaits d’un traitement. Selon le TAP, les agents à haute efficacité tels que le fingolimod permettent de stabiliser la SP-RR. Or les immunosuppresseurs tels que l’alemtuzumab font rétrocéder la détérioration fonctionnelle. Comme c’est le cas pour d’autres agents efficaces utilisés dans le traitement d’induction de la SP-RR, la fenêtre thérapeutique de l’alemtuzumab est relativement étroite; il faut donc l’utiliser de façon sélective auprès de patients bien informés des objectifs et des risques du traitement.
Évolution des traitements jusqu’aux options thérapeutiques actuelles
En 1993, l’interféron bêta-1b a été le premier agent homologué pour le ralentissement de l’évolution naturelle de la SP-RR1. Il a rapidement été rejoint par l’interféron bêta-1a et l’acétate de glatiramère, deux autres médicaments injectables associés à de légères réductions de la fréquence des poussées par rapport à un placebo. Dans le traitement de première intention de la SP-RR, ces agents de référence sont assortis d’un bilan d’innocuité largement éprouvé et favorable, mais la protection qu’ils offrent contre la progression de la maladie reste marginale2. Ces dix dernières années, le nombre croissant de traitements de fond opposés à la SP-RR a permis de personnaliser les traitements. L’arrivée des traitements à haute efficacité, à l’origine réservés aux patients dont la maladie n’était pas bien maîtrisée au moyen d’agents de première génération, a favorisé le perfectionnement de la séquence des traitements visant non seulement à réduire la fréquence des poussées de la SP-RR, mais aussi à en ralentir la progression.
Pour une entrevue exclusive avec le Dr Anthony Traboulsee couvrant l’impact sur la pratique clinique, cliquez ici
Les traitements de la SP-RR actuellement offerts peuvent être classés de multiples façons, notamment par mode d’administration, par mode d’action ou selon leur efficacité ou leur innocuité. Les agents de première génération étaient autoadministrés par injection. Plusieurs agents administrés par voie orale sont venus s’ajouter au fingolimod, le tout premier agent pour voie orale homologué il y a presque 10 ans. Le premier agent administré par perfusion intraveineuse, la mitoxantrone, est sur le marché depuis près de 20 ans, mais plusieurs anticorps monoclonaux ciblés l’ont rejointe depuis, parmi lesquels on compte le natalizumab et l’ocrélizumab, en plus de l’alemtuzumab.
Les modes d’action varient selon les agents. Les agents de première génération se classent parmi les immunomodulateurs, alors que les agents à haute efficacité enrayent, ou du moins restreignent le fonctionnement des cellules immunitaires responsables du processus pathologique auto-immun au sein du système nerveux central. L’alemtuzumab, comme l’ocrélizumab, la cladribine et la mitoxantrone, se classe parmi les inhibiteurs de cellules immunitaires3. Le natalizumab quant à lui bloque la circulation des cellules immunitaires et les empêche de participer à l’attaque inflammatoire sur le système nerveux central4.
Choix du traitement
Tout cet éventail d’options thérapeutiques a fait émerger plusieurs algorithmes de traitement concurrents. Jusqu’à récemment, c’est le paradigme de l’intensification des traitements qui prédominait. Fondé sur une démarche plaçant l’innocuité à l’avant-plan, le traitement des patients commençait habituellement avec un agent de première génération ou un médicament peu puissant, et ce traitement n’était modifié qu’au moment où l’on considérait que la maîtrise de l’évolution de la maladie était insuffisante5. Bien que la définition de maîtrise insuffisante ait fait l’objet de controverses, une démarche proposée en 2013 par le Groupe de travail canadien sur la SP (Canadian MS Working Group) préconisait une intensification des traitements fondée sur l’évolution effrénée de la maladie révélée par l’apparition de symptômes ou par l’IRM6. Des critères précis permettant de qualifier le risque de progression de la maladie de faible, de modéré ou d’important ont été présentés dans une étude récente (Tableau 1).
Cependant, l’incapacité à établir une corrélation entre la réduction du taux de poussées et la protection conférée contre l’aggravation de l’invalidité a soulevé de nombreuses préoccupations, ce qui a jeté des doutes sur le concept même d’intensification des traitements en fonction des symptômes. Un examen de 22 méta-analyses a révélé que les données appuyant les bienfaits à long terme des traitements de fond habituels présentaient des incohérences, malgré la robustesse des données démontrant une diminution de la fréquence des poussées à court terme7. Lors des études de prolongation portant sur les agents de première génération, un taux important d’invalidité s’accompagnait d’une augmentation des taux d’évolution vers une sclérose en plaques progressive secondaire (SPPS) lorsque le suivi s’étendait au-delà de cinq à sept ans8. En raison de l’inquiétude soulevée par la possibilité que les patients recevant des agents à l’efficacité limitée ne bénéficient pas d’une protection optimale contre la progression de la maladie, il a été proposé de recourir plus rapidement à des agents à haute efficacité, en particulier chez les patients présentant des signes avant-coureurs d’une maladie agressive9.
Même s’il est intéressant, le principe reposant sur l’administration plus rapide d’agents plus efficaces ne va pas forcément de soi. Étant donné que les facteurs prévisionnels d’une maladie agressive ne sont pas encore bien établis et que les agents plus efficaces s’accompagnent généralement d’un plus grand risque d’effets indésirables, il est important d’orienter la stratégie thérapeutique en fonction des préférences du patient. Bon nombre des patients ayant attentivement passé en revue l’ensemble des risques et des avantages potentiels d’une telle stratégie pourraient préférer un traitement susceptible de prévenir leur invalidité plutôt qu’un traitement bien toléré, mais dont la capacité à empêcher l’évolution de la maladie reste incertaine.
Évolution en matière de protection cérébrale
La mitoxantrone et le natalizumab comptent parmi les premiers agents associés à une régression de l’invalidité. Lors d’un essai contrôlé par placebo visant à évaluer la mitoxantrone administrée selon un calendrier trimestriel, des améliorations significatives du score enregistré à l’échelle EDSS ont été observées au bout de deux ans10. De même, une analyse a posteriori de l’essai AFFIRM, un essai déterminant mené sur le natalizumab, a fait ressortir une augmentation de 69 % de la probabilité cumulée d’amélioration du score à l’échelle EDSS au bout de deux ans par rapport au placebo11.
Cependant, d’importantes manifestations indésirables ont limité l’utilité de ces deux agents. Dans le cas de la mitoxantrone, une cardiotoxicité liée à la dose porte à croire que l’exposition à vie ne devrait pas dépasser 140 mg/m2 12. Le natalizumab a d’abord été retiré du marché en raison de son lien avec la leucoencéphalopathie multifocale progressive (LEMP), une complication mettant en jeu le pronostic vital. Comme il faisait preuve d’une efficacité inégalée au moment de son retrait du marché, il y a été réintroduit par la suite aux fins d’utilisation clinique, mais sous condition d’une prise en charge attentive du risque de LEMP13. Même si la menace posée par l’apparition d’une LEMP est réduite grâce aux programmes d’atténuation des risques14, le natalizumab est habituellement réservé aux cas réfractaires aux agents employés en première et en deuxième intention.
L’étude de phase III intitulée CARE-MS II portant sur l’alemtuzumab avait pour paramètres d’évaluation principaux le TAP et l’aggravation soutenue de l’invalidité15. Les patients atteints d’une SP-RR recrutés dans cette étude avaient présenté des poussées de la maladie pendant un traitement de première intention. L’agent de comparaison était l’interféron bêta-1a. Les patients ont reçu de l’alemtuzumab une fois par jour pendant cinq jours au départ, puis un deuxième traitement de trois jours au bout de 12 mois. L’interféron, quant à lui, a été administré trois jours par semaine pendant toute la durée de l’étude.
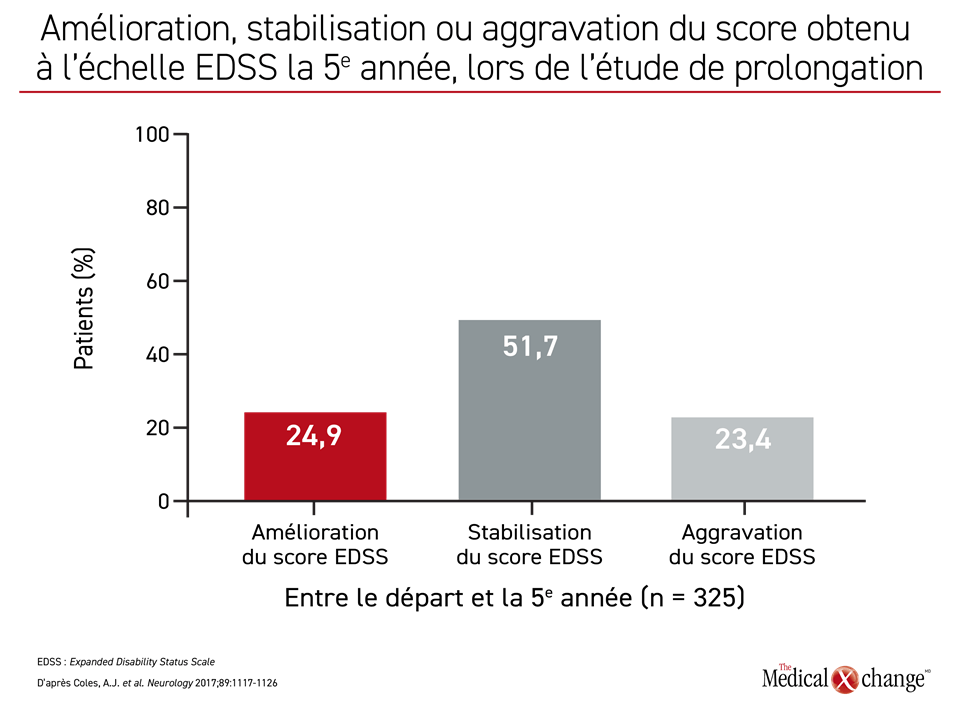
Au bout de deux ans, l’alemtuzumab affichait un avantage relatif important et très significatif pour les deux paramètres d’évaluation principaux. À preuve, le rapport des risques instantanés (RRI) avait baissé de plus de 40 % pour ce qui est de l’aggravation soutenue de l’invalidité (RRI : 0,58; p = 0,008). Or les études de prolongation ont mis au jour une protection encore plus grande contre la progression de la maladie. En effet, lors d’une étude de prolongation de trois ans dans laquelle ont été recrutés 92 % des patients ayant participé à l’essai à répartition aléatoire initial, le score enregistré à l’échelle EDSS de 24,9 % des patients ayant reçu de l’alemtuzumab s’était amélioré par rapport au départ16. Chez la plupart des autres patients, il est resté stable tout au long de la période de suivi prolongé (Figure 1).
Dans l’ensemble, la maladie de 51,8 % des patients n’a pas du tout progressé sur le plan clinique de la troisième à la cinquième année de l’étude de prolongation, et 48,6 % des patients ne présentaient aucune activité lésionnelle à l’IRM. Ces résultats étaient confirmés par l’amélioration de plusieurs autres mesures fonctionnelles par rapport au départ, comme le score à l’échelle MSFC (Multiple Sclerosis Functional Composite). Environ la moitié des patients affectés aléatoirement à l’alemtuzumab ont obtenu des améliorations dans chacun des sept domaines d’analyse fonctionnelle de l’échelle EDSS17.
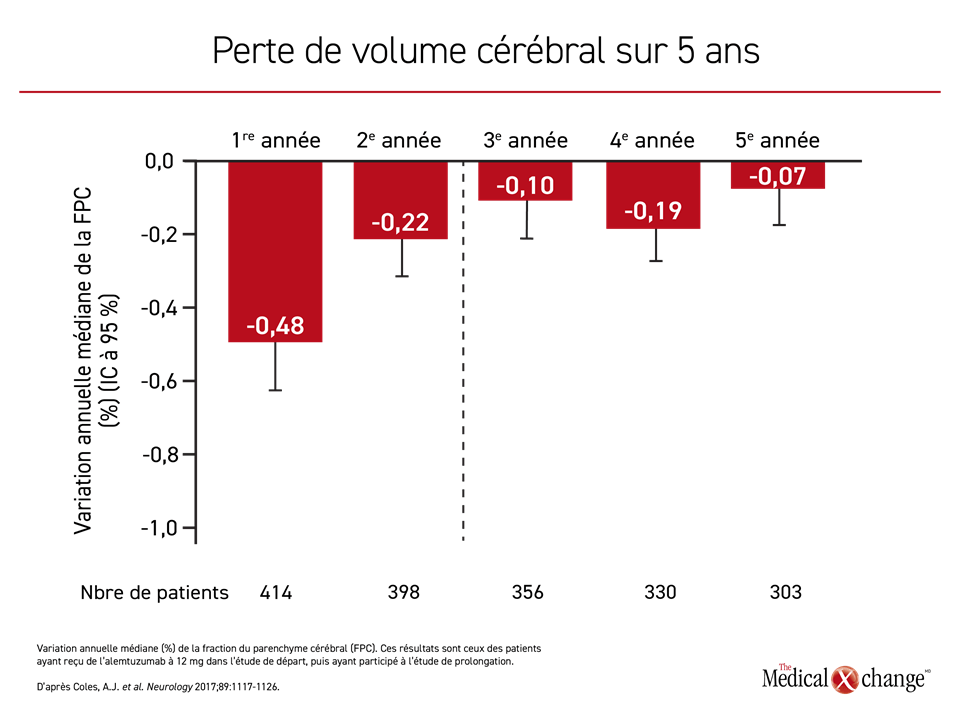
Fait important à mentionner et ayant possiblement un lien avec la capacité de l’alemtuzumab à empêcher la progression de la maladie : une deuxième étude de prolongation de longue durée, l’étude TOPAZ, a permis de constater une réduction de la perte de volume cérébral au fil du temps18 (Figure 2). Aucun autre traitement de la SP n’a eu des répercussions d’une telle ampleur sur la prévention de l’évolution de l’atrophie cérébrale, malgré des effets du même ordre sur la réduction du TAP. Dans le cadre du suivi des patients ayant participé aux quatre années de l’étude de prolongation CARE-MS II et ayant entrepris une période de prolongation supplémentaire de cinq ans qui n’est pas encore terminée, le score moyen à l’échelle EDSS s’est amélioré de 0,17 point, et il s’est amélioré ou est resté stable chez 70 % des patients au terme d’un suivi médian de huit ans19.
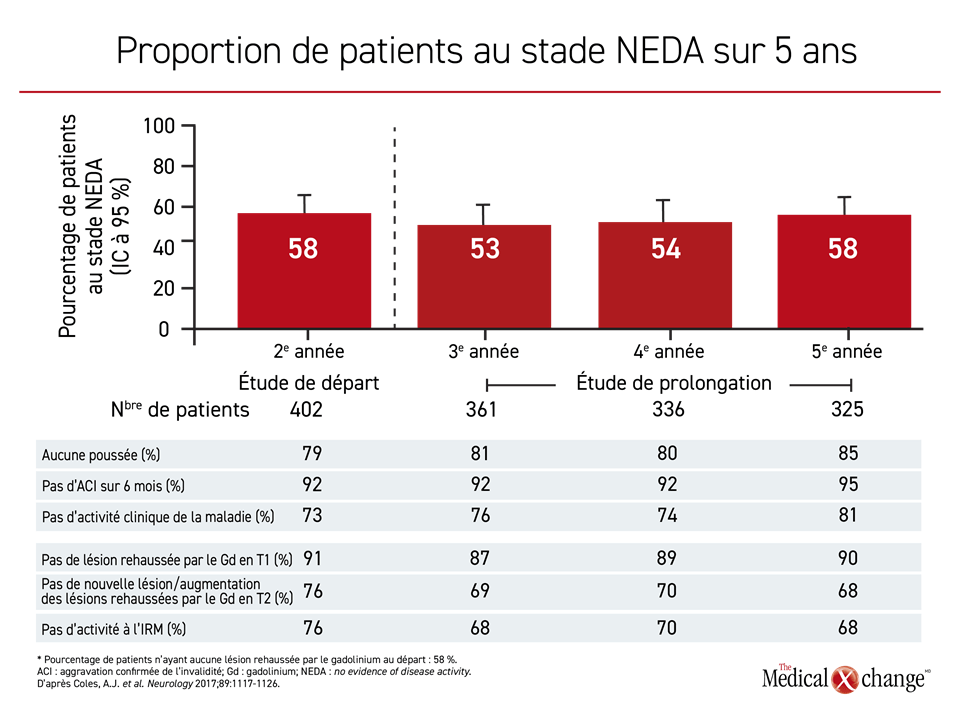
Ces bienfaits ont été observés même chez les patients ayant reçu peu, voire pas du tout, de traitements complémentaires à l’issue du protocole de phase III. Pendant la période de prolongation, quand l’alemtuzumab était offert au besoin, seulement 20,4 % des patients ont reçu un traitement supplémentaire par cet agent durant la 3e année. Or, les taux étaient encore plus bas la 4e et la 5e année. D’autres traitements de fond ont été proposés aux patients pendant cette période, mais moins de 10 % d’entre eux ont reçu un agent dirigé contre leur SP-RR, qui n’était pas de l’alemtuzumab. À la 5e année de suivi, la proportion de patients ne présentant aucun signe d’activité de la maladie (stade ASSAM) est toutefois restée la même qu’à la 2e (Figure 3).
Rien ne permet d’affirmer avec certitude que d’autres agents inhibiteurs des cellules immunitaires d’usage courant exercent des bienfaits similaires. L’essai déterminant de phase III mené sur la cladribine, un agent administré par voie orale, était contrôlé par placebo et avait le TAP pour paramètre d’évaluation principal20. Le TAP était aussi le paramètre d’évaluation principal des deux essais de phase III menés sur l’ocrélizumab, un anticorps monoclonal anti-CD20, mais l’agent de comparaison était de l’interféron bêta-1a21. Il est ressorti de chacun de ces essais que l’agent expérimental était supérieur à l’agent de comparaison pour ce qui était du TAP et de la protection relative conférée contre l’aggravation soutenue de l’invalidité. En outre, la proportion de patients présentant une amélioration durable de leur score à l’échelle EDSS dépassait de 33 % celle obtenue avec l’interféron.
Les traitements d’induction : traitement de l’affection
Devant le nombre croissant d’agents opposés à la SP-RR, on a d’abord considéré que les stratégies d’intensification du traitement étaient une bonne ligne de conduite. Par rapport à l’absence de traitement, les immunomodulateurs de première génération réduisent le risque de poussées et sont bien tolérés. L’intérêt suscité par des stratégies différentes, notamment les traitements d’induction, est nourri par la volonté d’entraver plus radicalement l’évolution de la maladie. Contrairement aux immunomodulateurs, les agents entraînant une déplétion des cellules immunitaires, comme la mitoxantrone et l’alemtuzumab, ciblent des facteurs intervenant dans le processus auto-immun.
Les stratégies d’induction ne sont pas nouvelles, qu’elles soient mises en œuvre d’emblée ou après l’échec d’autres traitements22. Lors d’une étude d’observation à long terme publiée il y a plus de 10 ans, l’administration d’un traitement d’induction par la mitoxantrone suivi d’un traitement d’entretien par un immunomodulateur a été reliée à une stabilisation durable de la maladie pendant au moins cinq ans23. Une étude visant à évaluer un traitement d’entretien par de l’acétate de glatiramère administré après un traitement d’induction par le cyclophosphamide a mis au jour des réductions significatives du TAP et des lésions rehaussées par le gadolinium à deux ans24.
L’alemtuzumab est l’agent le plus étudié comme traitement d’induction de la SP-RR. Après un traitement par l’alemtuzumab, la déplétion des lymphocytes T CD4+ et des lymphocytes B peut durer jusqu’à un an. Cette déplétion a été associée à une reprogrammation du système immunitaire25. Avec le temps, les cellules du système immunitaire prolifèrent de nouveau, mais les types de cellules pro-inflammatoires s’y retrouvent en proportions réduites, un effet attribué à la restauration des réseaux de tolérance immunitaire. Le facteur temps peut avoir son importance. L’alemtuzumab n’a pas fait preuve d’un effet protecteur contre la SPPS, ce qui porte à croire qu’il faudrait y avoir recours avant que les lésions au système nerveux central ne soient trop importantes22.
L’utilisation plus précoce et plus fréquente des traitements d’induction se fonde sur l’évolution des objectifs thérapeutiques. Plutôt que de tenter de modifier l’activité du système immunitaire, ce qui jusqu’à maintenant s’est révélé peu utile pour prévenir l’aggravation de l’invalidité, les traitements qui atténuent l’activité inflammatoire visent à entraver le processus pathologique, ce qui peut éviter l’apparition d’une atteinte structurelle, d’où la préservation de la fonction cérébrale26. Bien que les patients atteints d’une SP-RR agressive soient habituellement considérés comme les meilleurs candidats pour une telle méthode, l’évolution naturelle de la maladie est difficile à prévoir. Selon la définition de l’invalidité dans les cinq ans suivant le diagnostic, une SP agressive ne se verra que chez 10 % des patients environ27, mais presque tous les patients atteints de SP-RR sont exposés à l’évolution de leur maladie. Lors d’une étude menée chez des patients atteints de SP-RR suivis pendant 15 ans, seulement 2,9 % d’entre eux ont obtenu un score inférieur à 3 à l’échelle EDSS et n’affichaient aucun signe d’atteinte cognitive28.
Sélection des patients : évaluation du rapport entre les avantages et les risques
Les traitements exerçant de puissants effets sur le système immunitaire comportent habituellement des risques; il est donc nécessaire de calculer le rapport entre les avantages et les risques de ces traitements. L’alemtuzumab ne fait pas exception. Bien que les réactions associées à la perfusion soient les manifestations indésirables les plus fréquemment signalées lors des études cliniques, il est important de renseigner les patients sur les risques d’infections et de maladies auto-immunes secondaires, ces risques étant plus grands avec l’alemtuzumab.
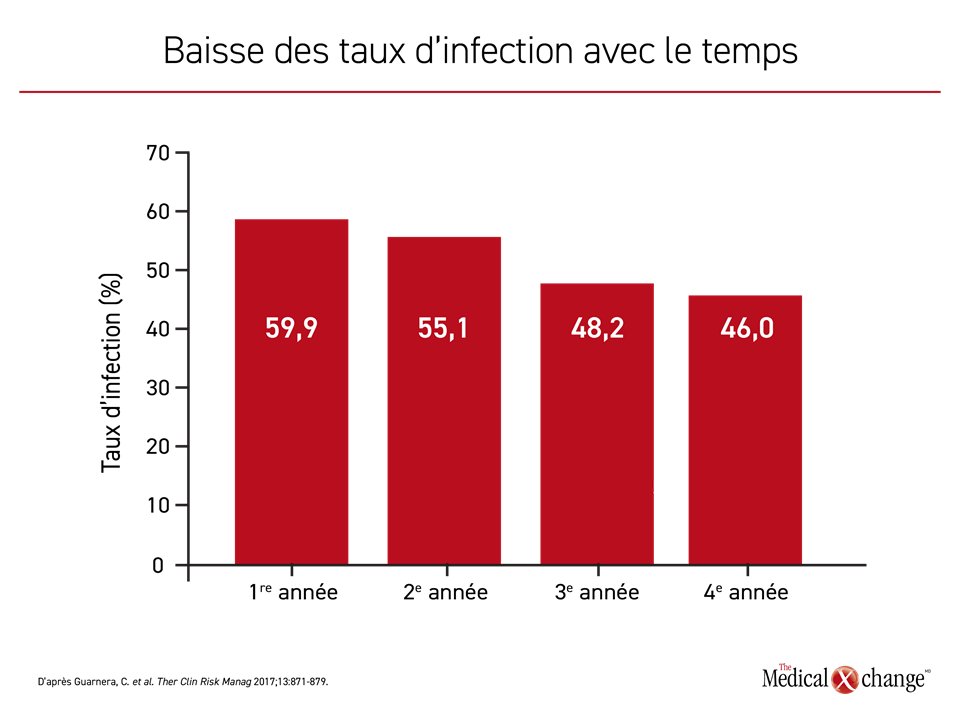
Dans le cadre de l’essai CARE-MS II, la majorité des patients répartis aléatoirement dans l’un ou l’autre des groupes de sujets a contracté une infection durant la période de l’étude (77 % des patients du groupe recevant l’alemtuzumab contre 66 % des patients recevant l’interféron bêta-1a). Il s’agissait surtout d’infections des voies respiratoires supérieures. Les infections graves ont été peu fréquentes dans les deux groupes de traitement, mais leur taux était légèrement plus faible dans le groupe recevant l’alemtuzumab (1 % contre 4 %). Lors des études de prolongation, les taux d’infection dans les groupes alemtuzumab ont diminué à chacune des années de l’étude, passant de 59,9 % la première année à 46 % la quatrième année (Figure 4). Compte tenu du lien entre l’alemtuzumab et un risque accru d’infections virales causées notamment par le virus de l’herpès et le virus varicelle-zona, les patients doivent se faire vacciner contre les maladies infectieuses évitables avant l’instauration d’un traitement par cet agent. Des infections rares, comme une méningite à Listeria et une forme pulmonaire de nocardiose imputable à Nocardia beijingensis29,30, ont été signalées chez des patients traités par de l’alemtuzumab, mais aucune n’a eu d’issue fatale.
Un parallèle a également été établi entre l’alemtuzumab et des maladies auto-immunes secondaires ayant possiblement un rapport avec la régénération post-thérapeutique des lymphocytes T. Elles touchent le plus souvent la thyroïde, entraînant des complications comme l’hyperthyroïdie, l’hypothyroïdie et la thyroïdite. Lors de l’essai CARE-MS II, cela s’est produit chez environ 16 % des patients15. Un purpura thrombocytopénique idiopathique (PTI), qui est également de nature auto-immune, a été observé chez 1 % des patients. Pendant l’essai CAMMS22331, un patient recevant de l’alemtuzumab ayant présenté un PTI a succombé à une hémorragie intracrânienne attribuée à cette complication. Toutefois, les complications auto-immunes ne sont habituellement pas difficiles à traiter chez les patients à qui l’on a expliqué comment en reconnaître les symptômes et les signaler.
L’utilisation de l’alemtuzumab comporte des risques importants, quoique généralement maîtrisables si les patients sont surveillés convenablement. Même s’il ne faut pas les sous-estimer, le rapport entre ces risques et les avantages de ce traitement peut être considéré comme favorable chez bon nombre de patients, notamment chez ceux dont la SP évolue rapidement peu de temps après s’être déclarée, un phénotype associé à une progression accélérée de la maladie3,8,32-34. Cependant, la plupart des patients atteints de SP-RR sont exposés à la progression de leur maladie. Comme les régimes thérapeutiques d’induction comportent d’autres caractéristiques, notamment le fait que les traitements par l’alemtuzumab soient administrés à un an d’intervalle, les patients choisiront vraisemblablement un traitement assorti d’un faible risque relatif d’aggravation de leur invalidité.
Conclusion
L’augmentation importante du nombre et des types de traitements de la SP-RR permet désormais une personnalisation des soins beaucoup plus grande. Les agents à haute efficacité, y compris ceux qui s’administrent par voie orale, réduisent la fréquence des poussées et retardent l’apparition de l’invalidité par rapport aux immunomodulateurs de première génération. Les traitements conçus pour entraîner une déplétion des cellules immunitaires responsables de la SP-RR permettent quant à eux de s’attaquer au processus physiopathologique sous-jacent comparativement aux traitements à haute efficacité. En éliminant les cellules immunitaires pour reprogrammer la réaction inflammatoire, l’alemtuzumab a été relié à une régression de l’invalidité plutôt qu’à sa simple stabilisation, comme en fait foi l’échelle EDSS. Cet effet s’accompagne d’une hausse du risque d’infections et de maladies auto-immunes secondaires, qui peuvent être graves, mais qui sont maîtrisables chez les patients à qui l’on a enseigné comment en reconnaître les signes et les symptômes.
Il faut inciter les patients atteints de SP-RR qui connaissent bien leur maladie et les traitements existants à soupeser les avantages et les risques des options thérapeutiques qui leur sont offertes. Les immunomodulateurs de première génération sont sûrs, mais leur efficacité est limitée. Les stratégies d’intensification des traitements étaient un moyen sensé d’enchaîner les unes après les autres les options thérapeutiques toujours plus nombreuses, mais l’évolution de la SP-RR est inévitable chez la quasi-totalité des patients. L’alemtuzumab constitue une option de traitement précoce ou même de première intention raisonnable dans les cas de SP-RR affichant les caractéristiques d’une maladie très agressive ou chez les patients qui souhaitent avant tout éviter de devenir invalides ou de perdre leurs fonctions cognitives.
Références
- Lublin F. History of modern multiple sclerosis therapy. J Neurol 2005;252 Suppl 3:iii3-iii9.
- Grand’Maison F, Yeung M, Morrow SA et al. Sequencing of disease-modifying therapies for relapsing-remitting multiple sclerosis: a theoretical approach to optimizing treatment. Curr Med Res Opin 2018;34:1419-30.
- Freedman MS, Selchen D, Prat A, Giacomini PS. Managing Multiple Sclerosis: Treatment Initiation, Modification, and Sequencing. Can J Neurol Sci 2018;45:489-503.
- Rice GP, Hartung HP, Calabresi PA. Anti-alpha4 integrin therapy for multiple sclerosis: mechanisms and rationale. Neurology 2005;64:1336-42.
- Fenu G, Lorefice L, Frau F, Coghe GC, Marrosu MG, Cocco E. Induction and escalation therapies in multiple sclerosis. Antiinflamm Antiallergy Agents Med Chem 2015;14:26-34.
- Ontaneda D, Tallantyre E, Kalincik T, Planchon SM, Evangelou N. Early highly effective versus escalation treatment approaches in relapsing multiple sclerosis. Lancet Neurol 2019;18:973-80.
- Claflin SB, Broadley S, Taylor BV. The Effect of Disease Modifying Therapies on Disability Progression in Multiple Sclerosis: A Systematic Overview of Meta-Analyses. Front Neurol 2018;9:1150.
- Stankiewicz JM, Weiner HL. An argument for broad use of high efficacy treatments in early multiple sclerosis. Neurol Neuroimmunol Neuroinflamm 2020;7.
- Grand’Maison F, Yeung M, Morrow SA et al. Sequencing of high-efficacy disease-modifying therapies in multiple sclerosis: perspectives and approaches. Neural Regen Res 2018;13:1871-4.
- Scott LJ, Figgitt DP. Mitoxantrone: a review of its use in multiple sclerosis. CNS Drugs 2004;18:379-96.
- Phillips JT, Giovannoni G, Lublin FD et al. Sustained improvement in Expanded Disability Status Scale as a new efficacy measure of neurological change in multiple sclerosis: treatment effects with natalizumab in patients with relapsing multiple sclerosis. Mult Scler 2011;17:970-9.
- Morrissey SP, Le Page E, Edan G. Mitoxantrone in the treatment of multiple sclerosis. Int MS J 2005;12:74-87.
- McCormack PL. Natalizumab: a review of its use in the management of relapsing-remitting multiple sclerosis. Drugs 2013;73:1463-81.
- Brandstadter R, Katz Sand I. The use of natalizumab for multiple sclerosis. Neuropsychiatr Dis Treat 2017;13:1691-702.
- Coles AJ, Twyman CL, Arnold DL et al. Alemtuzumab for patients with relapsing multiple sclerosis after disease-modifying therapy: a randomised controlled phase 3 trial. Lancet 2012;380:1829-39.
- Coles AJ, Cohen JA, Fox EJ et al. Alemtuzumab CARE-MS II 5-year follow-up: Efficacy and safety findings. Neurology 2017;89:1117-26.
- Giovannoni G, Cohen JA, Coles AJ et al. Alemtuzumab improves preexisting disability in active relapsing-remitting MS patients. Neurology 2016;87:1985-92.
- Schippling S, Pelletier D, Barnett M, Boster A, Comi G. Alemtuzumab reduced MRI lesions and the rate of brain volume loss in CARE-MS II patients switching from SC IFNB-1a: 5-year follow-up (TOPAZ study). Neurology 2018;90:P5.301.
- Alrouighani R, Singer BA, Broadley S, Eichau S, Hartung HP. Alemtuzumab improves clinical and MRI disease activity outcomes, including slowing of brain volume loss, iin relapsing-remitting multiple sclerosis patients over 8 years: CARE-MS II follow-up (TOPAZ study). Mult Scler Relat Disord 2018;26:258 (P609).
- Giovannoni G, Comi G, Cook S et al. A placebo-controlled trial of oral cladribine for relapsing multiple sclerosis. N Engl J Med 2010;362:416-26.
- Hauser SL, Bar-Or A, Comi G et al. Ocrelizumab versus Interferon Beta-1a in Relapsing Multiple Sclerosis. N Engl J Med 2017;376:221-34.
- Le Page E, Edan G. Induction or escalation therapy for patients with multiple sclerosis? Rev Neurol (Paris) 2018;174:449-57.
- Le Page E, Leray E, Taurin G et al. Mitoxantrone as induction treatment in aggressive relapsing remitting multiple sclerosis: treatment response factors in a 5 year follow-up observational study of 100 consecutive patients. J Neurol Neurosurg Psychiatry 2008;79:52-6.
- Cocco E, Marrosu MG. The current role of mitoxantrone in the treatment of multiple sclerosis. Expert Rev Neurother 2014;14:607-16.
- Cossburn M, Pace AA, Jones J et al. Autoimmune disease after alemtuzumab treatment for multiple sclerosis in a multicenter cohort. Neurology 2011;77:573-9.
- Cornaby C, Gibbons L, Mayhew V, Sloan CS, Welling A, Poole BD. B cell epitope spreading: mechanisms and contribution to autoimmune diseases. Immunol Lett 2015;163:56-68.
- Menon S, Shirani A, Zhao Y et al. Characterising aggressive multiple sclerosis. J Neurol Neurosurg Psychiatry 2013;84:1192-8.
- Tallantyre EC, Major PC, Atherton MJ et al. How common is truly benign MS in a UK population? J Neurol Neurosurg Psychiatry 2019;90:522-8.
- Sheikh-Taha M, Corman LC. Pulmonary Nocardia beijingensis infection associated with the use of alemtuzumab in a patient with multiple sclerosis. Mult Scler 2017;23:872-4.
- Rau D, Lang M, Harth A et al. Listeria Meningitis Complicating Alemtuzumab Treatment in Multiple Sclerosis–Report of Two Cases. Int J Mol Sci 2015;16:14669-76.
- Investigators CT, Coles AJ, Compston DA et al. Alemtuzumab vs. interferon beta-1a in early multiple sclerosis. N Engl J Med 2008;359:1786-801.
- Fernandez O. Is there a change of paradigm towards more effective treatment early in the course of apparent high-risk MS? Mult Scler Relat Disord 2017;17:75-83.
- Rush CA, MacLean HJ, Freedman MS. Aggressive multiple sclerosis: proposed definition and treatment algorithm. Nat Rev Neurol 2015;11:379-89.
- Rudick RA, Lee JC, Cutter GR et al. Disability progression in a clinical trial of relapsing-remitting multiple sclerosis: eight-year follow-up. Arch Neurol 2010;67:1329-35.