Rhumatologie
Réunion Convergence de l’American College of Rheumatology (ACR) de 2021
Un inhibiteur de l’IL-17 se montre efficace contre les formes pédiatriques de SpAax-nr et de RP
Réunion en ligne – Lors d’un essai clinique, un inhibiteur biologique de l’interleukine 17A (IL-17A) a permis de maîtriser deux sous-types de l’arthrite juvénile idiopathique (AJI) chez un taux élevé et soutenu d’enfants. Cet effet positif sur l’arthrite avec enthésite (ERA) et le rhumatisme psoriasique juvénile (RPJ) était à prévoir. Les agents qui ciblent l’IL 17 sont déjà indiqués pour le traitement de l’équivalent de ces deux affections chez l’adulte, soit la spondylarthrite axiale non radiographique (SpAax-nr) et le rhumatisme psoriasique (RP). Pendant les 2 années de traitement, les enfants de cette population ont généralement bien toléré l’inhibiteur de l’IL-17, celui-ci ayant affiché un bilan d’innocuité comparable à celui dressé chez les adultes.
Pendant l’étude JUNIPERA, qui a été présentée lors de la réunion Convergence de 2021 de l’ACR, les enfants et les adolescents traités contre une ERA et un RPJ ont répondu rapidement à l’inhibiteur de l’IL‑17 et la plupart d’entre eux ont gardé la maîtrise de leur maladie durant les 104 semaines de suivi. Le sécukinumab, l’inhibiteur de l’IL-17 en question, est indiqué depuis plus de 5 ans pour le traitement de la SpAax-nr et d’autres formes de spondylarthrite ankylosante chez les adultes.
Pour une entrevue exclusive avec le Dr Johannes Roth couvrant l’impact sur la pratique clinique, cliquez ici
Des résultats positifs pour le paramètre d’évaluation principal de l’étude
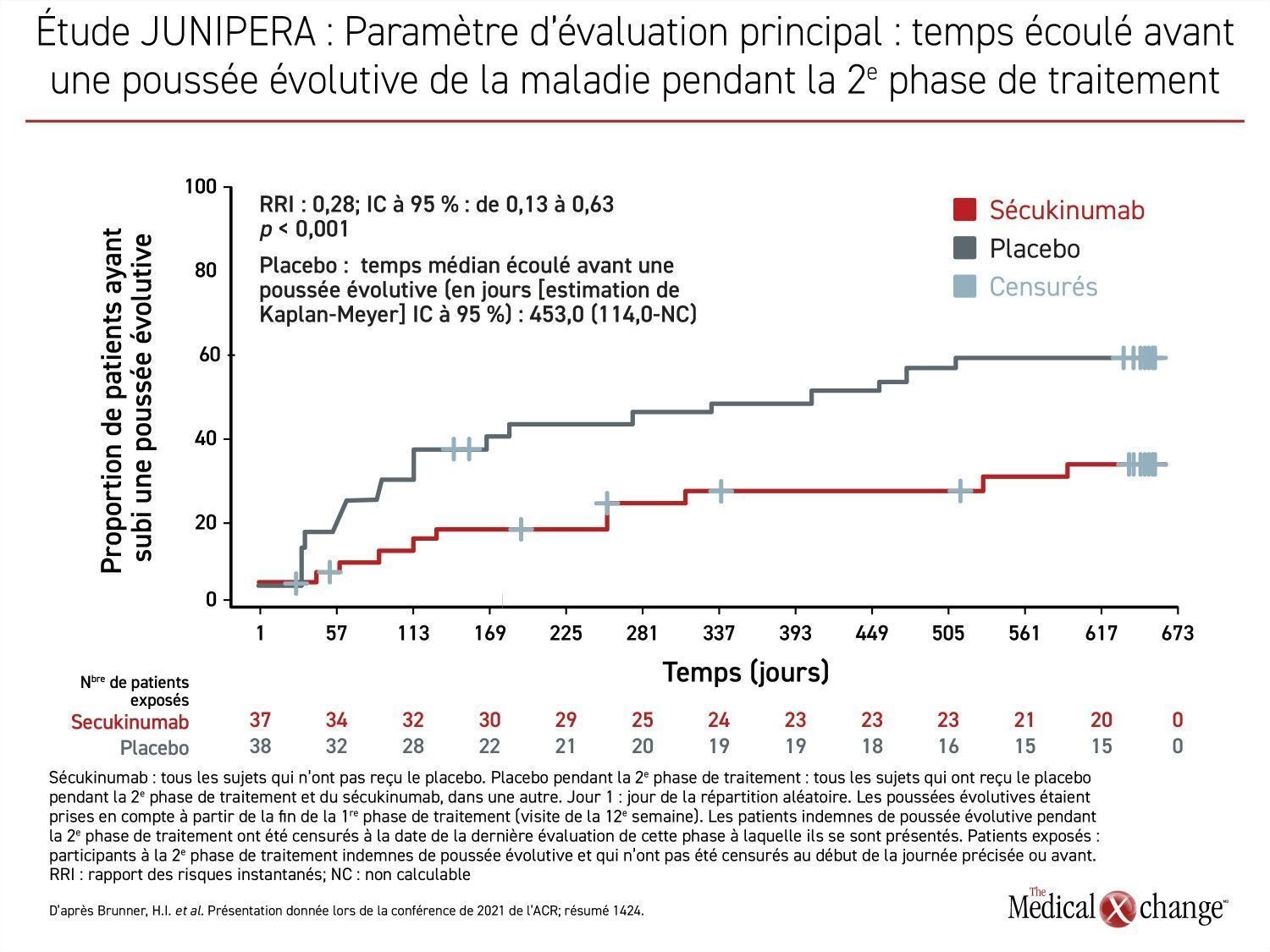
Le paramètre d’évaluation principal de cette étude était le temps écoulé avant que survienne une poussée évolutive durant la 2e phase de traitement (de la 12e à la 104e semaine) menée à l’insu après la phase d’induction de 12 semaines menée en mode ouvert. Le rapport des risques instantanés (RRI) montre que le sécukinumab y a abaissé le risque de poussée évolutive de 72 % (RRI : 0,28; p < 0,001), a rapporté la chercheuse principale, la Dre Hermine I. Brunner, Chef de la Rhumatologie, à l’Hôpital pour enfants de Cincinnati, en Ohio (Figure 1).
« Les scores attribués à l’enthésite et à la dactylite se sont énormément et durablement améliorés chez la plupart des patients pendant ces 2 années », a affirmé la Dre Brunner.
Cette efficacité s’est traduite chez les patients affectés au sécukinumab par un délai beaucoup plus long avant que survienne une poussée évolutive. À preuve, à la fin de la phase de traitement à l’insu, le temps médian écoulé n’était toujours pas atteint dans ce groupe, alors qu’il se chiffrait à 453 jours chez les témoins. Il s’agit d’un délai relativement long pour cette population de patients affligés d’une maladie évolutive, mais cela s’explique par la phase d’induction initiale en mode ouvert, car les patients devaient minimalement y avoir affiché une réponse ACR30 (atténuation d’au moins 30 % des symptômes par rapport aux valeurs de départ, mesurée d’après les nombreux marqueurs de l’activité pathologique définis par l’American College of Rheumatology, dont le nombre d’articulations malades) pour être admis à la phase menée à l’insu de l’étude.
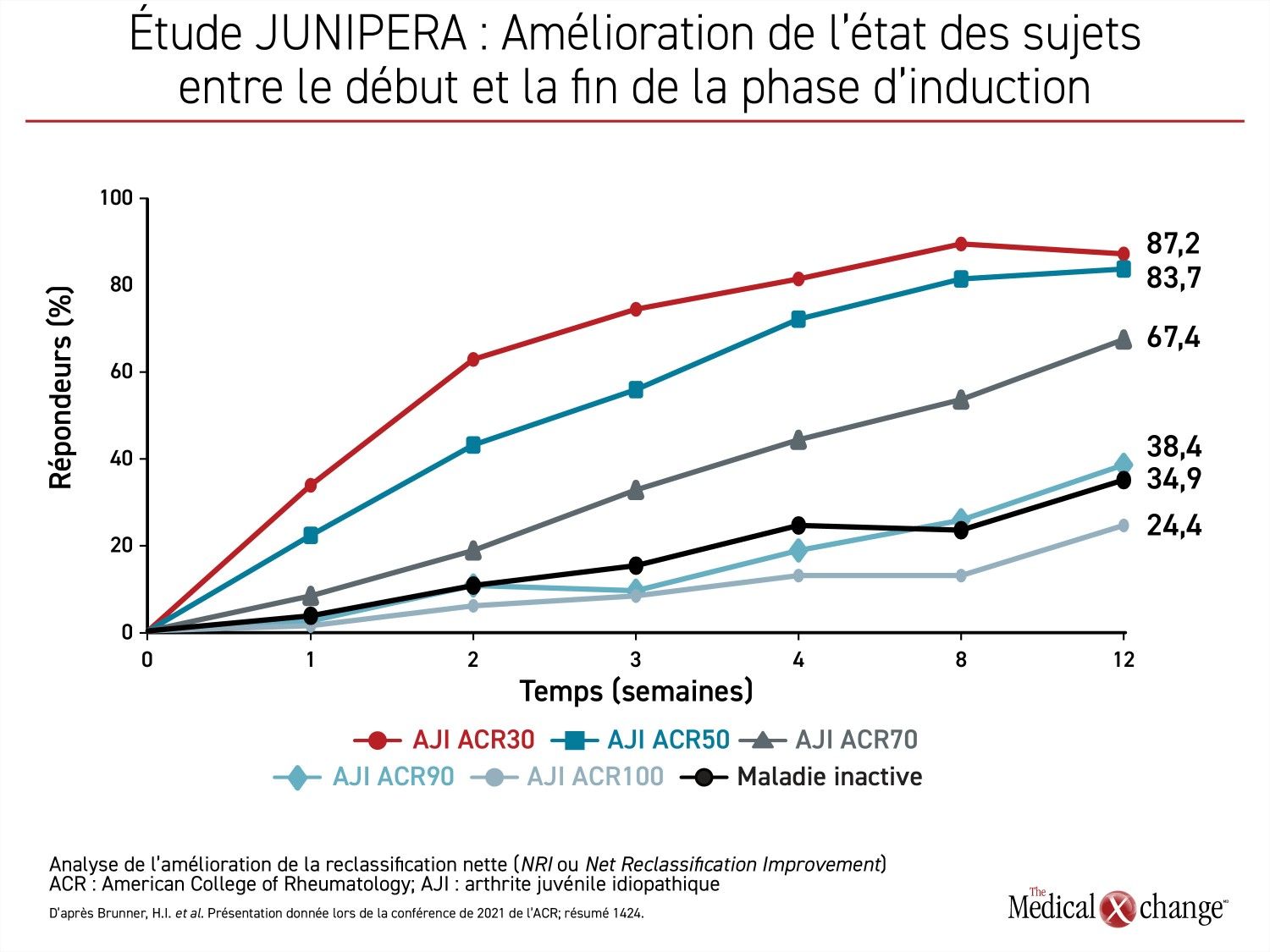
Très peu de participants à la phase ouverte de 12 semaines de l’étude JUNIPERA ont été écartés de la phase à l’insu sur la base de ce critère de réponse. Non seulement près de 90 % des participants à la phase ouverte ont-ils obtenu une réponse ACR30 ou mieux, mais 83,7 % et 67,4 % d’entre eux, soit la majorité, ont affiché une réponse ACR50 ou ACR70, respectivement. À 12 semaines, les symptômes avaient totalement disparu (ACR100) chez un taux substantiel de sujets, soit 24,4 % (Figure 2).
Plan et survol de l’étude JUNIPERA
Au cours de l’étude JUNIPERA, 97 adolescents et enfants âgés de plus de 2 ans ont été sélectionnés. Les critères d’admissibilité étaient les suivants : diagnostic confirmé d’ERA ou de RPJ depuis 6 mois ou plus, réponse insuffisante à au moins un anti-inflammatoire non stéroïdien (AINS) et à un antirhumatismal de fond, et antécédents ou présence d’une enthésite.
Selon le système d’évaluation JADAS-27 (Juvenile Arthritis Disease Activity Score) portant sur 27 articulations, le score attribué à l’activité pathologique s’élevait initialement à 14,8 chez les 52 enfants atteints d’ERA et à 15,5 chez les 34 affligés de RPJ. Environ les deux-tiers des patients des deux groupes recevaient du méthotrexate. Le score total moyen pour l’enthésite se chiffrait à 2,7 et à 2,3 dans les groupes ERA et RPJ. Pour la dactylite, il s’élevait à 0,4 et à 1,8. Toutes ces caractéristiques sont signes d’une atteinte pathologique importante. D’après la Dre Brunner, « un score JADAS-27 de 15 témoigne de symptômes assez intenses ».
Sur les 86 patients recrutés, 83 ont participé à la phase ouverte jusqu’à la fin des 12 semaines, ce qui impliquait 5 doses d’attaque hebdomadaires de sécukinumab, suivies de doses d’entretien mensuelles. Les doses injectées par voie sous-cutanée s’élevaient à 75 mg chez les enfants pesant moins de 50 kg et à 150 mg pour ceux pesant 50 kg ou plus. En moyenne, les enfants avaient à peu près 13 ans et pesaient environ 56 kg.
Sur les 75 participants à la phase à double insu (8 n’ont pas obtenu la réponse ACR30 exigée pour y être admis), 37 ont reçu du sécukinumab et 38 témoins, le placebo. Deux témoins et un patient du groupe sécukinumab ont cessé d’y participer en raison d’un effet indésirable. Les sujets subissant une poussée évolutive ou ayant quitté la phase à l’insu pour une autre raison pouvaient passer à une 2e phase de traitement par le sécukinumab en mode ouvert. Les autres patients poursuivaient la phase à l’insu jusqu’à la fin de l’étude (104e semaine).
Pendant la phase à l’insu, 21 témoins et 10 patients traités par le sécukinumab ont subi des poussées évolutives.
Réponse rapide et atténuation durable
L’évaluation des résultats obtenus pour l’enthésite et la dactylite a révélé que le traitement avait été très efficace dans les deux cas, mais qu’il l’avait été davantage contre la dactylite. Pendant la phase de traitement, le risque de poussée évolutive chez les patients affectés au sécukinumab plutôt qu’au placebo était de 85 % (RRI : 0,15) pour la dactylite et de 55 % (RRI : 0,45) pour l’enthésite.
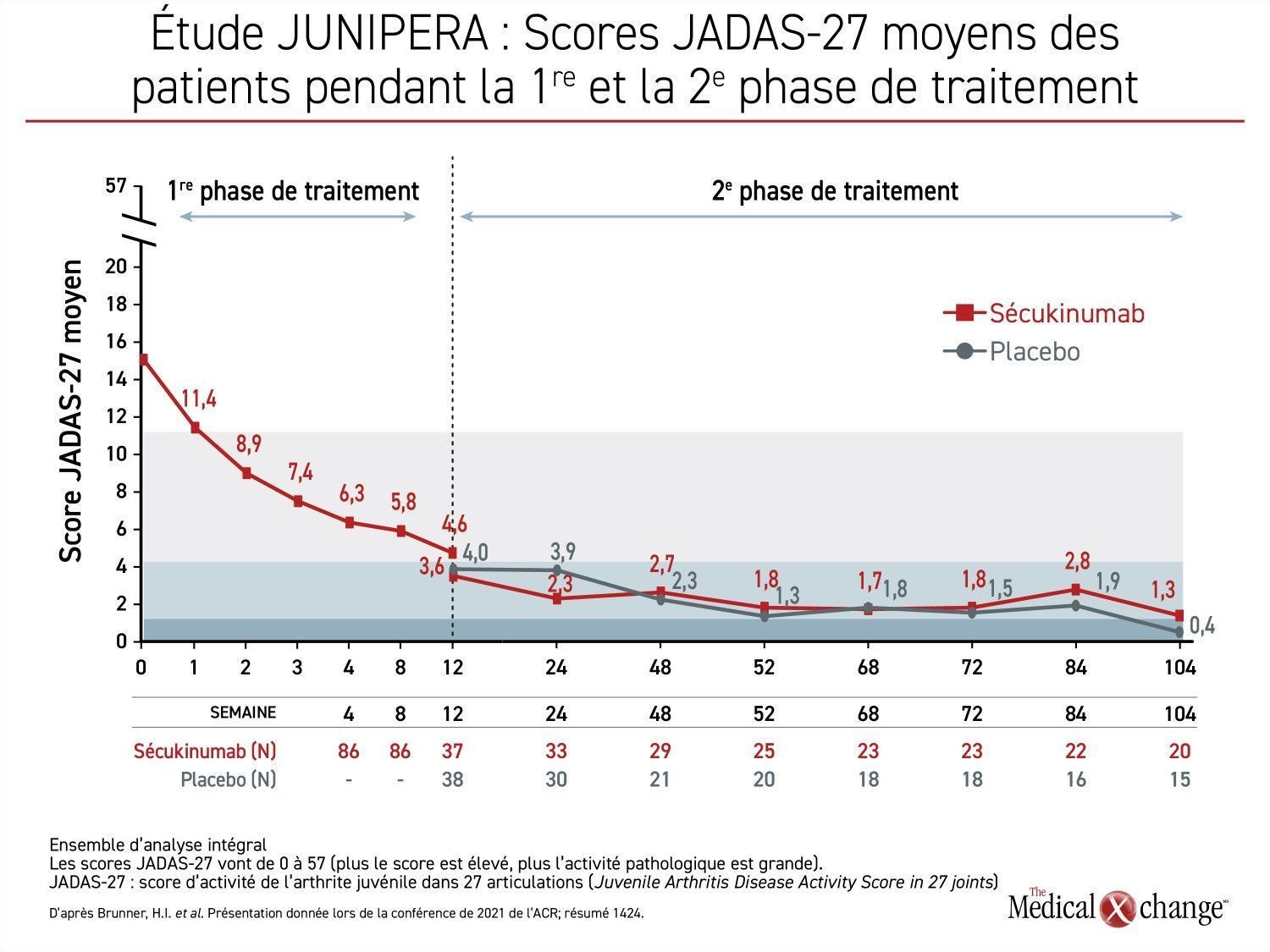
Les scores JADAS-27 moyens enregistrés pendant les 3 phases de traitement ont confirmé la rapidité de la réponse au sécukinumab et son efficacité soutenue en baissant vite et de façon constante dès le début de la 1re phase, quand tous les patients recevaient cet agent en mode ouvert. À 12 semaines, le score moyen se chiffrait à 4,6, ce qui témoigne d’une activité pathologique plutôt faible. Or les scores ont continué de baisser après la répartition aléatoire, que les patients aient reçu par la suite le traitement d’entretien par le sécukinumab ou le placebo (Figure 3).
« Les scores JADAS-27 ont chuté abruptement pendant les premières semaines de la phase de traitement en mode ouvert. Ils ont poursuivi leur chute pendant les premières semaines de la phase à l’insu, puis ils se sont généralement stabilisés », a précisé la Dre Brunner.
Les baisses soutenues des scores JADAS-27 obtenues même chez les témoins pendant la 2e phase de traitement ont été attribuées à la réponse durable observée pendant la phase d’induction en mode ouvert. À la 104e semaine de la phase de traitement à l’insu, une plus forte proportion de témoins en avaient été retirés en raison d’une poussée évolutive et avaient entrepris la 2e phase menée en mode ouvert. Cela dit, le score JADAS-27 moyen est resté inférieur à 3,8 chez ceux qui n’ont subi aucune poussée évolutive et qui ont poursuivi la phase à l’insu de l’étude.
Le bilan d’innocuité favorable dressé chez les adultes se répète chez les enfants et les adolescents
L’innocuité du sécukinumab dans cette population pédiatrique « cadrait avec celle qui avait déjà été rapportée [lors d’une étude de grande envergure] », a affirmé la Dre Brunner. C’est une bonne nouvelle pour les enfants et les adolescents qui deviendront un jour des adultes. Même si la proportion de patients ayant subi un effet indésirable pendant la phase à l’insu de l’étude JUNIPERA a été plus élevée (91,9 % vs 76,3%), les écarts étaient minces pour bien des effets indésirables survenus pendant le traitement. Si on les exprime par tranche de 100 années-patients de suivi, on en obtient 51,4 vs 49,3 pour les troubles digestifs, 32,4 vs 29,7 pour les troubles musculosquelettiques et du tissu conjonctif, 24,4 vs 32,4 pour les troubles de la peau et du tissu sous-cutané pour le sécukinumab et le placebo, respectivement. Les troubles du système nerveux (9,2 vs 15,4) ont été moins nombreux avec le sécukinumab.
Seule exception, les infections et infestations, qui ont été plus fréquentes avec le sécukinumab (158,2 vs 112,5/100 années-patients de suivi). Plus précisément, l’incidence des cas de rhinopharyngite (37,8 % vs 15,8 %) et de fièvre (16,2 % vs 5,3 %) était plus élevée dans le groupe sécukinumab. La Dre Brunner a ajouté qu’aucun de ces effets indésirables n’a menacé le pronostic vital. La proportion de patients traités par le sécukinumab qui ont été atteints d’une infection des voies respiratoires supérieures était similaire à celle des témoins (16,2 % vs 15,8 %).
Les inhibiteurs de l’IL-17 donnent des résultats constants contre les maladies inflammatoires
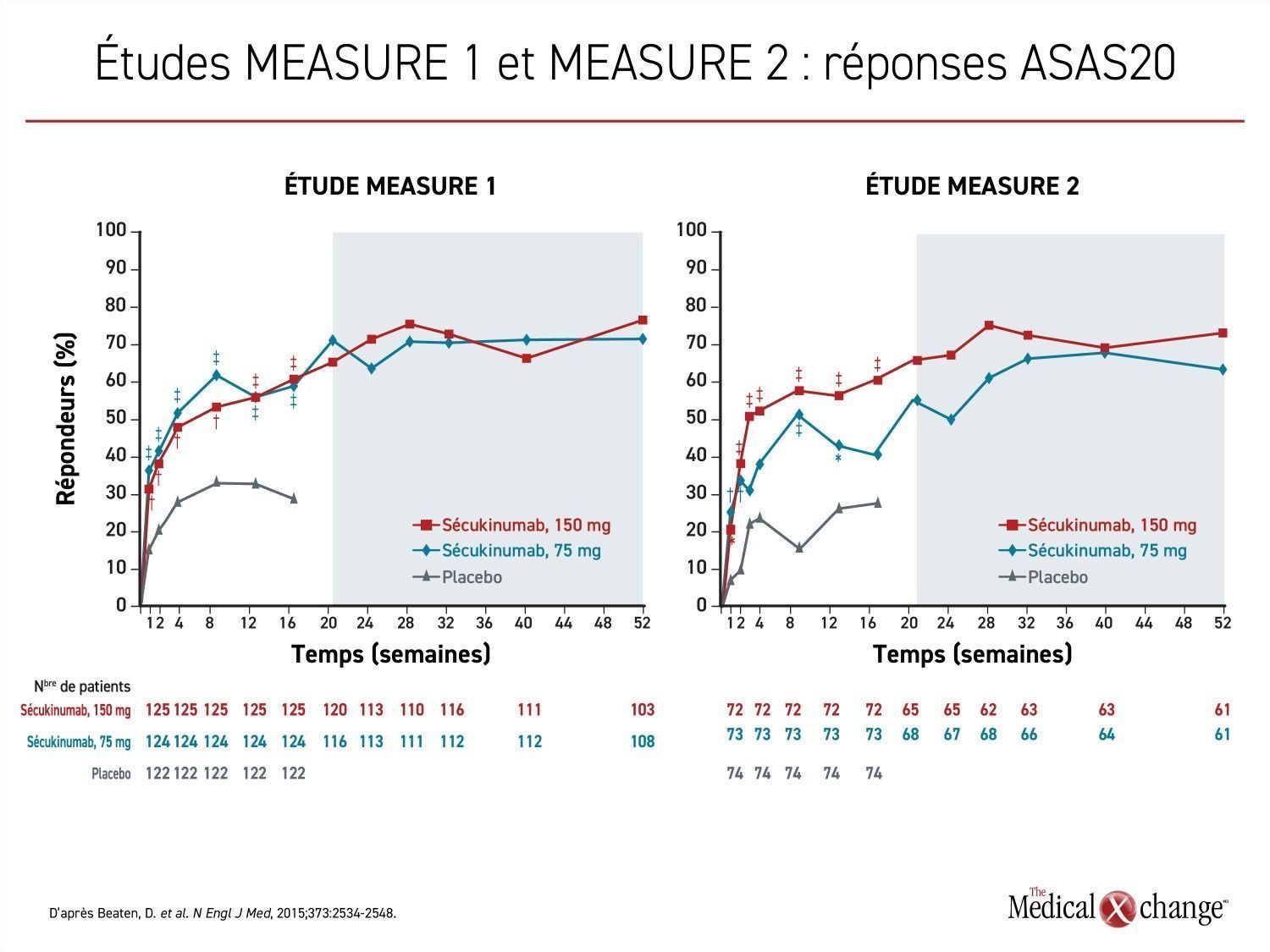
Le sécukinumab, un inhibiteur de l’IL-17A, a été le premier agent biologique homologué comme solution de rechange aux inhibiteurs du facteur de nécrose tumorale (iTNF) pour le traitement de la spondylarthrite ankylosante chez les adultes. Lors des études déterminantes MEASURE 1 et MEASURE 2, qui ont abouti à son homologation, la proportion de patients du groupe sécukinumab dosé à 150 mg ayant atteint l’objectif principal, soit une amélioration de 20 % de leur état selon les critères de l’Assessment of SpondyloArthritis International Society (réponse ASAS20), était plus de deux fois plus élevée que celle observée dans le groupe placebo (61 % vs 28 %; p < 0,001) (Figure 4).
Ces résultats sont en phase avec le rôle des voies de signalisation de l’IL-17 dans la pathogenèse des maladies inflammatoires dans l’ensemble et de celles touchant les articulations et la peau en particulier. Le sécukinumab est aujourd’hui un agent d’usage courant en première intention ou en remplacement des iTNF dans différentes formes de spondylarthrite ankylosante et de rhumatisme psoriasique. Or deux médicaments de sa classe l’ont rejoint, soit l’ixékizumab, qui a plusieurs indications en commun avec lui, et le brodalumab. Ces trois agents sont maintenant homologués contre le psoriasis en plaques, mais le brodalumab ne l’est pas encore contre les maladies rhumatismales. En outre, aucun d’eux n’a fait l’objet d’études comparatives directes multicentriques.
Le rôle des inhibiteurs de l’IL-17 dans la pathogenèse de la maladie
Les données recueillies chez les enfants sont venues confirmer l’utilité de l’inhibition de l’IL-17 dans la pathogenèse des arthropathies inflammatoires. Le sécukinumab cible l’IL-17A, qui, à la lumière des études expérimentales et cliniques sur la spondylarthrite ankylosante, subit une régulation positive dans la moelle osseuse sous-chondrale. Les autres sous-types d’IL-17 et l’IL-23 sont impliqués dans plusieurs maladies auto-immunes, mais la meilleure preuve de l’importance de l’IL-17A en tant que cible dans les cas de SpAax et de RP est l’efficacité clinique considérable des inhibiteurs de cette cytokine dans les essais cliniques multicentriques qui ont permis d’objectiver des réponses marquées tant sur le plan radiologique que clinique. Le programme de développement clinique du sécukinumab comptait 5 essais de phase III aux résultat positifs. Les articles publiés sur l’utilisation de cet agent en pratique clinique ont étayé son activité ainsi que la satisfaction des patients. Dans un de ces essais, 77 % des patients atteints de spondylarthrite ankylosante ont trouvé le sécukinumab supérieur à leur traitement antérieur (Magrey, M. et al. Ann Rheum Dis. 2018;77(suppl. 2):1014).
En plus d’être rassurante, l’innocuité du sécukinumab dans les formes juvéniles de SpAax-nr et le RPJ correspond à celle observée chez les adultes où il a beaucoup été utilisé et pas seulement contre la spondylarthrite ankylosante et le RP, mais aussi contre plusieurs formes de psoriasis, dont le psoriasis en plaques, pour lequel il est également indiqué. L’effet indésirable le plus souvent rapporté antérieurement, mais aussi pendant l’étude JUNIPERA, est une hausse du risque d’infection, mais les infections graves restent rares. Comme c’est le cas avec les autres agents biologiques, le lien entre le sécukinumab et l’uvéite ou les maladies inflammatoires chroniques de l’intestin (MICI) est incertain, puisque le risque d’en souffrir est déjà plus élevé chez les patients susceptibles de recevoir ces agents biologiques. Lors de l’étude JUNIPERA, une MICI et une uvéite sont apparues chez un et deux patients respectivement, mais selon la Dre Brunner, les cas d’uvéite n’avaient rien à voir avec le traitement.
Conclusion
Grâce à ses phases menées en mode ouvert et à l’insu, l’étude JUNIPERA a fourni plusieurs occasions d’évaluer l’efficacité et l’innocuité du sécukinumab dans des cas d’ERA et de RPJ. Pendant la phase d’induction en mode ouvert, près de 90 % des enfants et des adolescents ont satisfait au critère d’amélioration minimal en affichant une réponse ACR30 à la fin de la 12e semaines. La plupart des sujets ont obtenu une réponse ACR70 et une minorité, quoique notable, a vu ses symptômes disparaître complètement. Pendant la phase suivante menée à l’insu, la maîtrise de la maladie a duré longtemps, même chez les témoins. Au terme des 104 semaines de l’étude, le traitement d’entretien par le sécukinumab avait produit une baisse de 72 % du risque de poussée évolutive. Bien que certains effets indésirables, surtout des infections, aient été plus fréquents chez les patients affectés au sécukinumab que chez les témoins, leur incidence était semblable à celle rapportée dans les études réalisées chez des adultes. Les résultats de l’étude JUNIPERA en matière d’efficacité et d’innocuité sont rassurants pour les enfants et adolescents qui seront un jour traités dans un milieu clinique pour adultes.
L’expérience acquise avec un inhibiteur de l’IL-17 utilisé contre l’ERA et le RPJ porte à croire que les voies de signalisation de ces maladies auto-immunes chez les enfants et les adolescents ressemblent à celles de la SpAax-nr et du RP, ce qui consolide la position de l’IL-17A en tant que cible spécifique des voies qu’elles ont en commun.