Oncologie
Congrès annuel de 2023 de l’American Society of Clinical Oncology (ASCO)
Distinction des inhibiteurs de la BTK contre la LLC d’après leur efficacité et leur innocuité
Chicago – Les analyses rétrospectives présentées lors du congrès annuel de l’ASCO cherchaient à montrer que l’utilisation d’un inhibiteur de la tyrosine kinase de Bruton (iBTK) de première génération pouvait être viable malgré les effets collatéraux et la nécessité d’ajuster la dose de ce dernier dans la prise en charge des manifestations cardiaques. Or des études comparatives directes, telles que les études ALPINE et ELEVATE R/R, ont révélé que les iBTK de deuxième génération sont mieux tolérés et l’étude ALPINE a en plus mis au jour la supériorité de leur efficacité clinique. En plaçant ces analyses rétrospectives dans le contexte de ces études majeures, on cerne mieux l’enjeu des choix thérapeutiques et leurs implications.
Il y a plus de 10 ans, l’arrivée de l’ibrutinib, l’iBTK de première génération, a révolutionné le traitement de la leucémie lymphoïde chronique (LLC), du lymphome à petits lymphocytes (LPL) et de bien d’autres cancers des cellules B, mais des données probantes indubitables nous ont appris que la sélectivité pour la BTK, une propriété distinctive des agents de deuxième génération, compte énormément. Les analyses rétrospectives reposaient sur l’examen de dossiers médicaux informatisés (DMI) ou sur des analyses d’études groupées et même si elles visaient à expliquer pourquoi l’ibrutinib reste un choix viable malgré ses effets collatéraux, il demeure que des études prospectives multicentriques bien contrôlées nous ont fourni des données probantes ne laissant aucun doute sur la supériorité des agents de deuxième génération.
Inhibiteur de la BTK de première génération : il faut modifier sa posologie pour traiter ses effets indésirables
Deux études rétrospectives présentées devant l’ASCO ont porté sur le recours à des ajustements posologiques pour réduire les effets cardiotoxiques et autres effets collatéraux de l’ibrutinib.
Les chercheurs de l’une de ces études ont extrait de la base de données Acentrus les DMI de 1171 patients atteints de LLC ou de LPL afin d’évaluer les répercussions des ajustements posologiques sur le temps écoulé avant le prochain traitement (TÉPT). Des effets collatéraux ont motivé des ajustements posologiques chez 19,6 % des sujets de l’ensemble de l’effectif et chez 21,3 % de ceux qui étaient considérés comme très exposés à des incidents cardiovasculaires (CV), la moitié de ces ajustements ayant eu lieu dans les 6 premiers mois du traitement.
À 12 mois du suivi, une faible proportion seulement de l’ensemble de l’effectif (10,9 % vs 7,5 %; p = 0,254) ou des sujets exposés à un risque CV élevé (7,3 % vs 8,0 %; p = 0,774) avait eu besoin d’un nouveau traitement, a déclaré le Dre Kerry A. Rogers, professeure adjointe, à la Division d’hématologie de l’Université d’état de l’Ohio, à Columbus. Même si, d’après elle, ces données tirées de la pratique clinique témoignent de la souplesse posologique de l’ibrutinib, il demeure qu’elles ne tiennent pas compte du fait que les iBTK de deuxième génération risquent moins de provoquer des effets toxiques commandant un ajustement de la dose.
Effet des réductions de la dose sur la survie sans progression (SSP)
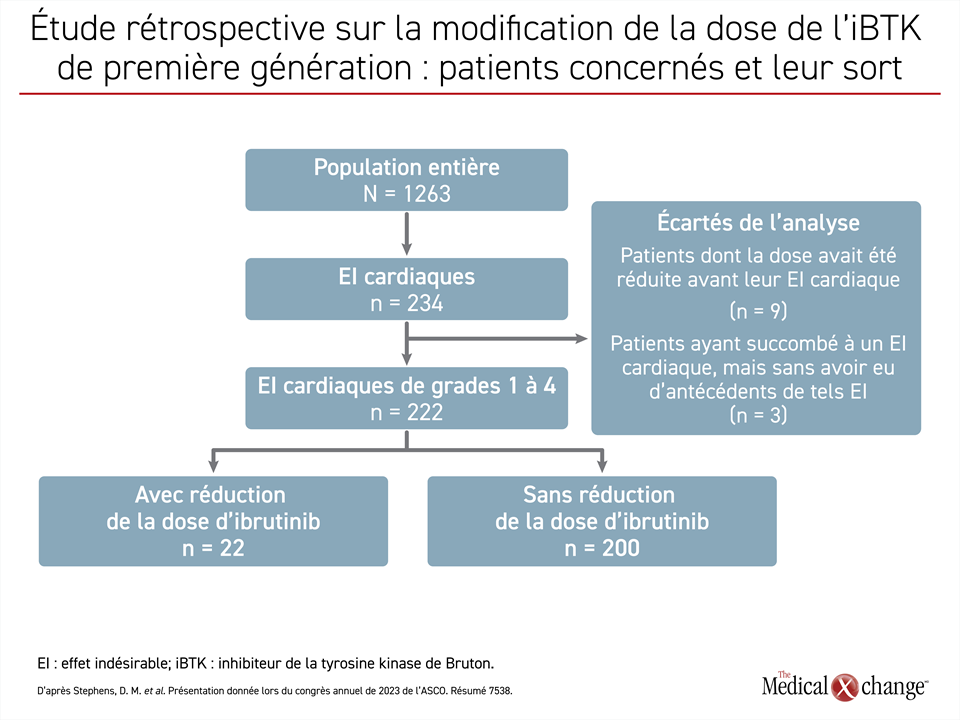
Une autre étude rétrospective menée chez 1263 patients ayant participé à 10 études cliniques sur l’emploi de l’ibrutinib contre la LLC, le LPL ou d’autres cancers des cellules B est venue étayer l’utilité de cet agent. Selon la Dre Deborah M. Stephens, professeure adjointe, à la Division d’hématologie et d’hémato-oncologie de l’Université de l’Utah, à Salt Lake City, elle a servi à évaluer l’effet sur la SSP des ajustements posologiques motivés par des incidents cardiaques.
Deux cent vingt-deux (17,6 %) des 1263 patients ont subi un incident cardiaque et 22 (9,9 %) d’entre eux ont vu leur dose d’ibrutinib réduite (figure 1). Bien que les patients dont la dose avait été modifiée pour une autre raison et que les 3 patients ayant succombé à un accident cardiaque sans avoir subi une telle modification aient été écartés de l’analyse, l’étude a révélé que le taux de SSP à 24 mois était légèrement plus élevé chez les sujets dont la dose avait été réduite pour cause d’effet indésirable conformément au guide posologique que chez ceux dont la dose n’avait pas diminué (86 % vs 76 %). L’écart n’était toutefois pas statistiquement significatif (Figure 1).
Ce qu’il faut retenir selon la Dre Stephens, c’est que les ajustements posologiques motivés par une cardiotoxicité « n’ont pas d’effet négatif » sur la SSP. Cela dit, les comparaisons effectuées pendant ces études ont uniquement porté sur des patients prenant de l’ibrutinib. Il convient donc d’interpréter les conclusions de cette analyse avec prudence, faute d’une comparaison avec un iBTK de deuxième génération réputé pour sa plus grande innocuité.
Une étude de phase III le confirme : un inhibiteur BTK de deuxième génération prolonge la SSP davantage
Les études ALPINE et ELEVATE R/R visaient à comparer directement un iBTK de deuxième génération à l’ibrutinib quand ils sont utilisés dans des cas de LLC ayant déjà été traitée. Bien qu’elles aient toutes les deux confirmé que l’iBTK de deuxième génération est assorti d’une plus grande innocuité que l’ibrutinib, qui est moins sélectif, leurs données présentaient des différences.
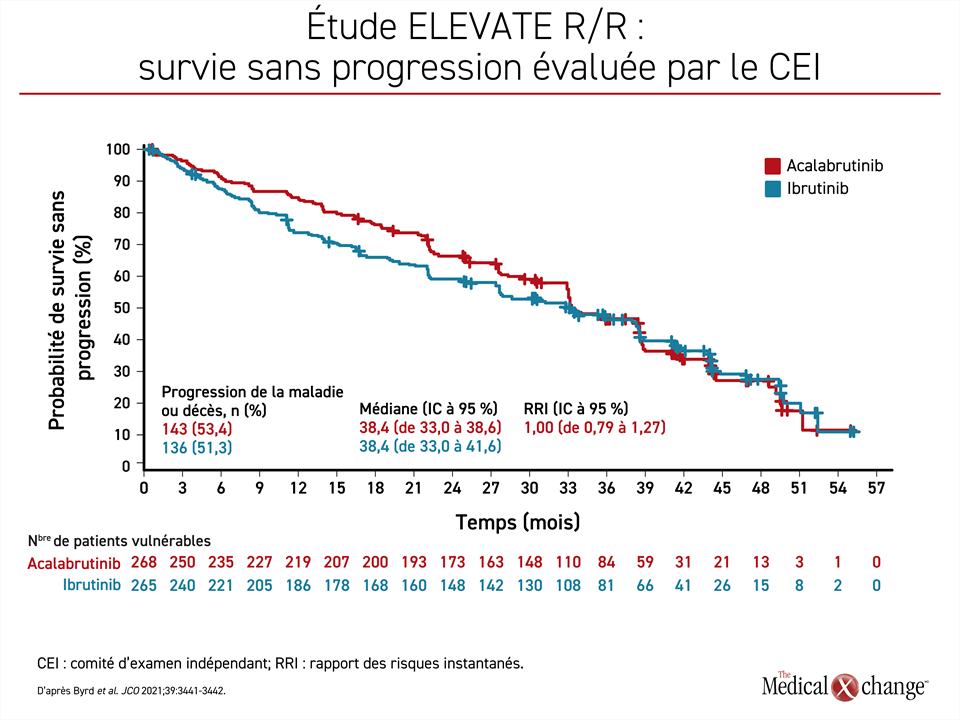
Lors de l’étude ouverte et à répartition aléatoire ELEVATE R/R dont les résultats ont été publiés en 2021, l’acalabrutinib ne s’est pas révélé inférieur à l’ibrutinib pour ce qui est de la SSP, son paramètre d’évaluation principal (Byrd et al. J Clin Oncol 2021;39:3441-3452). En fait, la SSP médiane enregistrée après 3 années de suivi était identique dans les deux groupes, soit 38,4 mois (p = 0,002), le rapport des risques instantanés se chiffrant à 1,00 (Figure 2).
Pourtant, le risque d’effets indésirables CV, notamment de fibrillation auriculaire et de flutter auriculaire, était plus faible dans le groupe acalabrutinib que dans le groupe ibrutinib (9,4 % vs 16,0 %; p = 0,02), ce qui a été vu comme un point important cliniquement et comme une preuve de l’avantage offert par l’iBTK de deuxième génération. La plus grande sélectivité de l’acalabrutinib pour la BTK expliquerait le bilan d’innocuité favorable de cet agent.
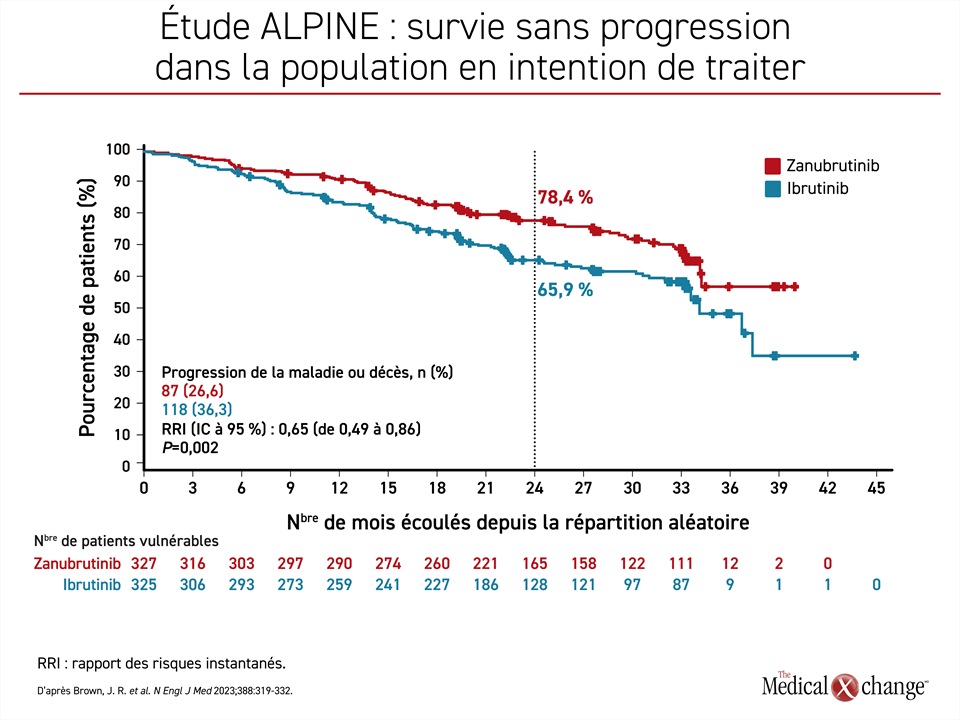
Lors de l’étude ouverte et à répartition aléatoire ALPINE dont les résultats ont été publiés plus tôt cette année et ont été présentés lors du congrès annuel de 2022 de l’American Society of Hematology (ASH), le zanubrutinib s’est révélé supérieur à l’ibrutinib pour la SSP, un paramètre d’évaluation de cette étude (Brown et al. N Engl J Med 2023;388:319-332). Après un suivi médian de 29,6 mois, la SSP médiane n’était toujours pas atteinte dans le groupe zanubrutinib, alors qu’elle s’établissait à 34,2 mois dans le groupe ibrutinib. La réduction relative à l’avantage du zanubrutinib pour ce qui est de l’évolution de la maladie ou du décès se chiffrait à 35 % (RRI : 0,65; p = 0,002) (Figure 3).
Comme ce fut le cas pendant l’étude de phase III sur l’acalabrutinib, le zanubrutinib a été relié à une incidence plus faible de troubles CV dans leur ensemble (21,3 % vs 29,6 %) et de fibrillation auriculaire en particulier (1,9 % vs 3,7 %). Les effets indésirables de grade 3 ou plus, la neutropénie (16,0 % vs 13,9 %) et l’hypertension (14,8 % vs 11,1 %) étaient légèrement plus répandus avec le zanubrutinib, mais les effets indésirables justifiant une réduction de la dose (12,3 % vs 17,0 %) ou l’abandon du traitement (15,4 % vs 22,2 %) l’étaient moins. Six décès dus à des événements cardiaques ont été rapportés, tous chez des patients prenant de l’ibrutinib.
Étude ALPINE : réponse favorable des sujets très vulnérables en raison de leur génome
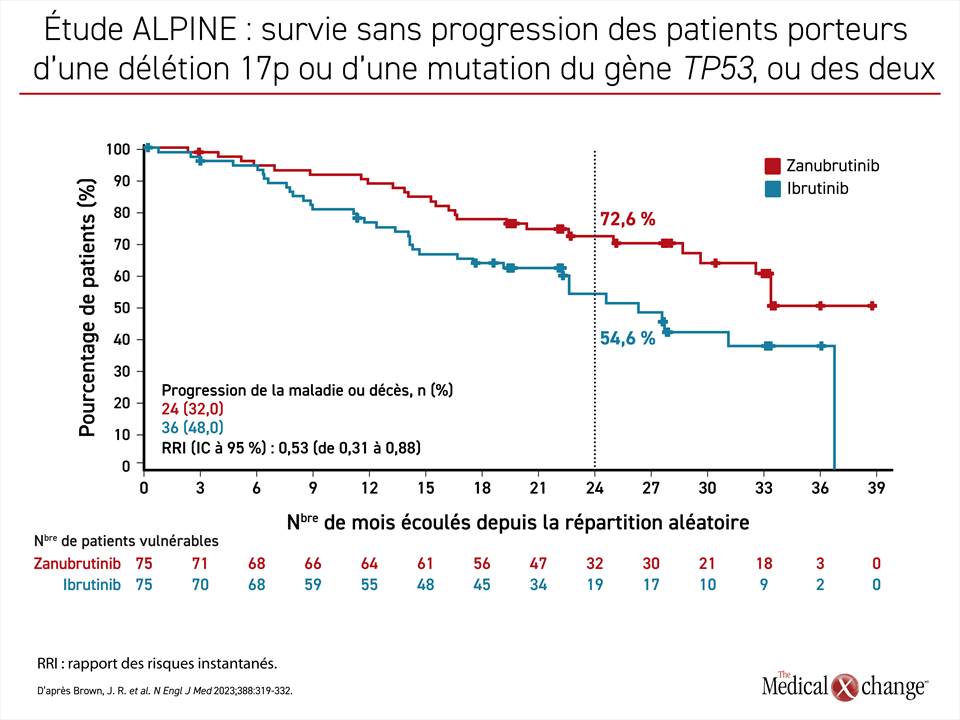
L’effectif de l’ELEVATE R/R était différent de celui de l’étude ALPINE. Notons que les critères d’admissibilité à l’étude ELEVATE R/R comprenaient la présence d’une délétion en 17p13.1 ou en 11q22.3. Lors de l’étude ALPINE, les patients atteints d’une LLC étaient admissibles indépendamment de leur génome. Lorsque le sous-groupe de sujets de l’étude ALPINE atteints d’une LLC très vulnérante, soit une maladie accompagnée d’une délétion 17p, d’une mutation du gène TP53 ou de ces deux anomalies, a été analysé séparément à 24 mois, le pourcentage de patients dont la maladie n’avait pas progressé était à peu près le même que celui observé dans la population en intention de traiter (72,6 % vs 78,4 %). L’efficacité dont a fait preuve l’ibrutinib dans ce sous-groupe très vulnérable de l’étude ALPINE était nettement inférieure à celle enregistrée dans la population en intention de traiter (54,6 % vs 65,9 %) (Figure 4).
Résultat : dans ce sous-groupe très vulnérable, la réduction de près de 50 % (RRI : 0,53; IC à 95 % : de 0,31 à 0,88) des cas de progression de la maladie ou de décès obtenue avec le zanubrutinib était donc encore plus marquée que celle observée avec l’ibrutinib. À 24 mois, 72,6 % des patients traités par le zanubrutinib étaient toujours en vie et en rémission contre 54,6 % de ceux affectés aléatoirement à l’ibrutinib. Un gain numérique du côté de la SG a été rapporté tôt pendant la phase de suivi, mais il n’avait pas franchi le seuil de la signification statistique, d’où la nécessité d’un suivi de plus longue durée (RRI : 0,76; IC à 95 % : de 0,51 à 1,11). Pendant l’étude ELEVATE R/R, la SG médiane n’a été atteinte dans aucun des deux groupes (RRI : 0,82; IC à 95 % : de 0,59 à 1,15), l’écart entre les courbes de la SG à 27 mois environ restant également non significatif.
Avantages de la posologie uniquotidienne
Au cours des études ALPINE et ELEVATE R/R, le zanubrutinib et l’acalabrutinib ont été prescrits à des doses respectives de 160 mg et de 100 mg, 2 fois par jour. Notons toutefois que la dose de 320 mg de zanubrutinib administrée 1 fois par jour a été homologuée par la Food and Drug Administration des États-Unis et par Santé Canada. Selon la Dre Jennifer R. Brown, directrice du Centre de traitement de la LLC, à l’Institut de cancérologie Dana-Farber, de Boston, au Massachusetts, qui a décrit les études ayant démontré ces propriétés, leur décision aurait reposé sur le taux de liaison de 100 % de la BTK dans les cellules du sang périphérique obtenu avec cet agent et sur ses caractéristiques pharmacocinétiques. Cette validation de l’utilisation de la dose uniquotidienne de 320 mg en dehors de l’étude ALPINE peut présenter de l’intérêt pour certains patients, notamment ceux qui ont du mal à respecter une posologie biquotidienne.
En fait, selon l’analyse rétrospective des DMI présentée par la Dre Rogers, la persistance relative des bienfaits du traitement observée chez les patients traités à l’aide de doses réduites d’ibrutinib s’expliquerait, entre autres, par un meilleur respect du traitement. Dans son analyse descriptive, la Dre Rogers a souligné que les patients dont la dose avait été réduite en raison d’effets toxiques « faisaient preuve d’une meilleure observance du traitement (…) que ceux qui avaient continué de recevoir la dose de départ de 420 mg/jour », ce qui pourrait aussi expliquer les résultats comparables obtenus pour le TÉPT.
Aucune conclusion sur l’efficacité et l’innocuité relatives des deux iBTK de deuxième génération ne peut être tirée d’études différentes, mais des données très probantes recueillies dans de nombreux établissements montrent que la sélectivité du zanubrutinib et de l’acalabrutinib pour la BTK a une grande portée clinique. Ces deux agents comportent un risque de cardiotoxicité plus faible, cette dernière étant incontestablement l’effet indésirable le plus important de l’iBTK de première génération. De plus, le zanubrutinib s’est montré beaucoup plus efficace que l’ibrutinib, ce qui vient appuyer le concept voulant qu’il supplante ce dernier.
Conclusion
Les lignes directrices régissant l’utilisation des iBTK dans le traitement de la LLC ont été révisées à la lumière de deux études majeures ayant montré que les agents de deuxième génération dotés d’une plus grande sélectivité pour la BTK devraient être privilégiés au détriment de l’agent de première génération. Plusieurs des études présentées au congrès de l’ASCO de cette année ont servi à vérifier si l’ibrutinib demeure un choix viable à partir de données rétrospectives. Cela dit, la question à savoir si la sélectivité pour la BTK a son importance a déjà trouvé réponse grâce à des études multicentriques bien contrôlées portant expressément sur ce sujet. L’ibrutinib a certes joué un rôle déterminant dans le traitement de la LLC, mais les agents de deuxième génération que sont le zanubrutinib et l’acalabrutinib ont clairement fait preuve d’une innocuité supérieure dans la prise en charge de cette maladie, sans compter que le zanubrutinib s’est aussi montré plus efficace.