Revue d’experts
Le Porteur du VIH Vieillissant
Chapitre 4 : Le déficit neuro-cognitif
Bruce James Brew, M. D
Université de la Nouvelle-Galles-du-Sud, Sydney, Australie
La détérioration des fonctions cognitives est une complication insidieuse et souvent progressive de l’infection par le virus de l’immunodéficience humaine (VIH). Même si les traitements antirétroviraux hautement actifs (TAHA ou HAART, en anglais) ont pratiquement éliminé la démence associée au stade ultime du syndrome d’immunodéficience acquise (sida), la déficience cognitive demeure une complication fréquente de l’infection par le VIH, même chez les patients dont la virémie est bien maîtrisée. Or l’incidence et la gravité des troubles cognitivo-moteurs imputables au VIH sont en hausse au sein de la population vieillissante des porteurs du VIH, conséquence possible de la plus grande vulnérabilité des personnes âgées en général et de l’affaiblissement graduel de leurs fonctions qui s’est produit pendant les nombreuses années où ils ont vécu avec leur infection. Les enjeux cliniques que représente cette complication sont énormes. Deux facteurs, entre autres, peuvent expliquer la variation du risque de déficience cognitive : la capacité relative qu’ont certains traitements antirétroviraux de traverser la barrière hémato-encéphalique et, ce faisant, de réduire la charge virale à l’intérieur du système nerveux central (SNC) et la vulnérabilité propre à chaque patient, celle-ci étant possiblement d’origine génétique. Des variables n’ayant aucun rapport avec le VIH pourraient aussi jouer un rôle important chez certains patients. Il convient donc de surveiller attentivement les perturbations des fonctions cognitives au moyen d’évaluations cliniques périodiques dans le cadre des stratégies visant à cerner et à prévenir les troubles cognitivo-moteurs imputables au VIH.
Le déficit cognitivo-moteur : son comportement épidémiologique
Avant l’arrivée des traitements antirétroviraux hautement actifs (TAHA), la démence était l’une des complications définissant le syndrome d’immunodéficience acquise (sida) causée par l’infection par le virus de l’immunodéficience humaine (VIH), puisque 15 % des patients au moins en étaient atteints au moment de leur décès1. À cette époque, le risque de démence liée au sida augmentait au fur et à mesure que la fonction immunitaire s’affaiblissait et semblait une conséquence directe de l’absence de maîtrise de l’infection par le VIH2. En notre ère post-TAHA, la démence liée au sida a été intégrée aux troubles cognitivo-moteurs associés au VIH, terme générique servant à décrire le spectre de la dégradation des fonctions neurologiques, qui s’étend des perturbations cognitivo-motrices asymptomatiques à la démence liée au sida3. Bien que les TAHA aient considérablement abaissé le risque de démence, l’incidence des troubles cognitivo-moteurs associés au VIH semble rester la même après ajustement en fonction de l’âge, du niveau d’instruction, du sexe, de la race et du nombre de lymphocytes T CD44. Les signes de déficit cognitif progressif observés chez les patients, même chez ceux dont la virémie est bien maîtrisée, portent à croire qu’un processus pathologique intracérébral se poursuit en dépit de l’élimination des signes cliniques de l’infection5. Lors d’une étude transversale terminée récemment, les chercheurs ont constaté que, contrairement aux cas de démence qui étaient rares, les troubles cognitivo-moteurs associés au VIH étaient répandus, puisque 52 % des sujets présentaient des perturbations neuropsychologiques plus ou moins marquées6. Ils ont notamment objectivé une déficience cognitive asymptomatique chez 33 % des sujets, une déficience cognitive légère, quoique symptomatique, chez 12 % des sujets et une démence chez 2 % des sujets. Pour ce qui est des autres sujets, leur déficit neuropsychologique avait une tout autre cause.
La déficience cognitive s’aggrave au fil du temps, même chez les patients dont l’infection par le VIH est bien maîtrisée, virémie plasmatique à l’appui.
La déficience cognitive s’aggrave au fil du temps, même chez les patients dont l’infection par le VIH est bien maîtrisée, virémie plasmatique à l’appui. Dans le cadre d’une étude ayant servi à observer pendant 27 mois des porteurs du VIH dont la virémie se situait sous le seuil de détection des méthodes de dosage, les chercheurs ont noté que le tiers de ces patients manifestaient une détérioration de leurs fonctions cognitives7. Après avoir écarté les causes traitables de cette déficience cognitive, ils en sont venus à la conclusion que l’âge et l’ancienneté de l’infection par le VIH constituaient probablement des facteurs de risque d’une telle détérioration. Or, au cours d’une étude prospective ayant permis de comparer une cohorte de patients âgés de plus de 50 ans à une autre cohorte composée de patients âgés de 20 à 39 ans, les chercheurs ont constaté que l’incidence de la déficience cognitive était deux fois plus élevée dans le groupe de sujets plus âgés (25 % vs 13 %; p = 0,041)8. Il est ressorti d’une étude sur les multiples facteurs de risque de déficience cognitive au sein d’une grande cohorte de sujets depuis l’arrivée des TAHA que l’âge avancé au moment de la séroconversion et l’ancienneté de l’infection étaient des facteurs de prédiction indépendants à ce chapitre9. Notons que des interactions possibles entre l’âge, la durée de l’infection et des facteurs de risque de troubles cognitifs n’ayant aucun lien avec le VIH, tels que les maladies vasculaires cérébrales, pourraient jouer un rôle important au sein de la population vieillissante des porteurs du VIH10.
La pathogenèse
Il est probable que le VIH traverse la barrière hématoencéphalique et pénètre dans le SNC au moyen d’un sous-groupe de monocytes infectés qui y créent un réservoir viral capable d’y exercer des effets neurotoxiques quelque temps après la séroconversion.
Le processus physiopathologique à l’origine des troubles cognitivo-moteurs associés au VIH est alimenté par les protéines virales neurotoxiques issues des cellules infectées par le VIH, telles que des astrocytes, des microglies et des macrophages, de même que par des cytokines, des chimiokines et d’autres médiateurs neurotoxiques libérés par les cellules saines du SNC responsables des signaux pro-inflammatoires15. Il est probable que le VIH traverse la barrière hématoencéphalique et pénètre dans le SNC au moyen d’un sous-groupe de monocytes infectés qui y créent un réservoir viral capable d’y exercer des effets neurotoxiques quelque temps après la séroconversion, possiblement dans un délai très court16. Dans les années qui suivent l’infection, la propagation du VIH dans le SNC se fait indépendamment de celle observée en périphérie17. Plusieurs mécanismes sont à l’origine des altérations neuronales et nerveuses telles que les lésions synaptiques et dendritiques, mais le stress oxydatif, qui participe notamment à l’excitotoxicité, est le plus important18, 19. Les études autopsiques ont surtout mis au jour des infiltrats de cellules mononucléées sous-corticaux, ainsi que des nodules microgliaux, des cellules géantes multinucléées et une gliose20. Chez les patients ayant reçu des TAHA, les infiltrats sont moins nombreux et chez quelques-uns d’entre eux, on note un chevauchement avec certaines caractéristiques de la maladie d’Alzheimer, telles que des dépôts amyloïdes. Les fonctions cognitives peuvent être stratifiées en fonction d’une série de paramètres, comme la vitesse de traitement de l’information, l’attention, le stockage de la mémoire et l’accès à cette dernière, qui font intervenir divers processus dans différentes zones de l’encéphale22. Comme les types de déficit cognitif observés varient d’une maladie à l’autre, l’utilisation de divers paramètres s’impose pour documenter les différents types d’altérations. Des chercheurs ont constaté qu’avant l’arrivée des TAHA, les troubles cognitifs prenaient souvent la forme d’une diminution de la motricité et d’une réduction de la fluence verbale, tandis que la perte de mémoire et les troubles des fonctions exécutives sont désormais plus répandus chez les patients vieillissants dont la virémie est bien maîtrisée23. D’autres études sont venues confirmer la nature des déficiences cognitives types observées chez les adultes vieillissants, telles que les problèmes de stockage de la mémoire et de remémoration23-25, laissant ainsi entendre que le déficit cognitif lié au VIH observé depuis l’apparition des TAHA coïncide avec celui produit par un processus pathologique associé au vieillissement, d’où l’amalgame de leurs effets26. Fait important à noter, les agents antirétroviraux se distinguent fortement les uns des autres, même au sein d’une même classe (par ex., les inhibiteurs de protéase ou les inhibiteurs nucléosidiques de la transcriptase inverse [INTI]), pour ce qui est de leur pénétration du liquide céphalorachidien (LCR)26. Selon une méthode de classement à trois niveaux de stratification fondée sur plusieurs variables, y compris la concentration de médicament dans le LCR, la majorité des inhibiteurs de protéase pénètrent peu le LCR contrairement à l’indinavir associé au ritonavir, l’amprénavir, le lopinavir et le darunavir, qui eux le pénètrent considérablement27, 28. Parmi les INTI, le ténofovir et la didanosine ont été les agents qui ont fait preuve de la pénétration la plus faible, tandis que l’abacavir et la zidovudine ont été ceux avec la plus forte. La théorie voulant que la réduction de la charge virale dans le LCR se traduise par une diminution de la production de protéines neurotoxiques, d’où la prévention ou le ralentissement du déficit cognitif, est séduisante, mais elle n’a pas encore été vérifiée dans le cadre d’études prospectives. Les traitements antirétroviraux reposant sur l’administration d’agents réputés pour leur faible pénétration sont associés à des concentrations d’ARN du VIH dans le LCR plus élevées que ceux reconnus pour leur forte pénétration de ce liquide27. Cela dit, peu d’études prospectives ont fait état d’une issue différente de la maladie sur le plan cognitif avec les agents à forte pénétration. Au cours d’un essai de douze semaines, l’abacavir ne s’est pas révélé plus efficace qu’un placebo pour améliorer les fonctions cognitives après son intégration à un traitement d’appoint stable, mais cet essai était relativement court et un seul agent, et non plusieurs, a été ajouté au traitement29. Dans l’ensemble, les données reliant une faible pénétration du LCR à une réplication plus marquée du VIH à l’intérieur de ce liquide justifient la réalisation d’essais cliniques approfondis, menés avec répartition aléatoire des sujets et qui serviront à comparer les répercussions que pourraient avoir sur les fonctions cognitivo-motrices divers traitements antirétroviraux exerçant des effets différents sur le LCR27, 30. La fragilisation liée au VIH est un phénomène qui a été signalé assez récemment et qui pourrait être le reflet d’un vieillissement accéléré des fonctions physiologiques, y compris celles du SNC31. Au cours de leur étude comparative menée chez des patients qui entreprenaient un traitement antirétroviral après l’âge de 50 ans, des chercheurs ont constaté que le risque de troubles cardiovasculaires, métaboliques ou neurologiques était plus de six fois plus élevé (p < 0,0001) que celui auquel était exposée une cohorte de patients plus jeunes, et ce, même si la tolérance aux traitements antirétroviraux avait été semblable dans les deux groupes32. Ils en ont déduit qu’un mécanisme indépendant causant l’accélération de la détérioration du SNC pourrait être en cause chez les porteurs du VIH qui avancent en âge.
Le diagnostic et la surveillance
Depuis que les médecins font appel aux TAHA, ils ne considèrent plus forcément les premiers signes discrets de déficit cognitif comme des indices de l’imminence d’une morbidité clinique importante; ils y voient plutôt une chance d’intervenir tôt.
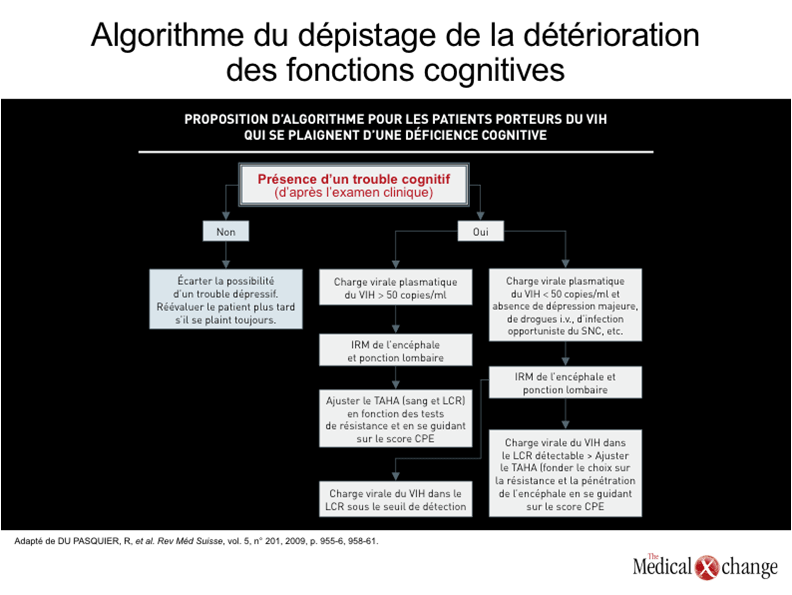
Compte tenu de l’incidence élevée de la déficience cognitive chez les porteurs du VIH, il convient de procéder périodiquement à des tests cognitifs chez tous les patients qui présentent une telle infection. Les mesures effectuées d’emblée, même chez les patients relativement jeunes, permettront de documenter les altérations que pourraient subir les fonctions cognitives par la suite. La première définition de la déficience cognitive imputable au VIH de l’American Academy of Neurology (AAN) remonte à 199133. Il n’en demeure pas moins que l’importance des déficits cognitifs observés dans les cas d’infection par ce virus a évolué depuis l’arrivée des TAHA. Avant que la médecine ne parvienne à maîtriser la virémie, l’apparition de la démence chez les porteurs du VIH était souvent le signe d’une détérioration immunologique avancée annonciatrice des stades ultimes de la maladie. Mais depuis que les médecins font appel aux TAHA, ils ne considèrent plus forcément les premiers signes discrets de déficit cognitif comme des indices de l’imminence d’une morbidité clinique importante; ils y voient plutôt une chance d’intervenir tôt. La détérioration des fonctions cognitives peut être difficile à déceler lorsque son évolution est lente. Qui plus est, l’évaluation de la cognition en bonne et due forme peut se révéler chronophage. Par conséquent, il est recommandé de procéder en trois temps. Le premier comporte un dépistage élémentaire, qui se fait en deux ou trois minutes à peine. Cette opération pourrait s’effectuer à l’aide d’un algorithme comme celui qui a été mis au point par Cysique et ses collègues ou en surveillant de près les « signaux d’alarme », comme l’illustre la (Fig. 1) Si l’un ou l’autre est positif, il faut alors demander au patient de revenir une semaine plus tard environ pour une évaluation plus approfondie. Pour cette deuxième étape, il conviendrait d’utiliser l’échelle CogState de démence liée au VIH, ou une autre plus détaillée et des questions ciblées, ce qui devrait exiger une dizaine ou une quinzaine de minutes environ. Advenant que les résultats soient positifs, il faut alors demander au patient de se prêter à une évaluation de la cognition en bonne et due forme une semaine plus tard environ34. Bien que cette surveillance en trois temps puisse se révéler utile pour détecter une détérioration des fonctions cognitives dès ses débuts, il est important d’établir un diagnostic différentiel en s’attardant sur les causes possibles d’une telle détérioration hormis les troubles cognitivo-moteurs associés au VIH. Devraient en faire partie, par exemple, la dépression et autres problèmes psychologiques, les troubles métaboliques, des complications opportunistes, s’il y a lieu, de même que des maladies dégénératives comme la maladie d’Alzheimer ou une altération cognitive d’origine vasculaire, qui sont parfois exacerbées par l’infection par le VIH.
La prise en charge
L’une des questions les plus importantes sur le plan clinique consiste à déterminer si les agents antirétroviraux se distinguent par leur aptitude pour prévenir, faire rétrocéder ou maîtriser les troubles cognitivo-moteurs associés au VIH. Dans la mesure où ces troubles sont une conséquence directe des neurotoxines générées par la réplication virale qui se produit à l’intérieur du SNC, la capacité des traitements antirétroviraux à traverser la barrière hématoencéphalique est probablement le facteur déterminant dans la protection relative conférée par ces derniers. Des chercheurs ont effectué plusieurs études dans le but de quantifier cette pénétration au moyen de diverses techniques, par exemple, en mesurant les concentrations de médicament dans le LCR et en évaluant la suppression du VIH de ce liquide pendant le traitement27. Quand on utilise des agents antirétroviraux qui pénètrent bien dans le LCR, on constate que la virémie y est plus faible que lorsqu’on emploie des agents qui y parviennent moins bien, et ce, même si on obtient une diminution de la charge virale plasmatique du même ordre35. L’analyse de régression multivariée effectuée dans le cadre d’une étude publiée récemment et réalisée chez plus de 2600 patients a permis de faire le rapprochement entre des traitements antirétroviraux ayant une bonne pénétration du LCR et une meilleure fonction cognitivo-motrice36.
Quand on utilise des agents antirétroviraux qui pénètrent bien dans le LCR, on constate que la virémie y est plus faible que lorsqu’on emploie des agents qui y parviennentmoins bien, et ce, même si on obtient une diminution de la charge virale plasmatique du même ordre.
La prise en charge des troubles cognitivo-moteurs associés au VIH est en pleine évolution. Il faudrait avant tout veiller à éliminer le virus du sang et du LCR. Jusqu’à maintenant, les adjuvants ne se sont pas montrés efficaces, exception faite peut-être de la mémantine qui a exercé des bienfaits modestes37, 38. Compte tenu du processus physiopathologique à l’origine du déficit cognitif, la maîtrise de la réplication du VIH à l’intérieur du LCR devient un objectif séduisant à atteindre, du moins en théorie. Des observations viennent appuyer cette démarche, et ce, même chez les sujets dont la charge virale plasmatique se situe sous le seuil de détection des techniques de dosage types, puisque ces méthodes permettent de déceler la réplication du VIH dans le LCR de 10 % de ces sujets39. La proportion de sujets chez lesquels les dosages de l’ARN non répétitif permettent de déceler des concentrations mesurables d’ARN du VIH est encore plus élevée, mais l’usage de ces techniques n’est pas généralisé pour le moment. En plus de l’étude citée précédemment au cours de laquelle un traitement antirétroviral ayant une bonne pénétration du LCR a été relié à une réduction de la charge virale dans ce liquide27, une autre étude a permis, au cours d’une période d’observation médiane de 15 semaines, de faire le rapprochement entre un traitement pénétrant très bien le LCR et une atténuation du déficit cognitif comparativement à un traitement moins efficace à ce chapitre30. Le remplacement des agents antirétroviraux pénétrant mal le LCR (par ex., le ténofovir) par d’autres plus efficaces à ce chapitre (par ex., l’abacavir) est une stratégie séduisante pour les patients présentant un déficit cognitif. Cela dit, pour orienter le traitement, il faudrait vérifier la résistance aux antirétroviraux des patients chez lesquels les techniques de dosage permettent de déceler la présence dans le LCR, mais pas dans le plasma. Dans de tels cas, il vaudrait peut-être mieux ajouter des antirétroviraux ayant une très bonne pénétration au traitement existant plutôt que de s’en servir pour le remplacer. Si le nombre précis d’antirétroviraux à ajouter reste inconnu, il est quand même possible de s’inspirer de la démarche adoptée chez les patients traités par des TAHA dont le VIH s’échappe dans le sang, qui repose sur l’ajout de deux antirétroviraux. La prise en charge optimale des patients aux prises avec des troubles cognitivo-moteurs associés au VIH chez lesquels les techniques de dosage ne permettent plus de déceler la présence du virus dans le plasma ni dans le LCR est inconnue. Il pourrait sembler logique d’adjoindre deux antirétroviraux pénétrant très bien le LCR au traitement existant, mais aucune donnée probante ne vient encore appuyer un tel ajout. Par ailleurs, son aptitude relative pour faire rétrocéder ou pour freiner la détérioration des fonctions cognitives pourrait dépendre du moment choisi pour modifier le traitement, d’une réduction précise de la charge virale dans le LCR ou d’autres facteurs. Des stratégies non pharmacologiques pourraient aussi être utiles pour ralentir la détérioration des fonctions cognitives, indépendamment du processus physiopathologique en cause. L’activité mentale et physique a fait la preuve de ses bienfaits chez les patients indemnes du VIH, tels que ceux qui sont atteints de la maladie d’Alzheimer40, et pourrait se justifier dans le traitement des sujets présentant des troubles cognitivo-moteurs associés au VIH. Il ne faudrait pas négliger non plus d’informer les patients au sujet des troubles cognitifs auxquels ils sont exposés et de les inciter à préserver leurs fonctions cognitives.
Conclusion
Les troubles cognitivo-moteurs associés au VIH se sont révélés une complication majeure de l’infection par le VIH depuis le début de l’épidémie. Même si la démence est un facteur de risque associé à une survie médiocre chez les patients atteints d’une forme avancée de l’infection par ce virus, chez les patients dont la virémie plasmatique est bien maîtrisée, la déficience cognitive pourrait être une menace voilée, quoique sérieuse, à leur bien-être à long terme. Force nous est de constater que la proportion de sujets porteurs du VIH qui sont exposés à une déficience cognitive parce que leur infection par ce virus remonte à de nombreuses années ou simplement parce qu’ils avancent en âge, ou les deux, ne cesse d’augmenter dans de nombreux pays, y compris le Canada. À la lumière de ce constat, il est à prévoir que la prise en charge de la déficience cognitivo-motrice dans le cadre des soins prodigués aux porteurs du VIH deviendra de plus en plus exigeante. Si l’incidence et la prévalence des maladies provoquant un déficit cognitivo-moteur, telles que la maladie d’Alzheimer, sont plus élevées chez les personnes âgées, la réplication du VIH dans le LCR semble intensifier ou accélérer ce type de déficit chez les porteurs de ce virus. Résultat : les déficits cognitifs s’observent plus tôt et plus fréquemment chez les porteurs du VIH. Or une plus grande conscientisation à l’égard de ces problèmes pourrait être la première étape vers une meilleure prise en charge de ces patients.
Références
1. McArthur JC, Hoover DR, Bacellar H, et al. Dementia in AIDS patients: incidence and risk factors. Multicenter AIDS Cohort Study. Neurology 1993;43(11):2245-52. 2. Brew BJ, Dunbar N, Pemberton L, Kaldor J. Predictive markers of AIDS dementia complex: CD4 cell count and cerebrospinal fluid concentrations of beta 2-microglobulin and neopterin.J Infect Dis 1996;174(2):294-8. 3. Antinori A, Arendt G, Becker JT, et al. Updated research nosology for HIV-associated neurocognitive disorders. Neurology 2007;69(18):1789-99. 4. Sacktor N, McDermott MP, Marder K, et al. HIV-associated cognitive impairment before and after the advent of combination therapy. J Neurovirol 2002;8(2):136-42. 5. Cysique LA, Maruff P, Brew BJ. Prevalence and pattern of neuropsychological impairment in human immunodeficiency virus-infected/acquired immunodeficiency syndrome (HIV/AIDS) patients across pre- and post-highly active antiretroviral therapy eras: a combined study of two cohorts. J Neurovirol 2004;10(6):350-7. 6. Heaton RK, Clifford DB, Franklin DR, Jr., et al. HIV-associated neurocognitive disorders persist in the era of potent antiretroviral therapy: CHARTER Study. Neurology 2010;75(23):2087-96. 7. Cysique LA, Maruff P, Brew BJ. Variable benefit in neuropsychological function in HIV-infected HAART-treated patients. Neurology 2006;66(9):1447-50. 8. Valcour V, Shikuma C, Shiramizu B, et al. Higher frequency of dementia in older HIV-1 individuals: the Hawaii Aging with HIV-1 Cohort. Neurology 2004;63(5):822-7. 9. Bhaskaran K, Mussini C, Antinori A, et al. Changes in the incidence and predictors of human immunodeficiency virus-associated dementia in the era of highly active antiretroviral therapy. Ann Neurol 2008;63(2):213-21. 10. Foley J, Ettenhofer M, Wright MJ, et al. Neurocognitive functioning in HIV-1 infection: effects of cerebrovascular risk factors and age. Clin Neuropsychol 2010;24(2):265-85. 11. Rappaport J, Berger JR. Genetic testing and HIV dementia: teasing out the molecular mechanisms of disease. AIDS 2010;24(10):1585-7. 12. Hinkin CH, Castellon SA, Levine AJ, Barclay TR, Singer EJ. Neurocognition in individuals co-infected with HIV and hepatitis C. J Addict Dis 2008;27(2):11-7. 13. McGuire D. CSF biomarkers in HIV dementia: through a glass darkly. Neurology 2009;73(23):1942-4. 14. Sevigny JJ, Albert SM, McDermott MP, et al. An evaluation of neurocognitive status and markers of immune activation as predictors of time to death in advanced HIV infection. Arch Neurol 2007;64(1):97-102. 15. Gray F, Adle-Biassette H, Chretien F, Lorin de la Grandmaison G, Force G, Keohane C. Neuropathology and neurodegeneration in human immunodeficiency virus infection. Pathogenesis of HIV-induced lesions of the brain, correlations with HIV-associated disorders and modifications according to treatments. Clin Neuropathol 2001;20(4):146-55. 16. Ricardo-Dukelow M, Kadiu I, Rozek W, et al. HIV-1 infected monocyte-derived macrophages affect the human brain microvascular endothelial cell proteome: new insights into blood-brain barrier dysfunction for HIV-1-associated dementia. J Neuroimmunol 2007;185(1-2):37-46. 17. Strain MC, Letendre S, Pillai SK, et al. Genetic composition of human immunodeficiency virus type 1 in cerebrospinal fluid and blood without treatment and during failing antiretroviral therapy. J Virol 2005;79(3):1772-88. 18. Harezlak J, Buchthal S, Taylor M, et al. Persistence of HIV-associated cognitive impairment, inflammation, and neuronal injury in era of highly active antiretroviral treatment. AIDS 2011. 19. Lindl KA, Marks DR, Kolson DL, Jordan-Sciutto KL. HIV-associated neurocognitive disorder: pathogenesis and therapeutic opportunities. J Neuroimmune Pharmacol 2010;5(3):294-309. 20. Ellis R, Langford D, Masliah E. HIV and antiretroviral therapy in the brain: neuronal injury and repair. Nat Rev Neurosci 2007;8(1):33-44. 21. Green DA, Masliah E, Vinters HV, Beizai P, Moore DJ, Achim CL. Brain deposition of beta-amyloid is a common pathologic feature in HIV positive patients. AIDS 2005;19(4):407-11. 22. Herndon RM. Handbook of Neurologic Rating Scales. New York: Demos Medical Publishing; 2006. 23. Heaton RK, Franklin DR, Ellis RJ, et al. HIV-associated neurocognitive disorders before and during the era of combination antiretroviral therapy: differences in rates, nature, and predictors. J Neurovirol 2011;17(1):3-16. 24. Woods SP, Iudicello JE, Moran LM, Carey CL, Dawson MS, Grant I. HIV-associated prospective memory impairment increases risk of dependence in everyday functioning. Neuropsychology 2008;22(1):110-7. 25. Reger M, Welsh R, Razani J, Martin DJ, Boone KB. A meta-analysis of the neuropsychological sequelae of HIV infection. J Int Neuropsychol Soc 2002;8(3):410-24. 26. Brew BJ, Crowe SM, Landay A, Cysique LA, Guillemin G. Neurodegeneration and ageing in the HAART era. J Neuroimmune Pharmacol 2009;4(2):163-74. 27. Letendre S, Marquie-Beck J, Capparelli E, et al. Validation of the CNS Penetration-Effectiveness rank for quantifying antiretroviral penetration into the central nervous system. Arch Neurol 2008;65(1):65-70. 28. Letendre S, Ellis R, Deutsch R, et al. Correlates of time-to-loss-of-viral-response in CSF and plasma in the CHARTER cohort. In: Conference on Retroviruses and Opportunistic Infections (CROI); 2010; San Francisco; 2010. p. Abs 430. 29. Brew BJ, Halman M, Catalan J, et al. Factors in AIDS dementia complex trial design: results and lessons from the abacavir trial. PLoS Clin Trials 2007;2(3):e13. 30. Letendre SL, McCutchan JA, Childers ME, et al. Enhancing antiretroviral therapy for human immunodeficiency virus cognitive disorders. Ann Neurol 2004;56(3):416-23. 31. Onen NF, Overton ET. A Review of Premature Frailty in HIV-infected Persons; Another Manifestation of HIV-Related Accelerated Aging. Curr Aging Sci 2011;4(1):33-41. 32. Orlando G, Meraviglia P, Cordier L, et al. Antiretroviral treatment and age-related comorbidities in a cohort of older HIV-infected patients. HIV Med 2006;7(8):549-57. 33. Nomenclature and research case definitions for neurologic manifestations of human immunodeficiency virus-type 1 (HIV-1) infection. Report of a Working Group of the American Academy of Neurology AIDS Task Force. Neurology 1991;41(6):778-85. 34. von Giesen HJ, Haslinger BA, Rohe S, Koller H, Arendt G. HIV Dementia Scale and psychomotor slowing–the best methods in screening for neuro-AIDS. J Neuropsychiatry Clin Neurosci 2005;17(2):185-91. 35. Marra CM, Zhao Y, Clifford DB, et al. Impact of combination antiretroviral therapy on cerebrospinal fluid HIV RNA and neurocognitive performance. AIDS 2009;23(11):1359-66. 36. Smurzynski M, Wu K, Letendre S, et al. Effects of central nervous system antiretroviral penetration on cognitive functioning in the ALLRT cohort. AIDS 2011;25(3):357-65. 37. Zhao Y, Navia BA, Marra CM, et al. Memantine for AIDS dementia complex: open-label report of ACTG 301. HIV Clin Trials 2010;11(1):59-67. 38. Brew BJ. Benefit or toxicity from neurologically targeted antiretroviral therapy? Clin Infect Dis 2010;50(6):930-2. 39. Eden A, Fuchs D, Hagberg L, et al. HIV-1 viral escape in cerebrospinal fluid of subjects on suppressive antiretroviral treatment. J Infect Dis 2010;202(12):1819-25. 40. Wilson RS, Barnes LL, Aggarwal NT, et al. Cognitive activity and the cognitive morbidity of Alzheimer disease. Neurology 2010;75(11):990-6.
Chapitre 4 : Le déficit neuro-cognitif
La détérioration des fonctions cognitives est une complication insidieuse et souvent progressive de l’infection par le virus de l’immunodéficience humaine (VIH). Même si les traitements antirétroviraux hautement actifs (TAHA ou HAART, en anglais) ont pratiquement éliminé la démence associée au stade ultime du syndrome d’immunodéficience acquise (sida), la déficience cognitive demeure une complication fréquente de l’infection par le VIH, même chez les patients dont la virémie est bien maîtrisée. Or l’incidence et la gravité des troubles cognitivo-moteurs imputables au VIH sont en hausse au sein de la population vieillissante des porteurs du VIH, conséquence possible de la plus grande vulnérabilité des personnes âgées en général et de l’affaiblissement graduel de leurs fonctions qui s’est produit pendant les nombreuses années où ils ont vécu avec leur infection. Les enjeux cliniques que représente cette complication sont énormes. Deux facteurs, entre autres, peuvent expliquer la variation du risque de déficience cognitive : la capacité relative qu’ont certains traitements antirétroviraux de traverser la barrière hémato-encéphalique et, ce faisant, de réduire la charge virale à l’intérieur du système nerveux central (SNC) et la vulnérabilité propre à chaque patient, celle-ci étant possiblement d’origine génétique. Des variables n’ayant aucun rapport avec le VIH pourraient aussi jouer un rôle important chez certains patients. Il convient donc de surveiller attentivement les perturbations des fonctions cognitives au moyen d’évaluations cliniques périodiques dans le cadre des stratégies visant à cerner et à prévenir les troubles cognitivo-moteurs imputables au VIH.
Afficher la revue