Dermatologie
Conférence sur l’urticaire UCARE de 2019 du réseau GA2LEN : revue d'expert
La redéfinition des soins opposés au spectre de l’urticaire chronique est enclenchée
Jaime Del Carpio, M.D., FRCPC
Professeur agrégé, Département de médecine, Université McGill
Montréal (Québec)
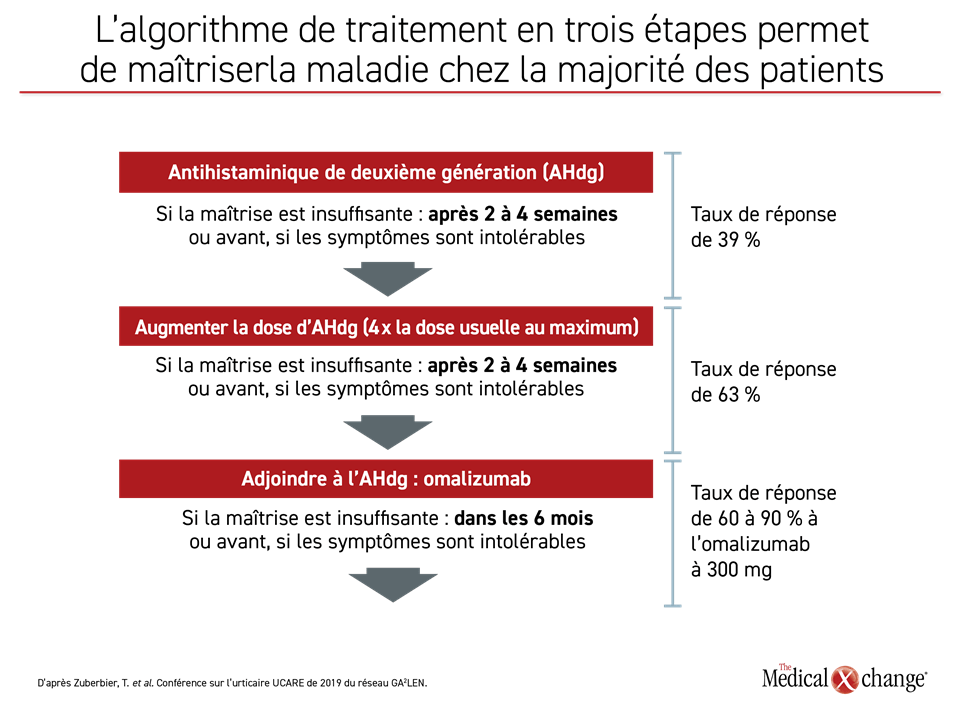
La fin de 2020 marquera le coup d’envoi des débats visant à remplacer les lignes directrices que l’EAACI/GA2LEN/EDF/OMA ont publiées sur l’urticaire en 20181. La nouvelle version devrait fournir des renseignements inédits sur les maladies concomitantes, les sous-types d’urticaire et les biomarqueurs, sujets qui ont tous été actualisés lors de la Conférence de 2019 du réseau GA2LEN (Global Allergy and Asthma European Network) et des Centres de référence et d’excellence sur l’urticaire (UCARE). Reste à espérer que les essais cliniques portant sur de nouveaux traitements seront terminés à temps. Le traitement en trois étapes recommandé permet certes de maîtriser l’urticaire chronique spontanée (UCS) la plupart du temps (Figure 1), mais nous verrons que les prochains médicaments permettront aussi de maîtriser la majorité des cas rebelles d’urticaire chronique (UC).
Contexte
Depuis la publication des dernières lignes directrices et la première conférence sur l’urticaire UCARE du réseau GA2LEN à Barcelone en 2017, la compréhension, la classification et le traitement de l’UC ont fait des pas de géant. Lors de la conférence de 2019, le crédit en a été attribué à la méthode de plus en plus systématique mise de l’avant par le réseau collaboratif mondial UCARE et aux données de la pratique clinique versées dans le registre CURE (Chronic Urticaria Registry) (Figure 1).
Pour une entrevue exclusive avec le Dr Jaime Del Carpio sur l’impact sur la pratique clinique, cliquez ici
Le réseau UCARE compte déjà 91 centres participants dans 36 pays, nombre qui ne cesse d’augmenter depuis sa création il y a trois ans, selon le Dr Maurer, Directeur de la recherche au Département de dermatologie et d’allergologie de l’Hôpital universitaire de la Charité, à Berlin, en Allemagne. Le nombre croissant de membres et de participants aux nombreux projets du réseau a sans nul doute propulsé la recherche. L’objectif ultime est ambitieux.
« Offrir à nos patients des traitements qui éliminent leur prurit, c’est bien, mais nous voulons faire plus dans 10 ans. Nous devons trouver un moyen de guérir la maladie », a déclaré le Dr Maurer, membre du comité scientifique et organisateur de la conférence sur l’urticaire UCARE du réseau GA2LEN.
Lors de cette conférence de deux jours, qui a attiré des participants de plus de 40 pays, les principaux thèmes abordés ont été les progrès réalisés dans la prise en charge des non-répondeurs et des maladies concomitantes, et les nouveaux outils de surveillance, notamment les résultats rapportés par les patients et les biomarqueurs. À la veille de la réunion, tout a été actualisé à partir des données du registre mondial CURE qui est appelé à devenir une formidable source de données sur l’UC au fur et à mesure de son enrichissement.
« Offrir à nos patients des traitements qui éliminent leur prurit, c’est bien, mais nous devons trouver un moyen de guérir la maladie. »
Créé en Allemagne et ouvert au reste du monde en 2016, le registre CURE compte actuellement 36 centres de 22 pays qui l’alimentent de leurs données. Le nombre d’établissements participants et la quantité de données soumises sur les quelque 3000 patients déjà inscrits grimpent en flèche. Ce registre est vu comme un outil essentiel pour traquer et caractériser l’UC, une maladie se déclinant en de nombreux sous-types et à l’évolution variable.
« Les études cliniques sur l’urticaire chronique ne sont qu’un pâle reflet de l’expérience vécue en pratique clinique en raison de l’hétérogénéité et des nombreux types d’urticaire », a affirmé le Dr Karsten Weller, Directeur du registre CURE et collègue du Dr Maurer. « Ces données nous permettent de poser des questions sur l’urticaire auxquelles les essais contrôlés à répartition aléatoire répondraient difficilement ».
Selon les données échantillonnées par le Dr Weller, 57 % des patients atteints d’UC chronique déjà inscrits au registre ne présentent que des papules ortiées, 37 % des autres étant affligés de papules ortiées et d’un œdème de Quincke et les 6 % restants, d’œdème uniquement.
« Les données du registre CURE nous permettent de poser des questions sur l’urticaire auxquelles les essais contrôlés à répartition aléatoire répondraient difficilement. »
Sont inscrits au registre CURE des patients atteints d’UCS ou d’urticaire chronique inductible (UCind). Il ressort de la comparaison de ces deux groupes que les 2066 patients atteints d’UCS, soit 76,9 % des patients inscrits à ce jour, sont un peu plus âgés que les 621 aux prises avec une UCind (âge moyen : 45,0 vs 39,6 ans) et que la représentation des deux sexes y est presque égale (71 % vs 70 %). Les cinq sous-types d’UCind les plus répandus sont le dermographisme symptomatique (38,8 %), l’urticaire au froid (29,4 %), l’urticaire cholinergique (14,6 %), l’urticaire retardée à la pression (9,5 %) et l’urticaire cardiaque (4,7 %), une répartition correspondant à celle publiée dans la littérature.
Conformément aux lignes directrices de 2018, la plupart des patients inscrits qui suivent un traitement prennent une dose type ou élevée d’antihistaminiques de deuxième génération ou de l’omalizumab, un anticorps monoclonal (Tableau 1). Source potentielle d’inquiétude, une proportion assez élevée des autres suit une corticothérapie générale dont l’usage prolongé est pourtant déconseillé dans les lignes directrices. Ces faits ont alimenté la discussion sur la conduite à tenir dans les cas où l’omalizumab, allié ou non à un antihistaminique en continu, ne permet pas de bien maîtriser la maladie.
Voir au-delà des lignes directrices : le patient difficile à traiter
Normalement, la plupart des patients traités d’après l’algorithme préconisé dans les lignes directrices de 2018 sont bien soulagés de leurs symptômes. Pour les autres, les réfractaires, les prochaines étapes sont plus nébuleuses si l’on se fie à ces lignes directrices et aux discussions tenues pendant la conférence sur l’urticaire UCARE du réseau GA2LEN, qui ont surtout porté sur l’utilisation de doses élevées d’omalizumab, l’utilité de la cyclosporine et les traitements expérimentaux.
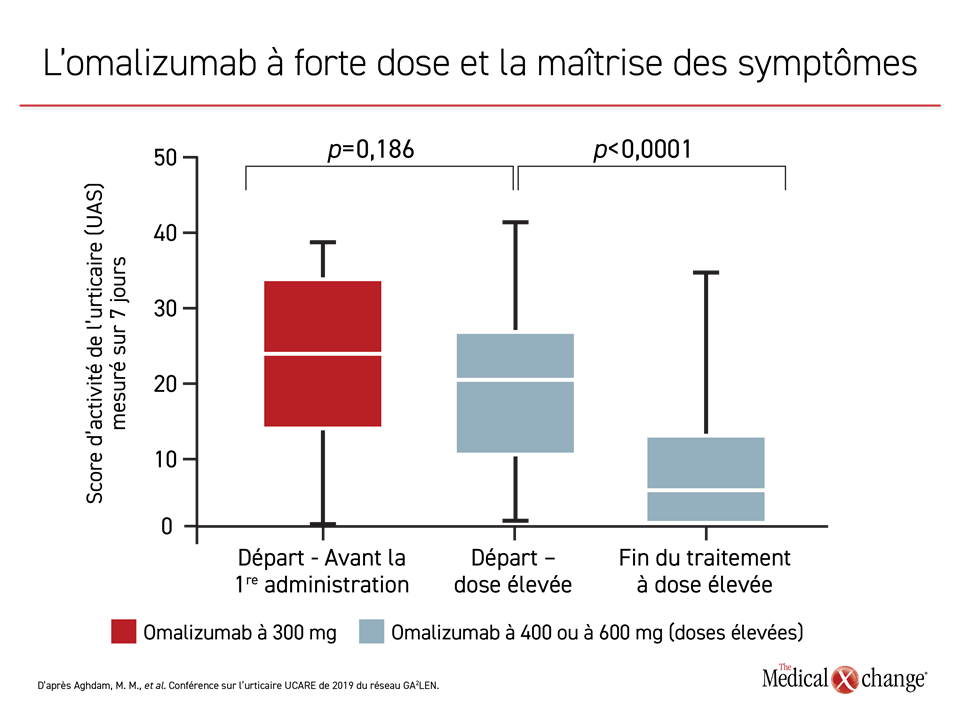
Selon plusieurs rapports et une analyse rétrospective publiée dernièrement (actualisée pendant la conférence), il est possible d’augmenter les taux de réponse en employant des doses d’omalizumab supérieures aux doses usuelles. Lors d’une étude récente sur l’UCS, 44 des 166 sujets ont reçu des doses élevées d’omalizumab2. Le score d’activité de leur urticaire (UAS) mesuré sur 7 jours a baissé chaque fois qu’ils passaient à un palier de dose supérieur, la dose usuelle étant de 300 mg toutes les 4 semaines (Figure 2).
D’après le Dr Todor A. Popov, de la Clinique d’allergologie et d’immunologie de l’Hôpital universitaire de Sofia, en Bulgarie, si l’omalizumab se montre plus actif, c’est parce que l’exposition des patients à cet agent est amplifiée. Celle-ci peut être obtenue en administrant une dose plus forte à la fréquence habituelle ou la dose usuelle plus souvent, soit toutes les 2 semaines. S’appuyant sur les données prouvant que des doses plus fortes d’omalizumab sont utiles lorsque les schémas types échouent, il a conclu à l’efficacité de cette stratégie et à son bien-fondé comme étape suivante du traitement.
La cyclosporine, une autre possibilité, est efficace et « assez sûre pendant une période pouvant aller jusqu’à un an », a affirmé le Dr Allen Kaplan, de la Division de pneumologie et des soins intensifs de l’Hôpital universitaire de la Caroline du Sud, à Charleston. Se servant de données ayant mis au jour une inhibition de la libération d’histamine proportionnelle à la dose de cyclosporine, le Dr Kaplan a souligné l’abondance de la littérature confirmant l’utilité de cet agent contre l’UCS. Il a toutefois reconnu que l’omalizumab à forte dose est mieux toléré et convient mieux aux cas mal maîtrisés par les doses types d’omalizumab. Par ailleurs, sachant que la pression sanguine et la fonction rénale des patients traités par la cyclosporine doivent être vérifiées toutes les 4 à 6 semaines, il a précisé qu’il s’en sert uniquement comme agent de remplacement ou d’appoint chez les patients que des doses élevées d’omalizumab (jusqu’à 600 mg toutes les deux semaines) ne parviennent pas à soulager suffisamment.
Beaucoup de participants, quoique pas tous, se sont dits d’accord avec cette stratégie pour les cas difficiles. Dans un sondage, 50 % d’entre eux ont choisi l’omalizumab à forte dose comme meilleure étape suivante lorsque les doses types se soldent par un échec, 21 % ont opté pour l’ajout de cyclosporine à la dose type d’omalizumab avant d’essayer la stratégie à dose élevée et 23 % ont voté en faveur de l’essai de la cyclosporine avant de recourir aux doses élevées d’omalizumab. Les autres ont dit choisir d’autres solutions telles que la dapsone ou l’hydroxychloroquine, avant de prescrire des doses élevées d’omalizumab ou de la cyclosporine, même si peu de données probantes les valident.
Si l’on en juge par la discussion tenue après le sondage, le coût est une préoccupation importante chez les participants donnant la priorité à la cyclosporine plutôt qu’à l’omalizumab à dose élevée. Ceux venant de pays où les listes de médicaments assurés sont courtes ont affirmé qu’il est souvent ardu, voire impossible, d’obtenir le remboursement de l’omalizumab à dose élevée, surtout compte tenu de la rareté des données recueillies chez les patients réfractaires.
Il est à prévoir que les prochaines lignes directrices fourniront davantage de conseils sur la prise en charge des patients qui ne répondent pas aux trois étapes de l’algorithme actuellement préconisé. Reconnaissant l’intérêt de recommandations d’experts quant à l’étape suivant celle de la cyclosporine, le Dr Kaplan a rappelé que l’utilité des agents souvent envisagés en troisième ou quatrième intention pour traiter l’UCS, comme la dapsone, le méthotrexate, la sulfasalazine et la gammaglobuline pour injection intraveineuse, n’est essentiellement soutenue que par des exposés de cas. Il faudra disposer de données probantes tirées d’essais portant sur ces agents ou d’autres, plus récents, pour que l’algorithme de traitement actuel soit modifié.
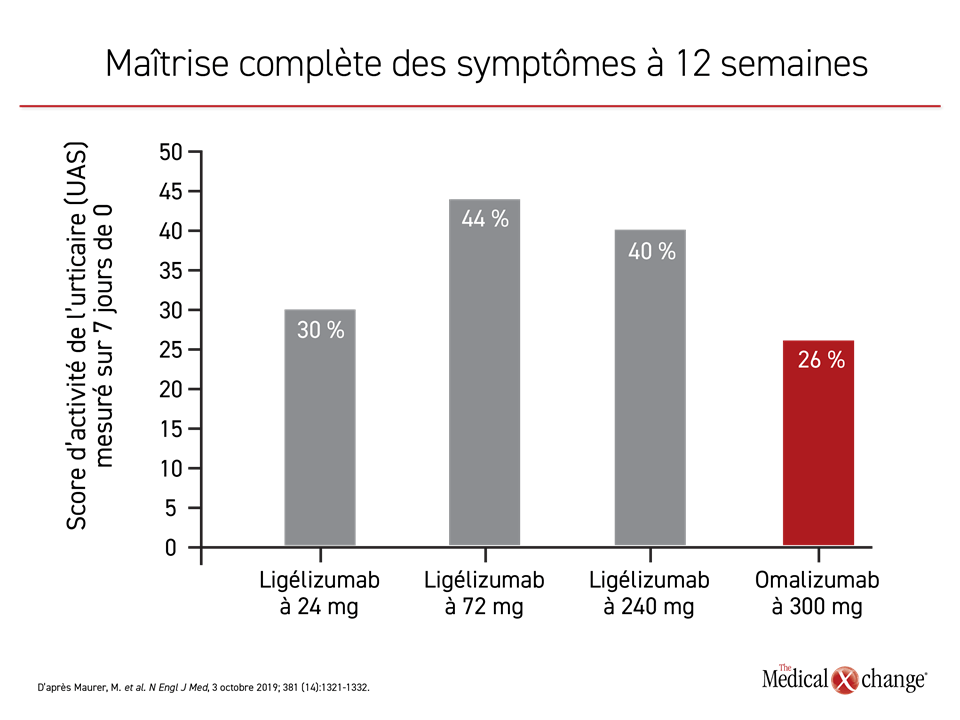
Le ligélizumab, un nouvel anticorps monoclonal anti-IgE, est généralement vu comme le plus prometteur de tous les agents expérimentaux. Au cours d’une étude de phase IIb de détermination de la dose publiée plusieurs semaines avant la conférence3 sur l’urticaire UCARE de 2019 du réseau GA2LEN, des patients atteints d’UCS mal maîtrisée à l’aide de fortes doses d’antihistaminiques ont été affectés aléatoirement à l’une des 3 doses de ligélizumab étudiées ou à la dose usuelle d’omalizumab (300 mg), chacune d’elles étant administrée toutes les 4 semaines pendant 20 semaines.
La comparaison des quatre groupes de sujets a permis de constater que les trois doses de ligélizumab ont produit des taux de réponse complète (obtention d’un UAS mesuré sur 7 jours de 0) plus élevés que le schéma posologique usuel de l’omalizumab (Figure 3). Selon la Dre Ana Gimenez-Arnau, professeure agrégée de dermatologie à l’Université autonome de Barcelone, en Espagne, les réactions au point d’injection ont été plus fréquentes avec le ligélizumab, mais aucune autre préoccupation n’a été soulevée concernant l’innocuité de l’un ou l’autre des médicaments.
« Pendant la période de suivi de cette étude déterminante, les patients recevant la dose la plus élevée de ligélizumab [240 mg toutes les 4 semaines] ont affiché une réponse complète plus rapidement que ceux traités par l’omalizumab [4 vs 9,5 semaines] », a ajouté la Dre Gimenez-Arnau.
Les chercheurs ont offert aux patients dont les symptômes étaient réapparus pendant les 24 semaines sans traitement ayant suivi la fin de l’étude de phase IIb d’être à nouveau traités toutes les 4 semaines par le ligélizumab à 240 mg dans le cadre d’une étude ouverte de prolongation. Pendant cette dernière, à laquelle ont participé 226 patients et dont les résultats ont été présentés sous forme de résumé durant la conférence4 sur l’urticaire UCARE de 2019 du réseau GA2LEN, le taux de réponse satisfaisante a grimpé de 58,7 % qu’il était à la 4e semaine, à 76,8 % à la 20e et à 84,2 % à la 52e. La réponse obtenue au terme du nouveau traitement était comparable que les patients aient reçu la dose faible ou élevée de ligélizumab pendant l’étude comparative. Il est à prévoir qu’une étude de phase III sera réalisée sur le ligélizumab.
De l’avis du Dr Elias Toubi, Directeur du Département d’allergologie et d’immunologie clinique du Centre médical Bnai Zion d’Haïfa, en Israël, des anticorps monoclonaux ciblant d’autres médiateurs immunologiques semblent également prometteurs grâce aux progrès réalisés dans la compréhension des phénomènes moléculaires à l’origine de l’UCS. Il a en outre énuméré plusieurs cibles aspécifiques (p. ex., l’interleukine 17) ayant un rapport avec d’autres maladies auto-immunes, de même que de nouvelles cibles particulièrement pertinentes pour l’UCS. Un de ces anticorps monoclonaux novateurs, appelé AK002 (antolimab), qui cible la protéine Siglec-8 qui se trouve à la surface des mastocytes et des granulocytes éosinophiles, en est aux premiers stades des essais cliniques.
« Il faut savoir que l’UCS est une maladie plus complexe qu’une autre placée uniquement sous la médiation des IgE »
« Il faut savoir que l’UCS est une maladie plus complexe qu’une autre placée uniquement sous la médiation des IgE », a affirmé le Dr Toubi. Il a ajouté qu’en plus des phénomènes survenant en aval et entraînant la libération d’histamine, les interventions opposées aux mécanismes fondamentaux qui sont le moteur des processus auto-immuns, comme la désactivation des lymphocytes T, suscitent un intérêt croissant. Il est convaincu qu’un éventail plus large d’options thérapeutiques pourrait aussi permettre de personnaliser le traitement en fonction du sous-type d’urticaire.
Maladies concomitantes : amélioration de l’issue de l’UC
Laissé de côté dans les lignes directrices de 2018, le fardeau que représentent les maladies concomitantes a été un sujet de discussion majeur pendant la conférence sur l’urticaire UCARE de 2019 du réseau GA2LEN. Comme l’UC ne peut être guérie, le dépistage et le traitement efficaces des maladies concomitantes deviennent particulièrement importants pour qui veut améliorer la qualité de vie des patients. Selon la Dre Mona Al-Ahmad, du Département d’allergologie du ministère de la Santé du Koweït, à Al Asimah, au Koweït, aucun protocole de prise en charge des maladies concomitantes ne fait encore l’unanimité, mais elle est d’avis que la première étape est la conscientisation.
« Il est important de tenir compte des maladies concomitantes au moment du diagnostic. Elles sont fréquentes, ça ne fait pas de doute », a-t-elle affirmé.
D’après la Dre Mona Al-Ahmad et le Dr Torsten Zuberbier qui s’est joint à elle pour évaluer les données probantes, les maladies concomitantes peuvent être divisées en deux catégories selon qu’elles sont d’origine immunologique ou non. Auteur principal des lignes directrices de l’EAACI/GA2LEN/EDF/OMA publiées en 2018, le Dr Zuberbier, qui est attaché au Département de dermatologie et d’allergologie de l’Hôpital universitaire de la Charité, de Berlin, en Allemagne, est d’accord pour dire que la prise en charge de ces maladies doit être intégrée aux soins courants.
« Il est important de tenir compte des maladies concomitantes au moment du diagnostic. Les données nous montrent qu’elles sont fréquentes. »
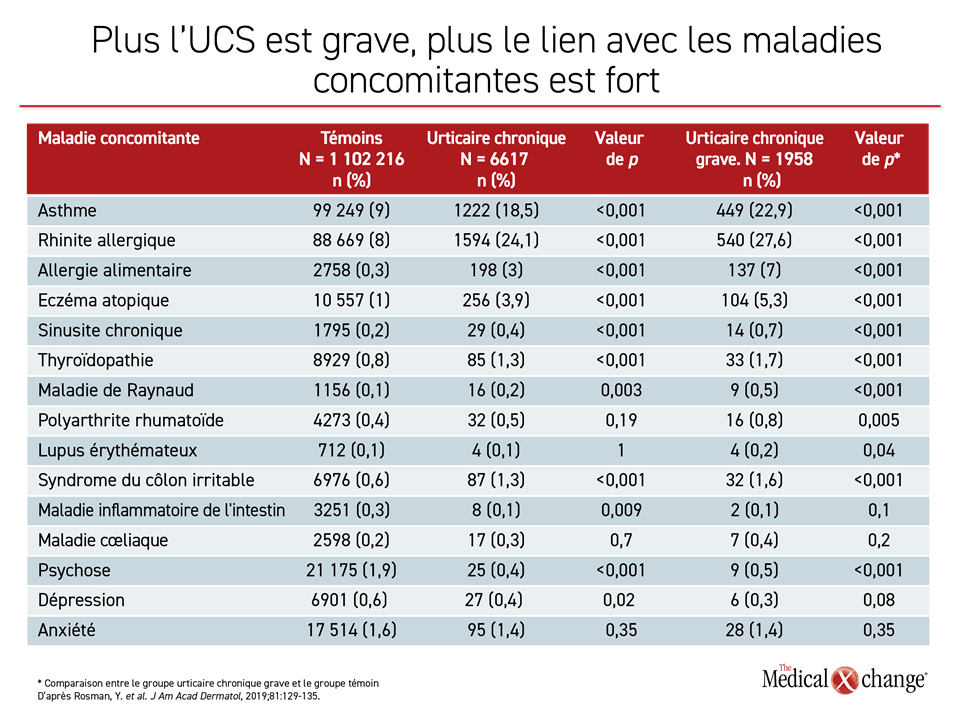
Il a ajouté que les maladies concomitantes d’origine immunologique, qui pourraient avoir des voies physiopathologiques en commun et qui accompagnent souvent l’UCS sont l’asthme, la thyroïdite de Hashimoto, la maladie de Raynaud, la rhinite allergique, l’eczéma atopique et le diabète de type 1. En général, plus l’UCS est grave, plus ces liens sont forts (Tableau 2).
Les troubles psychiatriques, surtout la dépression, comptent parmi les maladies concomitantes non immunologiques dont le lien avec l’UCS est le plus fort. À l’instar d’autres médecins, la Dre Al‑Ahmad a admis que la question à savoir si la dépression accompagne l’UCS ou si elle la conséquence de la chronicité de ses symptômes fait encore l’objet de débats. Quoi qu’il en soit, elle est convaincue que le traitement de la dépression dès les premiers signes d’UCS pourrait atténuer ses effets négatifs sur la qualité de vie.
L’intérêt du dépistage systématique des maladies concomitantes d’origine immunologique ou non est encore débattu, mais les données citées par le Dr Zuberbier confirment l’hypothèse voulant que le soulagement des maladies concomitantes permette logiquement d’améliorer l’issue de l’UCS directement ou non5. Par exemple, une petite étude a établi un parallèle entre l’emploi de lévothyroxine et l’atténuation de l’urticaire dans un sous-groupe de sujets atteints de thyroïdite de Hashimoto6. Mentionnant le lien entre l’UCS et le reflux gastro-œsophagien (RGO)7, il a soutenu que les bienfaits obtenus indépendamment de l’UCS justifient probablement que l’on décèle et traite cette maladie, au même titre que les autres.
La Dre Al-Ahmad a renchéri : « Il est important de tenir compte des maladies concomitantes quand nous évaluons un patient atteint d’UCS et de traiter celles que nous repérons, mais il demeure que nous avons besoin de plus de données à ce sujet ».
Les biomarqueurs et la surveillance de la maladie
Les biomarqueurs servant au diagnostic, à l’évaluation et à la surveillance de l’UCS seront-ils validés d’ici la rédaction des prochaines lignes directrices? Rien de moins sûr. Bien que prometteurs, les travaux assidus visant à concevoir des biomarqueurs permettant de distinguer les divers sous-types d’UC et partant, d’accélérer l’amorce d’un traitement efficace, n’ont toutefois pas encore abouti à la création d’instruments cliniques utiles, selon le Dr Simon Francis Thomsen, professeur de sciences biomédicales à l’Université de Copenhague, au Danemark.
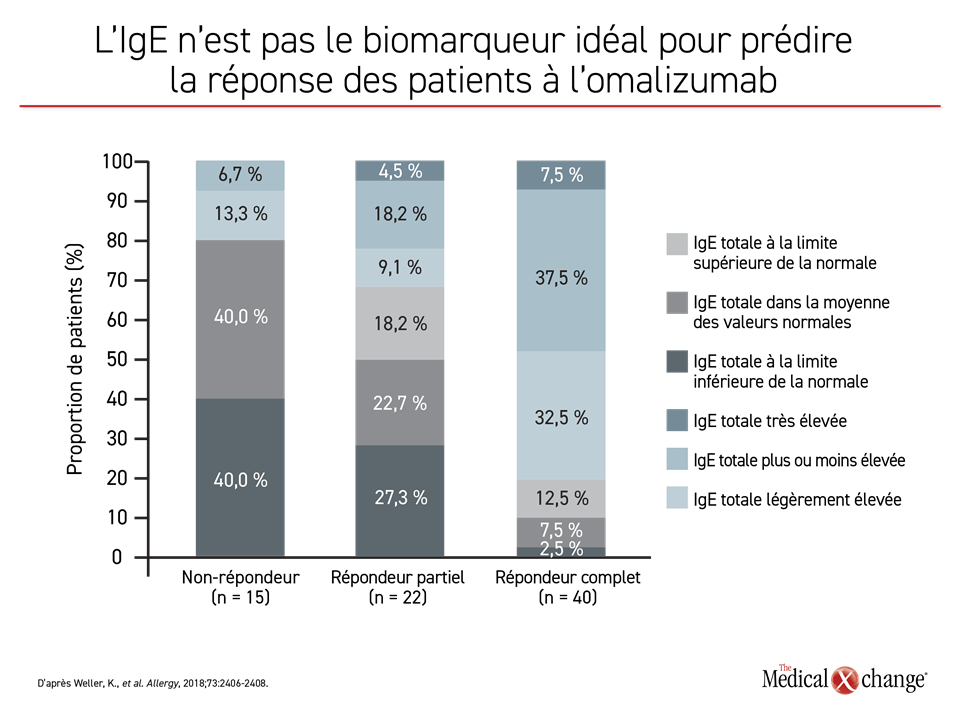
Il a parlé, entre autres, des taux sériques de D-dimère et d’IgE qui ont été reliés à une réaction favorable à l’omalizumab, d’où l’attention portée à la possibilité de les utiliser pour repérer les patients susceptibles de répondre à cet agent8,9, mais aucune corrélation solide qui justifierait leur application clinique n’a été établie. Une étude menée à l’institut du Dr Weller a démontré un lien entre les taux sériques d’IgE et une réaction favorable à l’omalizumab, même si des sujets dont les taux étaient faibles y ont réagi favorablement, tandis que d’autres présentant des taux élevés n’y ont pas répondu10 (Figure 4.
Que nous disposions ou non de biomarqueurs utiles en clinique d’ici la rédaction des prochaines lignes directrices, plusieurs experts s’accordent pour dire que les patients restent la meilleure source d’information sur le fardeau imposé par leur maladie. Les lignes directrices de 2018 répertorient plusieurs des outils, tels que l’UAS mesuré sur 7 jours, le questionnaire sur la qualité de vie liée à l’UC et le score d’évolution de l’œdème de Quincke, et qui y sont jugés utiles pour surveiller la maladie et vérifier la réponse au traitement. Lors de la conférence sur l’urticaire UCARE de 2019 du réseau GA2LEN, il a été question d’autres outils, comme ceux créés pour surveiller certaines UCind comme l’urticaire au froid ou l’urticaire cholinergique. L’objectif étant d’améliorer la qualité de vie, l’utilité de ces outils pour confirmer les bienfaits des stratégies thérapeutiques a pour ainsi dire fait l’unanimité.
Résumé
Grâce au projet collaboratif UCARE, l’amélioration des pratiques exemplaires pour la prise en charge de l’UCS et des autres formes d’UC s’accélère. Les démarches entreprises pour accroître la conscientisation au sujet de l’UC et de son retentissement considérable sur la qualité de vie lorsqu’elle n’est pas traitée s’accompagnent maintenant de programmes expressément créés pour mieux caractériser la maladie et perfectionner les stratégies thérapeutiques. Ont déjà été lancés, ou le seront prochainement, des projets de collaboration internationaux visant à évaluer l’effet de l’alimentation, de l’activité physique et autres habitudes de vie sur l’urticaire, à vérifier l’utilité d’associations médicamenteuses pour la maîtrise de cette maladie, à caractériser l’UCS chez les enfants et à collecter des données sur les sous-types les plus répandus d’UCind tels que l’urticaire au froid et de vascularite urticarienne.
Jumelé aux données recueillies dans le registre CURE à partir de la pratique clinique, le projet collaboratif UCARE devrait générer une hausse des taux de maîtrise de l’UC. La prochaine version des lignes directrices et celles qui la suivront tiendront compte des leçons qui seront tirées des avancées qu’on en attend.
Références
1. Zuberbier T, Aberer W, Asero R, et al. The EAACI/GA(2)LEN/EDF/WAO guideline for the definition, classification, diagnosis and management of urticaria. Allergy 2018;73:1393-1414.
2. Aghdam AM, van den Broek F, Rijken F et Knulst AC. High-dose omalizumab use in patients with chronic spontaneous urticaria. GA2LEN UCARE Urticaria Conference; 2019; Istanbul, Turquie.
3. Maurer M, Gimenez-Arnau AM, Sussman G, et al. Ligelizumab for Chronic Spontaneous Urticaria. N Engl J Med 2019;381:1321-1332.
4. Metz M, Baker DR, Chu YC, Danilycheva I, Hua E et Janocha R. Re-treatmet with ligelizumab achieves high rates of completely- and well-controlled symptoms in chronic spontaneous urticaria 2019 GA2LEN UCARE Urticaria Conference; 2019; Istanbul, Turquie.
5. Kolkhir P, Borzova E, Grattan C, Asero R, Pogorelov D et Maurer M. Autoimmune comorbidity in chronic spontaneous urticaria: A systematic review. Autoimmun Rev 2017;16:1196-1208.
6. Kim DH, Sung NH et Lee AY. Effect of Levothyroxine Treatment on Clinical Symptoms in Hypothyroid Patients with Chronic Urticaria and Thyroid Autoimmunity. Ann Dermatol 2016;28:199-204.
7. Aitella E, De Bartolomeis F, Savoia A, Fabiani M, Romano M et Astarita C. The overlap syndrome of urticaria and gastroesophageal reflux disease. PLoS One 2018;13:e0207602.
8. Asero R, Marzano AV, Ferrucci S et Cugno M. D-Dimer Plasma Levels Parallel the Clinical Response to Omalizumab in Patients with Severe Chronic Spontaneous Urticaria. Int Arch Allergy Immunol 2017;172:40-44.
9. Puxeddu I, Petrelli F, Angelotti F, Croia C et Migliorini P. Biomarkers In Chronic Spontaneous Urticaria: Current Targets And Clinical Implications. J Asthma Allergy 2019;12:285-295.
10. Weller K, Ohanyan T, Hawro T, et al. Total IgE levels are linked to the response of chronic spontaneous urticaria patients to omalizumab. Allergy 2018;73:2406-2408.