Revue d’experts
Bien utiliser les anticoagulants pour prévenir les AVC dans les cas de fibrillation auriculaire
1er chapitre : Prévention de l’AVC sur fond de fibrillation auriculaire – Les lignes directrices
Gustavo Saposnik, M.D., M.S.P., FRCPC
Professeur agrégé de neurologie
Chercheur de carrière, Fondation des maladies du cœur et de l’AVC du Canada
Directeur du Centre de recherche sur l’issue des AVC et de l’Unité des neurosciences de la décision
Hôpital St-Michael, Université de Toronto
Toronto (Ontario)
L’anticoagulation réduit significativement le risque d’AVC chez les patients atteints de fibrillation auriculaire (FA). Pourtant, les études ont montré à maintes reprises qu’ils ne reçoivent pas une anticoagulation convenable, que ce soit en prévention primaire ou secondaire; soit qu’ils ne se sont jamais fait prescrire d’anticoagulants, soit qu’ils ne reçoivent pas une dose thérapeutique, soit qu’ils ne respectent pas la prescription du médecin. Grâce à une meilleure compréhension des raisons expliquant cette adhésion décevante aux lignes directrices, il sera possible de contrer cette source de mortalité et de morbidité évitables. Ce programme met l’accent sur le risque d’AVC chez les patients atteints de FA et sur les stratégies éprouvées pour bien les prendre en charge qu’il s’agisse de prévenir un premier ou un deuxième AVC. Si l’emploi d’une anticoagulation convenable se généralisait, la morbidité et les décès évitables consécutifs à un AVC diminueraient considérablement.
Caractéristiques épidémiologiques de l’AVC sur fond de fibrillation auriculaire
La fibrillation auriculaire (FA) est un facteur de risque majeur, quoique facile à corriger, d’AVC1. Elle quintuple ce risque chez les patients qui en sont atteints2. De 20 à 30 % des AVC ischémiques, qui représentent environ 80 % de tous les AVC3, sont imputés à la FA, mais cette proportion s’accroît chez les patients âgés, puisqu’elle dépasse 35 % chez les plus de 80 ans4. Au Canada, où l’AVC se situe au 3e rang des causes les plus fréquentes de décès et au 10e, pour ce qui est de l’invalidité5,6, les stratégies visant à abaisser le risque d’AVC sur fond de FA sont une avenue importante pour réduire une morbidité et des décès évitables. Après un premier AVC, le risque ajusté en fonction de l’âge d’un deuxième AVC est plus que doublé chez les patients ne prenant pas d’anticoagulants7.
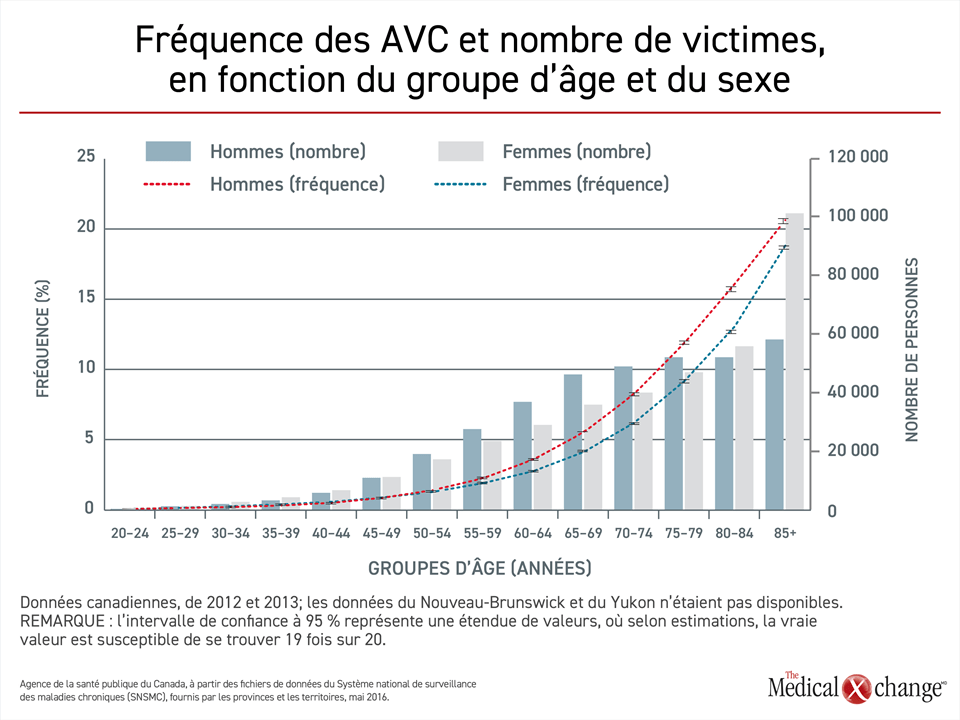
Qu’il s’agisse d’AVC ischémiques ou hémorragiques, le risque augmente avec l’âge3. À partir de 25 ans, le risque à vie s’élève à 25 %8, mais les AVC découlent de la prévalence de facteurs de risque corrigibles de vasculopathie, dont l’hypertension, le diabète, les dyslipidémies et l’obésité3. Résultat : l’incidence des AVC au Canada, comme ailleurs, reste faible jusqu’à un âge moyen avancé, lorsque les effets des mauvaises habitudes de vie, comme la sédentarité et une mauvaise alimentation, pavent la voie aux vasculopathies, dont l’AVC (Fig. 1).
Au Canada, environ 10 % des adultes âgés de 65 ans ou plus ont subi un AVC et plus de 400 000 d’entre eux y ont survécu9. L’incidence des AVC est un peu plus élevée chez les hommes que chez les femmes, mais les femmes d’au moins 80 ans comptent plus de survivantes. L’incidence des AVC et des décès qu’ils ont causés a chuté entre 2003 et 2012, possiblement grâce à l’administration plus rapide de traitements plus efficaces. Or le nombre absolu de survivants augmente en raison de la croissance et du vieillissement de la population9.
La FA, le type d’arythmie cardiaque le plus répandu, a aussi un lien avec l’âge, le risque à vie étant de 25 % environ et sa prévalence doublant à chaque décennie10. Comme l’espérance de vie plus longue et l’évolution démographique font en sorte que la proportion de personnes âgées de 65 ans ou plus augmente ici et ailleurs, l’épidémie de FA à laquelle nous assistons déjà devrait se poursuivre pendant les 20 prochaines années11. En plus de l’âge, l’AVC ischémique et la FA comptent plusieurs facteurs de risque en commun, dont l’hypertension, l’obésité, le diabète et les coronaropathies12. En elle-même, la FA multiplie par deux les décès toutes causes confondues chez la femme et les augmente de 50 % chez l’homme13, l’AVC n’étant qu’un facteur favorisant. Lorsqu’elle se déclare, le tiers des patients présentent déjà un dysfonctionnement ventriculaire gauche12. Une vasculopathie disséminée entre en jeu dans les nombreux décès imputables à un infarctus du myocarde et à d’autres problèmes cardiaques frappant les patients atteints de FA, ainsi que dans l’ischémie infraclinique que l’on sait maintenant causer des déficits neurologiques chez ces patients, même indemnes d’AVC14,15.
En outre, les patients atteints de FA risquent davantage de rester invalides à la suite d’un AVC ou d’y succomber. Par exemple, une étude menée en Ontario, au Canada, chez plus de 12 000 victimes d’un AVC ischémique aigu a révélé que la probabilité que celles atteintes de FA soient autonomes à 30 jours était de 30 % inférieure à celle des patients indemnes de FA16. Leur risque de décès à 30 jours et à 1 an était également plus élevé (22,3 % versus 10,2 %; p < 0,0001 et 37,1 % versus 19,5 %; p < 0,0001), tout comme leur risque de décès ou d’invalidité au départ de l’hôpital (69,7 % versus 54,7 %; p < 0,0001). En outre, ils étaient moins susceptibles de se rétablir à la suite d’une thrombolyse intraveineuse. D’autres études ont donné des résultats similaires4,17. Chez les patients ayant subi un premier AVC, la découverte d’une FA est associée à une augmentation du risque d’un deuxième AVC, même comparativement aux patients que l’on sait atteints de FA18.
C’est pourquoi il faut impérativement voir à la prévention primaire et à la prévention secondaire des AVC chez les patients atteints de FA. Selon plusieurs lignes directrices factuelles, la prévention des AVC au moyen d’anticoagulants a des effets salutaires chez pratiquement tous ces patients12,19-21, ce qui s’explique par les taux considérables de décès et d’invalidité qui assurent un rapport favorable entre les bienfaits de ces deux niveaux de prévention et les risques qu’ils comportent chez la grande majorité de ces patients. Comparativement aux personnes indemnes de FA, les patients atteints de FA sont beaucoup plus susceptibles de rester invalides consécutivement à un AVC (p < 0,0005) et risquent deux fois plus de mourir dans les six mois qui suivent (p < 0,001)4,17. Par ailleurs, ceux qui sont victimes d’un AVC, même mineur, ou d’accidents ischémiques transitoires (AIT) sont plus exposés aux incidents cardiovasculaires et à un nouvel AVC21. C’est pourquoi la classification du risque est absolument nécessaire pour prévenir les AVC chez les patients atteints de FA. Par exemple, une étude menée chez près de 100 guides d’opinion a fait ressortir des erreurs de classification du risque dans 50 % des scénarios de simulation et une inertie thérapeutique, définie comme l’absence d’anticoagulation amorcée par voie orale, dans 60 % d’entre eux22.
La solution : prendre en charge le risque d’AVC chez les patients atteints de FA
Toutes les lignes directrices régissant la prise en charge de la FA, dont celles rédigées au Canada19, aux États-Unis20 et en Europe12, recommandent les anticoagulants pour voie orale dans la prévention primaire des AVC et répertorient les patients qui en auraient besoin à l’aide de systèmes d’évaluation du risque. Au Canada, les lignes directrices sur la prévention secondaire des AVC soulignent l’importance du dépistage de la FA, de l’instauration d’une anticoagulation et de la correction des facteurs de risque vasculaires chez ces patients21.
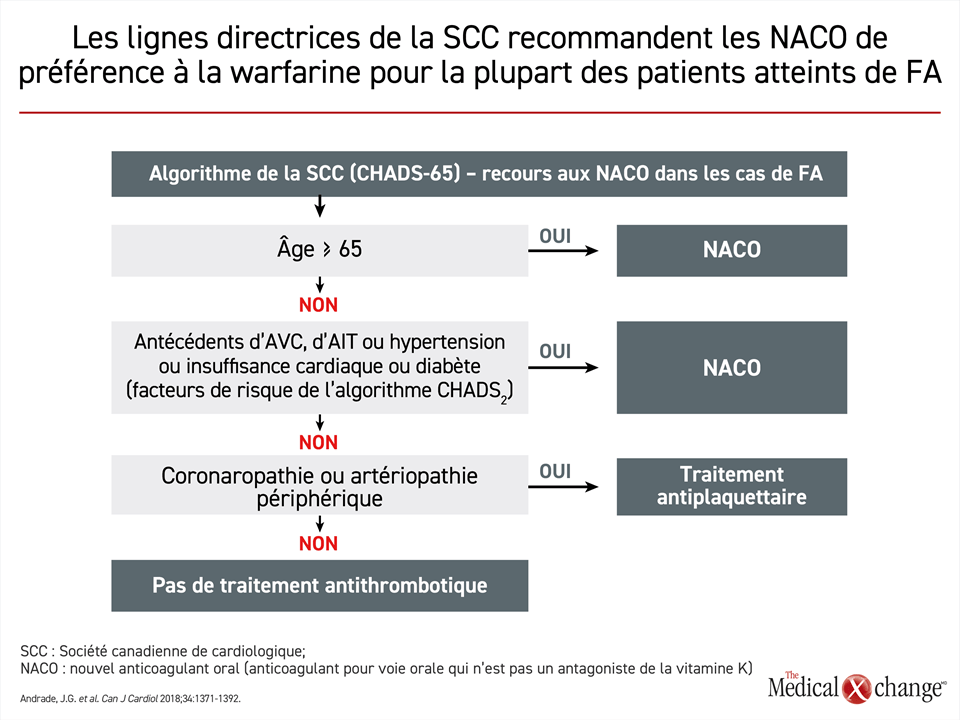
Les lignes directrices européennes et étatsuniennes préconisent l’identification des cas relevant de l’anticoagulation au moyen du système d’évaluation CHA2DS2-VASc (insuffisance cardiaque congestive, hypertension, âge, diabète, AVC, vasculopathie, âge et sexe), une version actualisée de l’algorithme CHADS2 qui ne prenait en compte ni la présence d’une vasculopathie ni le sexe23. Les lignes directrices de la Société canadienne de cardiologie (SCC) reposent sur une version simplifiée de l’algorithme CHADS2, l’algorithme CHADS-6519. Selon ce dernier, il faut envisager l’anticoagulation par voie orale chez tous les patients atteints de FA âgés de plus de 65 ans (Fig. 2). Elle est également recommandée chez les patients plus jeunes qui présentent n’importe lequel des facteurs de risque recensés dans l’algorithme CHADS2, dont des antécédents d’AVC, l’hypertension, une insuffisance cardiaque et le diabète. Étant donné la fréquence de la FA chez les patients de plus de 65 ans et chez ceux ayant des facteurs de risque cardiovasculaire courants, tels l’hypertension, il est probable que la plupart de ceux qui en sont bel et bien atteints aient besoin d’un NACO aux fins de prévention primaire d’un AVC.
Bien qu’elles reposent sur le système CHA2DS2-VASc, les lignes directrices européennes sur la prévention primaire des AVC sont comparables12. On y recommande l’anticoagulation par voie orale pour tout homme obtenant un score minimal de 1 et pour toute femme enregistrant un score de 2 ou plus. Toute personne d’au moins 65 ans et toute personne ayant des antécédents de vasculopathie, s’étant notamment exprimée par un infarctus du myocarde, une artériopathie périphérique ou une plaque aortique, obtient automatiquement un score de 1. Un score de 2 est attribué à un âge de 75 ans ou plus. Les lignes directrices étatsuniennes exigent deux facteurs de risque chez les hommes et trois, chez les femmes, sans égard à l’âge20, mais encore là, les dérogations à cette règle devraient être peu nombreuses chez les patients appartenant à la tranche d’âge où la FA se manifeste habituellement.
Les Recommandations canadiennes pour les pratiques optimales de soins de l’AVC sur la prévention secondaire de l’AVC préconisent le dépistage systématique de la FA21. Il est à prévoir que la prévention d’un deuxième AVC chez les patients atteints de FA procurera une protection du même ordre contre l’invalidité et le décès que celle du premier24,25. Dans le cadre d’une prise en charge à long terme, les nouveaux anticoagulants oraux (NACO), qui ne sont pas des antagonistes de la vitamine K, sont les agents privilégiés chez la plupart des patients atteints de FA ou victimes d’un nouvel AVC. Les patients porteurs d’une valvule cardiaque mécanique font exception. Pour obtenir des résultats optimaux, il est essentiel d’adapter la posologie des patients qui prennent de la warfarine afin d’atteindre le rapport international normalisé (RIN) visé. Celui-ci va de 2,0 à 3,0 en l’absence de valvule cardiaque mécanique et de 2,5 à 3,5 chez les porteurs d’une valvule. Il faut informer les patients qui prennent un NACO des dangers auxquels ils s’exposent s’ils oublient de prendre des doses et vérifier qu’ils respectent leur traitement périodiquement. Pour bien ajuster la dose de NACO, il faut évaluer la fonction rénale une fois par année ou plus souvent si elle risque de s’affaiblir.
Aujourd’hui, dans toutes les grandes lignes directrices, les NACO ont ravi à la warfarine (un antagoniste de la vitamine K) son titre de traitement type12,19,20. Quatre agents de cette classe sont homologués au Canada. Bien que les lignes directrices reconnaissent l’utilité de la warfarine comme solution de rechange, elles préconisent toutes l’emploi des NACO, ces agents ayant fait preuve dans des essais cliniques d’une efficacité semblable, voire supérieure, à celle de la warfarine et d’une incidence similaire ou inférieure d’hémorragie intracérébrale, le type d’hémorragie le plus craint. En outre, les NACO sont plus faciles à utiliser. Contrairement à la warfarine, nul besoin de surveiller le RIN ni d’ajuster la posologie afin d’obtenir l’effet anticoagulant recherché.
En règle générale, l’anticoagulation par voie orale n’est pas contre-indiquée chez les patients atteints de FA particulièrement ou fortement exposés aux hémorragies. Par exemple, les lignes directrices européennes recommandent de recenser les facteurs de risque d’hémorragie et de les corriger, mais stipulent qu’il n’y a généralement pas lieu de priver un patient d’une anticoagulation par voie orale parce qu’il court un risque élevé de saignement12. Les lignes directrices de la SCC sur la prévention de l’AVC chez les patients atteints de FA reconnaissent les facteurs de risque d’hémorragie, mais n’émettent aucune restriction quant à la prophylaxie au moyen d’anticoagulants19.
Essais déterminants : les NACO comme moyen type de prévenir les AVC
La warfarine est très efficace pour prévenir les AVC dans les cas de FA26, mais la préférence exprimée pour les NACO dans les lignes directrices en vigueur repose sur des faits. Les NACO ne sont certes pas interchangeables si l’on tient compte de caractéristiques importantes telles que leur innocuité chez les patients dont la fonction rénale est compromise, mais les essais déterminants menés sur chacun de ces agents ont montré qu’ils sont au moins aussi efficaces et sûrs que la warfarine. Les quatre NACO commercialisés au Canada sont le rivaroxaban, l’apixaban, l’édoxaban (des inhibiteurs du facteur Xa) et le dabigatran (un inhibiteur direct de la thrombine).
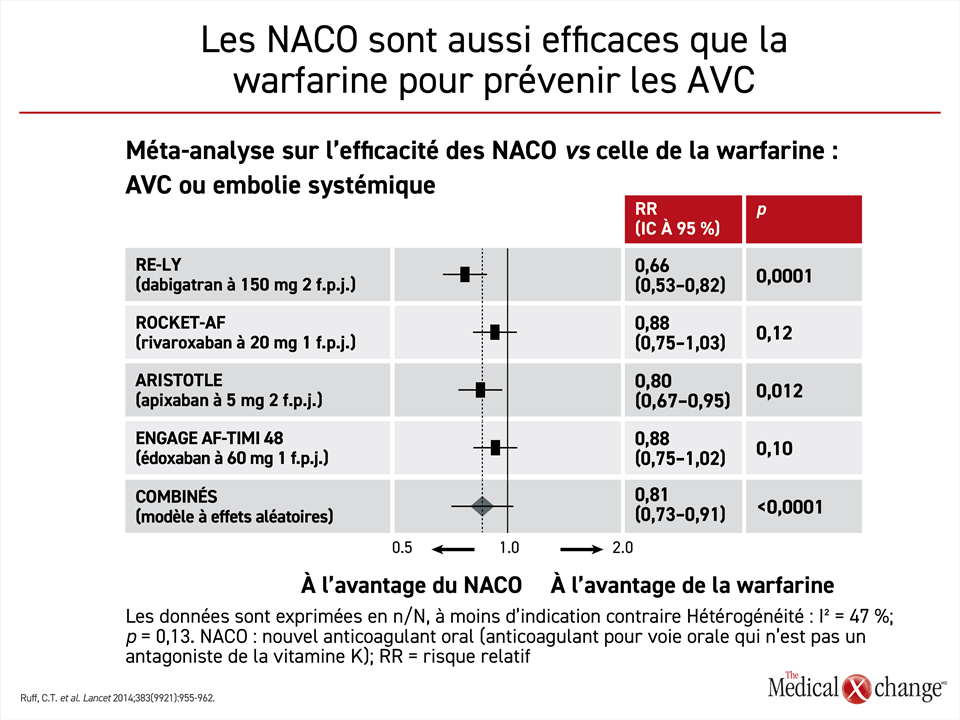
Les essais déterminants sur les NACO ont été réalisés selon une méthodologie similaire. Ils ont tous servi à vérifier leur non-infériorité par rapport à la warfarine en regard du paramètre d’évaluation principal : l’AVC ou l’embolie. Ils ont tous été reliés à un risque inférieur, au moins sur le plan numérique, de ces incidents comparativement à la warfarine, l’écart avec le dabigatran ayant été suffisamment grand lors de l’essai RE-LY pour être significatif. Une méta-analyse de ces essais a fait ressortir une réduction du risque 19 % plus marquée avec les NACO que celle obtenue avec la warfarine, soit une différence extrêmement significative (p < 0,0001)27 (Fig. 3).
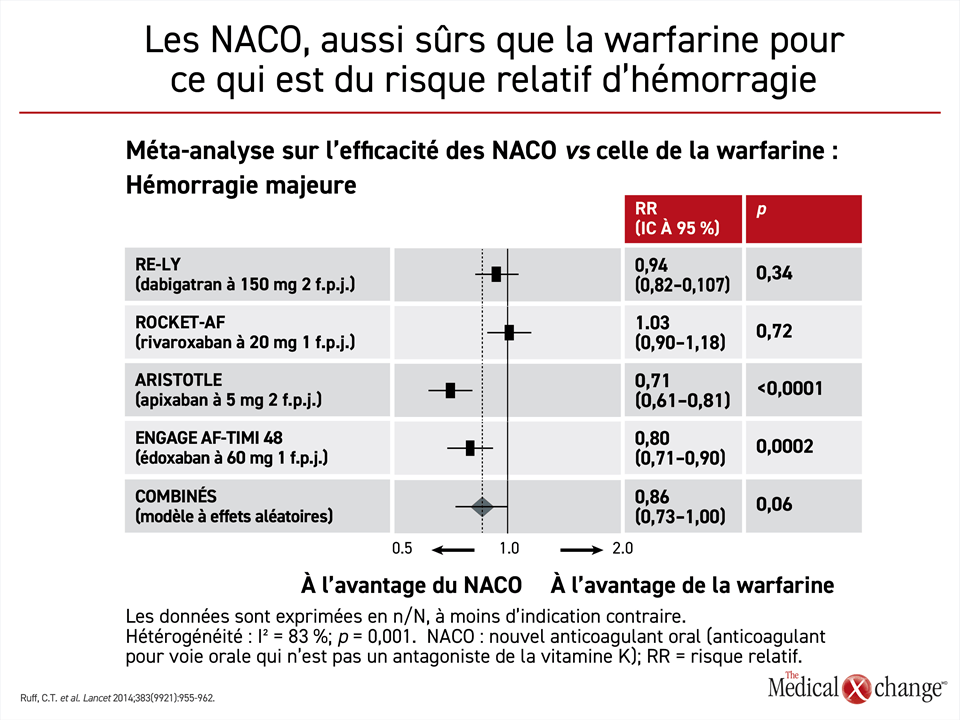
La comparaison de ces essais déterminants sous l’angle des hémorragies a révélé que le risque n’était pas plus élevé avec les NACO qu’avec la warfarine. Lors de l’essai ARISTOLE sur l’apixaban (p < 0,0001) et de l’essai ENGAGE AF-TIMI 48 sur l’édoxaban (p = 0,0002), ces NACO ont eu un avantage significatif sur la warfarine. La méta-analyse réalisée à partir de ces essais déterminants a révélé que la réduction du risque d’hémorragie enregistrée avec les NACO avait presque atteint la signification statistique (p = 0,06) (Fig. 4).
D’après une analyse selon l’intention de traiter réalisée lors de l’essai ROCKET-AF28, le rivaroxaban ne s’est pas montré inférieur à la warfarine pour ce qui était du paramètre d’évaluation principal, mais il lui a été statistiquement supérieur au vu d’une analyse effectuée selon le protocole. Si le rivaroxaban a été relié à une hausse de certaines manifestations hémorragiques non mortelles, il demeure qu’il a entraîné une baisse significative des AVC hémorragiques et des hémorragies intracérébrales. Aucun avantage du côté de la mortalité n’a été observé.
Les chercheurs de l’essai ARISTOTLE29 ont établi un parallèle entre l’apixaban et une diminution significative de 21 % du paramètre d’évaluation principal, une baisse de 31 % des hémorragies majeures et une réduction de 11 % des décès toutes causes confondues. En s’attardant à chacun des paramètres d’évaluation secondaires, ils ont constaté que comparativement à la warfarine, l’apixaban avait entraîné une baisse significative des AVC hémorragiques et des hémorragies intracérébrales, mais pas des AVC ischémiques.
Les chercheurs de l’essai ENGAGE AF-TIMI 4830 ont constaté que l’édoxaban à 60 mg avait abaissé le paramètre d’évaluation principal de 21 % par rapport à la warfarine (p < 0,001) et le risque d’hémorragie majeure, de 20 % (p < 0,001). Ils ont aussi relié la dose type de 60 mg d’édoxaban à une diminution relative de 14 % (p = 0,013) des décès d’origine cardiovasculaire et à une réduction de 10 % (p = 0,02) du paramètre d’évaluation secondaire composée de l’AVC, de l’embolie systémique ou du décès.
Lors de l’essai RE-LY31, le dabigatran à 150 mg a été associé à une baisse de 35 % du paramètre d’évaluation principal comparativement à la warfarine. Les AVC ischémiques ont été réduits de 24 % et les décès d’origine vasculaire, de 15 %. La diminution de 12 % des décès toutes causes confondues a frôlé la signification statistique (p = 0,051). La dose de 150 mg de dabigatran a été reliée à une augmentation du risque d’hémorragies digestives, mais pas des hémorragies majeures. Elle a toutefois été associée à une réduction de 60 % des hémorragies intracérébrales.
Il est impossible de comparer les NACO d’un essai à l’autre, mais le rapport entre les bienfaits escomptés de tous ces agents et les risques qu’ils comportent est jugé plus favorable que celui de la warfarine. Il est ressorti d’une méta-analyse de ces quatre essais ayant réuni plus de 70 000 patients que les NACO avaient entraîné une baisse de 19 % (p < 0,0001) des AVC ou des embolies systémiques, une réduction de 10 % (p = 0,0003) des décès toutes causes confondues27 et une diminution de 51 % (p < 0,0001) des hémorragies intracérébrales.
Selon cette méta-analyse, les hémorragies digestives étaient 25 % plus fréquentes avec les NACO (p = 0,04) qu’avec la warfarine. Quant à la catégorie des hémorragies majeures, les résultats ont été significativement hétérogènes d’un NACO à l’autre (p = 0,001)27, mais après groupement des données, ils ont été reliés à des résultats de 14 % inférieurs à ceux de la warfarine pour ce paramètre. Cet écart n’a pas franchi le seuil de la signification statistique, contrairement à la baisse de 29 % du risque d’hémorragie observée avec l’apixaban à 5 mg (p < 0,0001) et à celle de 20 % (p = 0,0002) obtenue avec l’édoxaban. Ce fut le cas aussi de la réduction de 6 % qu’a entraînée le rivaroxaban à 20 mg et de l’augmentation de 3 % des hémorragies majeures observée avec le dabigatran à 150 mg.
Malgré les résultats variables obtenus avec les NACO en matière d’efficacité et d’innocuité, les auteurs de cette méta-analyse considèrent que le rapport entre les bienfaits de ces agents et les risques qu’ils comportent est plus favorable que celui de la warfarine27. De plus, leur efficacité et leur innocuité avantageuses ont été qualifiées d’uniformes chez un large éventail de patients. Les différences entre les divers NACO pourraient avoir de l’importance pour certains groupes de patients, comme les personnes âgées32, mais ces données appuient les lignes directrices qui les préconisent à titre de traitement à privilégier10,12,20.
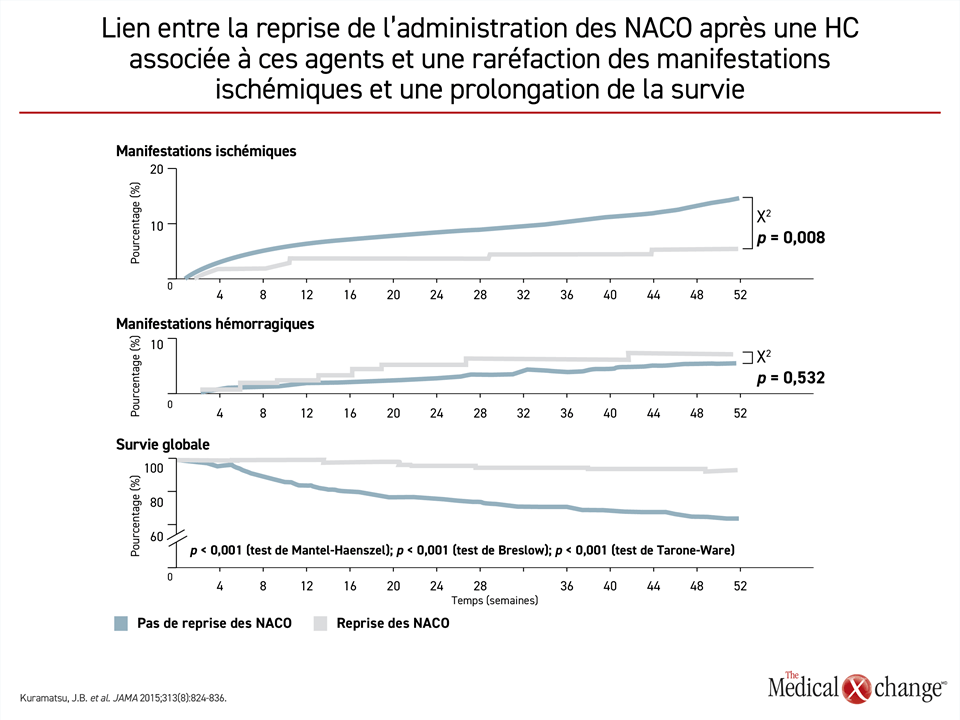
Selon les Recommandations canadiennes pour les pratiques optimales de soins de l’AVC, les avantages relatifs des NACO sur la warfarine s’étendent aux patients victimes d’un nouvel AVC21, mais le moment jugé opportun pour reprendre l’anticoagulation reste controversé. Même si la reprise de l’anticoagulation a permis de raréfier les décès chez les victimes d’AVC ayant déjà fait une hémorragie cérébrale (HC)33 (Fig. 5), on craint qu’elle augmente le risque de ce type d’hémorragie si elle est amorcée trop tôt après un premier AVC ischémique ou, à l’inverse, que les patients soient très vulnérables à un nouvel AVC si elle l’est trop tard. Les études publiées, qui sont majoritairement des études rétrospectives ou de petite envergure, font état de données hétérogènes34. Bien que la Société européenne de cardiologie préconise une règle simple selon laquelle l’anticoagulation peut être réamorcée le lendemain d’un accident ischémique transitoire, trois jours après un AVC non invalidant, six jours après un AVC de gravité moyenne et 12 jours après un AVC aigu35, les auteurs des lignes directrices du Royaume-Uni et de l’Allemagne considèrent que les données disponibles sont insuffisantes pour conclure à l’efficacité et à l’innocuité d’une telle reprise moins de 14 jours après un AVC34.
Essais menés dans l’espoir de déterminer le moment optimal pour reprendre l’anticoagulation
Quatre essais multicentriques de grande envergure menés avec répartition aléatoire pourraient bien répondre à la question du moment optimal pour reprendre une anticoagulation par voie orale (Fig. 6). Comptant de 1000 à près de 4000 sujets, trois de ces essais, intitulés TIMING, START et ELAN, devraient être terminés en 2021. Le quatrième prendra fin en 2022. Ils servent tous à comparer une reprise rapide de l’administration de NACO à une autre, plus tardive, après un AVC ischémique chez des patients atteints de FA. La méthodologie utilisée varie, mais une reprise dans les quatre jours y est généralement vue comme rapide. Les reprises tardives vont de cinq jours à plus de 14 jours après l’AVC. Les sujets de tous ces essais sont autorisés à prendre n’importe lequel des NACO actuellement homologués. Les chercheurs de ces quatre essais espèrent découvrir si l’efficacité et l’innocuité d’une reprise rapide de l’administration des NACO sont de même ampleur que celles d’une reprise plus tardive. Des résultats plaidant en faveur d’une reprise rapide auraient probablement des répercussions positives pour les patients, puisqu’elle leur permettrait de sortir de l’hôpital plus tôt et, sous l’angle de la pratique clinique, elle permettrait une meilleure observance et une plus grande persévérance envers un traitement amorcé en milieu hospitalier.
Anticoagulation par voie orale après l’établissement d’un diagnostic de FA à l’Urgence
Dès lors qu’un diagnostic de FA est posé à l’Urgence, les données probantes montrent qu’il est plus probable que les patients fassent exécuter une ordonnance pour un anticoagulant à prise orale si elle leur est remise avant qu’ils sortent de l’hôpital36. Selon cette étude de cohorte réalisée dans 15 hôpitaux du Canada, le risque absolu qu’une ordonnance ne soit pas exécutée à six mois et à 12 mois augmente en effet de 30,6 % et de 23,2 %. Le nombre de sujets à traiter à ces intervalles de mesure s’élève à trois et à quatre, respectivement. Ces disparités dans l’adhésion au traitement sont une des explications de l’écart thérapeutique en matière de prévention des AVC.
Résumé
L’anticoagulation par voie orale a fait ses preuves comme stratégie pour réduire le lourd fardeau clinique imposé par la prévention primaire et la prévention secondaire des AVC chez les patients atteints de FA. D’après les principales lignes directrices, y compris les canadiennes, les données probantes témoignant des fortes réductions du risque produites par les anticoagulants à prise orale en général et par les NACO en particulier sont convaincantes. Les lignes directrices régissant les deux niveaux de prévention sont simples. À moins de contre-indications évidentes, tous les patients devraient prendre un NACO, normalement aux doses types. Selon les lignes directrices de la SCC, seuls les patients de moins de 65 ans sans antécédents d’insuffisance cardiaque, d’hypertension, de diabète, de thromboembolie ou d’accident vasculaire cérébral sont exemptés des mesures de prévention primaire des AVC19. Quant à la prévention secondaire, les Recommandations canadiennes pour les pratiques optimales de soins de l’AVC indiquent qu’une anticoagulation par voie orale doit être envisagée chez tous les patients atteints de FA. L’adoption des lignes directrices en vigueur est l’occasion de réduire une source importante de morbidité et de mortalité au Canada.
Références
- Wolf PA, Dawber TR, Thomas HE, fils, et Kannel WB. Epidemiologic assessment of chronic atrial fibrillation and risk of stroke: the Framingham study. Neurology 1978;28:973-977.
- Kannel WB, Wolf PA, Benjamin EJ et Levy D. Prevalence, incidence, prognosis, and predisposing conditions for atrial fibrillation: population-based estimates. Am J Cardiol 1998;82:2N-9N.
- Boehme AK, Esenwa C et Elkind MS. Stroke Risk Factors, Genetics, and Prevention. Circ Res 2017;120:472-495.
- Reiffel JA. Atrial fibrillation and stroke: epidemiology. Am J Med 2014;127:e15-16.
- StatisticsCanada. Leading causes of death, total population, by age group and sex, Canada. http://www5statcangcca/cansim/a05?lang=eng&id=1020561 2017.
- DALYs GBD, Collaborators H. Global, regional, and national disability-adjusted life-years (DALYs) for 315 diseases and injuries and healthy life expectancy (HALE), 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet 2016;388:1603-1658.
- Penado S, Cano M, Acha O, Hernandez JL et Riancho JA. Atrial fibrillation as a risk factor for stroke recurrence. Am J Med 2003;114:206-210.
- Collaborators GBDLRoS, Feigin VL, Nguyen G, et al. Global, Regional, and Country-Specific Lifetime Risks of Stroke, 1990 and 2016. N Engl J Med 2018;379:2429-2437.
- CCDSS. Stroke in Canada: highlights from Canadian Chroni Disease Surveillance System (CCDSS). https://wwwcanadaca/en/public-health/services/publications/diseases-conditions/stroke-canada-fact-sheethtml 2019: Consulté le 1er juin 2020.
- Andrade J, Khairy P, Dobrev D et Nattel S. The clinical profile and pathophysiology of atrial fibrillation: relationships among clinical features, epidemiology, and mechanisms. Circ Res 2014;114:1453-1468.
- Morillo CA, Banerjee A, Perel P, Wood D et Jouven X. Atrial fibrillation: the current epidemic. J Geriatr Cardiol 2017;14:195-203.
- Kirchhof P, Benussi S, Kotecha D, et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016;37:2893-2962.
- Andersson T, Magnuson A, Bryngelsson IL, et al. All-cause mortality in 272,186 patients hospitalized with incident atrial fibrillation 1995-2008: a Swedish nationwide long-term case-control study. Eur Heart J 2013;34:1061-1067.
- Hahne K, Monnig G et Samol A. Atrial fibrillation and silent stroke: links, risks, and challenges. Vasc Health Risk Manag 2016;12:65-74.
- Gomez-Outes A, Suarez-Gea ML et Garcia-Pinilla JM. Causes of death in atrial fibrillation: Challenges and opportunities. Trends Cardiovasc Med 2017;27:494-503.
- Saposnik G, Gladstone D, Raptis R, et al. Atrial fibrillation in ischemic stroke: predicting response to thrombolysis and clinical outcomes. Stroke 2013;44:99-104.
- Gattringer T, Posekany A, Niederkorn K, et al. Predicting Early Mortality of Acute Ischemic Stroke. Stroke 2019;50:349-356.
- Kamel H, Johnson DR, Hegde M, et al. Detection of atrial fibrillation after stroke and the risk of recurrent stroke. J Stroke Cerebrovasc Dis 2012;21:726-731.
- Andrade JG, Verma A, Mitchell LB, et al. 2018 Focused Update of the Canadian Cardiovascular Society Guidelines for the Management of Atrial Fibrillation. Can J Cardiol 2018;34:1371-1392.
- January CT, Wann LS, Calkins H, et al. 2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society in Collaboration With the Society of Thoracic Surgeons. Circulation 2019;140:e125-e151.
- Wein T, Lindsay MP, Cote R, et al. Canadian stroke best practice recommendations: Secondary prevention of stroke, sixth edition practice guidelines, update 2017. Int J Stroke 2018;13:420-443.
- Sposato LA, Stirling D et Saposnik G. Therapeutic Decisions in Atrial Fibrillation for Stroke Prevention: The Role of Aversion to Ambiguity and Physicians’ Risk Preferences. J Stroke Cerebrovasc Dis 2018;27:2088-2095.
- Chen JY, Zhang AD, Lu HY, Guo J, Wang FF et Li ZC. CHADS2 versus CHA2DS2-VASc score in assessing the stroke and thromboembolism risk stratification in patients with atrial fibrillation: a systematic review and meta-analysis. J Geriatr Cardiol 2013;10:258-266.
- Dhamoon MS, Sciacca RR, Rundek T, Sacco RL et Elkind MS. Recurrent stroke and cardiac risks after first ischemic stroke: the Northern Manhattan Study. Neurology 2006;66:641-646.
- Aarnio K, Haapaniemi E, Melkas S, Kaste M, Tatlisumak T et Putaala J. Long-term mortality after first-ever and recurrent stroke in young adults. Stroke 2014;45:2670-2676.
- Hart RG, Pearce LA et Aguilar MI. Meta-analysis: antithrombotic therapy to prevent stroke in patients who have nonvalvular atrial fibrillation. Ann Intern Med 2007;146:857-867.
- Ruff CT, Giugliano RP, Braunwald E, et al. Comparison of the efficacy and safety of new oral anticoagulants with warfarin in patients with atrial fibrillation: a meta-analysis of randomised trials. Lancet 2014;383:955-962.
- Patel MR, Mahaffey KW, Garg J, et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011;365:883-891.
- Granger CB, Alexander JH, McMurray JJ, et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011;365:981-992.
- Giugliano RP, Ruff CT, Braunwald E, et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013;369:2093-2104.
- Connolly SJ, Ezekowitz MD, Yusuf S, et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009;361:1139-1151.
- Kato ET, Goto S et Giugliano RP. Overview of oral antithrombotic treatment in elderly patients with atrial fibrillation. Ageing Res Rev 2019;49:115-124.
- Kuramatsu JB, Gerner ST, Schellinger PD, et al. Anticoagulant reversal, blood pressure levels, and anticoagulant resumption in patients with anticoagulation-related intracerebral hemorrhage. JAMA 2015;313:824-836.
- Seiffge DJ, Werring DJ, Paciaroni M, et al. Timing of anticoagulation after recent ischaemic stroke in patients with atrial fibrillation. Lancet Neurol 2019;18:117-126.
- Heidbuchel H, Verhamme P, Alings M, et al. EHRA practical guide on the use of new oral anticoagulants in patients with non-valvular atrial fibrillation: executive summary. Eur Heart J 2013;34:2094-2106.
- Atzema CL, Jackevicius CA, Chong A, et al. Prescribing of oral anticoagulants in the emergency department and subsequent long-term use by older adults with atrial fibrillation. CMAJ 2019;191:E1345-E1354.
1er chapitre : Prévention de l’AVC sur fond de fibrillation auriculaire – Les lignes directrices
L’anticoagulation réduit significativement le risque d’AVC chez les patients atteints de fibrillation auriculaire (FA). Pourtant, les études ont montré à maintes reprises qu’ils ne reçoivent pas une anticoagulation convenable, que ce soit en prévention primaire ou secondaire; soit qu’ils ne se sont jamais fait prescrire d’anticoagulants, soit qu’ils ne reçoivent pas une dose thérapeutique, soit qu’ils ne respectent pas la prescription du médecin. Grâce à une meilleure compréhension des raisons expliquant cette adhésion décevante aux lignes directrices, il sera possible de contrer cette source de mortalité et de morbidité évitables. Ce programme met l’accent sur le risque d’AVC chez les patients atteints de FA et sur les stratégies éprouvées pour bien les prendre en charge qu’il s’agisse de prévenir un premier ou un deuxième AVC. Si l’emploi d’une anticoagulation convenable se généralisait, la morbidité et les décès évitables consécutifs à un AVC diminueraient considérablement.
Afficher la revue