Revue d’experts
L'asthme grave : caractérisation aux fins de personnalisation du traitement
Chapitre 3 : L’asthme grave hyperéosinophilique : son portrait clinique
Catherine Lemière, M.D., M.Sc.
Professeure, Département de médecine
Université of Montréal, Montréal, Québec
L’intérêt clinique de l’asthme hyperéosinophilique comme phénotype s’est confirmé à la lumière, du moins en partie, des bienfaits cliniques exercés par les traitements freinant l’activité des polynucléaires éosinophiles. Pour l’heure, les agents biologiques créés à cette fin sont réservés aux patients atteints d’asthme grave qui est, par définition, mal maîtrisé au moyen des traitements types. Pour y avoir recours dans les cas d’asthme hyperéosinophilique, il faut qu’une hyperéosinophilie soit présente. Or si elle est un biomarqueur de cette forme d’asthme, elle n’est toutefois pas un facteur prévisionnel infaillible d’un bienfait quelconque. L’asthme étant une maladie complexe et hétérogène, d’autres biomarqueurs pourraient permettre de caractériser les patients les plus susceptibles de réagir favorablement aux agents exerçant une régulation négative sur l’activité des cellules pro-inflammatoires que sont les polynucléaires éosinophiles. Le traitement de l’asthme grave hyperéosinophilique tel qu’il est défini aujourd’hui à l’aide d’un agent biologique doit s’inscrire dans trois grands axes, soit les bienfaits escomptés, l’innocuité et le coût. Les méthodes de sélection des patients pourraient bien évoluer au fur et à mesure de la publication de nouvelles données cliniques.
Le phénotype qu’est l’asthme grave hyperéosinophilique
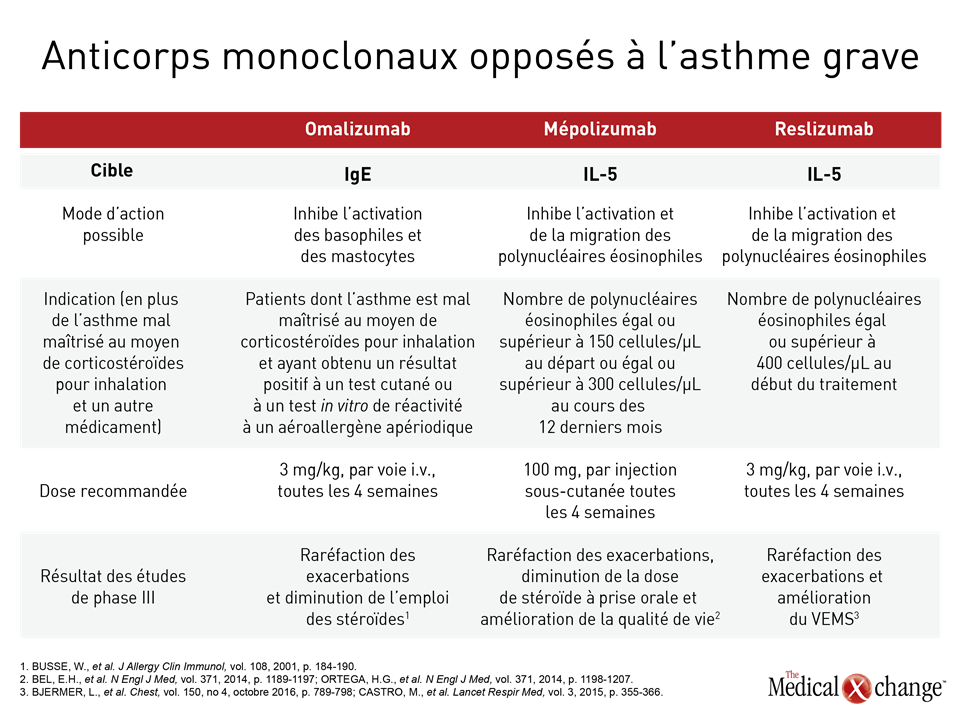
L’asthme est jugé grave quand les traitements types composés de doses élevées de corticostéroïdes pour inhalation (CSI) alliés à un autre agent de fond ne permettent pas de bien maîtriser ses symptômes ou lorsque ces derniers réapparaissent après que les doses élevées de CSI ou de corticostéroïdes pour voie générale sont réduites progressivement (Tableau 1)1. Il va de soi que cette définition ne concerne pas les patients dont les symptômes sont mal maîtrisés pour des raisons n’ayant rien à voir avec l’efficacité du traitement, comme le relâchement de l’observance du traitement ou une technique d’inhalation défaillante. Il est entendu que l’asthme d’un patient ne peut être qualifié de grave tant que ces facteurs confusionnels n’ont pas été vérifiés et éliminés. Le phénotypage présente un intérêt pratique pour la personnalisation du traitement des patients aux prises avec un asthme grave depuis que sont arrivés sur le marché des agents biologiques ciblant les voies moléculaires associées à l’évolution de la maladie chez ces patients2. L’omalizumab, qui cible les IgE, a été le premier agent biologique créé expressément pour le traitement d’un phénotype d’asthme grave. Selon la monographie canadienne, son utilisation doit être réservée aux patients ayant obtenu un résultat positif à un test cutané ou à un test in vitro de réactivité à un aéroallergène apériodique, qui est caractéristique du phénotype de l’asthme allergique. Par la suite, l’arrivée sur le marché d’agents biologiques ciblant l’interleukine-5 (IL-5), un médiateur important de la prolifération des polynucléaires éosinophiles, est venue enrichir l’arsenal thérapeutique opposé à l’asthme grave hyperéosinophilique. Tout comme l’omalizumab, les deux agents dirigés contre l’IL-5, soit le mépolizumab et le reslizumab, ont été homologués à titre de traitements d’entretien d’appoint chez les patients dont l’asthme est réfractaire aux traitements types. Leur monographie respective mentionne toutefois qu’ils ne peuvent être utilisés qu’en présence d’une éosinophilie (Tableau 2). Grâce à ces agents biologiques, le phénotypage est devenu un moyen de personnaliser le traitement de l’asthme grave. Cela dit, avant d’y avoir recours pour orienter le choix d’un agent biologique, il faut veiller à optimaliser le traitement type en plus d’évaluer et de traiter les maladies concomitantes risquant d’exacerber les symptômes. Ces molécules sont inutiles en l’absence d’une hyperéosinophilie. Si cette anomalie permet effectivement de repérer les patients ayant plus de chances de tirer avantage d’un agent biologique dirigé contre l’IL-5, il faut savoir qu’ils n’y réagissent pas tous aussi bien. En plus de coûter cher, ces agents doivent être injectés par voie sous-cutanée (s.-c.) ou intraveineuse (i.v.), ce que beaucoup de patients trouvent peu pratique comparativement aux traitements administrés par voie orale ou par inhalation. Résultat : ces médicaments ne sont pas utilisés en première intention, même si la maîtrise des symptômes est médiocre et si la concentration en polynucléaires éosinophiles dans le sang et les sécrétions est élevée. Or leur utilisation judicieuse a tout à fait sa place en pareil cas.
Les caractéristiques du phénotype de l’asthme hyperéosinophilique
Ce phénotype trouve son origine d’une classification encore plus élémentaire reposant sur l’inflammation imputable aux lymphocytes T auxiliaires de type 2 (TH2). L’asthme à inflammation lymphocytaire TH2 élevée est la conséquence d’une régulation positive de cytokines inflammatoires, telles que l’IL-4, l’IL-5 et l’IL-13, qui interviennent à leur tour dans les réactions immunitaires placées sous la médiation des polynucléaires éosinophiles, des mastocytes et des basophiles3. L’asthme à inflammation lymphocytaire TH2 faible, qui est moins fréquent et moins bien expliqué, se distingue de l’asthme à inflammation lymphocytaire TH2 élevée sur plusieurs plans, dont l’expression génique4, bien qu’il n’existe aucun biomarqueur normalisé pour ce sous-type5. Plus étroitement lié à la régulation positive des neutrophiles, il semble avoir un lien plus ténu avec l’inflammation ou la réaction allergique. Les travaux visant à mieux cerner les médiateurs sous-jacents de ce phénotype se poursuivent6. La sous-division des cas d’asthme à inflammation lymphocytaire TH2 élevée ou faible en fonction des divers phénotypes se révélera probablement utile pour orienter le choix d’un traitement. Or le phénotype hyperéosinophilique, une sous-catégorie d’asthme à inflammation lymphocytaire TH2 élevée, a gagné en pertinence grâce aux agents biologiques ciblant l’IL-5. Cette cytokine n’est pas la seule qui ait un lien avec l’activité des polynucléaires éosinophiles, mais il faut savoir qu’elle intervient dans la différenciation et la maturation de ces cellules dans la moelle osseuse, dans leur migration du sang vers les tissus et dans l’inhibition de leur apoptose7. L’inhibition de l’IL-5, ou de son récepteur alpha dont l’expression à la surface des polynucléaires éosinophiles est considérable8, entraîne une diminution marquée de l’éosinophilie dans le sang et les expectorations. Les études cliniques menées sur des agents biologiques opposés à l’IL-5 sont venues confirmer l’intérêt des polynucléaires éosinophiles comme cibles thérapeutiques dans les cas d’asthme grave, même si elles ont démontré que l’hyperéosinophilie, quoique nécessaire, n’est pas toujours suffisante pour prédire l’obtention d’une réaction favorable au traitement. Ainsi, il se peut que d’autres médiateurs entrent en jeu dans l’inflammation des voies aériennes des patients présentant une hyperéosinophilie, mais une réaction modeste, voire nulle aux agents anti-IL-5 malgré une diminution marquée de ce paramètre.
Les agents biologiques et l’asthme grave hyperéosinophilique : les études cliniques
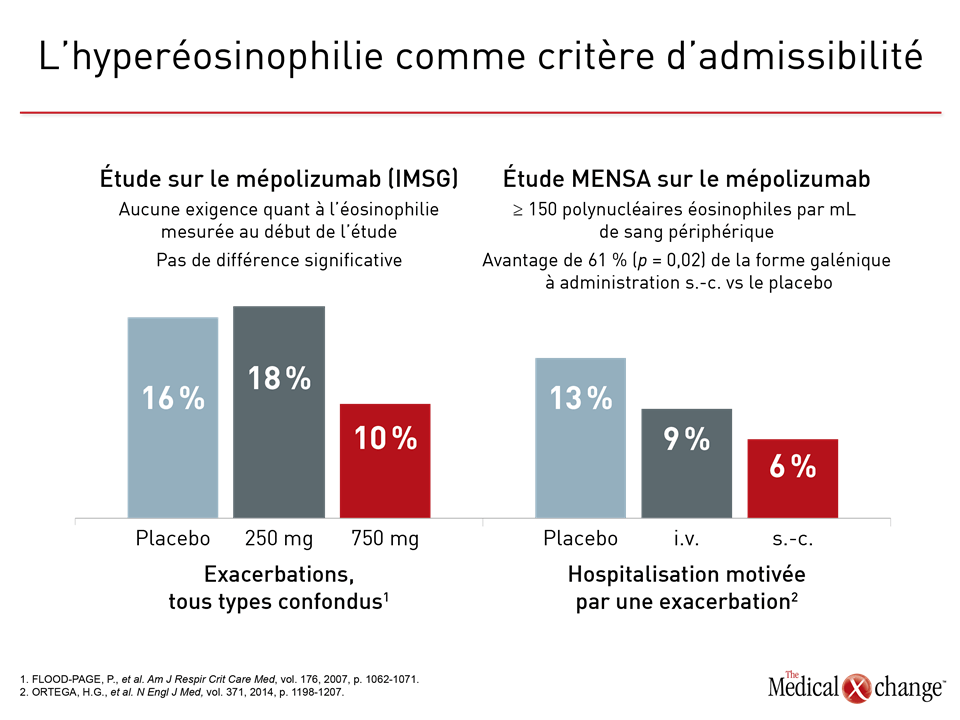
Les premières études cliniques réalisées avec des anticorps monoclonaux anti-IL-5 ont été décevantes. Elles étaient le plus souvent menées chez des patients aux prises avec un asthme persistant quoique modéré qui ne devait pas obligatoirement s’accompagner d’une hyperéosinophilie au moment du recrutement. Les chercheurs d’une étude sur le mépolizumab (International Mepolizumab Study Group [IMSG]) n’ont constaté aucun effet significatif sur les paramètres d’évaluation, quels qu’ils soient, y compris la fonction pulmonaire, et ce en dépit de baisses importantes des concentrations de polynucléaires éosinophiles dans le sang et les expectorations par rapport aux données de référence9. Une étude sur le reslizumab a révélé que la réduction proportionnelle à la dose de la concentration de polynucléaires éosinophiles n’était qu’au mieux associée à une tendance vers une amélioration de la fonction pulmonaire, mais qu’elle n’avait aucune incidence significative sur les autres indicateurs de l’activité pathologique10. Lorsque la présence d’une hyperéosinophilie est devenue un critère d’admissibilité lors des études subséquentes, les bienfaits cliniques de ces agents sont nettement ressortis. Dans le cadre de l’étude MENSA, une étude de phase III sur le mépolizumab, la fréquence des exacerbations a diminué de 53 % (p < 0,001) chez les patients ayant reçu la dose qui des deux s’est révélée la plus efficace11. Comparativement à l’étude citée plus haut sur le mépolizumab, l’étude MENSA a grandement corroboré l’importance de l’éosinophilie de départ (Fig. 1). Lors des études BREATH et CALIMA, des études de phase III réalisées respectivement sur le reslizumab et le benralizumab, un agent expérimental dirigé contre le récepteur alpha de l’IL-5, les chercheurs ont constaté que la fréquence annuelle des exacerbations avait baissé de 59 % (p < 0,001) et de 70 % (p < 0,001) avec les schémas posologiques les plus efficaces12,13. Si la section Indications et utilisation clinique de la monographie du mépolizumab et du reslizumab stipule que ces agents sont indiqués en présence d’une hyperéosinophilie, c’est en raison de ces observations. En théorie, les valeurs seuils établies pour les concentrations de polynucléaires éosinophiles dans les expectorations pourraient être des indicateurs plus représentatifs de l’évolution de l’éosinophilie dans les voies aériennes, mais les monographies n’en fournissent aucune. La valeur seuil des concentrations d’éosinophiles dans les expectorations qui permettrait de prédire de façon optimale une réaction clinique favorable aux agents anti-IL5 est effectivement inconnue, puisque ces concentrations n’ont pas été utilisées prospectivement chez un vaste effectif de sujets dans le cadre des études cliniques sur les traitements anti-IL-5. En outre, la majorité des centres ne disposent pas de l’équipement qu’il faut pour effectuer ce dosage. Comme l’ont souligné, entre autres, les auteurs des lignes directrices de l’ERS et de l’ATS sur l’asthme grave, la mise à disposition des agents biologiques a relancé la recherche de nouveaux biomarqueurs qui permettraient de personnaliser le traitement. Même si la précision des facteurs prévisionnels tant cliniques qu’analytiques d’une réponse aux traitements ciblés est imparfaite, il n’en demeure pas moins que plus de 100 médiateurs de l’inflammation ont été incriminés dans la pathogenèse de l’asthme14 et que la variabilité du rôle relatif joué par ces médiateurs chez certains patients pourrait expliquer la variabilité d’une telle réponse. En plus d’offrir de nouveaux moyens pour maîtriser la maladie, la mise au point de médicaments ciblant d’autres médiateurs de l’inflammation pourrait nous en apprendre davantage sur le rôle des autres cytokines, telles que l’IL-4 et l’IL-13, des chimiokines et des facteurs de croissance dans la pathogenèse de l’asthme.
Les agents biologiques et l’asthme grave hyperéosinophilique : des stratégies concrètes
L’asthme est un processus complexe se manifestant de bien des façons différentes. Avant de confirmer un cas d’asthme grave et d’envisager de recourir à un agent biologique, il faut vérifier si le patient utilise les traitements types correctement, même s’il semble répondre aux critères définissant l’asthme grave hyperéosinophilique. L’asthme s’accompagne souvent de maladies concomitantes traitables, comme la rhinite, la polypose nasale, l’apnée du sommeil et le reflux gastro-œsophagien (RGO), qui peuvent nuire à sa maîtrise en exacerbant l’obstruction des voies aériennes. En outre, certains médicaments tels que les β-bloquants, peuvent déclencher des symptômes cadrant avec ceux de l’asthme. N’oublions pas non plus que l’usage du tabac est une cause majeure et réversible d’obstruction des voies aériennes. Il faut également répertorier les facteurs environnementaux qui déclenchent les symptômes pulmonaires et les éliminer avant de pouvoir déclarer que les traitements types ne permettent pas de bien maîtriser les symptômes (Tableau 3). L’essai d’un agent biologique dirigé contre l’IL-5 est un choix sensé chez les patients présentant un phénotype persistant d’asthme grave hyperéosinophilique malgré l’utilisation optimale de médicaments pour inhalation et d’antagonistes des récepteurs des leucotriènes. Des facteurs tels que le coût et la commodité pourront orienter le choix d’un agent plutôt qu’un autre. Il n’existe aucune étude ayant servi à comparer directement le mépolizumab au reslizumab ou l’un de ces agents homologués au benralizumab, le seul autre anti-IL-5 ayant franchi l’étape des études de phase III. Le mépolizumab et le reslizumab, qui s’administrent respectivement par voie sous-cutanée et intraveineuse, se lient à l’IL-5 pour inhiber son activité, alors que le benralizumab se fixe au récepteur alpha de cette cytokine. Au terme d’une méta-analyse réalisée récemment à partir d’études à répartition aléatoire, les chercheurs n’ont relevé aucune différence statistique entre les bienfaits cliniques exercés par ces trois agents15. Un léger avantage s’est toutefois dessiné pour ce qui est des effets thérapeutiques moyens obtenus chez les patients dont l’éosinophilie sérique était au départ supérieure à 300 polynucléaires éosinophiles/mm3/L comparativement à ceux ayant présenté une éosinophilie plus basse. Cela dit, les gains enregistrés chez les patients dont le nombre de polynucléaires éosinophiles est faible sont bien documentés. Comme le recommandent l’ERS et l’ATS dans leurs lignes directrices, pour l’heure, il vaut mieux confier le traitement de l’asthme grave hyperéosinophilique aux établissements ayant une solide expérience du phénotypage, des stratégies visant à mesurer l’éosinophilie et de l’évaluation de la réaction au traitement. Faute de méthodes fiables pour prédire un quelconque effet positif, le traitement de ce phénotype, une fois l’éosinophilie connue, reste pour une large part empirique. Les anticorps dirigés contre l’IL-5 sont des options précieuses pour améliorer la maîtrise de l’asthme, notamment pour raréfier les exacerbations. Cependant, en raison de leur coût, ils doivent être réservés aux cas qui ne peuvent être maîtrisés au moyen de stratégies à la fois plus simples et moins chères. L’une des confirmations les plus importantes que nous ont fournies les traitements extrêmement ciblés, c’est que l’élément moteur de l’asthme grave n’est pas le même pour tout le monde. Il est fort probable que des stratégies pour améliorer la sélection des patients émergeront des études actuelles et à venir. Les agents qui ont un effet extrêmement ciblé sur certaines voies précises de l’inflammation laissent entrevoir la possibilité de faire rétrocéder l’asthme et non pas simplement de le maîtriser. En exerçant une régulation négative des composantes inflammatoires de l’asthme dès les premiers stades de la maladie, il pourrait être possible d’agir sur les phénomènes physiopathologiques qui régissent l’évolution de l’asthme vers la chronicité. Aucune étude clinique n’a encore été effectuée pour explorer cette possibilité. Cela dit, les progrès réalisés dans le recensement des médiateurs qui interviennent lourdement dans les phénomènes physiopathologiques à l’origine de l’asthme confirment tout l’intérêt de poursuivre la recherche de médicaments capables de perturber les voies sous-jacentes de la maladie et de réorienter l’action qui était auparavant essentiellement concentrée sur la prise en charge des symptômes.
Conclusion
Les agents biologiques ont fait en sorte que le phénotypage des patients atteints d’asthme grave a gagné en pertinence. Si l’hyperéosinophilie est une caractéristique nécessaire, quoiqu’insuffisante, pour envisager de recourir aux agents biologiques, ceux qui sont dirigés contre l’IL‑5 peuvent offrir une meilleure maîtrise de leur asthme à des patients particuliers qui disposaient jusqu’à maintenant de peu d’options. L’essai de ces agents a donc sa place comme traitement d’appoint des traitements types dans la mesure où ces derniers ont été optimalisés. Compte tenu de la variabilité de la réaction des patients à ces médicaments, il faut toutefois surveiller leur effet de près.
Références
- CHUNG, K.F., S.E. Wenzel, J.L. Brozek, et al. « International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma », Eur Respir J, vol. 43, 2014, p. 343-373.
- PAPATHANASSIOU, E., S. Loukides et P. Bakakos. « Severe asthma: anti-ige or anti-IL-5? », Eur Clin Respir J, vol. 3, 2016, p. 31813.
- WOODRUFF, P.G., B. Modrek, D.F. Choy, et al. « T-helper type 2-driven inflammation defines major subphenotypes of asthma », Am J Respir Crit Care Med, vol. 180, 2009, p. 388-395.
- STERK, P.J. et R.Lutter. « Asthma phenotyping: TH2-high, TH2-low, and beyond », J Allergy Clin Immunol, vol. 133, 2014, p. 395-396.
- ROBINSON, D., M. Humbert, R. Buhl, et al. « Revisiting Type 2-high and Type 2-low airway inflammation in asthma: current knowledge and therapeutic implications », Clin Exp Allergy, vol. 47, 2017, p. 161-175.
- FAHY, J.V. « Asthma Was Talking, But We Weren’t Listening. Missed or Ignored Signals That Have Slowed Treatment Progress », Ann Am Thorac Soc, vol. 13, suppl. 1, 2016, p. S78-82.
- VARRICCHI, G., D. Bagnasco, F. Borriello, E. Heffler et G.W. Canonica. « Interleukin-5 pathway inhibition in the treatment of eosinophilic respiratory disorders: evidence and unmet needs », Curr Opin Allergy Clin Immunol, vol. 16, 2016, p. 186-200.
- KOLBECK, R., A. Kozhich, M. Koike, et al. « MEDI-563, a humanized anti-IL-5 receptor alpha mab with enhanced antibody-dependent cell-mediated cytotoxicity function », J Allergy Clin Immunol, vol. 125, 2010, p. 1344-1353 e2.
- FLOOD-PAGE, P., C. Swenson, I. Faiferman, et al. « A study to evaluate safety and efficacy of mepolizumab in patients with moderate persistent asthma », Am J Respir Crit Care Med, vol. 176, 2007, p. 1062-1071.
- KIPS, J.C., B.J. O’Connor, S.J. Langley, et al. « Effect of SCH55700, a humanized anti-human interleukin-5 antibody, in severe persistent asthma: a pilot study », Am J Respir Crit Care Med, vol. 167, 2003, p. 1655-1659.
- ORTEGA, H.G., M.C. Liu, I.D. Pavord, et al. « Mepolizumab treatment in patients with severe eosinophilic asthma », N Engl J Med, vol. 371, 2014, p. 1198-1207.
- CASTRO, M., J. Zangrilli, M.E. Wechsler, et al. « Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicentre, parallel, double-blind, randomised, placebo-controlled, phase 3 trials », Lancet Respir Med, vol. 3, 2015, p. 355-366.
- FITZGERALD, J.M., E.R. Bleecker, P. Nair, et al. « Benralizumab, an anti-interleukin-5 receptor alpha monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised, double-blind, placebo-controlled phase 3 trial », Lancet, vol. 388, 2016, p. 2128-2141.
- ADCOCK, I.M., G. Caramori et K.F. Chung. « New targets for drug development in asthma », Lancet, vol. 372, 2008, p. 1073-1087.
- CABON, Y., N. Molinari, G. Marin, et al. « Comparison of anti-interleukin-5 therapies in patients with severe asthma: global and indirect meta-analyses of randomized placebo-controlled trials », Clin Exp Allergy, vol. 47, 2017, p. 129-138.
Chapitre 3 : L’asthme grave hyperéosinophilique : son portrait clinique
L’intérêt clinique de l’asthme hyperéosinophilique comme phénotype s’est confirmé à la lumière, du moins en partie, des bienfaits cliniques exercés par les traitements freinant l’activité des polynucléaires éosinophiles. Pour l’heure, les agents biologiques créés à cette fin sont réservés aux patients atteints d’asthme grave qui est, par définition, mal maîtrisé au moyen des traitements types. Pour y avoir recours dans les cas d’asthme hyperéosinophilique, il faut qu’une hyperéosinophilie soit présente. Or si elle est un biomarqueur de cette forme d’asthme, elle n’est toutefois pas un facteur prévisionnel infaillible d’un bienfait quelconque. L’asthme étant une maladie complexe et hétérogène, d’autres biomarqueurs pourraient permettre de caractériser les patients les plus susceptibles de réagir favorablement aux agents exerçant une régulation négative sur l’activité des cellules pro-inflammatoires que sont les polynucléaires éosinophiles. Le traitement de l’asthme grave hyperéosinophilique tel qu’il est défini aujourd’hui à l’aide d’un agent biologique doit s’inscrire dans trois grands axes, soit les bienfaits escomptés, l’innocuité et le coût. Les méthodes de sélection des patients pourraient bien évoluer au fur et à mesure de la publication de nouvelles données cliniques.
Afficher la revue