Revue d’experts
Le Porteur du VIH Vieillissant
Chapitre 5 : L’ostéoporose
Greg Bondy, M. Sc., M. D., FRCPC
Université de Columbie-Britannique, Vancouver, Colombie-Britannique
La perte accélérée de substance osseuse chez les porteurs du VIH laisse craindre une crise majeure de santé publique au Canada et dans les autres pays où cette population est vieillissante. Il semble en effet y avoir une interaction importante entre les facteurs de risque classiques d’ostéoporose et la raréfaction osseuse expressément liée au VIH et aux traitements qui sont dirigés contre ce virus. La perte de substance osseuse, un processus évolutif, est décelée peu de temps après l’infection, parallèlement au vieillissement accéléré des autres organes. Elle peut subsister en dépit de l’élimination du VIH, voire être exacerbée par certains agents antirétroviraux. Les stratégies visant à atténuer les répercussions de la déperdition osseuse reposent sur le dépistage de cette raréfaction dès ses débuts et sur les mesures énergiques mises en place pour prévenir ou corriger les processus sous-jacents. L’incidence de plus en plus élevée de fractures chez les porteurs du VIH qui prennent de l’âge a attiré l’attention de la communauté médicale sur cette complication. Compte tenu du basculement démographique, il est à prévoir que la déperdition osseuse tendra à se répandre chez les porteurs du VIH, vu qu’une proportion grandissante de ces patients arrive à un âge particulièrement vulnérable.
L’ostéoporose dans les cas d’infection par le VIH : son comportement épidémiologique
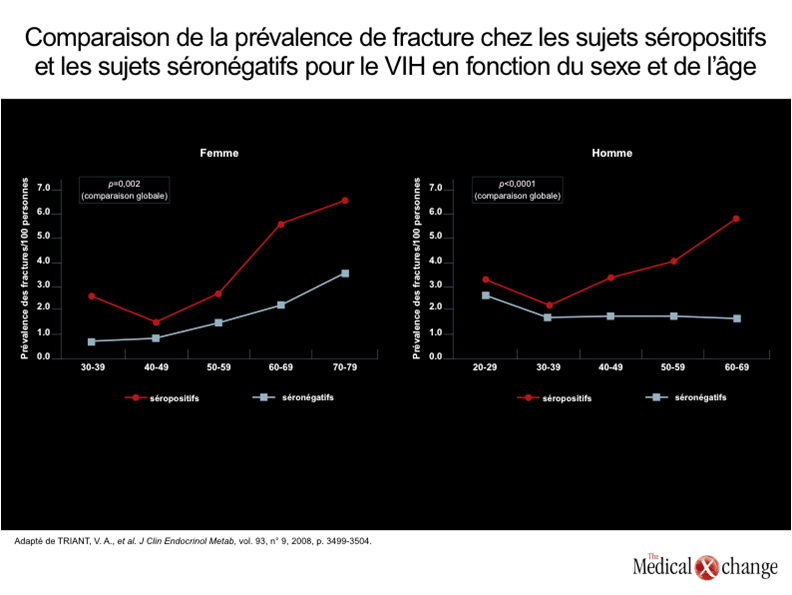
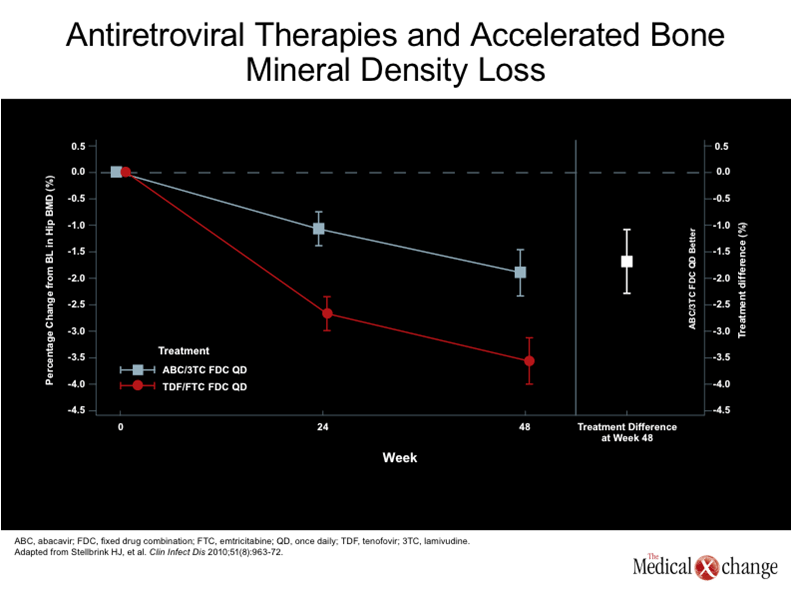
L’ostéoporose est un problème majeur de santé publique indépendamment de l’infection par le VIH. Même si la prévalence de cette affection est plus élevée chez les femmes ménopausées, autour de la soixantaine, la déperdition osseuse se fait à peu près à la même vitesse chez les hommes et chez les femmes1.Au Canada, où on assiste au vieillissement de la population2, on estime qu’une femme sur quatre et un homme sur huit présentent une ostéopénie qui les expose plus que les autres aux fractures osseuses3, 4. Les données recueillies aux États-Unis portent à croire que 50 % des adultes sont atteints d’ostéoporose avant d’avoir atteint l’âge de 80 ans5. Or l’ostéoporose semble apparaître à un âge beaucoup moins avancé chez les porteurs du VIH et sa prévalence augmente beaucoup plus rapidement6. Si on a d’abord émis l’hypothèse que l’ostéoporose était essentiellement une complication des traitements antirétroviraux7, on reconnaît aujourd’hui que l’infection par le VIH est en elle-même un facteur de risque indépendant d’ostéopathie8. Bien que certains traitements antirétroviraux semblent effectivement accélérer le processus, il convient de souligner que l’ostéopénie s’amorce peu de temps après l’infection, qu’il y ait traitement ou non6, 9. Dans les deux années qui suivent l’infection par le VIH, la déperdition osseuse peut atteindre 6 %10, soit un pourcentage voisin de celui qui est observé chez les femmes dans les deux années premières années de leur ménopause11. L’Organisation mondiale de la santé (OMS) définit l’ostéopénie chez les adultes de plus de 50 ans comme une densité osseuse inférieure à la moyenne observée chez les adultes âgés de 25 à 35 ans, cette différence équivalant à plus de 1,0 écart-type, mais à moins de 2,5 écarts-types12. C’est ce qu’on appelle le score T. Par définition, il y a ostéoporose quand la densité osseuse se situe à 2,5 écarts-types sous la moyenne. L’ostéopénie et l’ostéoporose peuvent également être établies d’après le score Z, qui rend compte des écarts-types par rapport à la moyenne des valeurs normales chez un groupe du même âge, de même sexe et de même origine ethnique. D’usage plus courant chez les jeunes, y compris les porteurs du VIH, le score Z est considéré comme anormal s’il correspond à 2,0 écarts-types de moins que la valeur de référence13. Chaque écart-type inférieur à la moyenne se traduit par une hausse brutale de l’incidence de fractures14. Chez les personnes séropositives à l’égard du VIH, le risque fracturaire varie en fonction de nombreux facteurs de risque, mais des études populationnelles portent à croire que la hausse globale de ce paramètre est très marquée. Au cours d’une de ces études, les chercheurs ont comparé la prévalence de fractures chez 8525 porteurs du VIH et chez 2 208 792 personnes indemnes de cette infection. Selon leurs calculs, la prévalence de fractures par tranche de 100 ans se chiffrait à 2,87 chez les sujets séropositifs et à 1,77 chez les témoins15, soit une augmentation de 62,1 % et une différence extrêmement significative sur le plan statistique (p < 0,0001). La hausse du risque n’était pas la même pour les divers types de fracture (par exemple, la prévalence de fractures vertébrales était près de deux fois plus élevée chez les porteuses du VIH, mais la différence observée pour la prévalence des fractures du col du fémur n’était pas significative sur le plan statistique); en revanche, l’augmentation globale de la prévalence de fractures était encore plus prononcée chez les hommes séropositifs (68,3 %; p < 0,0001) que chez les femmes (44,7 %; p = 0,002) (Fig. 1). Il a été démontré que certains agents antirétroviraux exacerbent la déperdition osseuse associée au VIH. Lors d’une étude secondaire réalisée en marge de l’étude ANRS 121, au cours de laquelle des sujets infectés par le VIH ont été répartis au hasard de manière à recevoir soit une association formée d’un inhibiteur de protéase et de ritonavir (IP+r), soit un inhibiteur non nucléosidique de la transcriptase inverse [INNTI]), soit les deux, la réduction moyenne de la densité osseuse du rachis lombaire était significativement plus prononcée dans le groupe recevant l’association IP+r (-5,8 %; p = 0,007) et dans celui traité à la fois par l’association IP+r et l’INNTI (-4,4 %; p = 0,001) que dans le groupe recevant l’INNTI seulement (-1,5 %)16. C’est avec le ténofovir que le lien le plus fort entre un agent antirétroviral et le risque d’accélération de la déperdition osseuse a été observé. En effet, au cours d’un essai multicentrique de 96 semaines ayant réuni 385 sujets et ayant servi à comparer le ténofovir allié au FTC à une association formée d’abacavir (ABC) et de lamivudine (3 TC), la variation moyenne observée par rapport au début de l’essai se chiffrait à 1,9 % chez les sujets du groupe traité par l’association ABC-3TC et à -3,6 % chez ceux qui avaient reçu l’association ténofovir-FTC17 (Fig. 2). Cette hausse de 89,4 % était extrêmement significative sur le plan statistique (p < 0,001). De plus, la comparaison des types de fracture caractérisés par une perte de densité osseuse supérieure à 6 % a permis de constater que la déperdition osseuse était souvent trois ou quatre fois plus élevée chez les sujets traités à l’aide de l’association à base de ténofovir que chez ceux qui avaient reçu celle à base d’ABC. C’était le cas des fractures du col du fémur (13 % vs 3 %) et du rachis (15 % vs 5 %). D’autres études comparatives avaient aussi fait le rapprochement entre une exposition au ténofovir et une hausse du risque de déperdition osseuse18, 19. Le vieillissement des porteurs du VIH laisse entrevoir une hausse de l’incidence de fractures, mais les conséquences de la déperdition osseuse s’installent graduellement, ce qui porte à croire que la mise en place rapide de mesures préventives pourrait corriger le risque clinique. La hausse de l’incidence de fractures chez les personnes infectées de longue date par le VIH illustre à quel point la déperdition osseuse est un enjeu majeur, mais les complications de l’ostéoporose pourraient quant à elles écourter la survie des porteurs du VIH qui avancent en âge.
La pathogenèse
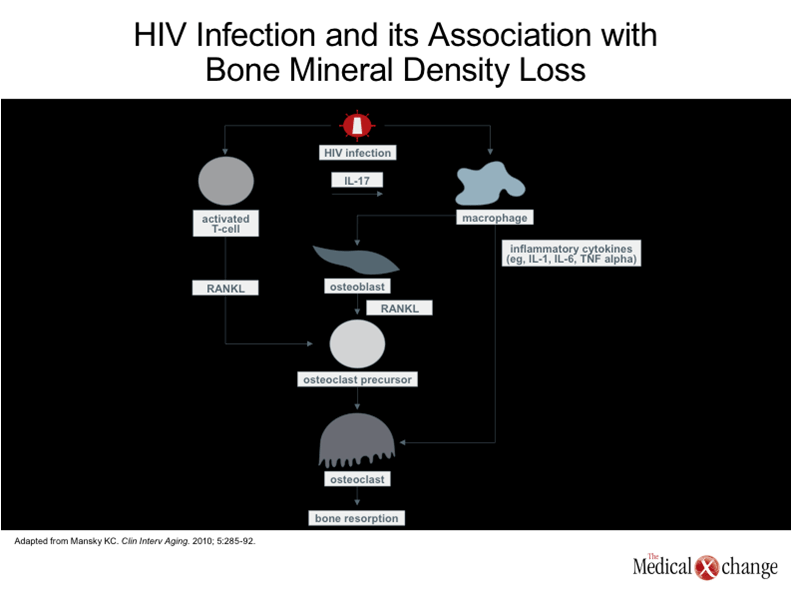
Le métabolisme osseux est un processus dynamique se traduisant par le remodelage osseux. Pour que la densité osseuse reste stable, il doit y avoir équilibre entre la résorption osseuse attribuable aux ostéoclastes et l’ostéoformation assurée par les ostéoblastes20. La masse osseuse maximale est atteinte à la fin de l’adolescence ou au début de l’âge adulte21. Or si elle est faible, elle peut constituer un facteur de risque d’ostéopénie plus tard dans la vie. Cela dit; le rythme auquel se produit la déperdition osseuse à l’âge adulte est influencé par un large éventail de facteurs, tels que l’alimentation, l’exercice et les concentrations hormonales, de même que par des facteurs qui agissent sur les voies de signalisation du métabolisme osseux22. D’entrée de jeu, les patients infectés par le VIH sont exposés aux mêmes facteurs de risque d’ostéoporose que les personnes indemnes de cette infection, y compris une mauvaise alimentation et une prédisposition d’origine génétique. Or le VIH et les traitements qui y sont opposés exercent des effets tout particuliers sur le métabolisme osseux. Fait le plus important à souligner peut-être, il a été démontré que les protéines du VIH favorisent l’apoptose des ostéoblastes, d’où l’inhibition de l’ostéoformation23, tandis que les protéines du VIH et les cytokines inflammatoires associées à l’infection par ce virus, telles que le facteur de nécrose tumorale alpha (TNF-α), ont été reliées à une intensification de l’activité des ostéoclastes et, partant, de la résorption osseuse (Fig. 3)23. Ces activités concordent avec les observations selon lesquelles l’infection par le VIH est rapidement suivie d’une déperdition osseuse marquée, peu importe le type de traitement choisi ou qu’il y ait effectivement un traitement ou non10. Les traitements antirétroviraux ont exercé des effets défavorables sur le métabolisme osseux en contexte expérimental. Par exemple, les chercheurs ont mis en évidence un lien entre l’éfavirenz, un inhibiteur non nucléosidique de la transcriptase inverse (INNTI), et une altération des enzymes hépatiques jouant un rôle important dans la biotransformation de la vitamine D. Ils ont également noté que des IP, comme le nelfinavir et le ritonavir, amplifient l’expression génique de certaines cytokines pro-inflammatoires (par ex., l’interleukine-8 [IL-8]) qui nuisent aux ostéoblastes. Toutefois, le lien entre ces agents et une exacerbation de la déperdition osseuse supérieure à celle produite par le VIH lui-même n’a pu être établi avec certitude, les études divergeant à ce chapitre24, 25. Le rapport entre le ténofovir et la déperdition osseuse, qui a été établi dans le cadre d’un essai prospectif, comparatif et réalisé avec répartition aléatoire des sujets17, a été objectivé de manière beaucoup plus constante. Plusieurs mécanismes pourraient intervenir, dont des altérations de l’expression des gènes qui régissent l’activité des ostéoblastes et des ostéoclastes26. Il se peut aussi que le ténofovir, un phosphonate susceptible d’être fixé par les ostéoclastes, déclenche un stress qui altère l’échange des signaux jouant un rôle important dans l’activité des ostéoblastes27. Le ténofovir est également associé à une altération de la fonction rénale28, qui en soi est un facteur de risque d’ostéoporose29. Des études plus poussées sur l’interaction entre ce médicament et les facteurs de risque classiques d’ostéoporose s’imposent donc. Par ailleurs, l’ostéoporose peut être vue comme une conséquence du vieillissement accéléré des porteurs du VIH, un phénomène assimilé à l’immunosénescence30. Selon le principe de l’immunosénescence, l’affaiblissement graduel des fonctions immunomodulatrices lié à l’âge pave la voie à un large éventail de maladies qui sont plus répandues chez les adultes vieillissants, telles que le cancer, l’athérosclérose et l’ostéoporose31.Or ce processus lié à l’âge semble s’enclencher plus tôt et progresser plus rapidement chez les porteurs du VIH en raison du stress que cette infection fait subir au système immunitaire32.
Le diagnostic et la surveillance de l’ostéoporose
Comme le risque d’ostéoporose est largement répandu chez les personnes qui prennent de l’âge, il est recommandé de surveiller la densité osseuse à partir de 65 ans33chez tous les Canadiens et avant 50 ans chez les femmes ménopausées et les hommes qui présentent des facteurs de risque. Parmi ces derniers, on trouve : les fractures par fragilité osseuse survenant après l’âge de 40 ans, des antécédents familiaux d’ostéoporose, l’usage du tabac, une grande consommation d’alcool, un poids corporel faible ou des troubles ayant un lien avec l’ostéoporose, tels que la polyarthrite rhumatoïde, le diabète de type 1 ou une inflammation chronique. Le dépistage de l’ostéoporose est conseillé chez les jeunes adultes qui ont subi une fracture par fragilité osseuse, qui ont suivi un traitement prolongé par des corticostéroïdes ou qui sont atteints d’affections liées à l’ostéoporose, comme l’hyperparathyroïdie. Ce dépistage se fait habituellement en évaluant la densité osseuse par absorptiométrie diphotonique (DEXA). Dans ses lignes directrices, Ostéoporose Canada ne pointe pas du doigt le VIH comme un facteur de risque d’ostéoporose contrairement à d’autres organismes, tels que l’Infectious Diseases Society of America (IDSA) qui préconise la réalisation d’examens par absorptiométrie diphotonique à partir de l’âge de 50 ans chez tous les porteurs du VIH présentant des facteurs de risque34. Cela dit, les auteurs d’une analyse concertée multinationale publiée récemment recommandent que tous les porteurs du VIH, indépendamment de leurs facteurs de risque d’ostéoporose, se prêtent à un dépistage de cette affection à partir de 50 ans8. Ces auteurs, essentiellement des cliniciens et des chercheurs pratiquant dans le domaine du VIH, conseillent de répéter cet examen tous les deux à cinq ans. Bien que le dépistage ne soit pas systématiquement recommandé avant l’âge de 50 ans, tout antécédent de fracture par fragilité osseuse justifie la réalisation d’un examen par absorptiométrie diphotonique, que le patient soit porteur du VIH ou non.
La prise en charge de l’ostéoporose
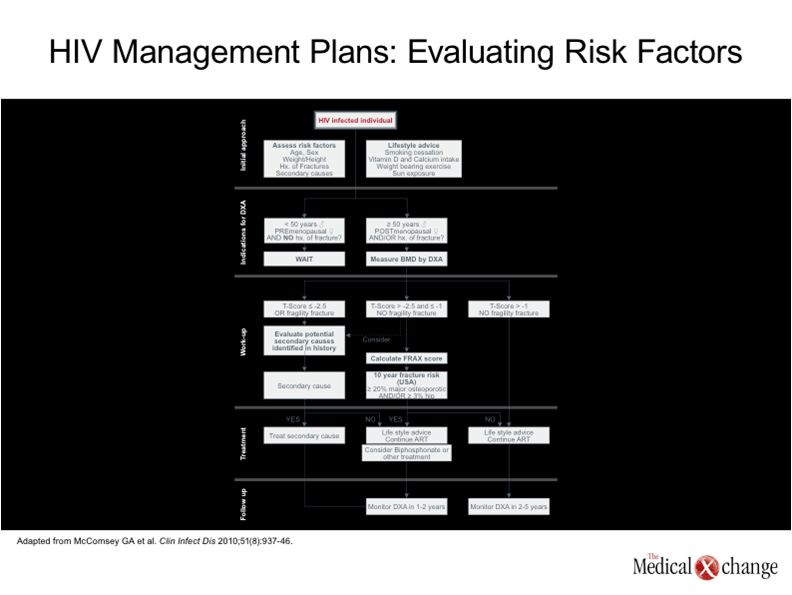
Il est essentiel de recenser au moyen d’une évaluation approfondie les facteurs de risque des patients dont le score T ou le score Z témoigne d’une déperdition osseuse marquée sur le plan clinique afin de mettre au point le plan de prise en charge qui convient (Fig. 4). L’alcoolisme, l’exposition aux corticostéroïdes et l’hypogonadisme sont des facteurs de risque d’ostéoporose répandus dans la population générale35, mais les patients infectés par le VIH ont des facteurs de risque qui leur sont propres, dont un poids corporel peu élevé, l’insulinorésistance et l’hyperlactatémie36, 37. Tout examen approfondi visant à déceler les causes secondaires d’ostéoporose doit comprendre les analyses hématochimiques habituelles, des épreuves fonctionnelles rénales, de même qu’un dosage de la l’hydroxyvitamine D sérique et des hormones appropriées selon le sexe du patient. S’il faut s’attaquer directement aux causes secondaires de l’ostéoporose, il convient aussi d’avoir recours à des traitements nutritionnels et pharmacologiques, de courte durée ou chroniques, pour améliorer le remodelage osseux. Il est logique d’utiliser chez les porteurs du VIH les mêmes médicaments employés chez les patients séronégatifs à l’égard de ce virus, bien que les données témoignant des bienfaits de ces traitements sur fond d’infection par le VIH sont généralement restreintes. Il est également possible de prescrire des bisphosphonates en plus de veiller à assurer une consommation de calcium et de vitamine D, une exposition à la lumière naturelle et une activité physique suffisantes. Ces médicaments ont effectivement réduit le risque fracturaire chez les personnes indemnes du VIH38. Lors d’une étude contrôlée par placebo ayant porté sur le zolédronate, un bisphosphonate, les cliniciens ont constaté une densification osseuse chez les porteurs du VIH, quoique la période de suivi n’ait pas été assez longue pour confirmer un effet quelconque sur le risque fracturaire39. Il serait bon d’opter pour un traitement antirétroviral exerçant un effet minime sur le remodelage osseux. L’élimination du VIH de manière soutenue est certes LA grande priorité pour qui veut prévenir les complications potentiellement fatales du VIH. Néanmoins, les données confirment de plus en plus que le ténofovir accroît le risque de déperdition osseuse. Même si les observations actuelles ne permettent pas de conclure de façon aussi nette que le ténofovir amplifie également le risque fracturaire, il serait bon de surveiller de plus près les porteurs du VIH présentant des facteurs de risque d’ostéoporose qui suivent des traitements à base de ce médicament ou d’étudier les solutions de rechange chez ceux qui en sont déjà atteints. La prévention de l’ostéoporose chez les sujets séropositifs pour le VIH n’a pas fait l’objet d’études approfondies. Toutefois, les porteurs de ce virus étant extrêmement exposés à cette complication, l’application de stratégies prophylactiques, telles qu’une activité physique appropriée et un apport suffisant en nutriments favorisant le remodelage osseux, même chez les jeunes adultes, paraît tout à fait logique. Ces modifications des habitudes de vie doivent être entreprises dès que l’on constate une ostéopénie, même si rien encore ne justifie l’utilisation de traitements pharmacologiques. Chez les patients aux prises avec une ostéoporose, il faut songer à procéder à des examens par absorptiométrie diphotonique (DEXA) un à deux ans après avoir amorcé le traitement de sorte que les traitements pharmacologiques –qui ne sont pas dépourvus d’effets indésirables ni bon marché40–puissent être interrompus si la densité osseuse devait se révéler de nouveau satisfaisante.
Conclusion
L’ostéoporose est une menace réelle pour la santé des porteurs du VIH qui avancent en âge. Chez ces patients, la déperdition osseuse et les complications cliniques de cette affection peuvent être observées une dizaine d’années plus tôt au moins que dans la population générale. L’infection par le VIH semble exercer des effets négatifs directs sur le remodelage osseux. Cela dit, la hausse de l’incidence d’ostéoporose dans cette population est multifactorielle et cette affection pourrait être un des éléments d’un syndrome de fragilisation alimenté par une immunosénescence accélérée. Chez les porteurs du VIH, il semble possible de faire rétrocéder l’ostéoporose en corrigeant les facteurs de risque, en ayant recours à des traitements pharmacologiques favorisant la densification osseuse et en réduisant l’exposition aux agents antirétroviraux qui accélèrent la déperdition osseuse. Il sera sans doute impératif d’apporter plus d’attention à ce problème si nous voulons prolonger la survie des personnes infectées par le VIH dont l’état est autrement bien maîtrisé avec des agents antirétroviraux.
Références
1. O’FLAHERTY, E. J. « Modeling normal aging bone loss, with consideration of bone loss in osteoporosis », Toxicol Sci, vol. 55, n° 1, 2000, p. 171-188. 2. SANTÉ CANADA. Vieillir au Canada, 2009 (consulté le 16 février 2011, à l’adresse suivante : http://dsp-psd.pwgsc.gc.ca/Collection/H39-608-2002F.pdf). 3. HANLEY, D. A. et R. G. Josse. « Prevention and management of osteoporosis: consensus statements from the Scientific Advisory Board of the Osteoporosis Society of Canada. 1. Introduction », CMAJ, vol. 155, n° 7, 1996, p. 921-923. 4. JACKSON, S. A., A. Tenenhouse et L. Robertson. « Vertebral fracture definition from population-based data: preliminary results from the Canadian Multicenter Osteoporosis Study (CaMos), Osteoporos Int, vol. 11, n° 8, 2000, p. 680-687. 5. LOOKER, A. C., E. S. Orwoll et C. C. Johnston, fils, et al. « Prevalence of low femoral bone density in older U.S. adults from NHANES III », J Bone Miner Res, vol. 12, n° 11,1997, p. 1761-1768. 6. BRUERA, D., N. Luna, D. O. David, L. M. Bergoglio et J. Zamudio. « Decreased bone mineral density in HIV-infected patients is independent of antiretroviral therapy », AIDS, vol. 17, n° 13, 2003, p. 1917-1923. 7. KNOBEL, H., A. Guelar, G. Vallecillo, X. Nogues et A. Diez. « Osteopenia in HIV-infected patients: is it the disease or is it the treatment? », AIDS, vol. 15, n° 6, 2001, p. 807-808. 8. MCCOMSEY, G. A., P. Tebas, E. Shane, et al. « Bone disease in HIV infection: a practical review and recommendations for HIV care providers », Clin Infect Dis, vol. 51, n° 8, 2010, p. 937-946. 9. BROWN, T. T. et R. B. Qaqish. « Antiretroviral therapy and the prevalence of osteopenia and osteoporosis: a meta-analytic review », AIDS, vol. 20, n° 17, 2006, p. 2165-2174. 10. BROWN, T. T., G. A. McComsey, M. S. King, R. B. Qaqish, B. M. Bernstein et B. A. da Silva. « Loss of bone mineral density after antiretroviral therapy initiation, independent of antiretroviral regimen », J Acquir Immune Defic Syndr, vol. 51, n° 5, 2009, p. 554-561. 11. FINKELSTEIN, J. S., S. E. Brockwell, V. Mehta, et al. « Bone mineral density changes during the menopause transition in a multiethnic cohort of women », J Clin Endocrinol Metab, vol. 93, n° 3, 2008, p. 861-868. 12. OMS. « Assessment of fracture risk and its application to screening for post-menopausal osteoporosis », World Health Organ Tech Rep Ser, vol. 843, 1994, p. 1-129. 13. NOF. Clinician’s Guide to prevention and treatment of osteoporosis. National Osteoporosis Foundation, 2010. 14. MARSHALL, D., O. Johnell et H. Wedel. « Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures », BMJ, vol. 312, n° 7041, 1996, p. 1254-1259. 15. TRIANT, V. A., T. T. Brown, H. Lee et S. K. Grinspoon. « Fracture prevalence among human immunodeficiency virus (HIV)-infected versus non-HIV-infected patients in a large U.S. healthcare system », J Clin Endocrinol Metab, vol. 93, n° 9, 2008, p. 3499-3504. 16. DUVIVIER, C., S. Kolta, L. Assoumou, et al. « Greater decrease in bone mineral density with protease inhibitor regimens compared with nonnucleoside reverse transcriptase inhibitor regimens in HIV-1 infected naive patients », AIDS, vol. 23, n° 7, 2009, p. 817-824. 17. STELLBRINK, H. J., C. Orkin, J. R. Arribas, et al. « Comparison of changes in bone density and turnover with abacavir-lamivudine versus tenofovir-emtricitabine in HIV-infected adults: 48-week results from the ASSERT study », Clin Infect Dis, vol. 51, n° 8, 2010, p. 963-972. 18. GALLANT, J. E., S. Staszewski, A. L. Pozniak, et al. « Efficacy and safety of tenofovir DF vs stavudine in combination therapy in antiretroviral-naive patients: a 3-year randomized trial », JAMA, vol. 292, n° 2, 2004, p. 191-201. 19. GRUND, B., G. Peng, C. L. Gibert, et al. « Continuous antiretroviral therapy decreases bone mineral density », AIDS, vol. 23, n° 12, 2009, p. 1519-1529. 20. MARTIN, T. J. et N. A. Sims. « Osteoclast-derived activity in the coupling of bone formation to resorption », Trends Mol Med, vol. 11, n° 2, 2005, p. 76-81. 21. MORA, S. et V. Gilsanz. « Establishment of peak bone mass », Endocrinol Metab Clin North Am, vol. 32, n° 1, 2003, p. 39-63. 22. RAHMANI, P. et S. Morin. « Prevention of osteoporosis-related fractures among postmenopausal women and older men », CMAJ, vol. 181, n° 11, 2009, p. 815-820. 23. GIBELLINI, D., E. De Crignis, C. Ponti, et al. « HIV-1 triggers apoptosis in primary osteoblasts and HOBIT cells through TNFalpha activation », J Med Virol, vol. 80, n° 9, 2008, p. 1507-1514. 24. FABBRICIANI, G. et G. V. De Socio. « Efavirenz and bone health », AIDS, vol. 23, n° 9, 2009, p. 1181. 25. AMIEL, C., A. Ostertag, L. Slama, et al. « BMD is reduced in HIV-infected men irrespective of treatment », J Bone Miner Res, vol. 19, n° 3, 2004, p. 402-409. 26. GRIGSBY, I. F., L. Pham, L. M. Mansky, R. Gopalakrishnan, A. E. Carlson et K. C. Mansky. « Tenofovir treatment of primary osteoblasts alters gene expression profiles: implications for bone mineral density loss », Biochem Biophys Res Commun, vol. 394, n° 1, 2010, p. 48-53. 27. GRIGSBY, I. F., L. Pham, L. M. Mansky, R. Gopalakrishnan et K. C. Mansky. « Tenofovir-associated bone density loss », Ther Clin Risk Manag, vol. 6, 2010, p. 41-47. 28. ZIMMERMANN, A. E., T. Pizzoferrato, J. Bedford, A. Morris, R. Hoffman et G. Braden. « Tenofovir-associated acute and chronic kidney disease: a case of multiple drug interactions », Clin Infect Dis, vol. 42, n° 2, 2006, p. 283-290. 29. JASSAL, S. K., D. von Muhlen et E. Barrett-Connor. « Measures of renal function, BMD, bone loss, and osteoporotic fracture in older adults: the Rancho Bernardo study », J Bone Miner Res, vol. 22, n° 2, 2007, p. 203-210. 30. DEEKS, S. G. « HIV infection, inflammation, immunosenescence, and aging », Annu Rev Med, vol. 62, 2011, p. 141-155. 31. PAWELEC, G. Immunosenescence. Springer, Philadelphie, 2007. 32. MOLINA-PINELO, S., A. Vallejo, L. Diaz, et al. « Premature immunosenescence in HIV-infected patients on highly active antiretroviral therapy with low-level CD4 T cell repopulation », J Antimicrob Chemother, vol. 64, n° 3, 2009, p. 579-588. 33. PAPAIOANNOU, A., S. Morin, A, M. Cheung, et al. « 2010 clinical practice guidelines for the diagnosis and management of osteoporosis in Canada: summary », CMAJ, vol. 182, n° 17, 2010, p. 1864-1873. 34. ABERG, J. A., J. E. Kaplan, H. Libman, et al. « Primary care guidelines for the management of persons infected with human immunodeficiency virus: 2009 update by the HIV medicine Association of the Infectious Diseases Society of America », Clin Infect Dis, vol. 49, n° 5, 2009, p. 651-681. 35. COHEN, A. et E. Shane. Primer on the metabolic bone diseases and other disorders of bone and mineral metabolism: premenopausal osteoporosis, J. W. Wiley, 2008. 36. CHEW, N. S., P. P. Doran et W. G. Powderly. « Osteopenia and osteoporosis in HIV: pathogenesis and treatment », Curr Opin HIV AIDS, vol. 2, n° 4, 2007, p. 318-323. 37. POLLOCK, E., A. E. Klotsas, J. Compston et E. Gkrania-Klotsas. « Bone health in HIV infection », Br Med Bull, vol. 92, 2009, p. 123-133. 38. BILEZIKIAN, J. P. « Efficacy of bisphosphonates in reducing fracture risk in postmenopausal osteoporosis », Am J Med, vol. 122 (suppl. 2), 2009, p. S14-S21. 39. HUANG, J., L. Meixner, S. Fernandez et J. A. McCutchan. « A double-blinded, randomized controlled trial of zoledronate therapy for HIV-associated osteopenia and osteoporosis »,AIDS, vol. 23, n° 1, 2009, p. 51-57. 40. ODVINA, C. V., J. E. Zerwekh, D. S. Rao, N. Maalouf, F. A. Gottschalk et C. Y. Pak. « Severely suppressed bone turnover: a potential complication of alendronate therapy », J Clin Endocrinol Metab, vol. 90, n° 3, 2005, p. 1294-1301.
Chapitre 5 : L’ostéoporose
La perte accélérée de substance osseuse chez les porteurs du VIH laisse craindre une crise majeure de santé publique au Canada et dans les autres pays où cette population est vieillissante. Il semble en effet y avoir une interaction importante entre les facteurs de risque classiques d’ostéoporose et la raréfaction osseuse expressément liée au VIH et aux traitements qui sont dirigés contre ce virus. La perte de substance osseuse, un processus évolutif, est décelée peu de temps après l’infection, parallèlement au vieillissement accéléré des autres organes. Elle peut subsister en dépit de l’élimination du VIH, voire être exacerbée par certains agents antirétroviraux. Les stratégies visant à atténuer les répercussions de la déperdition osseuse reposent sur le dépistage de cette raréfaction dès ses débuts et sur les mesures énergiques mises en place pour prévenir ou corriger les processus sous-jacents. L’incidence de plus en plus élevée de fractures chez les porteurs du VIH qui prennent de l’âge a attiré l’attention de la communauté médicale sur cette complication. Compte tenu du basculement démographique, il est à prévoir que la déperdition osseuse tendra à se répandre chez les porteurs du VIH, vu qu’une proportion grandissante de ces patients arrive à un âge particulièrement vulnérable.
Afficher la revue