Revue d’experts
Le Porteur du VIH Vieillissant
Chapitre 3 : L’altération de la fonction rénale
Derek M. Fine, M. D.
École de médecine Johns Hopkins, Baltimore, MD
Les néphropathies chroniques constituent une lourde menace pour la survie à long terme des personnes infectées par le virus de l’immunodéficience humaine (VIH). Les agents antirétroviraux hautement actifs (TAHA) ont considérablement abaissé le risque d’insuffisance rénale chronique au stade ultime (IRSU) expressément liée au VIH, comme ce fût le cas pour beaucoup d’autres complications de l’infection par le VIH lorsque celle-ci n’est pas bien maîtrisée. Les TAHA ont aussi atténué le dysfonctionnement rénal causé indirectement par cette infection, mais ils ne l’ont toutefois pas éliminé. Jusqu’à tout récemment, le risque d’insuffisance rénale, vue sous l’angle des complications du VIH, concernait surtout les patients Afro-américains qui se sont révélés particulièrement vulnérables à la néphropathie associée au VIH. Or l’incidence de l’insuffisance rénale ne cesse de grimper chez les sujets vieillissants dont l’infection par le VIH est autrement bien maîtrisée. Les médicaments habituellement utilisés pour préserver la fonction rénale sur fond d’infection par le VIH, tels que les inhibiteurs du système rénine-angiotensine-aldostérone (SRAA), sont utiles, mais d’autres stratégies doivent être prises en considération. Parmi ces dernières, on trouve le recours privilégié aux agents antirétroviraux qui risquent le moins d’aggraver le dysfonctionnement rénal. La surveillance étroite de la fonction rénale s’impose en raison de la variation interindividuelle du risque de néphropathies et de l’évolution différente de ces maladies une fois qu’elles sont installées.
Contexte
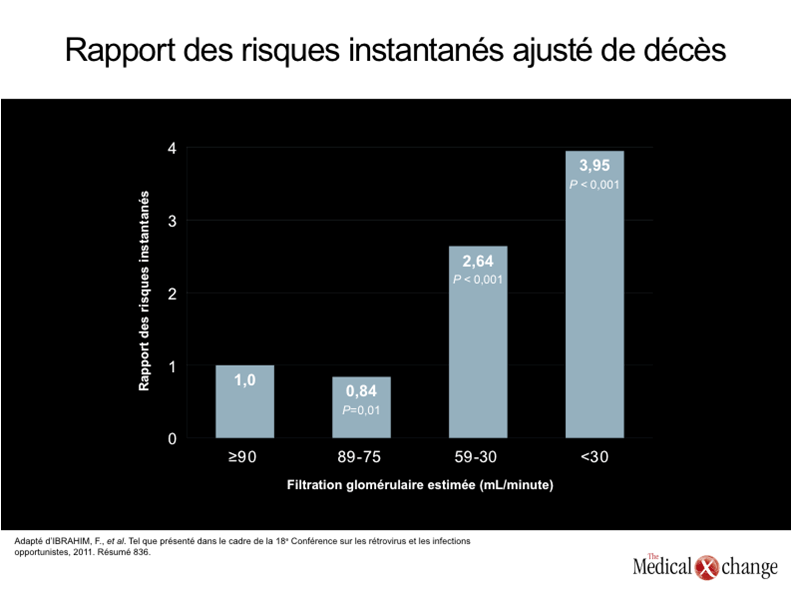
Un des premiers cas de néphropathie associée au virus de l’immunodéficience humaine, qui a été rapporté en 1984, concernait une hyalinose segmentaire et focale avec syndrome néphrotique d’origine nébuleuse1. Au cours de la période qui a suivi et qui mené à la mise au point des agents antirétroviraux hautement actifs (TAHA), la néphropathie associée au VIH a été reconnue comme une cause majeure de mortalité liée au VIH, notamment chez les sujets de race noire2. Cette affection s’accompagnait souvent de protéinurie grave et d’une insuffisance rénale aiguë menant rapidement à l’insuffisance rénale chronique au stade ultime (IRSU), puis au décès3. À l’ère des TAHA, le risque d‘IRSU a diminué considérablement chez les porteurs du VIH, qu’ils soient de race blanche ou de race noire4, 5. Les sujets d’ascendance africaine, toutefois, continuent d’être particulièrement exposés à la néphropathie associée au VIH et aux autres formes de néphropathie6. Cette situation s’explique, dans une large mesure, par une certaine prédisposition génétique imputable aux variantes du gène APOL1 du chromosome 227qui sont toujours présentes chez les sujets atteints de néphropathie associée au VIH, une entité histopathologique distincte des néphropathies chroniques, confirmée idéalement par biopsie. Les variantes de ce gène polymorphe semblent aussi expliquer le fait que les sujets de race noire séronégatifs à l’égard du VIH risquent davantage que ceux de race blanche d’être atteints d’IRSU8, et que la fonction rénale des porteurs du VIH de race noire se détériore beaucoup plus rapidement que celle des porteurs de race blanche5.Aucun essai avec répartition aléatoire des sujets n’a été réalisé pour confirmer l’aptitude des TAHA à prévenir la néphropathie associée au VIH, mais des analyses rétrospectives ont révélé que cette complication est rarement observée chez les patients qui entreprennent leur traitement par ces médicaments avant que leur immunodéficience ait atteint un stade avancé et qui parviennent à garder leur virémie sous le seuil de 400 copies/mL9. La néphropathie associée au VIH ne se voit pratiquement plus que chez les patients qui amorcent leur traitement antirétroviral alors que leur immunodéficience en est déjà à un stade avancé, mais les stratégies appliquées à l’heure actuelle, comme nous le verrons plus bas, pourraient freiner l’évolution de l’insuffisance rénale vers le stade ultime. La transplantation rénale peut offrir aux patients qui se dirigent vers l’IRSU une survie à long terme exempte de dialyse10. Même si le risque de néphropathie spécifiquement associée au VIH a diminué avec l’arrivée des TAHA, il est à prévoir que les autres types de néphropathie risquent d’augmenter chez les porteurs du VIH vieillissants, et ce, pour un certain nombre de raisons. La microalbuminurie, signe précurseur d’une néphropathie plus grave, est jusqu’à cinq fois plus fréquente chez les sujets séropositifs à l’égard du VIH que chez les témoins séronégatifs après ajustement des diverses variables11. Contrairement à la néphropathie associée au VIH, les néphropathies observées à l’ère des TAHA sont reliées à des processus pathologiques peu évolutifs et non pas aigus, même si, à terme, elles peuvent être tout aussi dangereuses. L’évaluation de la fonction rénale effectuée chez 20 132 porteurs du VIH a révélé que, depuis l’arrivée des TAHA, la filtration glomérulaire estimée au départ est un facteur de prédiction puissant de mortalité12 (Fig. 1). Cela n’a rien de surprenant compte tenu du grand nombre d’études effectuées chez les sujets séronégatifs à l’égard du VIH, qui ont fait ressortir des résultats similaires. La littérature faisant état de l’accélération des processus liés à l’âge chez les porteurs du VIH est de plus en plus abondante. Elle nous apprend, entre autres, que les reins peuvent être touchés de manière directe et indirecte13. Par exemple, le diabète de type 2, qui est un facteur de risque majeur d’altération de la fonction rénale, est quatre fois plus fréquent chez les porteurs du VIH que dans la population de témoins appariés en fonction de l’âge14. La prévalence de l’hypertension, autre risque d’altération de la fonction rénale, est jusqu’à trois fois plus élevée15, tandis que le virus de l’hépatite C (VHC), qui affaiblit aussi la fonction rénale, est beaucoup plus répandu chez les personnes infectées par le VIH que chez celles qui ne le sont pas16. En outre, il ne fait plus de doute maintenant que plusieurs agents antirétroviraux accroissent le risque de néphropathie chronique. L’augmentation relative du risque est parfois minime, mais les agents antirétroviraux devant être pris indéfiniment, il se peut que ce risque provienne d’un effet cumulatif. Il n’y a pas d’objectif plus prioritaire dans le traitement du VIH que le maintien de la charge virale à un faible niveau, c’est entendu. Cela dit, il pourrait être particulièrement judicieux de choisir un agent qui risque peu d’altérer la fonction rénale chez les patients qui présentent dès le départ des facteurs de risque de néphropathie ou dont la fonction rénale est déjà affaiblie17. Il est essentiel pour le clinicien de reconnaître le problème croissant que représentent les néphropathies chroniques chez les porteurs du VIH qui prennent de l’âge et de tenir compte des manifestations et des causes extrêmement variées de ces affections18. Fait important à noter, les processus pathologiques à l’origine de ces maladies sont souvent les mêmes que ceux qui sont observés chez les personnes indemnes de l’infection par le VIH, mais ils se produisent à un plus jeune âge et ils risquent davantage de provoquer des complications gravissimes en un temps beaucoup plus court (Tableau 1). La néphropathie associée au VIH qui était observée avant l’arrivée des TAHA et les néphropathies chroniques qui affligent souvent les personnes vieillissantes dont l’infection par le VIH est bien maîtrisée, sont imputables à des processus pathologiques très différents. En effet, on a fait le rapprochement entre la néphropathie associée au VIH et l’infection localisée des cellules des glomérules rénaux et des cellules de l’épithélium tubulaire par le VIH, qui entraîne une glomérulosclérose et une fibrose tubulo-interstitielle19, 20. Dès lors qu’elle touche les cellules épithéliales du rein, l’infection par le VIH accélère l’altération de la filtration glomérulaire en perturbant directement le fonctionnement de ces cellules. La glomérulonéphrite à complexes immuns propre à l’infection par le VIH et la microangiopathie thrombotique liée au VIH, qui ne sont pas plus fréquentes chez les sujets de race noire, sont des maladies moins répandues chez les porteurs de ce virus7. Pour comprendre la multiplication récente des cas de néphropathie chez les personnes vivant avec le VIH, il faut d’abord reconnaître que les néphropathies chroniques sont des maladies courantes chez les personnes séronégatives et que l’incidence globale de ces affections est en hausse. Cette hausse de l’incidence des néphropathies chroniques est probablement imputable, du moins en partie, au problème croissant d’obésité et des maladies qui y sont associées, surtout le diabète21; elle peut aussi être reliée au basculement démographique qui fait en sorte que l’âge médian augmente au Canada et à l’étranger22. Les tendances similaires qui se dessinent parmi les porteurs du VIH, notamment au chapitre du vieillissement, expliqueraient la hausse de l’incidence des néphropathies chroniques dans cette population. Par ailleurs, non seulement les porteurs du VIH risquent-ils bien plus de souffrir de maladies nuisant à la fonction rénale, comme l’hépatite C, mais ils risquent aussi d’être relativement plus exposés à des substances néphrotoxiques telles que les agents antirétroviraux, les drogues illicites (par ex., la cocaïne) et les antibiotiques (par ex., la gentamicine et l’amphotéricine)23. Les patients infectés par le VIH ne risquent probablement pas d’être exposés davantage aux autres agents connus pour leur néphrotoxicité comme les anti-inflammatoires non stéroïdiens (AINS), mais la grande quantité de médicaments qu’ils prennent pourrait les rendre plus vulnérables aux complications rénales telles que la néphrite interstitielle aiguë24. Pratiquement tous les agents antirétroviraux ont été incriminés dans des cas d’insuffisance rénale aiguë, mais les deux qui ont été le plus souvent reliés à des effets néphrotoxiques aigus ou chroniques sont le ténofovir, un inhibiteur nucléosidique de la transcriptase inverse (INTI) et l’indinavir, un inhibiteur de protéase (IP)6. Dans l’ensemble, le risque d’insuffisance rénale aiguë et de néphropathie chronique est faible chez les patients jeunes et relativement en santé traités par le ténofovir25, mais cet agent peut provoquer une tubulopathie rénale proximale qui pourrait comporter un risque plus élevé d’insuffisance rénale chez les patients présentant d’autres facteurs de risque. Il se peut que le risque de lésions aux reins associé au ténofovir soit plus élevé chez les patients qui sont déjà atteints d’une néphropathie chronique et chez ceux qui y sont exposés de manière prolongée26. Lors de l’analyse rétrospective des données recueillies chez 10 000 patients exposés au ténofovir, les chercheurs ont recensé des cas de néphrotoxicité chez seulement 2 % de ces patients. Ils ont toutefois constaté qu’il était plus probable de déceler une hausse de la créatininémie sérique supérieure à > 0,5 mg/dL (44,2 µmol/L) si la créatininémie sérique mesurée au départ était élevée, dans les cas de traitement concomitant avec un autre agent néphrotoxique et chez les patients plus âgés27. Le risque associé à l’indinavir, contrairement au ténofovir, semble tirer son origine d’une néphrite interstitielle chronique28, mais cet inhibiteur de protéase est rarement utilisé de nos jours et ne vient donc pas alourdir le risque de manière substantielle (Tableau 2).
Caractéristiques cliniques et évaluation de la néphropathie chez les porteurs du VIH
À l’ère post-TAHA, il ne faut pas oublier que la néphropathie associée au VIH demeure une complication possible de l’infection par le VIH, surtout chez les sujets d’ascendance africaine dont la virémie n’est pas maîtrisée en dépit de l’utilisation d’agents antirétroviraux. La néphropathie associée au VIH s’accompagne habituellement d’une protéinurie marquée, qui n’est pas toujours néphrotique, et d’une insuffisance rénale aiguë qui évolue rapidement3. La néphropathie associée au VIH, qui n’est généralement pas reliée à l’hypertension ou à un œdème, s’observe habituellement chez les patients dont l’infection par VIH a évolué vers le syndrome d’immunodéficience acquise (sida) ou ayant un faible nombre de lymphocytes T CD4 et une charge virale élevée. Cela dit, dans la plupart des cas de néphropathie dont sont affligées aujourd’hui les personnes vivant avec le VIH, soit que la maladie n’a pas de lien causal direct avec cette infection (par ex., les traitements antirétroviraux), soit qu’elle est attribuable à des processus pathologiques que l’infection peut avoir exacerbés, sans les avoir causés pour autant. Bon nombre des facteurs à l’origine des néphropathies chez les sujets séropositifs à l’égard du VIH sont les mêmes que ceux observés chez les personnes séronégatives, sauf que ces affections se manifestent plus tôt et qu’elles peuvent s’accompagner de complications, comme une infection concomitante par le VHC. Il peut être utile au moment de poser un diagnostic de faire la distinction entre l’insuffisance rénale aiguë qui témoigne d’une altération rapide de la fonction rénale, et les néphropathies chroniques qui, bien qu’évoluant lentement, sont le plus souvent irréversibles, et ce, même si leur progression peut être ralentie (Fig. 2). Que la néphropathie soit imputable à une glomérulonéphrite d’origine immunitaire ou à une insuffisance rénale évolutive provoquée par d’autres processus pathologiques, y compris un déclin de la fonction rénale liée au vieillissement ou des lésions rénales d’origine médicamenteuse, elle risque d’être silencieuse au début sur le plan clinique, seules des analyses de laboratoire pouvant permettre de la déceler. Il convient donc de prévoir des épreuves fonctionnelles rénales dans le cadre de l’évaluation systématique des patients infectés par le VIH, y compris ceux qui sont autrement bien portants et dont l’infection est bien maîtrisée29. En règle générale, dans les cas de néphropathie s’accompagnant de protéinurie (il s’agit habituellement d’affections glomérulaires), cette dernière est le premier signe à se manifester30. Une telle hausse de la concentration en protéines témoignant d’une anomalie de la fonction rénale peut être décelée chez le tiers des porteurs du VIH31. Bien que la protéinurie ne soit pas toujours suffisamment marquée pour justifier un traitement, elle est souvent liée à une néphropathie évolutive, d’où la nécessité de surveiller étroitement ces patients. La protéinurie, même lorsqu’elle est de l’ordre de la microalbuminurie (de 30 à 300 mg/24 heures), est un signe pronostic sombre, puisqu’elle laisse entrevoir des risques pour la santé tels que des accidents cardiovasculaires. Le recueil d’urines de 24 heures est ordinairement considéré comme la méthode la plus précise pour évaluer la protéinurie. D’après les lignes directrices de l’Infectious Diseases Society of America (IDSA), les bandelettes réactives constituent toutefois un moyen de détection acceptable pour la surveillance de la fonction rénale chez les patients infectés par le VIH. Il n’en demeure pas moins que la détermination ponctuelle du rapport protéine/créatinine à partir d’un seul échantillon d’urine donne une évaluation plus précise de la protéinurie et qu’elle a un côté pratique non négligeable. Indépendamment de l’ampleur de la protéinurie, l’estimation de la filtration glomérulaire (au moyen de formules fondées sur la créatinine) se justifie chez tous les patients dès son apparition aux fins d’évaluation de leur fonction rénale. On s’entend pour dire que, par définition, il y a néphropathie chronique quand la filtration glomérulaire estimée est inférieure à 60 mL/min/173 m2 et qu’elle persiste pendant au moins trois mois ou quand une autre anomalie rénale, comme la protéinurie, est présente depuis plus de trois mois, quelle que soit la filtration glomérulaire estimée32. La fréquence à laquelle seront répétées les estimations de la filtration glomérulaire doit reposer sur les critères suivants : ampleur de la protéinurie, présence de facteurs de risque de néphropathie chronique, de diabète ou d’autres maladies concomitantes, exposition à des médicaments néphrotoxiques, usage du tabac, dyslipidémie ou utilisation de drogues injectables29. Chez les sujets jeunes autrement en santé, dont l’infection par le VIH est bien maîtrisée et ne présentant pas de facteurs de risque de néphropathie, la surveillance systématique de la fonction rénale peut se faire dans le cadre des examens de santé périodiques, mais elle devra avoir lieu à intervalles de plus en plus rapprochés et à l’aide de méthodes de plus en plus poussées au fur et à mesure que le patient avancera en âge et que s’ajouteront des facteurs de risque. L’utilisation des bandelettes réactives pour mesurer la protéinurie peut suffire chez les patients peu exposés, mais le moindre doute quant à la présence possible d’une néphropathie doit donner lieu à des examens et analyses supplémentaires, y compris la détermination du rapport protéine/créatinine ou du rapport albumine/créatinine et l’estimation de la filtration glomérulaire chez les sujets très exposés ou quand la présence d’une protéinurie incite à approfondir les évaluations. Chez les sujets infectés par le VIH, il arrive parfois que l’on doive procéder à une biopsie rénale pour poser un diagnostic de certitude sur la cause de l’insuffisance rénale aiguë ou d’une néphropathie, y compris la néphropathie associée au VIH. On doit effectuer ce type de prélèvement sans délai chez les patients présentant une insuffisance rénale aiguë, surtout si on soupçonne la présence d’une néphropathie associée au VIH, en raison de la détérioration rapide de la fonction rénale provoquée par cette affection. La néphrite interstitielle aiguë fait aussi partie des causes les plus fréquentes d’insuffisance rénale aiguë chez les porteurs du VIH. Tout comme celles de la néphropathie associée au VIH, les caractéristiques de la néphrite interstitielle aiguë permettent de la diagnostiquer plus facilement à la biopsie. Il peut être inutile de procéder à ce type de prélèvement chez les victimes d’une néphropathie si la détérioration de leur fonction rénale cadre avec une maladie concomitante telle que le diabète. La biopsie peut toutefois se révéler utile pour évaluer l’atteinte rénale chez les patients infectés par le VHC et faciliter le choix de la stratégie de prise en charge qui convient le mieux. Elle peut également présenter un grand intérêt pour orienter la prise en charge des patients quand plusieurs diagnostics sont possibles.
Traitement
Dans bien des cas, la néphropathie est une maladie irréversible, mais il est possible de ralentir sensiblement son évolution. La première étape consiste à contrer ou à éliminer les sources possibles de néphropathie ou de néphrotoxicité. Il peut s’agir, par exemple, de traiter une hépatite C ou de passer à un TAHA exempt de ténofovir. La détection de la détérioration de la fonction rénale dès ses débuts permet d’intervenir pendant que les dommages aux reins sont limités, surtout si la cause peut être déterminée. Chez les patients traités par le ténofovir, par exemple, le risque immédiat de néphropathie d’importance clinique semble très faible si la fonction rénale s’affaiblit lentement, mais les effets négatifs des traitements prolongés peuvent s’accumuler ou s’intensifier chez les sujets qui présentent d’autres facteurs de risque de néphropathie chronique33. Dans le cas des patients atteints d’une néphropathie associée au VIH ou d’une néphropathie à complexes immuns, qui n’ont pas encore entrepris un traitement antirétroviral, la suppression de la charge virale est éminemment prioritaire et il faut s’en occuper sur le champ. Les stéroïdes peuvent aussi se révéler utiles durant les manifestations aiguës de la néphropathie associée au VIH. Au terme de la phase aiguë, il est possible de ralentir la détérioration de la fonction rénale à l’aide des inhibiteurs de l’enzyme de conversion de l’angiotensine (ECA)34. Les soins à prodiguer aux patients dont la néphropathie associée au VIH (ou de toute autre néphropathie) a dégénéré en IRSU, ou qui risque fortement de le faire, doivent être confiés à un néphrologue qui veillera à leur offrir des traitements par dialyse ou par des techniques de pointe telles que la transplantation d’organe. Chez les patients aux prises avec une néphropathie, les mêmes principes de préservation de la fonction rénale s’appliquent, que les sujets soient séropositifs ou séronégatifs à l’égard du VIH. Il s’agit donc de maîtriser scrupuleusement la tension artérielle, la glycémie (chez les patients diabétiques) et les dyslipidémies, d’éviter les agents néphrotoxiques et d’administrer des doses appropriées d’inhibiteurs de l’ECA ou d’autres inhibiteurs du système rénine-angiotensine. Il est également plus prudent d’éviter de fumer et de boire peu d’alcool. En outre, il convient de rester à l’affût d’une anémie et d’anomalies du renouvellement osseux étant donné le lien avéré entre le dysfonctionnement rénal et de tels problèmes.
Conclusion
L’infection par le VIH s’est révélée un facteur de risque de dysfonctionnement rénal et d’évolution vers une IRSU dès le début de l’épidémie. Bien que l’arrivée des TAHA ait fortement atténué le risque de néphropathie associée au VIH, il est à prévoir que, comparativement aux sujets du même âge indemnes de ce virus, l’incidence des néphropathies augmentera plus rapidement au sein de la population vieillissante des porteurs du VIH, et ce, même si leur infection est bien maîtrisée. Nous avons de nombreuses raisons de craindre une augmentation de l’incidence de néphropathie chronique chez les personnes séropositives qui avancent en âge, telles qu’un plus grand nombre de facteurs de risque, une exposition plus importante aux agents néphrotoxiques et un processus de vieillissement qui semble accéléré chez ces patients. Les examens de santé périodiques doivent comprendre la surveillance systématique de la fonction rénale aussi bien chez les sujets sains que chez les porteurs du VIH, mais elle devra avoir lieu plus souvent et plus minutieusement chez ces derniers.
Références
1. RAO, T. K., E. J. Filippone, A. D. Nicastri, et al. « Associated focal and segmental glomerulosclerosis in the acquired immunodeficiency syndrome », N Engl J Med, vol. 310, n° 11, 1984, p. 669-673. 2. WINSTON, J. A. et P. E. Klotman. « Are we missing an epidemic of HIV-associated nephropathy? », J Am Soc Nephrol, vol. 7, n° 1, 1996, p. 1-7. 3. CARBONE, L., V. D’Agati, J. T. Cheng et G. B. Appel. « Course and prognosis of human immunodeficiency virus-associated nephropathy », Am J Med, vol. 87, n° 4, 1989, p. 389-395. 4. AHUJA, T. S., J. Grady et S. Khan. « Changing trends in the survival of dialysis patients with human immunodeficiency virus in the United States », J Am Soc Nephrol, vol. 13, n° 7, 2002, p. 1889-1893. 5. LUCAS, G. M., B. Lau, M. G. Atta, D. M. Fine, J. Keruly et R. D. Moore. « Chronic kidney disease incidence, and progression to end-stage renal disease, in HIV-infected individuals: a tale of two races », J Infect Dis, vol. 197, n° 11, 2008, p. 1548-1557. 6. WINSTON, J., G. Deray, T. Hawkins, L. Szczech, C. Wyatt et B. Young. « Kidney disease in patients with HIV infection and AIDS », Clin Infect Dis, vol. 47, n° 11, 2008, p. 1449-1457. 7. GENOVESE, G., D. J. Friedman, M. D. Ross, et al. « Association of trypanolytic ApoL1 variants with kidney disease in African Americans », Science, vol. 329, n° 5993, 2010, p. 841-845. 8. CHOI, A. I., R. A. Rodriguez, P. Bacchetti, D. Bertenthal, P. A. Volberding et A. M. O’Hare. « Racial differences in end-stage renal disease rates in HIV infection versus diabetes », J Am Soc Nephrol, vol. 18, n° 11, 2007, p. 2968-2974. 9. ESTRELLA, M., D. M. Fine, J. E. Gallant, et al. « HIV type 1 RNA level as a clinical indicator of renal pathology in HIV-infected patients », Clin Infect Dis, vol. 43, n° 3, 2006, p. 377-380. 10. STOCK, P. G., B. Barin, B. Murphy, et al. « Outcomes of kidney transplantation in HIV-infected recipients », N Engl J Med, vol. 363, n° 21, 2010, p. 2004-2014. 11. SZCZECH, L. A., C. Grunfeld, R. Scherzer, et al. « Microalbuminuria in HIV infection », AIDS, vol. 21, n° 8, 2007, p. 1003-1009. 12. IBRAHIM, F., L. Hamzh, R. Jones, D. Nitsch, C. Sabin et F. Post. Renal disease: long-term outcomes and prognostic factors, présenté lors de la 18e conférence sur les rétrovirus et les infections opportunistes, 2011, résumé 836. 13. VANCE, D. E., M. Mugavero, J. Willig, J. L. Raper et M. S. Saag. « Aging with HIV: a cross-sectional study of comorbidity prevalence and clinical characteristics across decades of life », J Assoc Nurses AIDS Care, vol. 22, n° 1, 2011, p. 17-25. 14. BROWN, T. T., S. R. Cole, X. Li, et al. « Antiretroviral therapy and the prevalence and incidence of diabetes mellitus in the multicenter AIDS cohort study », Arch Intern Med, vol. 165, n° 10, 2005, p. 1179-1184. 15. GAZZARUSO, C., R. Bruno, A. Garzaniti, et al. « Hypertension among HIV patients: prevalence and relationships to insulin resistance and metabolic syndrome », J Hypertens, vol. 21, n° 7, 2003, p. 1377-1382. 16. SHERMAN, M., S. Shafran, K. Burak, et al. « Management of chronic hepatitis C: consensus guidelines », Can J Gastroenterol, vol. 21 (suppl. C), 2007, p. 25C-34C. 17. HAWKINS, T. « Understanding and managing the adverse effects of antiretroviral therapy », Antiviral Res, vol. 85, n° 1, 2010, p. 201-209. 18. RACHAKONDA, A. K. et P. L. Kimmel. « CKD in HIV-infected patients other than HIV-associated nephropathy », Adv Chronic Kidney Dis, vol. 17, n° 1, 2010, p. 83-93. 19. MARRAS, D., L. A. Bruggeman, F. Gao, et al. « Replication and compartmentalization of HIV-1 in kidney epithelium of patients with HIV-associated nephropathy »,Nat Med, vol. 8, n° 5, 2002, p. 522-526. 20. ALPERS, C. E. et J. Kowalewska. « Emerging paradigms in the renal pathology of viral diseases », Clin J Am Soc Nephrol, vol. 2 (suppl. 1), 2007, p. S6-S12. 21. WILD, S., G. Roglic, A. Green, R. Sicree et H. King. « Global prevalence of diabetes: estimates for the year 2000 and projections for 2030 », Diabetes Care, vol. 27, n° 5, 2004, p. 1047-1053. 22. LEVIN, A., B. Hemmelgarn, B. Culleton, et al. « Guidelines for the management of chronic kidney disease », CMAJ, vol. 179, n° 11, 2008, p. 1154-1162. 23. FINE, D. M., M. A. Perazella, G. M. Lucas et M. G. Atta. « Renal disease in patients with HIV infection: epidemiology, pathogenesis and management », Drugs, vol. 68, n° 7, 2008, p. 963-980. 24. PARKHIE, S. M., D. M. Fine, G. M. Lucas et M. G. Atta. « Characteristics of patients with HIV and biopsy-proven acute interstitial nephritis », Clin J Am Soc Nephrol, vol. 5, n° 5, 2010, p. 798-804. 25. IZZEDINE, H., J. S. Hulot, D. Vittecoq, et al. « Long-term renal safety of tenofovir disoproxil fumarate in antiretroviral-naive HIV-1-infected patients. Data from a double-blind randomized active-controlled multicentre study », Nephrol Dial Transplant, vol. 20, n° 4, 2005, p. 743-746. 26. MOCROFT, A., O. Kirk, P. Reiss, et al. « Estimated glomerular filtration rate, chronic kidney disease and antiretroviral drug use in HIV-positive patients »,AIDS, vol. 24. n° 11, 2010, p. 1667-1678. 27. NELSON, M. R., C. Katlama, J. S. Montaner, et al. « The safety of tenofovir disoproxil fumarate for the treatment of HIV infection in adults: the first 4 years », AIDS, vol. 21, n° 10, 2007, p. 1273-1281. 28. BERNS, J. S. et N. Kasbekar. « Highly active antiretroviral therapy and the kidney: an update on antiretroviral medications for nephrologists », Clin J Am Soc Nephrol, vol. 1, n° 1, 2006, p. 117-129. 29. GUPTA, S. K., J. A. Eustace, J. A. Winston, et al. « Guidelines for the management of chronic kidney disease in HIV-infected patients: recommendations of the HIV Medicine Association of the Infectious Diseases Society of America », Clin Infect Dis, vol. 40, n° 11, 2005, p. 1559-1585. 30. ESTRELLA, M. M. et D. M. Fine. « Screening for chronic kidney disease in HIV-infected patients », Adv Chronic Kidney Dis, vol. 17, n° 1, 2010, p. 26-35. 31. GUPTA, S. K., B. W. Mamlin, C. S. Johnson, M. D. Dollins, J. M. Topf et M. P. Dube. « Prevalence of proteinuria and the development of chronic kidney disease in HIV-infected patients »,Clin Nephrol, vol. 61, n° 1, 2004, p. 1-6. 32. LEVEY, A. S., J. Coresh, E. Balk, et al. « National Kidney Foundation practice guidelines for chronic kidney disease: evaluation, classification, and stratification », Ann Intern Med, vol. 139, n° 2, 2003, p. 137-147. 33. RODRIGUEZ-NOVOA, S., E. Alvarez, P. Labarga et V Soriano. « Renal toxicity associated with tenofovir use », Expert Opin Drug Saf, vol. 9, n° 4, 2010, p. 545-559. 34. WEI, A., G. C. Burns, B. A. Williams, N. B. Mohammed, P. Visintainer et S. L. Sivak. « Long-term renal survival in HIV-associated nephropathy with angiotensin-converting enzyme inhibition », Kidney Int, vol. 64, n° 4, 2003, p. 1462-1471.
Chapitre 3 : L’altération de la fonction rénale
Les néphropathies chroniques constituent une lourde menace pour la survie à long terme des personnes infectées par le virus de l’immunodéficience humaine (VIH). Les agents antirétroviraux hautement actifs (TAHA) ont considérablement abaissé le risque d’insuffisance rénale chronique au stade ultime (IRSU) expressément liée au VIH, comme ce fût le cas pour beaucoup d’autres complications de l’infection par le VIH lorsque celle-ci n’est pas bien maîtrisée. Les TAHA ont aussi atténué le dysfonctionnement rénal causé indirectement par cette infection, mais ils ne l’ont toutefois pas éliminé. Jusqu’à tout récemment, le risque d’insuffisance rénale, vue sous l’angle des complications du VIH, concernait surtout les patients Afro-américains qui se sont révélés particulièrement vulnérables à la néphropathie associée au VIH. Or l’incidence de l’insuffisance rénale ne cesse de grimper chez les sujets vieillissants dont l’infection par le VIH est autrement bien maîtrisée. Les médicaments habituellement utilisés pour préserver la fonction rénale sur fond d’infection par le VIH, tels que les inhibiteurs du système rénine-angiotensine-aldostérone (SRAA), sont utiles, mais d’autres stratégies doivent être prises en considération. Parmi ces dernières, on trouve le recours privilégié aux agents antirétroviraux qui risquent le moins d’aggraver le dysfonctionnement rénal. La surveillance étroite de la fonction rénale s’impose en raison de la variation interindividuelle du risque de néphropathies et de l’évolution différente de ces maladies une fois qu’elles sont installées.
Afficher la revue