Neurologie
Réunion CURE SMA de 2021 sur la recherche et les soins cliniques
La thérapie génique, un traitement efficace en première ou en deuxième ligne contre l’amyotrophie spinale
Réunion en ligne – Une thérapie de substitution génique homologuée contre l’amyotrophie spinale (AS) se montre efficace chez les enfants déjà été traités contre cette maladie et chez les enfants plus âgés que les participants aux essais déterminants. Bien que son emploi soit autorisé jusqu’à l’âge de 24 mois, elle a été administrée dans les premiers mois de vie, le plus souvent avant l’apparition des symptômes, à la plupart des participants aux études initiales et déterminantes qui portaient essentiellement sur l’AS de type 1, la forme la plus répandue et la plus grave de cette maladie. Or de nouvelles données indiquent qu’un éventail beaucoup plus large d’enfants pourrait en bénéficier.
La thérapie génique opposée à l’AS de type 1 a fait ses preuves. Alors que l’espérance de vie de ces patients est généralement inférieure à deux ans, certains enfants suivis depuis plus de cinq ans maintenant se sont développés normalement ou presque. Lorsqu’il a été homologué, l’onasemnogène abéparvovec, l’agent de thérapie génique en question, qui permet de remplacer le gène SMN1 afin de restaurer l’expression de la protéine SMA, est devenu le deuxième agent homologué contre cette maladie complexe. Le traitement d’entretien du premier agent, le nusinersen, un oligonucléotide antisens agissant sur l’épissage de l’ARN pré-messager du gène SMN2, s’administre par voie intrathécale tous les 4 mois. La thérapie de substitution génique n’est administrée qu’une seule fois.
RÉPONSE D’ENFANTS PLUS VIEUX À LA THÉRAPIE GÉNIQUE
« Les deux agents ont énormément amélioré le pronostic de l’AS, mais presque tous les participants aux essais cliniques sur l’onasemnogène abéparvovec avaient moins de 6 mois et n’avaient jamais été traités auparavant », a rapporté le Dr Eric Wu, chercheur et clinicien-chercheur principal, chez Analysis Group, de Boston, au Massachusetts. Les gains obtenus chez des enfants plus vieux ou déjà exposés au nusinersen n’ont pas été mesurés pendant ces études, mais « nous avons acquis un peu d’expérience aujourd’hui grâce aux données de ces groupes de patients traités en pratique clinique ».
« Nous avons acquis un peu d’expérience aujourd’hui avec la thérapie génique grâce aux données des enfants plus vieux ou déjà exposés au nusinersen qui ont été traités en pratique clinique. »
Une analyse intermédiaire ayant porté sur les données de 14 patients tous traités à l’âge de 6 mois ou plus : 4 d’entre eux avaient reçu une thérapie génique en première ligne, alors que les 10 autres étaient passés à l’onasemnogène abéparvovec après avoir été traités par le nusinersen. La plupart de ces 10 patients (80 %) étaient atteints d’AS de type 1. Dans le groupe traité par l’onasemnogène abéparvovec seulement, 25 % des patients étaient atteints du type 1, 25 %, du type 2 et 50 %, du type 3. Les résultats ont été évalués à partir des dossiers médicaux. Aucun des patients n’avait participé à un essai clinique ou au registre RESTORE, une étude observationnelle internationale sur l’onasemnogène abéparvovec assortie d’une période de suivi maximale de 15 ans.
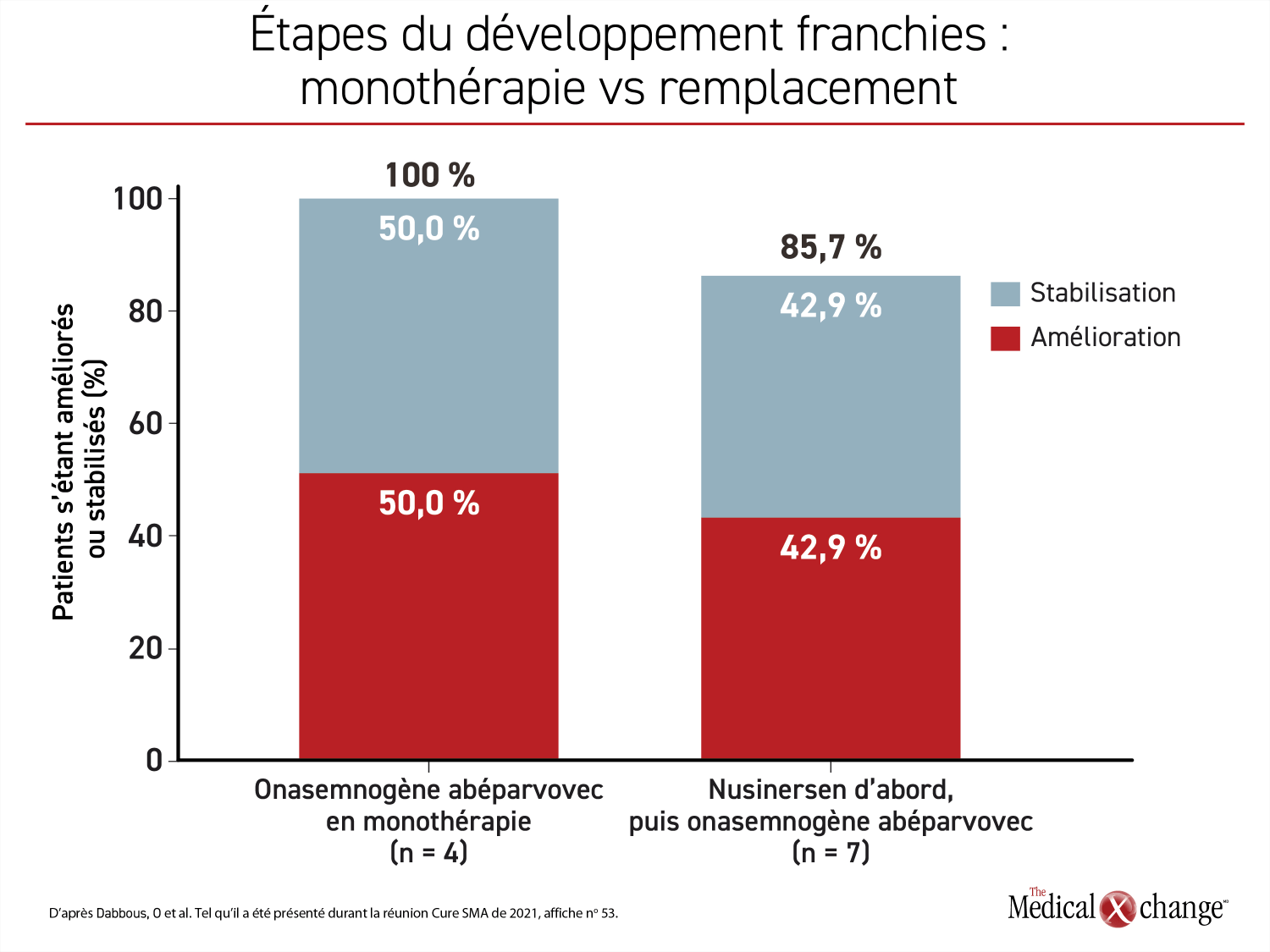
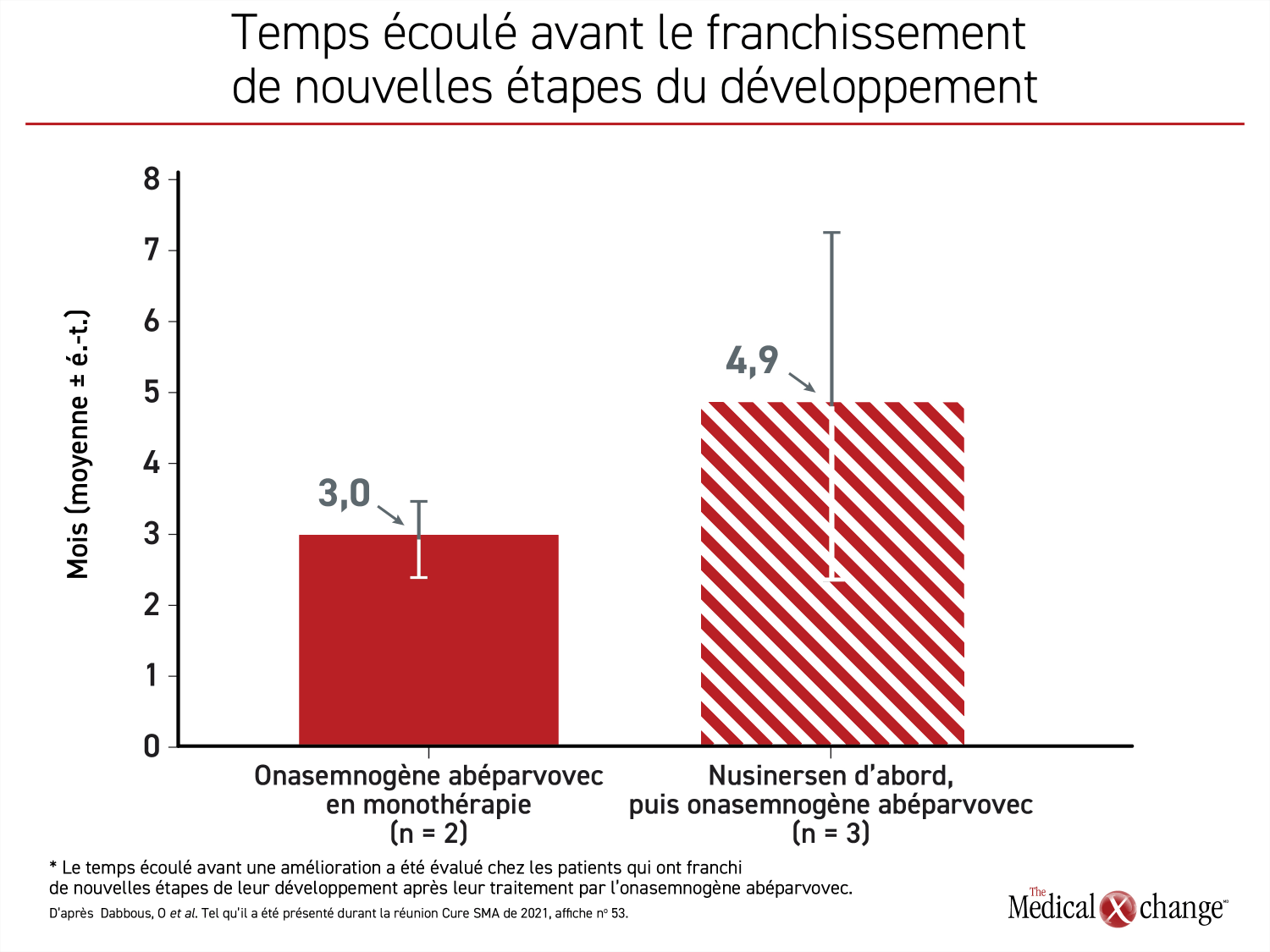
Similaire dans les deux groupes, l’âge moyen des sujets au début du traitement par l’onasemnogène abéparvovec était légèrement supérieur à 17 mois (extrêmes : 9 et 24 mois environ). Les 4 patients ayant reçu l’onasemnogène abéparvovec en monothérapie avaient tous franchi normalement les étapes du développement correspondant à leur âge. Ce renseignement était connu pour 7 des 10 patients d’abord traités par le nusinersen. Or 6 (86 %) d’entre eux ont franchi une nouvelle étape de leur développement, comme se nourrir sans aide ou commencer à parler, après être passés à l’onasemnogène abéparvovec. Cela dit, ces derniers ont mis plus de temps à franchir une nouvelle étape de leur développement que ceux traités d’emblée par l’onasemnogène abéparvovec seulement (4,9 vs 3,0 mois) (Figure 1) (Figure 2).
Amélioration obtenue avec la thérapie génique administrée en première ou en deuxième ligne
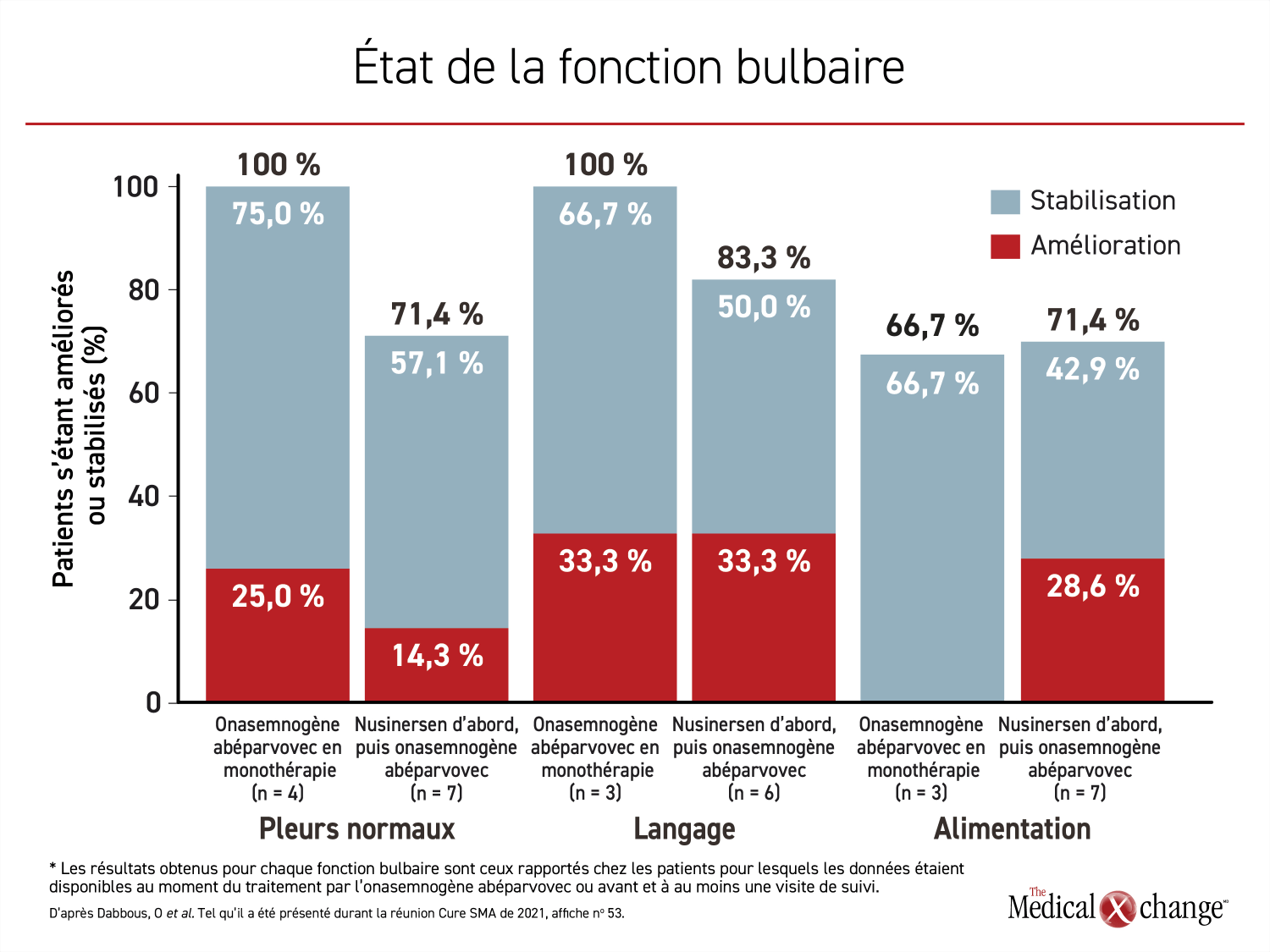
La plupart des fonctions évaluées en lien avec la thérapie de substitution génique se sont améliorées ou stabilisées qu’elle soit administrée en première ou en deuxième ligne. Après l’emploi du nusinersen, elle a permis à 33,3 % des patients d’améliorer leurs aptitudes de langage et à 50 % des patients de les conserver. De plus, la vigueur des pleurs s’est améliorée ou stabilisée chez 14,3 % et 57,1 % des patients, tout comme l’alimentation, chez 28,6 % et 42,9 % des patients, respectivement. Chez les patients traités d’emblée par l’onasemnogène abéparvovec, les pourcentages calculés au moment du suivi pour ces trois fonctions étaient de 100 %, de 100 % et de 66,7 % (Figure 3).
Un rapport favorable entre les risques et les bienfaits du traitement chez les enfants de plus de 6 mois ressort des données issues de la pratique clinique
A aussi été présentée lors de cette réunion une seconde analyse sur la thérapie de substitution génique utilisée en pratique clinique chez 69 enfants plus vieux atteints d’AS inscrits au registre RESTORE et traités pour la première fois après l’âge de 6 mois; la moitié d’entre eux environ ont été traités en 6 et 12 mois et la plupart des autres, entre 12 et 24 mois. Ils étaient majoritairement (65 %) atteints d’AS de type 1. Trente pour cent des patients étaient porteurs de trois copies du gène SMN2, tandis que presque tous les autres en avaient deux.
Parmi ces patients, 22 (31 %) ont reçu seulement de l’onasemnogène abéparvovec en première ligne et 28 (40 %) sont passés à cet agent après avoir été traités par du nusinersen ou du risdiplam, un nouveau modificateur d’épissage de l’ARN pré-messager du gène SMN2 pour voie orale. La plupart des autres ont été traités par un modificateur d’épissage de l’ARN pré-messager du gène SMN2 avant et après l’onasemnogène abéparvovec. Les réponses cliniques ont été mesurées au moyen d’outils d’évaluation des fonctions neurologiques et motrices validés, soit les tests HINE-2 (Hammersmith Infant Neurological Examination) et CHOP INTEND (Children’s Hospital of Philadelphia Infant Test of Neuromuscular Disorders).
L’état de 96 % des patients s’est amélioré selon le score obtenu au test CHOP INTEND
« Sur les 23 patients évalués à au moins deux reprises avec le test CHOP INTEND, 22 (96 %) ont amélioré leur score ou l’ont conservé pendant toute la durée de l’étude », a déclaré le Dr Laurent Servais, du Département de pédiatrie du Centre des maladies neuromusculaires d’Oxford, au R.-U.
Pendant la période de suivi maximale de 2 ans, le score obtenu au test CHOP INTEND a augmenté chez 19 (83 %) des patients, 15 (65 % de l’ensemble des patients) d’entre eux ayant enregistré un gain de 4 points ou plus. Selon le Dr Servais, 4 patients seulement ont été évalués à au moins deux reprises avec le test HINE-2. Un patient a affiché une réponse « marginale », mais les 3 autres ont amélioré leur score.
Dans cette analyse de la pratique clinique, les taux d’effets indésirables étaient semblables chez les enfants traités entre 6 et 12 mois et chez ceux traités plus tard. Bon nombre des effets indésirables, tels que les variations du rythme cardiaque et les hausses de la troponinémie, n’ont pas entraîné de problèmes cardiaques ni d’autres manifestations d’importance sur le plan clinique. Tous les cas d’hépatotoxicité, qui s’est généralement traduite par des hausses des taux d’enzymes hépatiques, mais aussi une insuffisance hépatique aiguë, se sont résorbés après un traitement par la prednisolone. Un décès imputable à un arrêt respiratoire n’a pas été considéré comme lié au traitement. Le Dr Servais a ajouté que des cas de thrombopénie avaient été signalés, mais qu’ils s’étaient tous révélés spontanément résolutifs.
« D’après les données disponibles à ce jour, le rapport entre les risques et les bienfaits de l’onasemnogène abéparvovec reste favorable même chez les patients traités après l’âge de 6 mois », a affirmé le Dr Servais.
« D’après les données disponibles à ce jour, le rapport entre les risques et les bienfaits de l’onasemnogène abéparvovec reste favorable même chez les patients traités après l’âge de 6 mois. »
Poursuite des étapes du développement pendant le suivi à long terme
Les données collectées chez les patients plus vieux atteints d’AS et ceux antérieurement traités viennent s’ajouter à celles recueillies pendant le suivi prolongé du premier groupe de patients jamais traités par l’onasemnogène abéparvovec, de même que chez les participants aux études cliniques ayant mené à son homologation. Le premier groupe, qui forme la cohorte LT-001, est suivi depuis plus de 5 ans, alors que le dernier est suivi dans le cadre de l’étude LT-002. Dans les deux cas, les gains remarquables observés pour les étapes du développement ont été durables.
« Jusqu’à maintenant, aucun des patients n’a régressé », a affirmé le Dr John W. Day, professeur de neurologie, au Centre médical de l’université Stanford, en Californie.
Les bienfaits de la thérapie génique se manifestent habituellement dans les semaines ou les mois après son administration. Le Dr Day a précisé que si certains gains ne sont pas immédiats, une fois qu’ils sont acquis, même tardivement, ils ne se perdent pas. À preuve, le traitement a été administré à un enfant de la cohorte LT-001 déjà affligé d’une grande faiblesse neuromusculaire. Il a pris du mieux lentement, mais a réussi à se tenir debout avec de l’aide après 42 mois environ. Deux années plus tard, il n’a toujours pas régressé.
La réponse à la thérapie génique est solide
« Ce que nous avons constaté jusqu’à aujourd’hui, c’est que la réponse est durable, que l’effet du traitement s’est maintenu aussi longtemps que nous avons suivi les patients, y compris les enfants de l’étude LT-001 dont l’âge peut aller jusqu’à 6,1 ans », a déclaré le Dr Day.
Les sujets des études LT-002, soit les études déterminantes STRIVE et SPR1NT qui ont servi à l’homologation de l’onasemnogène abéparvovec, sont suivis depuis 2,7 ans maintenant. Parlant de deux études, le Dr Day a rapporté que bon nombre des patients continuent de franchir toutes les étapes de leur développement à un âge normal et que jusqu’à maintenant, « aucun n’a régressé ». Résultat : aucun des participants aux études STRIVE et SPR1NT suivis à ce jour n’est sous quelque forme que ce soit de ventilation assistée ni alimenté par sonde.
Parce qu’il fournit un gène SMN1 fonctionnel, l’onasemnogène abéparvovec s’attaque à la déficience sous-jacente de l’AS en éliminant le déficit en protéine SMN responsable de la dégénérescence neuromusculaire. Les traitements axés sur l’épissage de l’ARN pré-messager du gène SMN2 peuvent aussi augmenter les taux de protéine SMN circulants, mais il faut savoir que ce gène est moins efficace que le gène SMN1 pour produire la protéine SMN. Bien que cela reste à prouver, la thérapie génique pourrait avoir des propriétés curatives, alors que les traitements axés sur l’épissage de l’ARN pré-messager du gène SMN2 doivent être administrés indéfiniment. Que le médicament soit administré par voie intrathécale ou orale, ce schéma posologique peut être une contrainte majeure.
Évaluation de la persévérance à l’égard du traitement
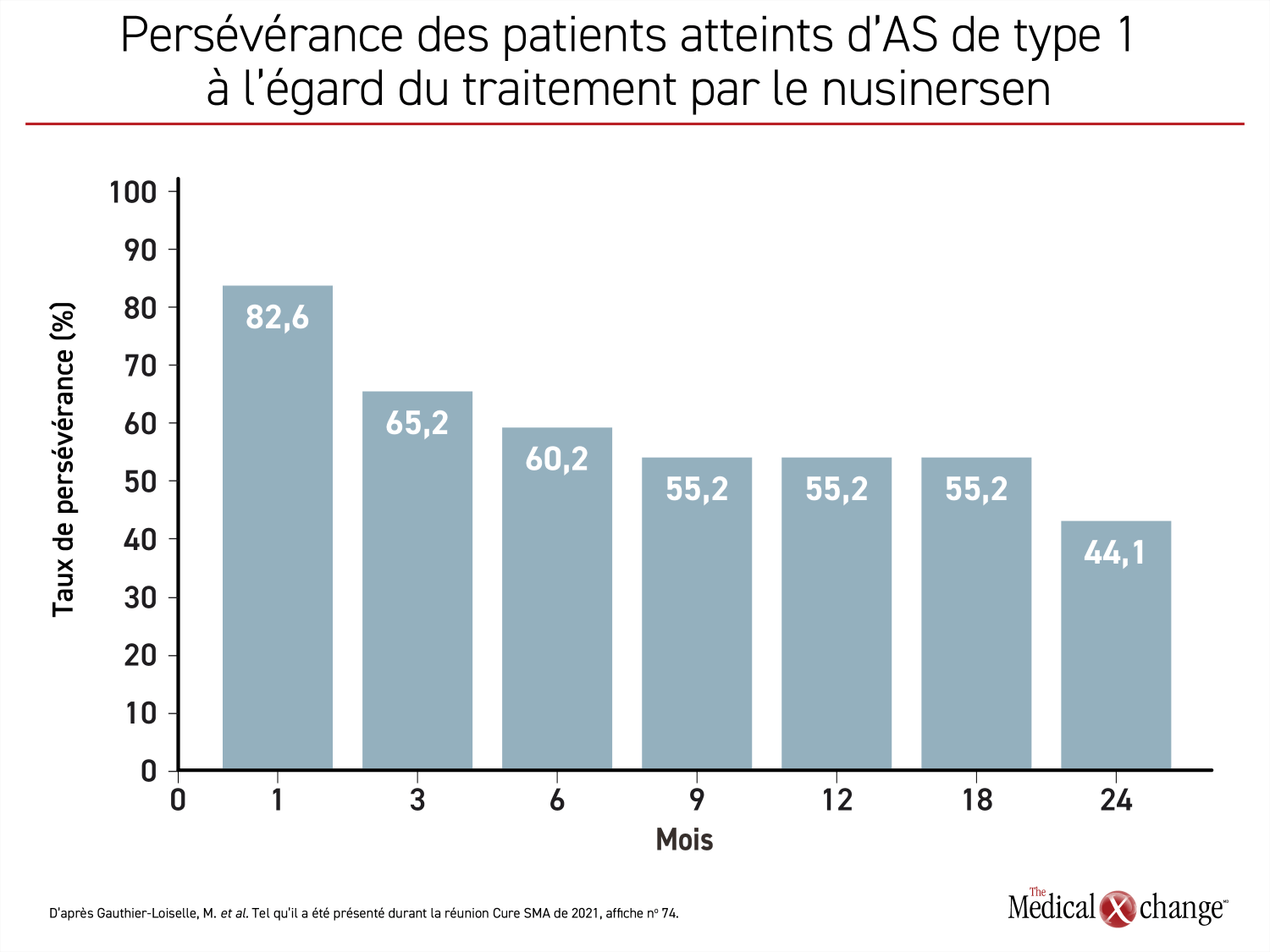
La persévérance à l’égard du traitement par le nusinersen est, semble-t-il, problématique. C’est ce qu’a révélé une étude des données posologiques enregistrées dans la base de données relatives aux soins de santé Symphony Health Integrated Dataverseâ des États-Unis. Elle visait à analyser la persévérance thérapeutique des patients atteints d’AS de type 1, 2 ou 3 traités en pratique clinique. Pendant les 2 années qu’a duré cette étude, moins de la moitié des patients atteints d’AS de type 1, celui dont le pronostic est le plus sombre, ont poursuivi leur traitement par le nusinersen (Figure 4) et 48 % des patients avaient abandonné leur traitement après un délai médian de 18,5 mois. Avoisinant les 60 %, les taux d’abandons étaient encore plus élevés dans les types 2 et 3.
Les patients qui cessent leur traitement par le nusinersen, ce qui se confirme après l’omission de 2 doses consécutives ou plus, « étaient plus exposés aux problèmes qui accompagnent généralement l’AS, tels qu’une difficulté à s’alimenter, de la dyspnée et des anomalies respiratoires, et une faiblesse musculaire », a affirmé la Dre Marjolaine Gauthier-Loiselle, chercheuse et directrice, chez Analysis Group, de Montréal, au Québec. Elle a précisé que la multiplication de ces problèmes a été observée aussi bien dans les cas d’AS de types 2 et 3 que dans ceux de type 1.
Les retards de traitement, définis comme un délai d’au moins 28 jours après la date prévue pour l’administration d’une dose d’entretien par voie intrathécale, ont également été fréquents chez la moitié des patients environ. Il a été impossible d’expliquer ces abandons et ces retards à partir de ces données, mais la Dre Gauthier-Loiselle suppose que « des problèmes logistiques » comme les déplacements vers les établissements de santé pourraient y être pour quelque chose. Elle n’a pas abordé la question à savoir comment les familles perçoivent les désagréments et la douleur causés par l’administration trimestrielle du médicament par voie intrathécale, mais elle a appelé à la prudence en déclarant que « dans cette population de patients, les retards de traitement peuvent se solder par une perte de fonction des motoneurones et l’évolution de la maladie ».
« Dans cette population de patients, les retards de traitement peuvent se solder par une perte de fonction des motoneurones et l’évolution de la maladie. »
Fenêtre temporelle des étapes du développement
Tout indique, y compris l’expérience acquise avec les traitements opposés à l’AS, que beaucoup d’étapes neurologiques doivent être franchies pendant une fenêtre temporelle précise de la petite enfance pour ne pas compromettre le gain de fonction. Après avoir examiné les données des études LT-002, le Dr Kevin A. Straus, directeur médical, de la Clinic for Special Children, de Strasburg, en Pennsylvanie, a rapporté qu’il est possible d’obtenir des effets positifs majeurs sur le plan clinique en amorçant le traitement contre l’AS de type 1 tardivement, mais qu’un traitement instauré dès l’apparition des premiers symptômes ou avant semble offrir les meilleures chances pour que les enfants franchissent les diverses étapes du développement à un âge normal.
« Ce qui ressort le plus des données, c’est qu’il faut traiter les patients le plus tôt possible pour exploiter les bienfaits des traitements de fond », a-t-il ajouté. Et c’est vrai, peu importe le mode d’action du médicament.
« Ce qui ressort le plus des données, c’est qu’il faut traiter les patients le plus tôt possible pour exploiter les bienfaits des traitements de fond. »
Conclusion
Les traitements opposés à l’AS ont été révolutionnaires. Dans les cas d’AS de type 1, une forme inexorablement mortelle de la maladie si elle n’est pas traitée, la plupart des patients traités dans les mois qui suivent leur naissance à l’aide de la thérapie génique ont réussi à franchir les étapes de leur développement à un âge normal après avoir reçu un seul traitement. Les effets positifs de la thérapie génique semblent s’accumuler même chez les patients plus vieux, y compris ceux atteints d’AS de type 2 ou 3, que l’onasemnogène abéparvovec soit le premier ou le deuxième traitement qui leur soit offert. Les traitements reposant sur l’épissage de l’ARN pré-messager du gène SMN2 sont également reliés à des améliorations importantes quand les patients respectent le schéma thérapeutique.