Rhumatologie
EULAR Congrès européen annuel de rhumatologie de 2018
Particularité d’action des inhibiteurs de la JAK contre la polyarthrite rhumatoïde
Amsterdam – Les nouveaux inhibiteurs des Janus kinases (JAK) mettent à l’épreuve la théorie voulant que l’affinité pour la voie de la JAK1 joue un rôle prépondérant dans les bienfaits exercés contre la polyarthrite rhumatoïde (PR). Or ni le tofacitinib, le premier inhibiteur des JAK à avoir été homologué, ni le baricitinib, qui l’a dernièrement été aux États-Unis pour le traitement de la PR, ne sont dotés d’une sélectivité relative marquée pour cette voie. En revanche, deux des agents récents faisant actuellement l’objet d’études cliniques, soit l’upadacitinib et le filgotinib, font preuve d’une affinité bien plus grande pour cette voie que pour les autres isoformes. Pendant le congrès de 2018 de l’EULAR, il a été question du parallèle établi entre des taux élevés d’activité contre la PR chez des patients réagissant très peu aux traitements de fond de synthèse classiques et l’upadacitinib lors d’études de phase III et le filgotinib dans le cadre d’une étude de phase II. Même si les inhibiteurs des JAK n’ont pas encore été comparés les uns aux autres, la précision avec laquelle les JAK sont ciblées pourrait bien faire basculer le rapport entre les bienfaits des agents de cette classe et les risques qu’ils comportent.
La voie de signalisation des JAK : à la recherche de l’intervalle thérapeutique
L’activité exercée par le tofacitinib a fait la démonstration que l’inhibition de la voie de signalisation JAK/STAT est un moyen efficace pour traiter la PR et d’autres maladies inflammatoires. Cela dit, cet agent est doté d’une sélectivité quasi inexistante pour les JAK, ce qui laisse entrevoir la possibilité qu’une plus grande sélectivité exerce des effets relatifs plus marqués. Les quatre protéines JAK, soit la JAK1, la JAK2, la JAK3 et la TYK2, régissent diverses fonctions cellulaires dont l’action sur quelques-unes seulement offrirait des bienfaits cliniques. Dans les cas de PR, c’est la JAK1, qui régule l’expression de l’IL-6 et de l’interféron alpha, qui est la cible putative. À l’inverse, l’inhibition des autres voies des JAK, notamment la JAK2, qui régule l’érythropoïèse, ou la JAK3, qui intervient dans la régulation des cellules NK, pourrait énormément poser problème en nuisant au rapport entre les bienfaits des agents qui en sont responsables et les risques que ces derniers comportent.
« En mettant au point deux médicaments dotés de sélectivité pour la JAK1, les chercheurs tentaient de déterminer l’intervalle thérapeutique, c’est-à-dire la dose permettant d’agir sur la JAK1, mais n’exerçant pas un effet trop prononcé sur les autres JAK », a expliqué le Dr John D. Isaacs, de l’Institut de médecine cellulaire de l’Université de Newcastle, au R.-U. Aucun des inhibiteurs de JAK ayant atteint le stade des études cliniques n’a un effet inhibiteur parfait sur l’une ou l’autre des quatre voies des JAK. Les effets relatifs qu’ils exercent sur chacune d’elles donnent plutôt lieu à des rapports bienfaits-risques très différents.
Selon le Dr Isaacs, il faut absolument recueillir des données cliniques parce que les caractéristiques thérapeutiques d’un agent ne se définissent pas uniquement par son activité sur une des voies des JAK ou sur son manque d’activité sur une autre ». Les autres facteurs propres à chaque inhibiteur des voies des JAK ont également leur importance.
Les caractéristiques pharmacocinétiques influencent l’activité d’un médicament
« Je ne parle pas uniquement de l’activité relative sur les différentes enzymes JAK, ou ce qu’on appelle la sélectivité, mais plutôt de la concentration intracellulaire, étant donné que l’aptitude d’une molécule à pénétrer dans les cellules dépend de ses caractéristiques pharmacocinétiques. La concentration est un facteur important dans l’inhibition de l’enzyme JAK ciblée, mais un inhibiteur de JAK peut devenir moins sélectif s’il pénètre dans la cellule à une concentration extrêmement élevée », a expliqué le Dr Isaacs.
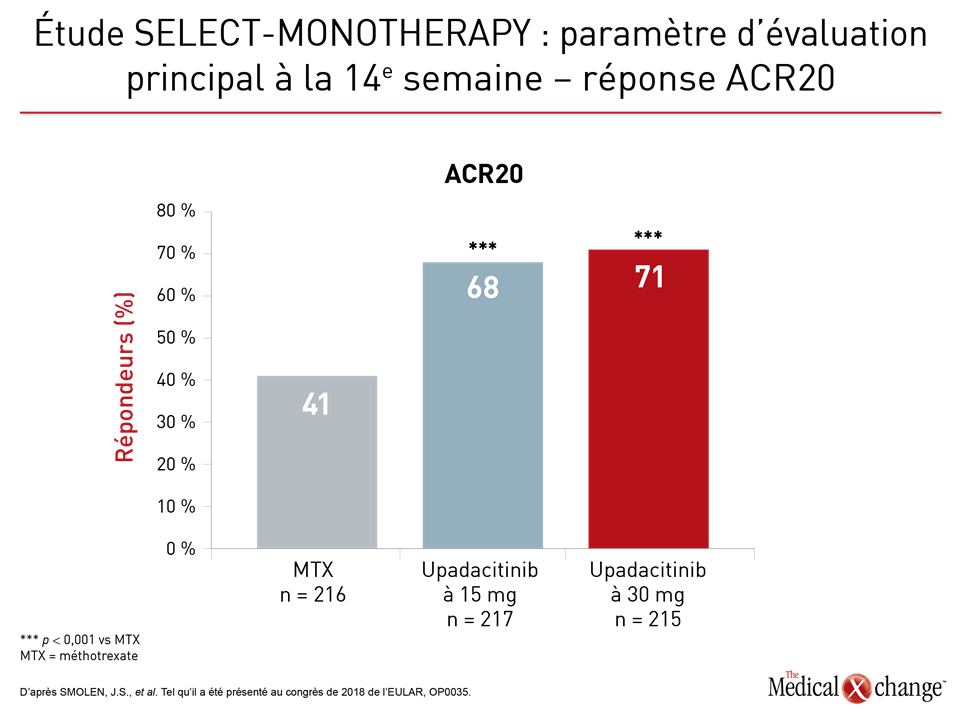
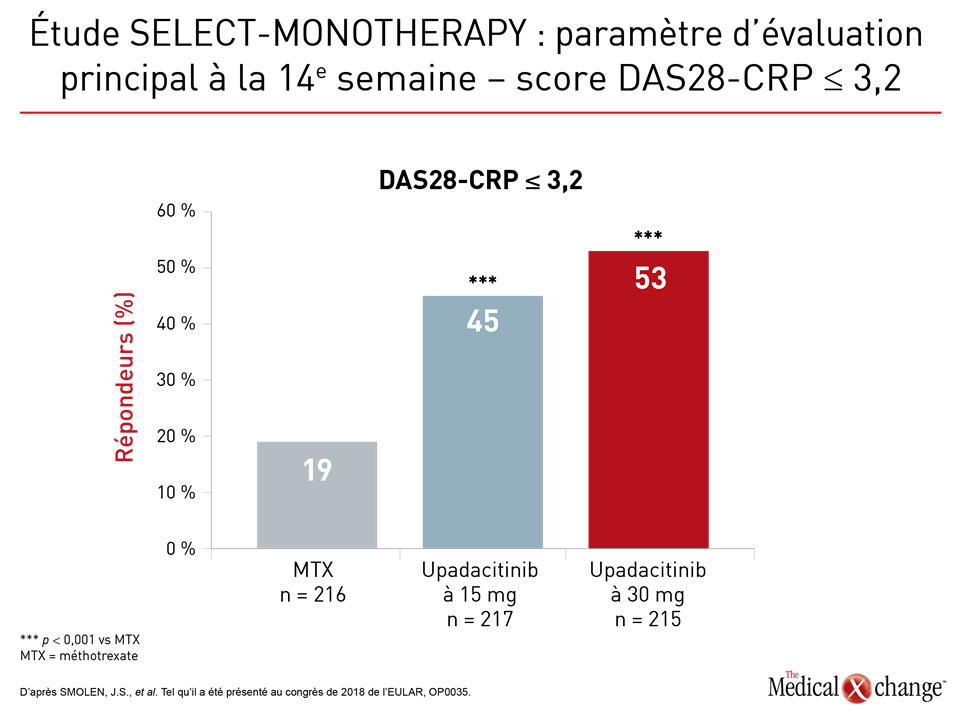
Plusieurs séries de données issues d’études de phase III sur l’upadacitinib ont été présentées au congrès de l’EULAR de cette année. Lors de l’étude SELECT-MONOTHERAPY, 648 patients ont été recrutés. Ils avaient tous réagi de façon insuffisante à au moins un traitement de fond de synthèse classique et continuaient à éprouver des symptômes de PR modérés ou graves malgré un traitement par le méthotrexate (MTX). Ils ont été affectés aléatoirement à un traitement uniquotidien reposant sur l’administration de 15 mg d’upadacitinib ou de 30 mg d’upadacitinib, ou poursuivaient leur traitement par le méthotrexate. Cette étude visait essentiellement à déterminer la proportion de patients montrant une atténuation de l’évolution de leur maladie confirmée par leur réponse ACR20 ou un score d’activité pathologique 28 mesuré au moyen de la protéine C-réactive (DAS28-CRP) de 3,2 ou moins (Figures 1a and 1b).
L’upadacitinib s’est révélé beaucoup plus avantageux que le méthotrexate, et la différence entre les deux agents était extrêmement significative, peu importe le critère de mesure utilisé. En outre, l’upadacitinib l’a significativement emporté sur le méthotrexate pour tous les principaux paramètres d’évaluation secondaires, notamment la réponse ACR50, la réponse ACR70, le résultat obtenu au questionnaire d’évaluation de l’état de santé sans invalidité (HAQ-DI) et la durée des raideurs matinales.
Un taux de rémission frôlant les 20 % à la 14e semaine
Le Dr Josef Smolen, du Département de rhumatologie, de l’Université de Vienne, en Autriche, a rapporté qu’à la 14e semaine, 14 % et 18 % des patients affectés aux doses de 15 mg et de 30 mg d’upadacitinib étaient en rémission clinique qui, par définition, devait correspondre à un indice SDAI (Simplified Disease Activity Index) de 3,3 ou moins, comparativement à 1 % des patients traités par le méthotrexate. Si un critère de mesure de 2,6 au maximum était utilisé pour le score DAS-CRP, ces taux de rémission passaient alors à 28 %, 41 % et 8 %, respectivement.
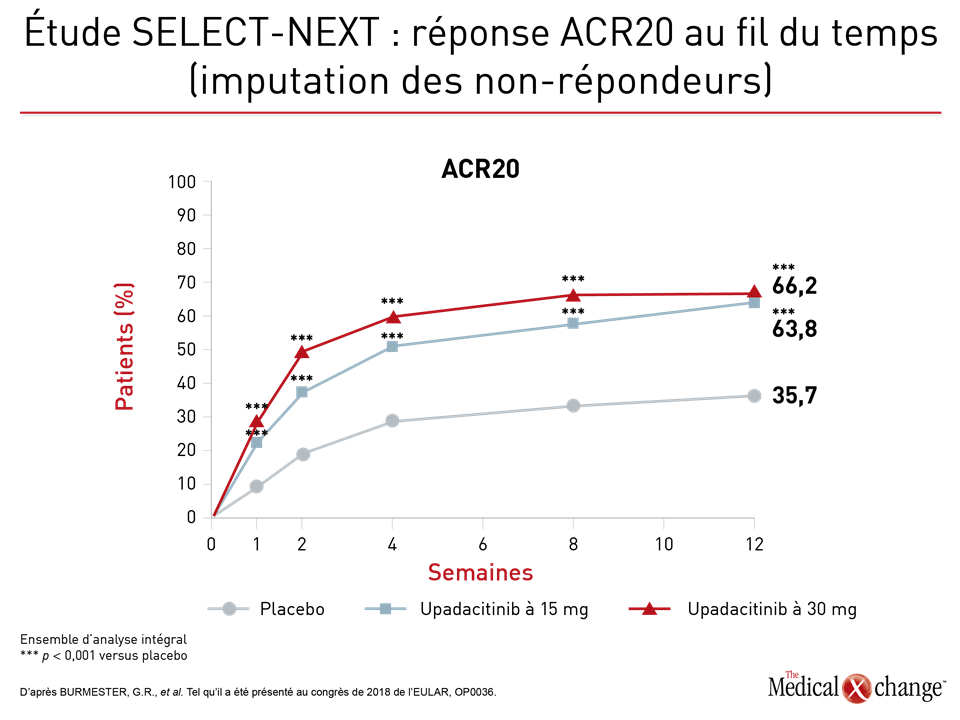
Des taux de réponse et de rémission d’une ampleur similaire ont aussi été obtenus rapidement dans le cadre de l’étude de phase III intitulée SELECT-NEXT. Les 661 patients y ayant participé, qui avaient aussi des antécédents de réponse insatisfaisante à leur traitement de fond de synthèse classique, ont été répartis aléatoirement de façon à recevoir 15 mg d’upadacitinib, 30 mg d’upadacitinib ou un placebo. Il leur était permis de continuer à prendre leur traitement de fond de synthèse classique. Selon les données présentées pendant le congrès de 2018 de l’EULAR, les taux de réponse ACR20 enregistrés à la 12e semaine chez les sujets traités par la dose de 15 mg d’upadacitinib (64 %) et de 30 mg d’upadacitinib (66 %) correspondaient à près du double de ceux calculés pour le placebo (36 %; p < 0,001 versus l’une ou l’autre des doses d’upadacitinib).
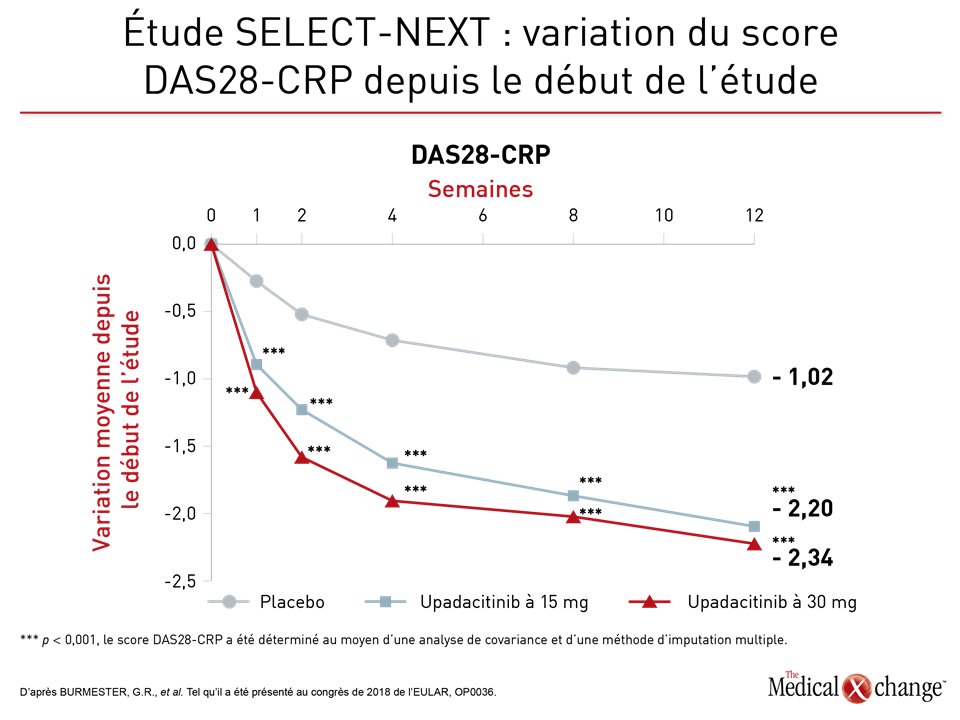
Qui plus est, selon le Dr Gerd R. Burmester, du Département de rhumatologie et d’immunologie clinique de la Clinique universitaire de la Charité, à Berlin, en Allemagne, la réponse des patients au traitement s’est manifestée rapidement, à preuve, les graphiques qu’il a présenté et qui rendent compte d’une maîtrise de la maladie à la fois considérable et significative sur le plan statistique dans la semaine ayant suivi le début du traitement (Figures 2a and 2b).
Le Dr Burmester a ajouté que comme ce fut le cas pendant l’étude SELECT-MONOTHERAPY, le médicament a agi rapidement, d’où les taux de maîtrise et de rémission de la maladie très élevés enregistrés à la fin de l’étude SELECT-NEXT. Pour ce qui est de la rémission, définie par un indice SDAI de 3,3 au maximum, le taux calculé à 12 semaines est passé de 3 % dans le groupe témoin à 10 % (p < 0,01) dans le groupe traité par l’upadacitinib à 15 mg et à 12 % dans celui ayant reçu la dose de 30 mg d’upadacitinib (p < 0,001); il était donc de trois à quatre fois plus élevé. Quant au score DAS28-CRP (moins de 2,6), les taux obtenus à 12 semaines se chiffraient à 10 %, à 31 % et à 28 % (p < 0,001dans les deux cas versus le placebo), respectivement.
Une innocuité qui se confirme grâce aux données de plus en plus abondantes
Les effets indésirables rapportés lors de cette étude ainsi que d’une autre, de phase III et dont les données actualisées ont été présentées pendant le congrès, l’étude SELECT-BEYOND, correspondaient à ceux répertoriés dans le cadre des études de phase II. Les effets indésirables graves tous types confondus et ceux ayant motivé l’abandon du traitement ne se sont pas révélés systématiquement plus fréquents avec l’une ou l’autre des doses d’upadacitinib qu’avec le placebo. Pendant l’étude SELECT-NEXT, par exemple, 2,3 % des témoins et 2,7 % de ceux traités par l’upadacitinib à 30 mg ont éprouvé des effets indésirables sérieux. Ces derniers ont touché 4,1 % des sujets prenant de l’upadacitinib à 15 mg, mais ont motivé l’abandon du traitement chez 3,2 % d’entre eux, soit un pourcentage identique à celui observé chez les témoins.
Une réponse au traitement rapide
Selon les données actualisées de l’étude SELECT-BEYOND, au cours de laquelle 499 patients ayant montré une réponse insatisfaisante à un traitement de fond biologique ont été répartis aléatoirement de façon à recevoir de l’upadacitinib ou un placebo, la vitesse avec laquelle les patients ont répondu à l’upadacitinib a, dans ce cas-ci également, attiré l’attention du chercheur principal, le Dr Mark C. Genovese, de la Division d’immunologie et de rhumatologie, de l’Université Stanford, en Californie.
Dès la première semaine, la proportion de patients ayant obtenu une réponse ACR20 chez les patients traités par l’upadacitinib à 15 ou à 30 mg correspondait à plus du double de celle observée chez les témoins.
« Dès la première semaine, la proportion de patients ayant obtenu une réponse ACR20 chez les patients traités par l’upadacitinib à 15 ou à 30 mg (27,4 % et 24,8 %, respectivement) correspondait à plus du double de celle observée chez les témoins (10,7 %; p < 0,001) », a rapporté le Dr Genovese. Il a ajouté que cette rapidité d’action constitue un avantage particulièrement appréciable aux yeux des patients dont les symptômes persistent malgré l’utilisation de traitements de fond classiques ou biologiques.
Une réponse soutenue et durable
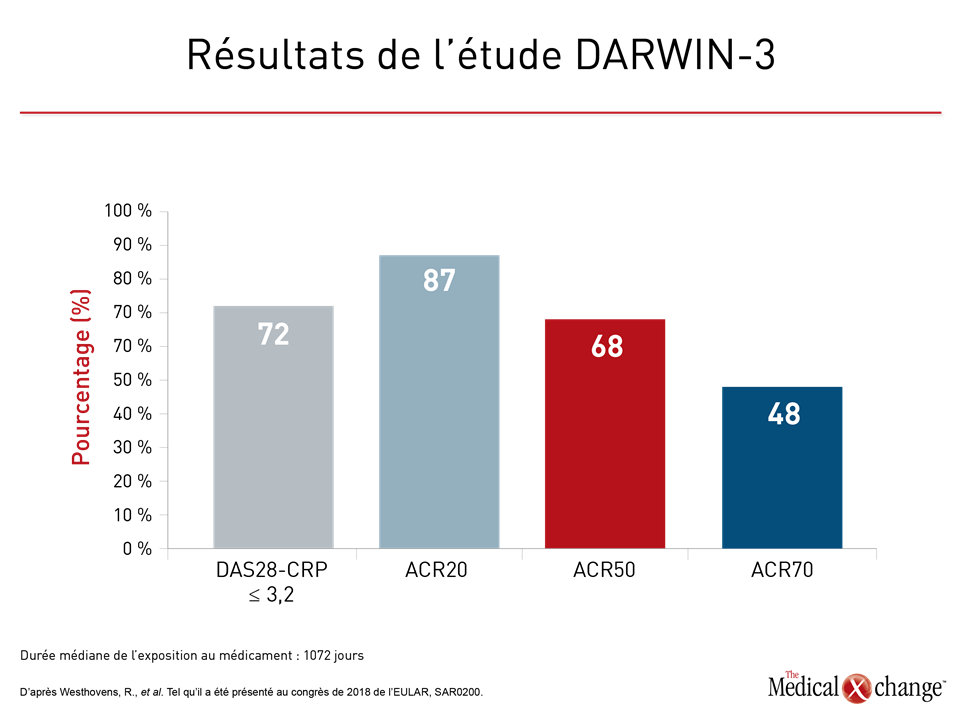
Certes, les études sur le filgotinib ne sont pas aussi avancées, mais une étude ouverte de prolongation de phase IIb au programme clinique DARWIN est également venue confirmer l’intérêt de poursuivre l’essai de cet inhibiteur de JAK. Bien que l’innocuité de cet agent ait été l’objet principal de cette étude de prolongation, intitulée DARWIN-3 et qui a été présentée dans le cadre du congrès de 2018 de l’EULAR, il n’empêche que la constance de son activité a été impressionnante. Au terme d’un traitement de 1072 jours (durée médiane), les taux de réponse objectivée à la dernière visite de suivi, qu’elle ait été mesurée d’après les paramètres ACR20, ACR50, ACR70 ou DAS28-CRP (3,2 au maximum), s’étaient maintenus selon le Dr René Westhovens, professeur de rhumatologie, à l’Université de Louvain en Belgique (Figure 3).
« Nous pouvons aussi affirmer que le filgotinib reste bien toléré pendant de longues périodes d’exposition », a ajouté le Dr Westhovens, qui n’a relevé aucun nouveau signe préoccupant en matière d’innocuité au terme d’une exposition au médicament de 1931 années-patients. Il également mentionné avoir remarqué que le filgotinib commence à agir rapidement, cet avantage potentiel ayant possiblement un lien avec son affinité relativement forte pour la JAK1.
La sélectivité du tofacitinib pour la JAK1 évaluée au moyen d’épreuves enzymatiques et exprimée sous forme de concentration inhibitrice à 50 % in vitro (CI50) est de 15,1 nM, mais des concentrations relativement faibles sont aussi nécessaires pour inhiber la JAK2 (77,4 nM) et la JAK3 (55 nM). De même, la CI50 du baricitinib est de 4,0, mais celle pour la JAK2 n’est que de 6,6 nM. Cela leur confère une sélectivité relativement faible pour les voies de la JAK1 et de la JAK2. En revanche, bien que la CI50 de l’upadacitinib soit de 47 nM pour la JAK1, elle grimpe à 120 nM pour la JAK2 et à 2304 nM pour la JAK3. Le filgotinib est assorti de la CI50 la plus élevée pour la JAK1, soit 363 nM, mais celle pour la JAK2 est de 2400 nM et dépasse les 10 000 nM pour la JAK3, ce qui signifie que cet agent, à l’instar de l’upadacitinib, est doté d’une sélectivité relative pour la JAK1, peu importe la dose utilisée.
Sa sélectivité en situation clinique
On ignore quel peut être l’intérêt de cette sélectivité variable en regard des bienfaits ou des risques cliniques. Qui plus est, le Dr Isaacs, qui a passé en revue ces données lors d’un symposium tenu pendant le congrès de 2018 de l’EULAR, a prévenu les participants que la sélectivité observée in vitro ne peut être prise en compte isolément. Des corrélations ont certes été observées en situation expérimentale entre la sélectivité pour les JAK et une activité clinique théorique, telle que l’inhibition de la JAK1 et celle de l’IL-6, une cytokine, mais elles sont imparfaites.
« Les effets de ces agents sont tributaires de l’ampleur de l’exposition à ces derniers et ils dictent leur sélectivité relative pour les quatre isoformes des enzymes JAK, mais c’est l’expérience clinique qui déterminera l’intérêt que peut présenter la différence de sélectivité d’un inhibiteur de JAK à l’autre sur le plan clinique », a-t-il précisé. Il a qualifié les études « d’instructives », mais a appelé à la prudence en mentionnant que les « données laissent entrevoir certains paradoxes », d’où la nécessité d’acquérir une expérience clinique pour confirmer leur utilité.
« Des données probantes indiquent que l’inhibition sélective de la JAK1 pourrait permettre d’optimiser l’efficacité du traitement, sans exercer un effet négatif important sur les paramètres dont la médiation est assurée par les autres isoformes », a affirmé le Dr Isaacs.
De plus, il reste à découvrir lesquels parmi les divers aspects de la sélectivité pour les JAK auront de l’importance au chapitre des effets cliniques. Après avoir analysé l’expérience clinique acquise avec chacun des quatre inhibiteurs de JAK commercialisés ou encore au stade des études cliniques, la Dre Andrea Rubbert-Roth, médecin principal à la Clinique de médecine interne, de l’Université de Cologne, en Allemagne, a fait valoir qu’en l’absence d’études comparatives, nous disposons de peu de données probantes faisant état de différences majeures en matière d’efficacité et d’innocuité entre les divers agents. Cela dit, elle a elle aussi parlé de la rapidité d’action des agents dotés d’une plus grande sélectivité.
« Fait impressionnant – et je peux en témoigner ayant moi-même participé aux études cliniques – les patients affichent une réponse importante au bout d’une semaine à peine. »
« Fait impressionnant – et je peux en témoigner ayant moi-même participé aux études cliniques – les patients affichent une réponse importante au bout d’une semaine à peine, a déclaré la Dre Rubbert-Roth, faisant particulièrement référence à l’upadacitinib. C’est frappant. Quand vous revoyez vos patients une semaine plus tard, vous ne vous attendez pas vraiment à voir une énorme différence, mais quand j’entends mes patients me dire que l’enflure a diminué et que la douleur s’est atténuée après si peu de temps, c’est vraiment encourageant ».
Conclusion
La notion de la sélectivité des inhibiteurs de JAK gagne en importance maintenant que commencent à être employés en pratique clinique les nouveaux agents de cette classe, dont les effets sont concentrés sur la JAK1. Jusqu’à aujourd’hui, les données issues des études de phase III ayant porté sur l’upadacitinib et celles de l’étude de phase II sur le filgotinib laissent entrevoir une efficacité et une innocuité à tout le moins du même ordre que celles du tofacitinib, le premier agent de cette classe. Même si la Dre Rubbert-Roth a qualifié les inhibiteurs de JAK de « traitements pour voie orale ayant un effet biologique », l’intervalle thérapeutique plus favorable que pourraient offrir les nouveaux inhibiteurs faisant preuve d’une plus grande sélectivité pour les JAK pourrait bien faire faire un bond en avant à ces agents dans l’algorithme de traitement.