Revue d’experts
Bien utiliser les anticoagulants pour prévenir les AVC dans les cas de fibrillation auriculaire
3e chapitre : Considérations d’ordre pratique à propos de la prévention de l’AVC à l’aide d’anticoagulants à prise orale
Ashkan Shoamanesh, M.D.
Professeur agrégé, Division de neurologie
Université McMaster
Hamilton (Ontario)
Bien souvent, les anticoagulants à prise orale qui ne sont pas des antagonistes de la vitamine K (NACO) ne sont pas utilisés aux doses recommandées ou adaptées à la prévention des AVC dans les cas de fibrillation auriculaire (FA). Attribuée à l’appréhension des cliniciens envers les saignements, cette situation porte à croire qu’ils n’ont pas saisi tout le potentiel de ces agents pour réduire le risque chez ces patients, le rapport entre les avantages et les risques de la prévention des AVC étant favorable chez presque tous. Lors des essais déterminants, les quatre NACO offerts ont fait preuve d’une efficacité similaire ou supérieure à celle de la warfarine. Pour choisir un NACO et en fixer la dose, il faut tenir compte chez certains patients des légères différences d’innocuité entre ces agents et la warfarine, et entre chacun d’eux pour ce qui est de la pharmacocinétique. En reconnaissant l’importance de l’anticoagulation chez les patients atteints de FA et celle des fondements d’un traitement bien adapté, nous aurons une excellente occasion d’atténuer une cause importante de morbidité et de décès au Canada.
Simplifier le choix d’un NACO pour la prévention de l’AVC
L’anticoagulothérapie est un moyen efficace pour réduire le risque d’AVC et d’autres incidents thromboemboliques posé par la FA, mais elle s’accompagne d’un risque de saignement. Dans les cas où elle est indiquée, les gains qu’elle permet de réaliser en raréfiant les AVC ischémiques mortels ou possiblement invalidants l’emportent généralement, et de beaucoup, sur le risque d’hémorragie cérébrale (HC) ou d’hémorragie majeure. Les cliniciens doivent mettre ces issues opposées en parallèle pour que la peur d’une HC ou d’une hémorragie grave iatrogène ne prive pas leurs patients des doses d’anticoagulants qui permettraient de prévenir un AVC, ce qui est bien plus important.
Au moment de calculer le risque, la seule utilisation des scores attribués aux saignements comme ceux obtenus sur les échelles HAS-BLED ou HEMORR2HAGES ne donne qu’un côté de la médaille, puisque ces scores, ceux attribués au risque de thromboembolie (CHADS2 ou CHA2DS2-VASc) et le risque absolu d’incident ischémique ont tendance à être colinéaires. L’ampleur des avantages tirés de l’anticoagulothérapie l’emporte généralement sur la hausse du risque absolu d’incidents hémorragiques chez les patients jugés très vulnérables aux saignements. Il est regrettable que les registres nationaux continuent de témoigner de la sous-utilisation des anticoagulants. Dans le registre PINNACLE, un projet de qualité commandité par l’American College of Cardiology, seulement 45 % des patients atteints de FA ne présentant pourtant aucune contre-indication à ces agents suivaient une anticoagulothérapie convenable1.
Le risque d’AVC lié à la FA, tout comme le risque de FA elle-même, augmente avec l’âge2,3. Même si le risque d’hémorragie majeure, dont l’HC, augmente aussi avec l’âge, le rapport entre les bienfaits et les risques de la prévention des AVC reste favorable dans toutes les tranches d’âge de patients atteints de FA4. Une étude rétrospective ayant porté sur des nonagénaires a fait ressortir un gain clinique net, que la warfarine à prise orale soit comparée à l’abstention thérapeutique ou à l’AAS5, mais les NACO ont été reliés à un risque d’HC plus bas que celui de la warfarine dans cette population très âgée, d’où un gain clinique net encore plus marqué.
Dans les principales lignes directrices, la prévention des AVC chez les patients atteints de FA n’est frappée d’aucune restriction liée à l’âge. Or on ne compte plus les séries de données indiquant que l’anticoagulothérapie orale est refusée aux patients âgés ou leur est prescrite à des doses trop basses alors qu’elle serait tout à fait indiquée6,7. Une étude a révélé que la proportion de patients atteints de FA prenant un anticoagulant à prise orale à leur départ de l’hôpital chutait peu à peu à chaque décennie d’âge, passant de 75 % chez ceux de moins de 70 ans à 24 % chez ceux de 90 ans ou plus8. Questionnés sur les raisons expliquant ces freins à l’anticoagulothérapie, les cliniciens prescripteurs ont surtout invoqué le risque d’hémorragie.
Les AVC liés à la FA risquant plus de provoquer une invalidité et le décès que les hémorragies majeures, les avantages relatifs de l’anticoagulothérapie orale sont au moins aussi grands, voire plus grands, chez les personnes âgées que chez leurs cadets9. Lors des essais cliniques d’envergure ayant porté sur l’anticoagulothérapie orale chez des patients atteints de FA, le gain net, soit la raréfaction des AVC après prise en compte de la moindre hausse du risque de saignement, a été calculé avec des doses thérapeutiques complètes10. Hormis quelques exceptions, comme les patients affligés d’une insuffisance rénale grave qui étaient écartés des essais à répartition aléatoire déterminants, les doses recommandées dans les lignes directrices conviennent à tous les patients exposés à un AVC lié à la FA.
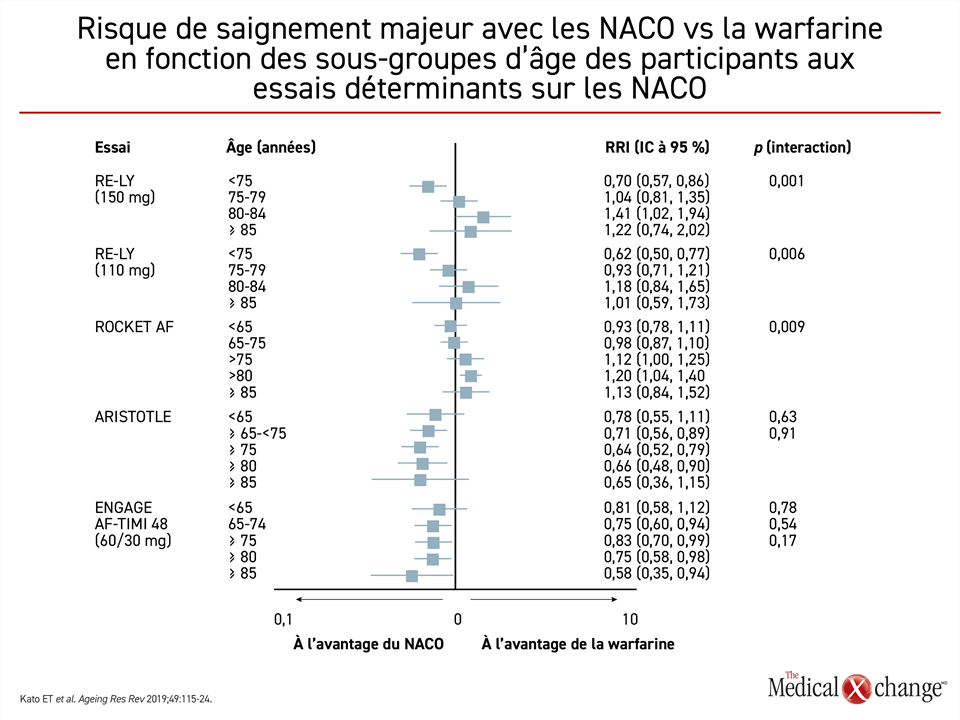
La warfarine est un anticoagulant à prise orale acceptable pour prévenir les AVC chez les patients atteints de FA, mais les NACO sont les agents pour voie orale privilégiés dans les principales lignes directrices pour les raisons suivantes : ils sont plus pratiques, ils sont aussi efficaces sinon plus pour prévenir les AVC, ils réduisent de moitié le risque d’HC et ils sont assortis d’un risque de saignement majeur semblable, voire inférieur11-13. Certaines données probantes indiquent que l’avantage des NACO en matière d’innocuité pourrait s’amplifier avec l’âge des patients. Lors des essais ARISTOTLE et ENGAGE AF-TIMI 48 sur l’apixaban et l’édoxaban14,15, les taux de saignements enregistrés avec les NACO ont eu tendance à être plus bas que ceux obtenus avec la warfarine chaque fois que l’âge des patients augmentait de 5 ans10 (Fig. 1). Dans une analyse de ce lien prévue au protocole de l’essai ENGAGE AF-TIMI 48, la baisse du risque d’hémorragie majeure s’est traduite par un gain clinique net plus prononcé chez les patients de 75 ans et plus que chez les plus jeunes16.
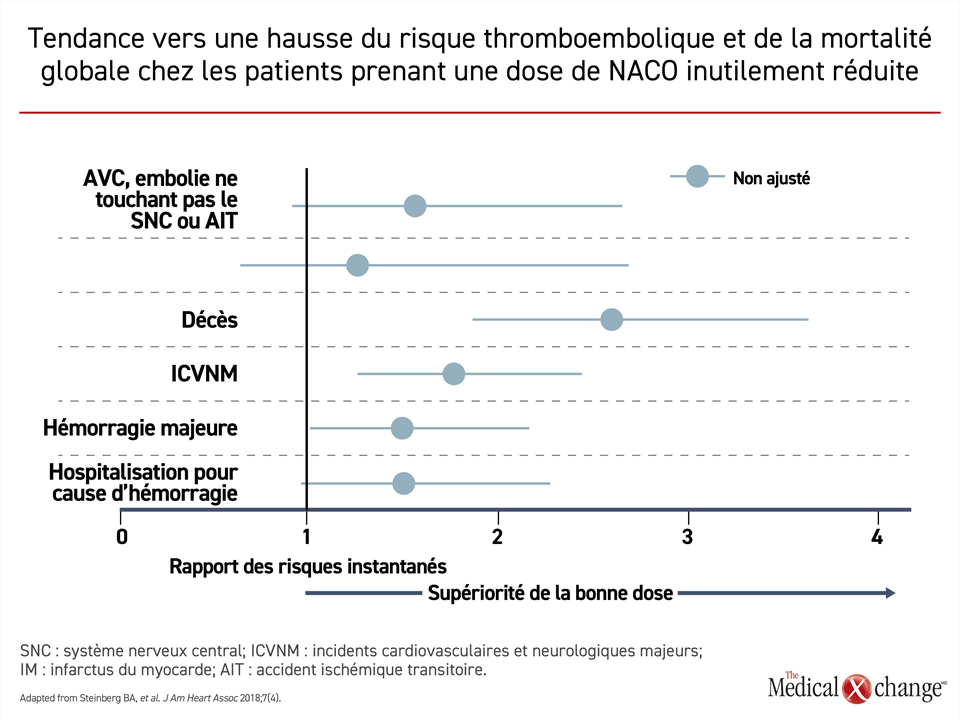
Le fait que les patients âgés atteints de FA tirent généralement un plus grand gain clinique net d’une anticoagulothérapie orale que leurs cadets ne doit pas faire renoncer aux efforts déployés pour minimiser le risque de saignement, quel que soit l’âge des patients. Il convient de tenir compte des facteurs de risque modifiables et de les corriger, notamment une hypertension mal maîtrisée, l’abus d’alcool, une propension aux chutes et l’usage inutile de médicaments associés à un risque accru de saignement, et de repérer les causes d’anémie et de les traiter13. Cela dit, la présence de facteurs de risque de saignement, tels qu’un âge avancé, n’interdit pas le recours à des doses complètes d’anticoagulants à prise orale dans les cas de FA pour lesquels la prévention d’un AVC est indiquée. Lors de l’essai ORBIT II, 1289 (16 %) des 7925 patients évalués prenaient des doses de NACO qui ont été jugées réduites sans raison valable17. Après avoir comparé ces patients à ceux ayant pris une dose type, les chercheurs ont constaté que leur risque de décès était beaucoup plus élevé, la différence étant extrêmement significative (Fig. 2).
On croit souvent, à tort, que la prévention des AVC doit être adaptée à l’âge et à la vulnérabilité des patients aux saignements. Des études d’observation ont maintes fois permis de constater que beaucoup de patients atteints de FA âgés, affligés de maladies concomitantes ou vus comme plus exposés aux saignements ne prennent pas la bonne dose d’anticoagulant à prise orale ou n’en prennent pas du tout18. L’étude GARFIELD-AF a établi que des antécédents de saignement permettaient de prédire une anticoagulothérapie inadaptée chez les patients atteints de FA19. Or les lignes directrices sont fondées en partie sur les données de cette étude. Dans les cas où une anticoagulothérapie était indiquée, le risque d’hémorragie majeure était plus faible et non pas plus élevé chez les patients privés de ce traitement (0,5 % vs 0,8 %; p < 0,001; peut-être en raison d’un biais d’indication plutôt que d’un effet du traitement), alors que le risque d’AVC (1,6 % vs 1,1 %; p < 0,001) et le risque de décès toutes causes confondues (5,3 % vs 3,9 %; p < 0,001) étaient significativement plus grands. Une étude cas-témoins multicentrique a révélé que l’utilisation d’une dose inadaptée de NACO ou plus faible que celle recommandée dans la monographie était l’un des facteurs de risque les plus puissants d’AVC, puisqu’elle multiplie ce risque ajusté par 3,5 environ20. La réduction injustifiée de la dose de NACO ne fait qu’augmenter le risque de thromboembolie, sans pour autant raréfier les manifestations hémorragiques21.
De même, l’anticoagulothérapie a soulevé certaines inquiétudes chez les patients atteints de FA victimes d’un AVC ischémique et ayant montré des signes de microsaignements cérébraux occultes, c’est-à-dire des lésions intraparenchymateuses arrondies, de moins de 10 mm de diamètre, surchargées d’hémosidérine et visibles sur les séquences d’imagerie par résonnance magnétique ayant une bonne sensibilité pour les anomalies sanguines. Les microsaignements sont le plus souvent le signe d’une microangiopathie cérébrale liée à l’âge chez les patients atteints de FA, notamment une artériopathie hypertensive ou une angiopathie amyloïde. En pareil contexte, ils sont associés à une hausse du risque d’HC, mais aussi à un risque accru d’AVC ischémique22. Dans le même ordre d’idée, les taux absolus d’AVC ischémique éclipsent, et de beaucoup, ceux de l’HC chez les patients victimes d’un AVC ischémique affichant des microsaignements à l’IRM, peu importe leur gravité. Il ne faut donc pas priver ces patients d’une anticoagulothérapie si elle est indiquée chez eux22,23.
Quant aux patients de plus de 65 ans qui sont atteints de FA et qui présentent un autre facteur de risque d’AVC, comme l’hypertension ou le diabète, les éventuels bienfaits de l’anticoagulothérapie restent à préciser dans certains contextes particuliers, notamment chez les patients ayant des antécédents d’HC, puisqu’ils ont été écartés des essais à répartition aléatoire menés sur l’emploi de ce traitement dans la FA. Or selon des méta-analyses de données d’observation, l’anticoagulothérapie réduirait les décès toutes causes confondues et permettrait d’obtenir des gains nets, même dans ce sous-groupe de patients très vulnérables, y compris chez les patients victimes d’une hémorragie cérébrale lobaire chez lesquels l’incidence à long terme d’une nouvelle HC est la plus élevée24,25. Fait intéressant, le risque d’AVC ischémique se chiffrerait entre 10 et 13 % par année chez les patients ayant déjà fait une hémorragie cérébrale et ne suivant pas d’anticoagulothérapie26,27.
Dans un algorithme proposé dans le cadre d’une revue récente, il est recommandé d’amorcer un traitement par des NACO au moins quatre semaines après que les clichés d’imagerie aient confirmé la résorption de l’HC, et ce malgré l’absence d’un essai de phase III à répartition aléatoire28. Pendant l’essai canadien NASPAF-ICH (non publié) mené chez 30 patients atteints de FA ayant déjà fait une hémorragie cérébrale et répartis aléatoirement de façon à prendre une dose type d’un NACO ou 81 mg d’AAS par jour, un seul sujet a fait un AVC ischémique pendant la période de suivi moyenne de 1,53 année; il faisait partie du groupe AAS. Par ailleurs, aucun des sujets des deux groupes n’a été affligé d’une nouvelle hémorragie cérébrale. Tous les sujets surveillaient étroitement leur pression artérielle à domicile afin de s’assurer qu’elle reste inférieure à 130/80 mmHg, condition sine qua non pour envisager d’amorcer ou de réamorcer une anticoagulothérapie dans cette population, puisqu’elle peut réduire de moitié le risque de récidive d’une hémorragie cérébrale.
Ces premiers résultats sont étudiés de plus près dans le cadre d’essais à répartition aléatoire. Le plus important, l’essai international de phase III ENRICH-AF, est mené chez des patients atteints de FA ayant obtenu un score minimal de 2 sur l’échelle CHA2DS2-VASc et ayant des antécédents d’HC qui, après répartition aléatoire, suivront un traitement par de l’édoxaban ou un traitement témoin30. Les témoins ne recevront pas d’antithrombotique ou d’antiplaquettaire en monothérapie, la décision étant laissée au clinicien traitant. La dose d’édoxaban à l’étude est de 60 mg, mais une dose de 30 mg sera administrée aux patients répondant aux critères justifiant son utilisation, conformément aux critères de l’essai ENGAGE AF-TIMI 48 et des recommandations posologiques de la monographie en vigueur. Les paramètres d’évaluation principaux (AVC ischémique, AVC hémorragique et AVC de nature indéterminée) seront examinés une fois que 123 de ces accidents seront survenus. Des incidents ischémiques, comme l’infarctus du myocarde et le décès toutes causes confondues, comptent parmi les paramètres d’évaluation secondaires. Cet essai, où seront également surveillées les HC et les hémorragies majeures, servira à déterminer si le NACO utilisé pour prévenir les AVC permet d’enregistrer un gain clinique net dans cette population très vulnérable.
Les NACO ne sont pas identiques : des caractéristiques les distinguent
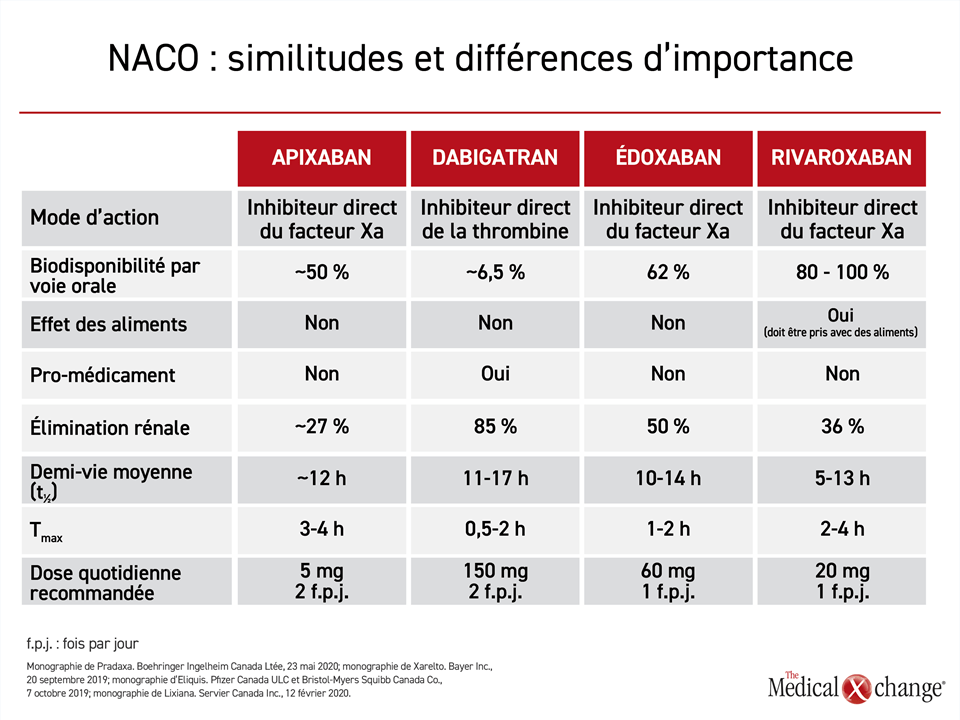
Les quatre NACO homologués pour la prévention des AVC chez les patients atteints de FA sont recommandés indistinctement dans les lignes directrices actuelles, dont les canadiennes11-13. Lors des essais de phase III déterminants, ils ont tous fait preuve d’une efficacité comparable ou supérieure à celle de la warfarine pour prévenir les AVC, et d’un risque de saignement similaire ou plus faible14,15,31,32. Ils y sont tous considérés plus pratiques que la warfarine : ils peuvent être administrés à des doses fixes et le traitement ne demande pas de surveillance particulière12,13,33. Les propriétés pharmacocinétiques propres à chacun, quoique similaires, varient quelque peu et ces variations pourraient devenir importantes sur le plan clinique pour certains patients (Tableau 1)34.
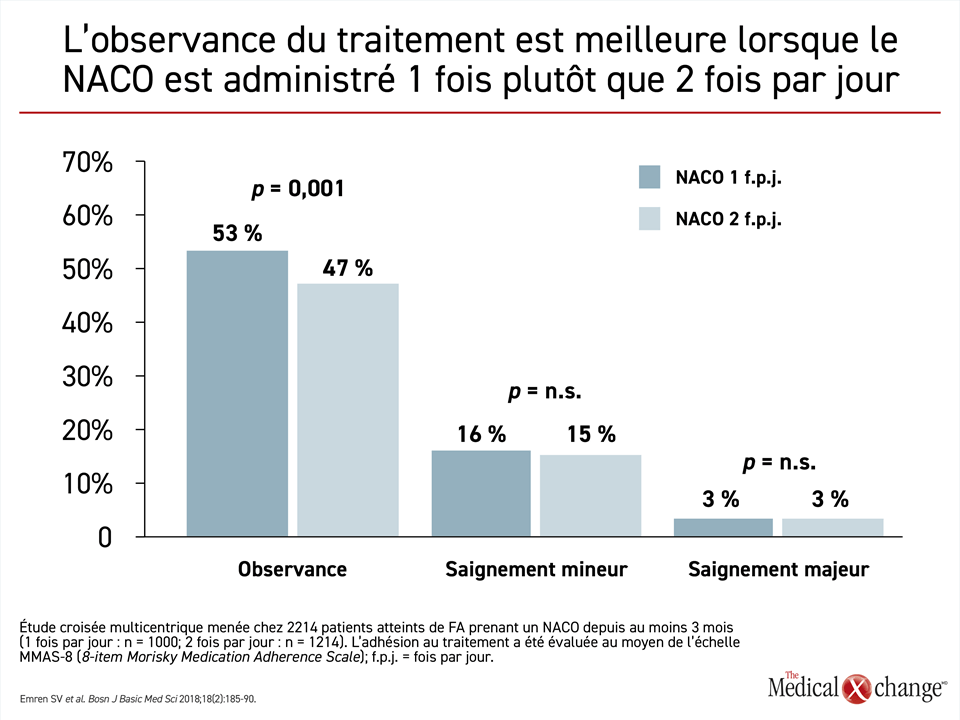
La fréquence d’administration, le risque relatif d’interactions médicamenteuses, le risque d’un effet des aliments sur la biotransformation du NACO et la dépendance de ce dernier envers la fonction rénale pour son élimination sont les plus susceptibles d’avoir de l’importance pour les cliniciens ou les patients amenés à en choisir un. La fréquence d’administration peut avoir de l’importance aux yeux des patients et pour l’efficacité à long terme du traitement. Les patients ne trouvent pas tous que l’administration uniquotidienne est plus pratique, mais des données probantes montrent que sa plus grande simplicité permet d’améliorer légèrement, quoique significativement, l’observance du traitement (Fig. 3).
Le rivaroxaban est le seul NACO sur lequel les aliments ont un effet. Selon les prescriptions du guide thérapeutique, lorsqu’il est administré aux doses quotidiennes supérieures à 10 mg utilisées dans les cas de FA, le rivaroxaban doit être pris avec un repas pour que sa biodisponibilité soit optimale35. Les analyses pharmacocinétiques tirées des études menées chez des patients et des volontaires sains indiquent que cet agent atteint les concentrations voulues sur 24 heures qu’il soit administré au déjeuner ou au souper, mais qu’il est important de le prendre au même repas tous les jours afin d’être protégé 24 heures sur 24. Tous les NACO, sauf le dabigatran, qui est présenté en capsules renfermant de l’acide tartrique, un ingrédient essentiel à son absorption par le tube digestif, peuvent être écrasés avant d’être avalés par des patients atteints de dysphagie ou d’être administrés par des sondes d’alimentation.
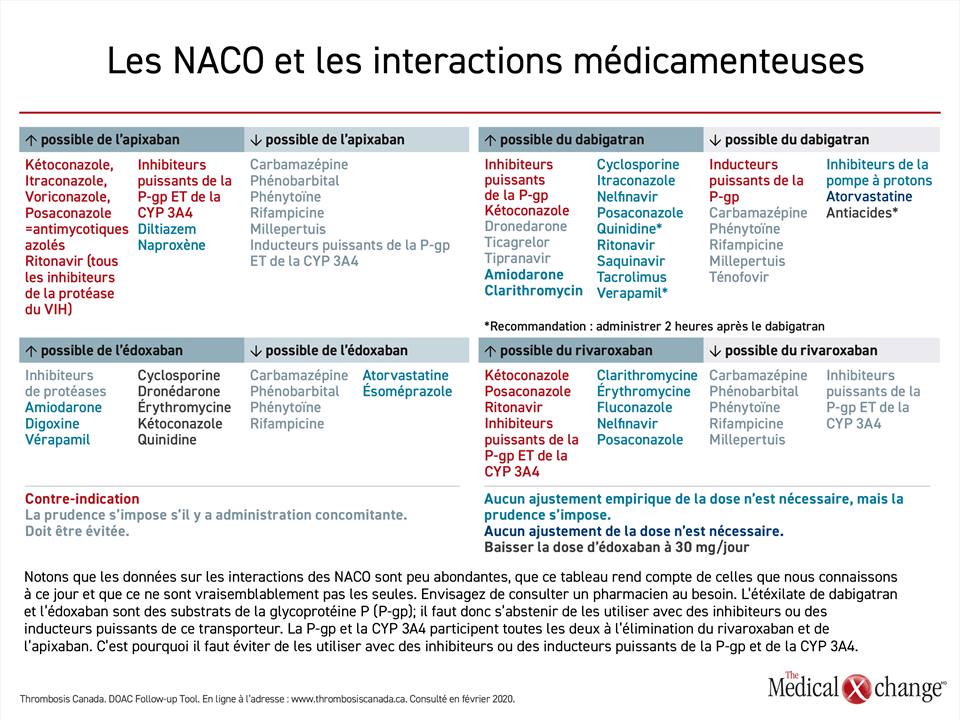
Quant au risque d’interaction médicamenteuse, aucun NACO n’est épargné, mais il y a des différences. L’apixaban et le rivaroxaban font concurrence aux médicaments ou aux aliments qui sont biotransformés par l’isoenzyme hépatique 3A4 du cytochrome P450, comme certains antifongiques, quelques inhibiteurs de la tyrosine kinase et le jus de pamplemousse. Ces deux NACO, dont l’élimination dépend plus ou moins du métabolisme hépatique, doivent donc être utilisés avec prudence chez les patients traités par des inhibiteurs ou des inducteurs de la CYP 3A4. Le dabigatran et l’édoxaban sont peu métabolisés, voire pas du tout, par le foie.
Ces quatre médicaments empruntent le système de transport de la glycoprotéine P (P-gp), d’où la possibilité d’interactions avec des inhibiteurs ou des inducteurs puissants de ce transporteur, tels que la cyclosporine, la digoxine ou certains agents antiépileptiques, en particulier chez les patients dont les reins sont affaiblis, organes où la P-gp est la plus active. Cela dit, les restrictions émises dans les monographies reposent en bonne partie sur les essais déterminants. Les essais menés sur les premiers NACO (apixaban, rivaroxaban et dabigatran) ont exclu l’emploi concomitant d’inhibiteurs puissants de la P-gp, ce qui s’est traduit par une contre-indication relative de ces médicaments en présence de tels agents (Tableau 2). Toutefois, pendant l’étude ENGAGE AF-TIMI 48, l’utilisation d’un inhibiteur puissant de la P-gp commandait uniquement un ajustement de la dose d’édoxaban et non pas l’exclusion du patient. C’est ce qui explique que cet essai ait permis de démontrer l’innocuité d’une dose faible d’édoxaban, soit 30 mg, chez les patients prenant un inhibiteur puissant de la P-gp et que la monographie en vigueur permette son utilisation dans un tel contexte.
Les NACO sont préférables à la warfarine chez la plupart des patients souffrant d’insuffisance rénale, si les doses sont adaptées correctement36. Selon les différentes monographies, ces ajustements peuvent se faire en fonction de la clairance de la créatinine, de la créatininémie, du poids et de l’âge du patient, un facteur de risque important pour l’insuffisance rénale sur fond de FA37 (Fig. 4). Éliminé à 85 % par les reins, le dabigatran est celui qui dépend le plus de la clairance rénale. À environ 27 %, l’apixaban est celui qui en dépend le moins. Quant à l’édoxaban (50 %) et au rivaroxaban (36 %), leur dépendance est moyenne.
Démarche factuelle pour la prévention des AVC sur fond de FA
Les principales lignes directrices sur la prévention de l’AVC chez les patients atteints de FA sont assez uniformes, mais il est clair que les professionnels de la santé ont besoin d’être mieux renseignés. Seulement 60 % des professionnels de la santé ayant répondu à un sondage canadien ont admis prescrire des anticoagulants à prise orale avec assurance38. Même si la majorité des répondants savaient qu’il faut adapter la dose d’après la fonction rénale et l’âge du patient, seulement 25 % d’entre eux connaissaient l’effet des aliments sur le rivaroxaban. Les taux élevés d’abstention thérapeutique inopportune ou la prescription de doses sous-optimales d’anticoagulant chez les patients atteints de FA qui répondent pourtant aux critères définis dans les lignes directrices régissant la prévention des AVC confirment les lacunes persistantes dans les connaissances de ces professionnels sur ce moyen important de réduire la morbidité et les décès imputables aux AVC et pourtant évitables10,39.
Les lignes directrices sur la prévention primaire et la prévention secondaire chez les patients atteints de FA sont simples. Hormis quelques exceptions, la plupart de ceux qui ont plus de 65 ans et beaucoup de leurs cadets affichant d’autres facteurs de risque vasculaire sont en droit de recevoir une anticoagulothérapie orale. Si tous les patients atteints de FA chez lesquels ce traitement est indiqué étaient traités — aux doses qui leur conviennent — la plupart des AVC liés à cette arythmie seraient évités20.
L’usage approprié des anticoagulants à prise orale chez les insuffisants rénaux, chez les patients devant subir une chirurgie ou se rétablissant d’un premier AVC est avec force détails dans les lignes directrices, mais de façon claire. Certes, il faut réduire la dose dans certains cas précis afin de conserver un rapport optimal entre les bienfaits du traitement et les risques qu’il comporte, mais l’utilisation trop répandue dans la pratique courante de doses insuffisantes de NACO en contravention des recommandations des monographies apparaît comme un facteur de risque majeur et pourtant corrigible d’AVC lié à la FA.
Résumé
Un recours plus rigoureux et uniforme à l’anticoagulothérapie orale chez les patients atteints de FA réduira la morbidité et la mortalité au Canada. Pendant les essais cliniques, tous les NACO, même s’ils ne sont pas forcément interchangeables, ont fait preuve d’une efficacité égale, voire supérieure à celle de la warfarine et ont réduit le risque d’HC de moitié. Quant aux autres formes d’hémorragie majeure, les taux obtenus ont été les mêmes ou inférieurs. Ces agents sont relativement simples à utiliser. Même s’il est important de reconnaître les circonstances où un ajustement de la dose s’impose, il demeure que la grande majorité des patients atteints de FA qui auraient besoin d’une prophylaxie contre les AVC devraient en suivre une indéfiniment et aux doses thérapeutiques éprouvées prescrites dans les monographies et adaptées à la situation de chacun d’eux.
Références
- Hsu, J.C., Maddox, T.M., Kennedy, K.F., et al. Oral Anticoagulant Therapy Prescription in Patients With Atrial Fibrillation Across the Spectrum of Stroke Risk: Insights From the NCDR PINNACLE Registry. JAMA Cardiol 2016;1:55-62.
- Feigin, V.L., Forouzanfar, M.H., Krishnamurthi, R. et al. Global and regional burden of stroke during 1990-2010: findings from the Global Burden of Disease Study 2010. Lancet 2014;383:245-254.
- Miyasaka, Y., Barnes, M.E., Gersh, B.J., et al. Secular trends in incidence of atrial fibrillation in Olmsted County, Minnesota, 1980 to 2000, and implications on the projections for future prevalence. Circulation 2006;114:119-125.
- van Walraven, C., Hart, R.G., Connolly, S., et al. Effect of age on stroke prevention therapy in patients with atrial fibrillation: the atrial fibrillation investigators. Stroke 2009;40:1410-1416.
- Fordyce, C.B., Hellkamp, A.S., Lokhnygina, Y., et al. On-Treatment Outcomes in Patients With Worsening Renal Function With Rivaroxaban Compared With Warfarin: Insights From ROCKET AF. Circulation 2016;134:37-47.
- Fang, M.C., Stafford, R.S., Ruskin, J.N. et Singer, D.E. National trends in antiarrhythmic and antithrombotic medication use in atrial fibrillation. Arch Intern Med 2004;164:55-60.
- Nieuwlaat, R., Capucci, A., Camm, A.J., et al. Atrial fibrillation management : a prospective survey in ESC member countries: the Euro Heart Survey on Atrial Fibrillation. Eur Heart J 2005;26:2422-2434.
- Hylek, E.M., D’Antonio, J., Evans-Molina, C., Shea, C., Henault, L.E. et Regan, S. Translating the results of randomized trials into clinical practice: the challenge of warfarin candidacy among hospitalized elderly patients with atrial fibrillation. Stroke 2006;37:1075-1080.
- Marinigh, R., Lip, G.Y., Fiotti, N., Giansante, C. et Lane, D.A. Age as a risk factor for stroke in atrial fibrillation patients: implications for thromboprophylaxis. J Am Coll Cardiol 2010;56:827-837.
- Kato, E.T., Goto, S. et Giugliano, R.P. Overview of oral antithrombotic treatment in elderly patients with atrial fibrillation. Ageing Res Rev 2019;49:115-124.
- Andrade, J., Khairy, P., Dobrev, D. et Nattel, S. The clinical profile and pathophysiology of atrial fibrillation: relationships among clinical features, epidemiology, and mechanisms. Circ Res 2014;114:1453-1468.
- January, C.T., Wann, L.S., Calkins, H., et al. 2019 AHA/ACC/HRS Focused Update of the 2014 AHA/ACC/HRS Guideline for the Management of Patients With Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society in Collaboration With the Society of Thoracic Surgeons. Circulation 2019;140:e125-e151.
- Kirchhof, P., Benussi, S., Kotecha, D., et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur Heart J 2016;37:2893-2962.
- Granger, C.B., Alexander, J.H., McMurray, J.J., et al. Apixaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2011;365:981-992.
- Giugliano, R.P., Ruff, C.T., Braunwald, E., et al. Edoxaban versus warfarin in patients with atrial fibrillation. N Engl J Med 2013;369:2093-2104.
- Kato, E.T., Giugliano, R.P., Ruff, C.T., et al. Efficacy and Safety of Edoxaban in Elderly Patients With Atrial Fibrillation in the ENGAGE AF-TIMI 48 Trial. J Am Heart Assoc 2016;5.
- Steinberg, B.A., Shrader, P., Pieper, K., et al. Frequency and Outcomes of Reduced Dose Non-Vitamin K Antagonist Anticoagulants: Results From ORBIT-AF II (The Outcomes Registry for Better Informed Treatment of Atrial Fibrillation II). J Am Heart Assoc 2018;7.
- Seelig, J., Pisters, R., Hemels, M.E., Huisman, M.V., Ten Cate, H. et Alings, M. When to withhold oral anticoagulation in atrial fibrillation – an overview of frequent clinical discussion topics. Vasc Health Risk Manag 2019;15:399-408.
- Bassand, J.P., Accetta, G., Al Mahmeed, W., et al. Risk factors for death, stroke, and bleeding in 28,628 patients from the GARFIELD-AF registry: Rationale for comprehensive management of atrial fibrillation. PLoS One 2018;13:e0191592.
- Paciaroni, M., Agnelli, G., Caso, V., et al. Causes and Risk Factors of Cerebral Ischemic Events in Patients With Atrial Fibrillation Treated With Non-Vitamin K Antagonist Oral Anticoagulants for Stroke Prevention. Stroke 2019;50:2168-2174.
- Yao, X., Shah, N.D., Sangaralingham, L.R., Gersh, B.J. et Noseworthy, P.A. Non-Vitamin K Antagonist Oral Anticoagulant Dosing in Patients With Atrial Fibrillation and Renal Dysfunction. J Am Coll Cardiol 2017;69:2779-2790.
- Wilson, D., Ambler, G., Lee, K.J., et al. Cerebral microbleeds and stroke risk after ischaemic stroke or transient ischaemic attack: a pooled analysis of individual patient data from cohort studies. Lancet Neurol 2019;18:653-665.
- Shoamanesh, A., Charidimou, A., Sharma, M. et Hart, R.G. Should Patients With Ischemic Stroke or Transient Ischemic Attack With Atrial Fibrillation and Microbleeds Be Anticoagulated? Stroke 2017;48:3408-3412.
- Biffi, A., Kuramatsu, J.B., Leasure, A., et al. Oral Anticoagulation and Functional Outcome after Intracerebral Hemorrhage. Ann Neurol 2017;82:755-765.
- Murthy, S.B., Gupta, A., Merkler, A.E., et al. Restarting Anticoagulant Therapy After Intracranial Hemorrhage: A Systematic Review and Meta-Analysis. Stroke 2017;48:1594-1600.
- Nielsen, P.B., Larsen, T.B., Skjoth, F., Gorst-Rasmussen, A., Rasmussen, L.H. et Lip, G.Y. Restarting Anticoagulant Treatment After Intracranial Hemorrhage in Patients With Atrial Fibrillation and the Impact on Recurrent Stroke, Mortality, and Bleeding: A Nationwide Cohort Study. Circulation 2015;132:517-525.
- Kuramatsu, J.B., Gerner, S.T., Schellinger, P.D., et al. Anticoagulant reversal, blood pressure levels, and anticoagulant resumption in patients with anticoagulation-related intracerebral hemorrhage. JAMA 2015;313:824-836.
- Hawkes, M.A. et Rabinstein, A.A. Anticoagulation for atrial fibrillation after intracranial hemorrhage : A systematic review. Neurol Clin Pract 2018;8:48-57.
- Shoamanesh, A., Charidimou, A. et Sheth, K.N. Comorbid Atrial Fibrillation in Cerebral Amyloid Angiopathy-related Intracerebral Hemorrhage : Between a Rock and a Hard Place. J Stroke Cerebrovasc Dis 2019;28:104351.
- clinicaltrials.gov. Edoxaban for intracranial hemorrhage survivors with atrial fibrillation (ENRICH-AF). https://clinicaltrialsgov/ct2/show/NCT03950076. Consulté le 15 juin 2020.
- Patel, M.R., Mahaffey, K.W., Garg, J., et al. Rivaroxaban versus warfarin in nonvalvular atrial fibrillation. N Engl J Med 2011;365:883-891.
- Connolly, S.J., Ezekowitz, M.D., Yusuf, S., et al. Dabigatran versus warfarin in patients with atrial fibrillation. N Engl J Med 2009;361:1139-1151.
- Andrade, J.G., Verma, A., Mitchell, L.B., et al. 2018 Focused Update of the Canadian Cardiovascular Society Guidelines for the Management of Atrial Fibrillation. Can J Cardiol 2018;34:1371-1392.
- Yeh, C.H., Hogg, K. et Weitz J.I. Overview of the new oral anticoagulants: opportunities and challenges. Arterioscler Thromb Vasc Biol 2015;35:1056-1065.
- Zhang, L., Peters, G., Haskell, L., Patel, P., Nandy, P. et Moore, K.T. A Cross-Study Analysis Evaluating the Effects of Food on the Pharmacokinetics of Rivaroxaban in Clinical Studies. J Clin Pharmacol 2017;57:1607-1615.
- Harel, Z., Sholzberg, M., Shah, P.S., et al. Comparisons between novel oral anticoagulants and vitamin K antagonists in patients with CKD. J Am Soc Nephrol 2014;25:431-442.
- Kulkarni, N., Gukathasan, N., Sartori, S. et Baber U. Chronic Kidney Disease and Atrial Fibrillation: A Contemporary Overview. J Atr Fibrillation 2012;5:448.
- Piran, S., Schulman, S., Panju, M. et Pai, M. Oral anticoagulant dosing, administration, and storage: a cross-sectional survey of Canadian health care providers. J Thromb Thrombolysis 2018;45:180-185.
- Fernandes, L., Sargento-Freitas, J., Milner, J., et al. Ischemic stroke in patients previously anticoagulated for non-valvular atrial fibrillation: Why does it happen? Rev Port Cardiol 2019;38:117-124.
3e chapitre : Considérations d’ordre pratique à propos de la prévention de l’AVC à l’aide d’anticoagulants à prise orale
Bien souvent, les anticoagulants à prise orale qui ne sont pas des antagonistes de la vitamine K (NACO) ne sont pas utilisés aux doses recommandées ou adaptées à la prévention des AVC dans les cas de fibrillation auriculaire (FA). Attribuée à l’appréhension des cliniciens envers les saignements, cette situation porte à croire qu’ils n’ont pas saisi tout le potentiel de ces agents pour réduire le risque chez ces patients, le rapport entre les avantages et les risques de la prévention des AVC étant favorable chez presque tous. Lors des essais déterminants, les quatre NACO offerts ont fait preuve d’une efficacité similaire ou supérieure à celle de la warfarine. Pour choisir un NACO et en fixer la dose, il faut tenir compte chez certains patients des légères différences d’innocuité entre ces agents et la warfarine, et entre chacun d’eux pour ce qui est de la pharmacocinétique. En reconnaissant l’importance de l’anticoagulation chez les patients atteints de FA et celle des fondements d’un traitement bien adapté, nous aurons une excellente occasion d’atténuer une cause importante de morbidité et de décès au Canada.
Afficher la revue