Revue d’experts
L'asthme grave : caractérisation aux fins de personnalisation du traitement
Chapitre 2 : Endotypes de l’asthme grave
Harold Kim, M.D., FRCPC
Division de l’immunologie et de l’allergologie cliniques
Université Western Ontario et université McMaster,
London et Hamilton, Ontario
La médecine de précision, qui traite des mécanismes physiopathologiques sous-jacents de l’asthme, est tributaire des progrès réalisés dans la définition des endotypes de cette maladie. Contrairement aux phénotypes descriptifs utilisés de longue date pour grouper les patients d’après des caractéristiques observables, les endotypes font référence à des mécanismes physiopathologiques distincts susceptibles d’être pris pour cibles. Même s’il ne fait que commencer, le recensement d’endotypes signifiants de l’asthme progresse. Les biomarqueurs, indices d’une plus grande probabilité d’obtenir une réaction favorable aux traitements ciblés actuellement offerts, ont été le premier pas vers la personnalisation des traitements. Cela dit, il est peu probable que l’asthme — terme générique désignant un ensemble de processus pathologiques complexes et hétérogènes — soit ramené à des endotypes définis par un seul mécanisme moléculaire, surtout s’il est grave. Les phénomènes moléculaires, génétiques et épigénétiques étant utilisés pour distinguer les divers endotypes les uns des autres, l’objectif sera plutôt de découvrir les principaux processus que la médecine de précision pourra prendre pour cibles chez les patients ayant en commun certaines manifestations de la maladie.
Contexte
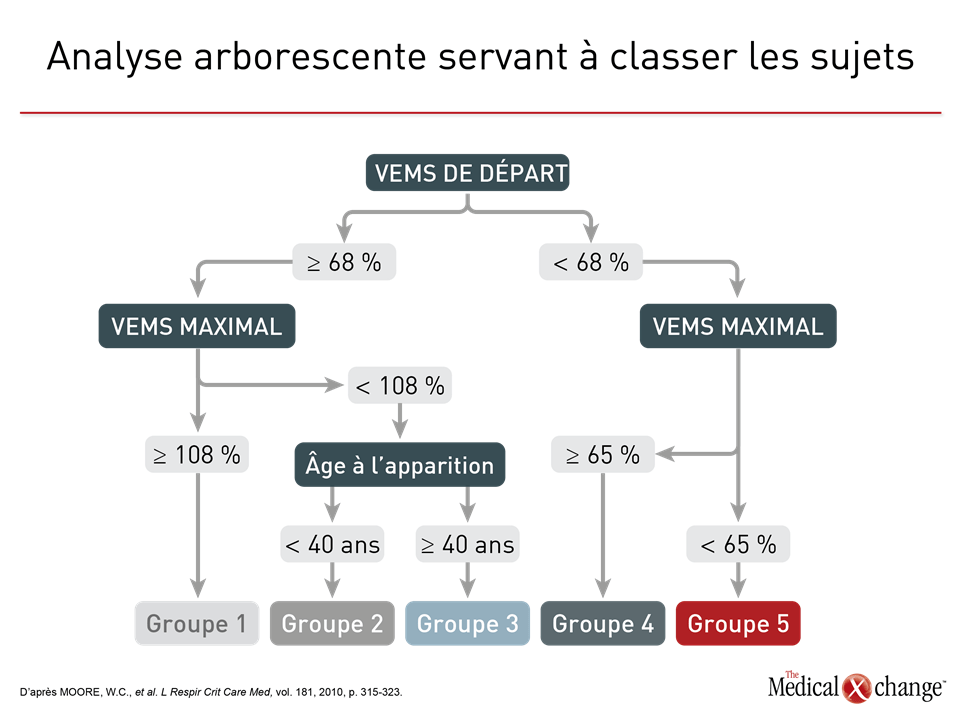
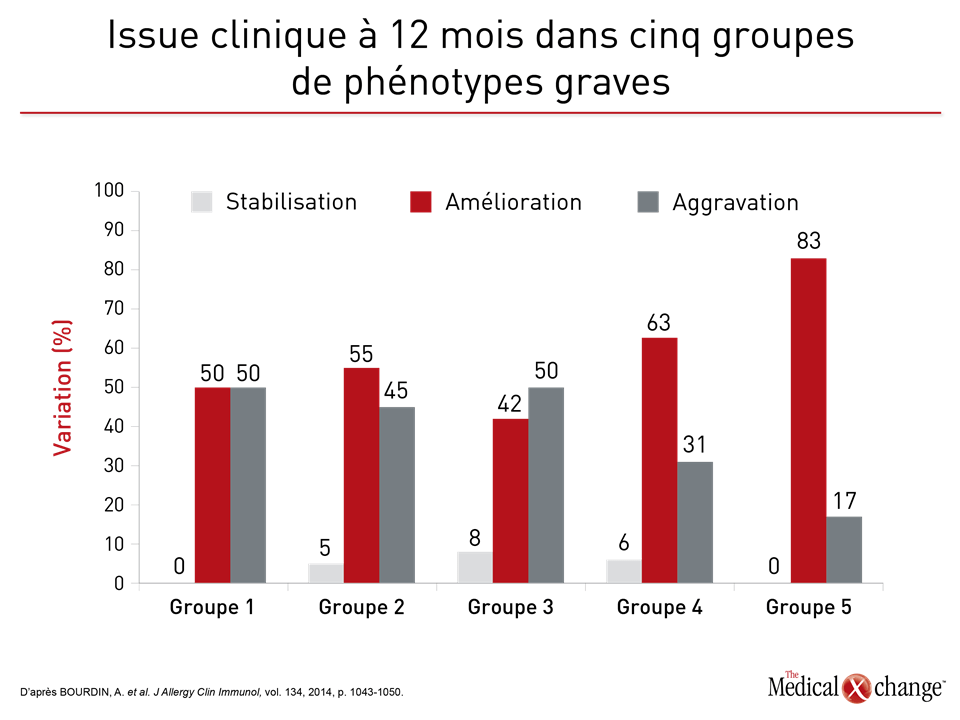
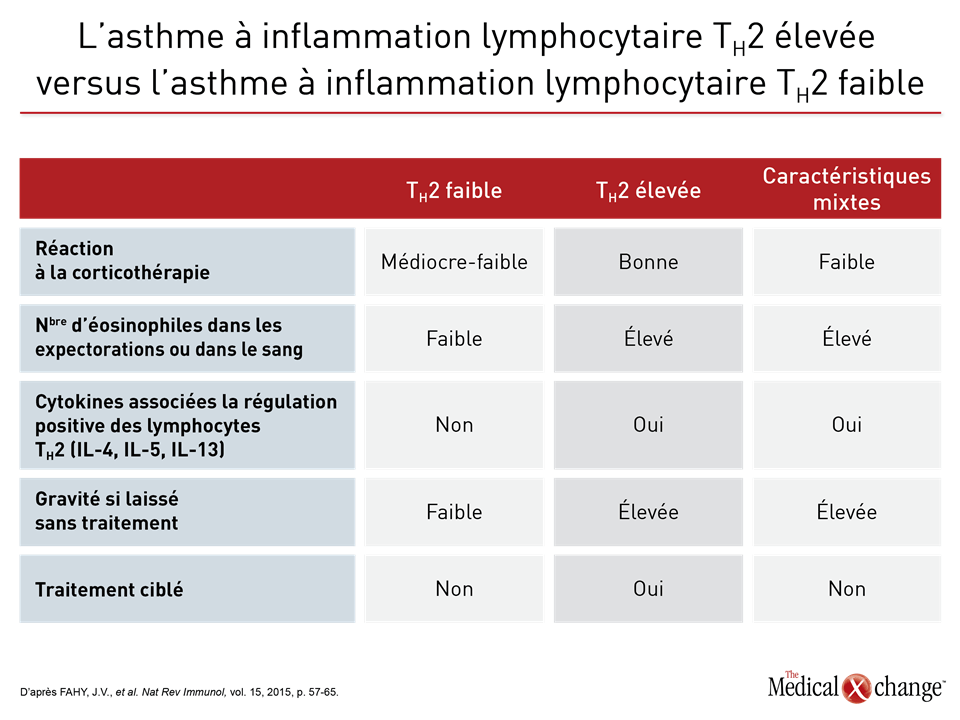
Cela fait plus de 50 ans que les phénotypes sont le fondement des stratégies visant à mettre de l’ordre dans l’hétérogénéité de l’asthme1. Les manifestations cliniques, telles que l’âge à l’apparition de la maladie, la réaction au traitement ou les éléments déclenchant les symptômes, s’étant révélées insuffisantes pour distinguer utilement les différents types cliniques de l’asthme, surtout les cas graves, le phénotypage s’est complexifié pour s’adapter aux nombreux traits de la maladie. Le programme SARP (Severe Asthma Research Program) en est un bon exemple. Lors d’une des premières analyses du SARP, plusieurs centaines de variables cliniques ont été ramenées à 34 variables principales, puis évaluées au moyen d’une analyse typologique fondée sur des statistiques2. Cinq groupes distincts ont été décrits en fonction de paramètres cliniques, physiologiques et inflammatoires (Fig. 1). À l’instar d’autres stratégies visant à obtenir un meilleur phénotypage, celle-ci a prouvé de façon probante que l’asthme est une maladie hétérogène mettant probablement en jeu des ensembles de mécanismes physiopathologiques distincts. Notons toutefois que les caractéristiques ayant servi à définir les phénotypes précis établis jusqu’à présent ne sont pas l’apanage d’un seul, mais en chevauchent plusieurs. Ainsi, les différences extrêmement significatives au chapitre des caractéristiques cliniques, dont la fonction respiratoire, l’âge médian à l’apparition de l’asthme et l’indice de masse corporelle médian, qui ont été observées entre les groupes établis par le programme SARP n’étaient pas des traits exclusifs, mais témoignaient plutôt de différences relatives, d’où leur intérêt limité pour la caractérisation de la maladie chez les patients pris individuellement. Selon une analyse longitudinale subséquente au cours de laquelle l’issue clinique a servi d’élément de comparaison entre les groupes établis par le programme SARP, les chercheurs n’ont constaté aucune différence sur une période d’observation de 12 mois (Fig. 2)3, que ce soit, par exemple, pour le délai écoulé avant la première exacerbation ou la maîtrise de l’asthme objectivée au moyen du questionnaire ACQ (Asthma Control Questionnaire). Il existe effectivement une faible corrélation entre le phénotypage et l’issue clinique. Par exemple, la maîtrise de l’asthme à 12 mois d’après l’évaluation qu’en faisaient les patients a été comparée pour cinq phénotypes4. Or un phénotype caractérisé par des exacerbations fréquentes a été relié à une moins bonne maîtrise des symptômes qu’un autre, caractérisé par l’apparition précoce de la maladie. Bien que les auteurs en aient conclu que les phénotypes peuvent être utiles pour prédire l’issue du traitement, ils n’ont pas vérifié s’il était possible de l’améliorer en modifiant le traitement en fonction du phénotype pas plus qu’ils n’ont évalué l’intérêt du phénotypage chez chaque patient pris isolément par opposition aux différences intergroupes qu’ils avaient observées. Ils ont toutefois admis que des études de validation s’imposent. Dans cette étude, tout comme pendant l’analyse initiale du programme SARP, le phénotypage a uniquement été établi d’après des caractéristiques cliniques observables. Or les phénotypes définis en tenant compte des biomarqueurs, parfois appelés phénotypes moléculaires5, permettent de cerner des sous-types d’asthme plus distinctement. En effet, les biomarqueurs peuvent être les témoins de phénomènes physiopathologiques sous-jacents même s’ils ne donnent pas forcément d’indices sur l’importance du rôle joué par ces phénomènes dans la maladie. En fait, les phénotypes moléculaires et les endotypes sont apparentés et ne sont pas toujours traités différemment. L’asthme est jugé à inflammation lymphocytaire TH2 élevée ou faible d’après des caractéristiques cliniques et des biomarqueurs témoignant de l’activité du système immunitaire (Tableau 1). Selon certaines études, il s’agirait de phénotypes, alors que d’autres les qualifient plutôt d’endotypes6,7. Cette utilisation incohérente du terme « endotype » est compréhensible. Les sous-types que sont l’asthme à inflammation lymphocytaire TH2 élevée ou faible, qui ont été proposés il y a près de 20 ans8, à une époque où il était moins évident que plus d’une voie physiopathologique était probablement impliquée dans l’asthme, reposaient à la fois sur des caractéristiques cliniques et sur des biomarqueurs de l’inflammation. L’utilisation du mot « endotype » est plus récente et témoigne du fait que les différents mécanismes pathologiques en présence appellent des stratégies thérapeutiques taillées sur mesure9. La description et l’étude de l’asthme à inflammation lymphocytaire TH2 élevée ou faible ont fourni une bonne partie du cadre nécessaire à la recherche d’endotypes signifiants, même si ces appellations ne sont pas suffisamment précises pour définir les cibles thérapeutiques.
Les biomarqueurs utilisés pour l’endotypage
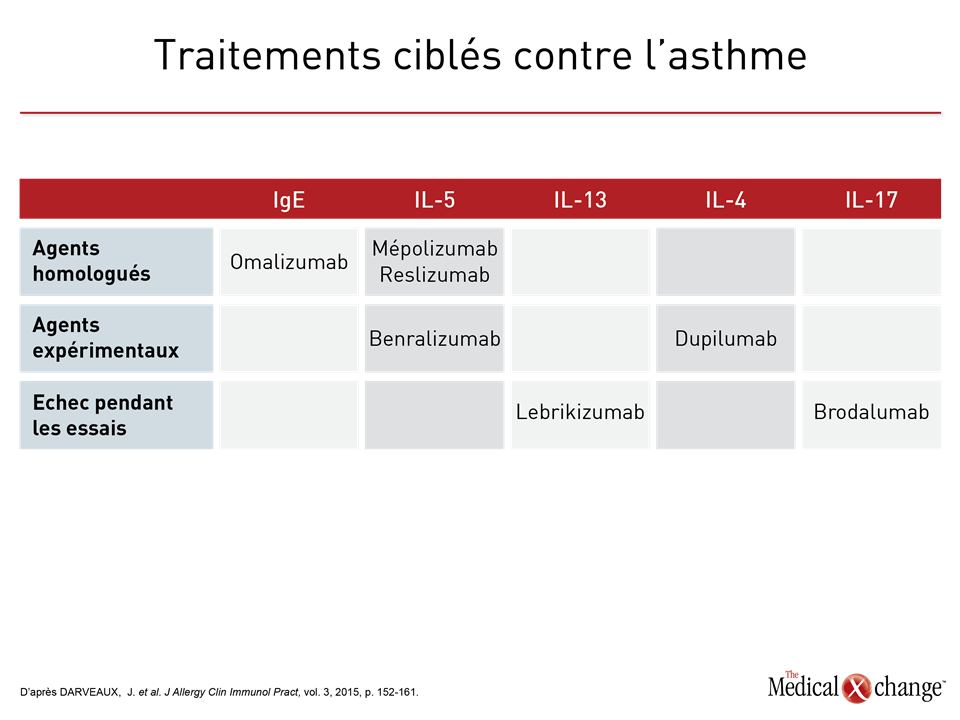
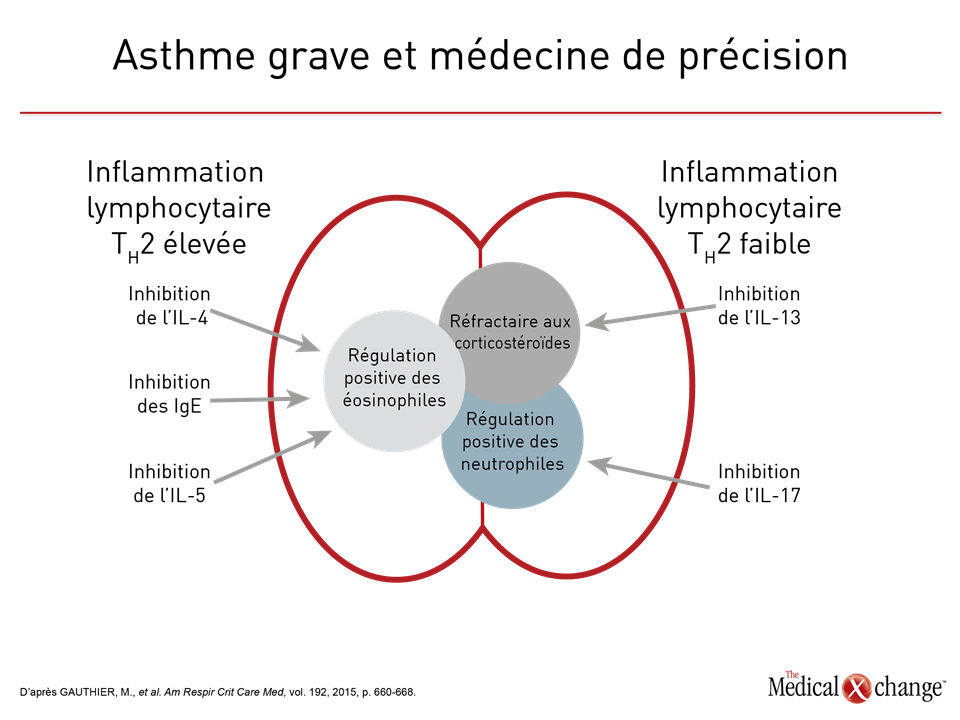
C’est en 1958 qu’était publié un article nous ayant appris que les patients atteints d’asthme ne présentent pas tous une hyperéosinophilie des voies aériennes10. Des études réalisées par la suite ont permis de faire le rapprochement entre d’une part, l’hyperéosinophilie et une réaction favorable à la corticothérapie et d’autre part, une éosinophilie faible à une réaction nettement insatisfaisante11,12. D’autres ont ensuite révélé que la présence ou l’absence de granulocytes éosinophiles avait un lien avec des phénomènes apparentés au sein de la voie de l’inflammation, notamment l’expression relative des cytokines que sont les interleukines 4 (IL-4) et 5 (IL-5)13. Si la distinction entre l’asthme à inflammation lymphocytaire TH2 élevée et l’asthme à inflammation lymphocytaire TH2 faible est aujourd’hui largement acceptée, c’est grâce à ces observations14. Cette stratification est importante, parce qu’elle laisse entrevoir l’existence de différences fondamentales dans les modes d’activation du système immunitaire, qui sont les forces motrices de l’inflammation des voies aériennes et des spasmes bronchique chez les patients atteints d’une forme clinique d’asthme. Le concept classique voulant que l’asthme soit une maladie placée sous la médiation des lymphocytes T auxiliaires de type 2 (TH2) repose sur la théorie selon laquelle l’exposition à un élément déclencheur ou un incident, comme une infection virale des voies aériennes, pousse ce sous-groupe de lymphocyte T auxiliaires à lancer la production d’anticorps de la classe des IgE et de cytokines telles que l’IL-4, l’IL-5 et l’IL-13, ce qui entraîne l’activation et la mobilisation des granulocytes éosinophiles. Contrairement à l’immunité de type TH1, qui est associée à la libération d’interféron gamma, d’IL-2 et du facteur de nécrose tumorale pour induire une immunité à médiation cellulaire15, l’immunité de type TH2 est plus étroitement liée aux réactions allergiques, ce qui a mené à la théorie voulant que l’asthme, surtout s’il est apparu pendant l’enfance, est le fruit d’une activation inadaptée des cellules TH216. Bien que cet asthme où prédominent les granulocytes éosinophiles, qualifié d’asthme à inflammation lymphocytaire TH2 élevée, ait longtemps été vu comme la forme classique de cette maladie, il faut savoir que seulement 50 % environ des cas correspondent à cette description17. Les patients qui ne présentent pas cette caractéristique, c’est-à-dire ceux qui sont atteints d’asthme à inflammation lymphocytaire TH2 faible, ont été reconnus grâce à divers moyens dont au premier chef, une faible concentration de granulocytes éosinophiles dans le sang ou les expectorations, dont la définition varie. Une valeur seuil fixée à moins de 2 % de granulocytes éosinophiles dans les expectorations est toutefois ressortie d’une analyse ayant porté sur l’asthme non éosinophilique dans la population générale18. Or des pourcentages plus élevés ont été employés pour repérer les patients atteints d’un asthme grave hyperéosinophilique susceptibles de tirer avantage d’un agent biologique dont l’usage est conditionné par la présence d’une hyperéosinophilie19. Notons que d’autres paramètres ont aussi été utilisés comme une réaction nettement insatisfaisante aux corticostéroïdes, une faible expression des cytokines associées aux granulocytes éosinophiles TH2 (p. ex., l’IL-5) et un profil d’expression génétique lié aux formes d’asthme autres que celles à inflammation lymphocytaire TH2 élevée20. Le problème avec le fait d’appeler endotypes les types d’asthme à inflammation lymphocytaire TH2 élevée ou faible, c’est, semble-t-il, leur manque de spécificité. Les agents biologiques ciblant les IgE et la voie de l’IL-5, qui subissent une régulation positive dans les cas d’asthme à inflammation lymphocytaire TH2 élevée, sont efficaces, mais la corrélation entre la réaction au traitement et la présence de la cible, comme une forte concentration d’IgE dans le cas de l’omalizumab ou de granulocytes éosinophiles dans celui du mépolizumab et du reslizumab, des inhibiteurs de la voie de l’IL-5, reste approximative21-23. L’omalizumab s’est montré efficace pour atténuer les réactions allergiques indépendamment de l’allergène en cause24, mais la présence de fortes concentrations d’IgE n’est pas explicitement exigée dans sa monographie aux fins d’utilisation contre l’asthme. En revanche, celle des inhibiteurs de la voie de l’IL-5 stipule bien que ces agents ne doivent être utilisés que sur fond d’hyperéosinophilie, mais la présence de cette dernière n’est pas pour autant une garantie de réaction favorable au traitement25. Une analyse a en effet permis de déduire que le nombre de granulocytes éosinophiles dans les expectorations n’est pas un facteur de prédiction d’une réaction favorable au mépolizumab26. Lors d’une étude de phase II portant sur l’asthme, les bienfaits obtenus avec le lébrikizumab, qui cible l’IL-13, ont été inconstants, même si cet agent est aussi associé à une régulation négative de l’activation des granulocytes éosinophiles27. Le dupilumab, un inhibiteur de la voie de signalisation de l’IL-4 et de l’IL-13, a fait preuve d’activité clinique dans les cas d’asthme grave indépendamment du nombre de granulocytes éosinophiles28 (Tableau 2). Les données appuyant la candidature de l’asthme à inflammation lymphocytaire TH2 faible au titre d’endotype sont encore moins convaincantes. Bien qu’une théorie veuille que ce type d’inflammation soit causé par un dérèglement des réactions immunitaires innées qui entraînerait de l’inflammation essentiellement par régulation positive des granulocytes neutrophiles29, la séquence exacte des phénomènes en jeu et la possibilité que l’un d’entre eux puisse être pris pour cible restent à élucider. Par exemple, les chercheurs soupçonnent que la régulation positive de l’IL-17, qui est réputée stimuler des cytokines et des chimiokines jouant un rôle important pour l’activation et la mobilisation des granulocytes neutrophiles, est l’élément moteur de l’asthme non hyperéosinophilique à inflammation lymphocytaire TH2 faible30. Une étude clinique menée sur le brodalumab, un anticorps dirigé contre l’IL-17, n’a pourtant mis au jour aucun effet thérapeutique31. Alors que nous parvenons habituellement à traiter l’asthme à inflammation lymphocytaire TH2 élevée au moyen d’agents anti-IL-5, l’impossibilité dans laquelle nous nous trouvons de maîtriser l’asthme à inflammation lymphocytaire TH2 faible en inhibant l’IL-17 ou toute autre cible unique, donne à penser qu’il reste encore beaucoup à faire pour définir convenablement les mécanismes physiopathologiques de cette forme de la maladie. D’autres phénotypes, tels que l’asthme d’apparition tardive, l’asthme associé à l’obésité ou l’asthme provoqué par l’effort, peuvent être définis à l’aide d’endotypes n’ayant pas de lien, ou alors un lien indirect, avec la nature de l’inflammation lymphocytaire TH2. L’asthme provoqué par l’effort, par exemple, est associé à une régulation positive de médiateurs de l’inflammation ayant un lien plus étroit avec l’œdème et la bronchoconstriction, notamment des leucotriènes et des prostaglandines32. Au vu de ces classifications cliniques de l’asthme, comme les phénotypes d’asthme à inflammation lymphocytaire TH2 élevée ou faible, la définition d’endotypes utiles sur le plan clinique pourrait exiger la prise en compte d’un large éventail de caractéristiques. Or il se peut que la complexité de ces dernières augmente proportionnellement à la gravité de la maladie. Chez les enfants atteints d’asthme grave, par exemple, il est possible que les concentrations de granulocytes éosinophiles et neutrophiles soient élevées, les différences devenant moins nettes et compliquant d’autant la caractérisation en fonction de l’inflammation imputable aux lymphocytes T auxiliaires33.
Résumé clinique
Si des progrès sont réalisés en endotypage, c’est parce nous connaissons de mieux en mieux tous les détails entourant les phénomènes physiopathologiques propres aux divers phénotypes de l’asthme. Ces progrès devraient permettre de décortiquer les mécanismes pathologiques menant à l’expression de la maladie. Bien qu’une compréhension approfondie des phénomènes physiopathologiques à l’origine de l’asthme puisse en définitive aboutir à des stratégies de prévention des éléments déclencheurs initiaux, rien n’est plus important pour le moment que de neutraliser les moteurs de l’inflammation dans les formes graves d’asthme (Fig. 3). L’asthme grave, qui se définit généralement par une maladie mal maîtrisée malgré l’utilisation d’une corticothérapie à doses élevées, n’afflige que 10 % ou moins des patients, mais il faut savoir qu’il est incriminé dans une forte proportion des consultations d’urgence34 et dans un grand nombre de décès liés à l’asthme au Canada comme ailleurs dans le monde35. La mise au point de traitements ciblés a marqué un jalon majeur vers la définition des endotypes et la médecine de précision. Les inhibiteurs de la voie de l’IL-5, notamment, ont été reliés à des baisses considérables et significatives sur le plan clinique des exacerbations motivant une visite à l’Urgence ou une hospitalisation36-38. En outre, les concentrations élevées de granulocytes éosinophiles ont montré qu’elles pouvaient servir de facteur de prévision d’une réaction favorable au traitement, ce qui a confirmé la pertinence de cette cible. La suppression de la voie de l’IL-5 de l’activation des granulocytes éosinophiles sera vraisemblablement l’une des nombreuses étapes vers l’inhibition de médiateurs de l’inflammation extrêmement spécifiques ayant un rapport avec cet endotype et avec les autres qui émergeront probablement des travaux de recherche sur les processus physiopathologiques à l’origine de l’asthme. L’identification des divers éléments qui entrent en jeu dans la cascade inflammatoire a connu des progrès fulgurants. Les prochaines étapes seront consacrées à la conversion des phénotypes de l’asthme en endotypes, que rendra possible la reconnaissance des éléments de la cascade inflammatoire qui servent de locomotive à ces sous-types d’asthme. Ces réalisations pourront à leur tour fournir des cibles de traitement propres à cet endotype et venir donner plus de moyens à la médecine de précision pour la prise en charge d’une maladie, ou d’un ensemble de maladies, qui s’est révélée infiniment complexe.
Conclusion
Il est bien possible que le mot asthme utilisé pour désigner des symptômes provoqués par un ensemble hétérogène de processus physiopathologiques soit aussi peu précis que l’est le mot cancer pour nommer une entité morbide. Dans leurs lignes directrices sur l’asthme grave, l’ERS et l’ATS, qui ont maintes fois préconisé le phénotypage comme stratégie pour personnaliser les traitements, insistent sur l’importance de reconnaître les différents processus pathologiques sous-jacents39. La détermination des endotypes est tributaire d’une connaissance aiguë des voies physiopathologiques propres à l’asthme. Elle n’en est peut-être encore qu’à ses balbutiements, mais il ne fait pas de doute qu’elle est appelée à devenir un outil précieux pour améliorer le traitement de l’asthme. La détermination des endotypes est chargée de promesses. Il suffit de penser aux nouvelles possibilités de traitement qu’elle laisse entrevoir contre l’asthme grave qui est, par définition, réfractaire aux traitements classiques.
Références
- GAUTHIER, M., A. Rayet S.E. Wenzel. « Evolving Concepts of Asthma », Am J Respir Crit Care Med, vol. 192, 2015, p. 660-668.
- MOORE, W.C., D.A. Meyers, S.E. Wenzel, et al. « Identification of asthma phenotypes using cluster analysis in the Severe Asthma Research Program », Am J Respir Crit Care Med, vol. 181, 2010, p. 315-323.
- BOURDIN, A., N. Molinari, I. Vachier, et al. « Prognostic value of cluster analysis of severe asthma phenotypes », J Allergy Clin Immunol, vol. 134, 2014, p. 1043-1050.
- KHUSIAL, R.J., J.K. Sont, R.J.B. Loijmans, et al. « Longitudinal outcomes of different asthma phenotypes in primary care, an observational study », NPJ Prim Care Respir Med, vol. 27, 2017, p. 55.
- PAPI, A., M. Saetta et L. Fabbri. « Severe asthma: phenotyping to endotyping or vice versa? », Eur Respir J, vol. 49, 2017.
- KUO, C.S., S. Pavlidis, M. Loza, et al. « T-helper cell type 2 (Th2) and non-Th2 molecular phenotypes of asthma using sputum transcriptomics in U-BIOPRED », Eur Respir J, vol. 49, 2017.
- STOKES, J.R. et T.B. Casale. « Characterization of asthma endotypes: implications for therapy », Ann Allergy Asthma Immunol, vol. 117, 2016, p.121-125.
- WENZEL, S.E., L.B. Schwartz, E.L. Langmack, et al. « Evidence that severe asthma can be divided pathologically into two inflammatory subtypes with distinct physiologic and clinical characteristics », Am J Respir Crit Care Med, vol. 160, 1999, 1001-1008.
- LOTVALL, J., C.A. Akdis, L.B. Bacharier, et al. « Asthma endotypes: a new approach to classification of disease entities within the asthma syndrome », J Allergy Clin Immunol, vol. 127, 2011, p. 355-360.
- BROWN, H.M. « Treatment of chronic asthma with prednisolone; significance of eosinophils in the sputum », Lancet, vol. 2, 1958, p. 1245-1247.
- GREEN, R.H., C.E. Brightling, S. McKenna, et al. « Asthma exacerbations and sputum eosinophil counts: a randomised controlled trial » Lancet, vol. 360, 2002, 1715-1721.
- PAVORD, I.D., C.E. Brightling, G. Woltmann et A.J. Wardlaw. « Non-eosinophilic corticosteroid unresponsive asthma », Lancet, vol. 353, 1999, p. 2213-2214.
- LEUNG, D.Y., R.J. Martin, S.J. Szefler, et al. « Dysregulation of interleukin 4, interleukin 5, and interferon gamma gene expression in steroid-resistant asthma », J Exp Med, vol. 181, 1995, p. 33-40.
- WOODRUFF, P.G., B. Modrek, D.F. Choy, et al. « T-helper type 2-driven inflammation defines major subphenotypes of asthma », Am J Respir Crit Care Med, vol. 180, 2009, p. 388-395.
- ROMAGNANI, S. « T-cell subsets (Th1 versus Th2) » Ann Allergy Asthma Immunol, vol. 85, 2000, p. 9-18; quiz, 21.
- BARNES, P.J. « Th2 cytokines and asthma: an introduction », Respir Res, vol. 2, 2001, p. 64-65.
- PEARCE, N., J. Douwes et R. Beasley. « Is allergen exposure the major primary cause of asthma? », Thorax, vol. 55, 2000, p. 424-431.
- DOUWES, J., P. Gibson, J. Pekkanen et N. Pearce. « Non-eosinophilic asthma: importance and possible mechanisms », Thorax, vol. 57, 2002, p. 643-648.
- CHOY, M.S., D. Dixit, M.B. Bridgeman. « Mepolizumab (Nucala) For Severe Eosinophilic Asthma », P T, vol. 41, 2016, p. 619-622.
- CHUNG, K.F. « Personalised medicine in asthma: time for action: Number 1 in the Series « Personalised medicine in respiratory diseases » Edited by Renaud Louis and Nicolas Roche », Eur Respir Rev, vol. 26, 2017.
- CHAPMAN, K.R., A. Cartier, J. Hebert, R.A. McIvor et R.R. Schellenberg. « The role of omalizumab in the treatment of severe allergic asthma », Can Respir J, vol. 13, suppl. B, 2006, p. 1B-9B.
- DEEKS, E.D. « Mepolizumab: A Review in Eosinophilic Asthma », BioDrugs, vol. 30, 2016, p. 361-370.
- MUKHERJEE, M., R. Sehmi et P. Nair. « Anti-IL5 therapy for asthma and beyond ». World Allergy Organ J, vol. 7, 2014, p. 32.
- CASALE, T.B., I.L. Bernstein, W.W. Busse, et al. « Use of an anti-IgE humanized monoclonal antibody in ragweed-induced allergic rhinitis », J Allergy Clin Immunol, vol. 100, 1997, p. 110-121.
- DARVEAUX, J. et W.W. Busse. « Biologics in asthma–the next step toward personalized treatment », J Allergy Clin Immunol Pract, vol. 3, 2015, p. 152-160; quiz 61.
- KATZ, L.E., G.J. Gleich, B.F. Hartley, S.W. Yancey et H.G. Ortega. « Blood eosinophil count is a useful biomarker to identify patients with severe eosinophilic asthma », Ann Am Thorac Soc, vol. 11, 2014, p. 531-536.
- HANANIA, N.A., P. Korenblat, K.R. Chapman, et al. « Efficacy and safety of lebrikizumab in patients with uncontrolled asthma (LAVOLTA I and LAVOLTA II): replicate, phase 3, randomised, double-blind, placebo-controlled trials », Lancet Respir Med, vol. 4, 2016, p. 781-796.
- WENZEL, S., M. Castro, J. Corren, et al. « Dupilumab efficacy and safety in adults with uncontrolled persistent asthma despite use of medium-to-high-dose inhaled corticosteroids plus a long-acting beta2 agonist: a randomised double-blind placebo-controlled pivotal phase 2b dose-ranging trial », Lancet, vol. 388, 2016, p. 31-44.
- CIEPIELA, O., M. Ostafin et U. Demkow. « Neutrophils in asthma–a review », Respir Physiol Neurobiol, vol. 209, 2015, p. 13-16.
- AGACHE, I. et C.A. Akdis. « Endotypes of allergic diseases and asthma: An important step in building blocks for the future of precision medicine », Allergol Int, vol. 65, 2016, p. 243-252.
- BUSSE, W.W., S. Holgate, E. Kerwin, et al. « Randomized, double-blind, placebo-controlled study of brodalumab, a human anti-IL-17 receptor monoclonal antibody, in moderate to severe asthma », Am J Respir Crit Care Med, vol. 188, 2013, p. 1294-1302.
- BOULET, L.P. et P.M. O’Byrne. « Asthma and exercise-induced bronchoconstriction in athletes », N Engl J Med, vol. 372, 2015, p. 641-648.
- FITZPATRICK, A.M., M. Higgins, F. Holguin, et al. « The molecular phenotype of severe asthma in children », J Allergy Clin Immunol, vol. 125, 2010, p. 5:851-857 e18.
- RAY, A., M. Raundhal, T.B. Oriss, P. Ray, S.E. Wenzel. « Current concepts of severe asthma », J Clin Invest, vol. 126, 2016, p. 2394-2403.
- TO, T., J. Simatovic, J. Zhu, et al. « Asthma deaths in a large provincial health system. A 10-year population-based study », Ann Am Thorac Soc, vol. 11, 2014, p. 1210-1217.
- ORTEGA, H.G., M.C. Liu, I.D. Pavord, et al. « Mepolizumab treatment in patients with severe eosinophilic asthma », N Engl J Med, vol. 371, 2014, p. 1198-1207.
- CASTRO, M., J. Zangrilli, M.E. Wechsler, et al. « Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicentre, parallel, double-blind, randomised, placebo-controlled, phase 3 trials », Lancet Respir Med, vol. 3, 2015, p. 355-366.
- Fitzgerald, J.M., E.R. Bleecker, P. Nair, et al. « Benralizumab, an anti-interleukin-5 receptor alpha monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised, double-blind, placebo-controlled phase 3 trial », Lancet, vol. 388, 2016, p. 2128-2141.
- CHUNG, K.F., S.E. Wenzel, J.L. Brozek, et al. « International ERS/ATS guidelines on definition, evaluation and treatment of severe asthma», Eur Respir J, vol. 43, 2014, p. 343-373.
Chapitre 2 : Endotypes de l’asthme grave
La médecine de précision, qui traite des mécanismes physiopathologiques sous-jacents de l’asthme, est tributaire des progrès réalisés dans la définition des endotypes de cette maladie. Contrairement aux phénotypes descriptifs utilisés de longue date pour grouper les patients d’après des caractéristiques observables, les endotypes font référence à des mécanismes physiopathologiques distincts susceptibles d’être pris pour cibles. Même s’il ne fait que commencer, le recensement d’endotypes signifiants de l’asthme progresse. Les biomarqueurs, indices d’une plus grande probabilité d’obtenir une réaction favorable aux traitements ciblés actuellement offerts, ont été le premier pas vers la personnalisation des traitements. Cela dit, il est peu probable que l’asthme — terme générique désignant un ensemble de processus pathologiques complexes et hétérogènes — soit ramené à des endotypes définis par un seul mécanisme moléculaire, surtout s’il est grave. Les phénomènes moléculaires, génétiques et épigénétiques étant utilisés pour distinguer les divers endotypes les uns des autres, l’objectif sera plutôt de découvrir les principaux processus que la médecine de précision pourra prendre pour cibles chez les patients ayant en commun certaines manifestations de la maladie.
Afficher la revue