Revue d’experts
L'asthme grave : caractérisation aux fins de personnalisation du traitement
Chapitre 4 : Les agents anti-IL-5 et les autres agents biologiques opposés à l’asthme grave
J. Mark FitzGerald, M.D., FRCPC
Professeur, Division de pneumologie
Université de Colombie-Britannique,
Vancouver, Colombie-Britannique
Les anticorps monoclonaux ciblant la voie de l’interleukine 5 (IL-5) exercent des effets positifs contre l’asthme hyperéosinophilique grave ne réagissant pas de manière optimale à un traitement par inhalation bien conduit, tel qu’une corticothérapie alliée à un β-agoniste à longue durée d’action. Cette inhibition de l’IL-5 a mené au constat que les granulocytes éosinophiles, qui parviennent à maturité et prolifèrent en réaction à cette cytokine, pouvaient être pris pour cibles en tant que médiateurs de l’inflammation des voies aériennes. Les indications actuelles des inhibiteurs de l’IL-5 reposent sur l’évaluation de la raison d’être, de la méthodologie et des résultats des essais cliniques ayant porté sur ces agents, mais l’utilisation de ces derniers pourrait évoluer à la lumière des études qui serviront à répondre aux questions restées sans réponse, notamment à propos de l’importance relative de la déplétion en éosinophiles. Les propriétés qui distinguent les agents anti-IL-5 les uns des autres, dont leur mode d’action, pourraient se révéler importantes sur le plan clinique et aider à mieux comprendre comment ils jugulent l’inflammation des voies aériennes. Ces agents biologiques sont relativement bien tolérés même s’ils sont administrés pendant longtemps, mais il demeure que leur utilisation efficiente passe obligatoirement par une sélection minutieuse des patients et la personnalisation des soins.
Contexte
L’établissement d’un lien entre l’hyperéosinophilie et l’asthme remonte à plus d’un siècle1. La corrélation entre un asthme grave et des concentrations élevées de granulocytes éosinophiles dans le sang et les expectorations donne à penser que l’hyperéosinophilie est un facteur intervenant dans la pathogenèse de l’asthme sur lequel il serait possible d’agir1. Avant même l’arrivée des traitements expressément conçus pour exercer une régulation négative des granulocytes éosinophiles ou pour en inhiber l’activation, les chercheurs avaient constaté que la diminution de ces cellules dans les expectorations obtenue en ajustant les doses de corticostéroïdes pour inhalation (CSI) se traduisait par une raréfaction des exacerbations2,3. Les granulocytes éosinophiles, tout comme les autres leucocytes, se forment dans la moelle osseuse et migrent dans la grande circulation une fois complètement différenciés4. Ils résident généralement dans les tissus muqueux périphériques, dont le tissu lymphoïde, durant leur demi-vie relativement courte. La moelle osseuse contient plusieurs progéniteurs des granulocytes éosinophiles, mais l’IL-5, une cytokine, joue un rôle prépondérant dans leur orientation vers une différenciation éosinophile4. D’autres cytokines produites par les lymphocytes T auxiliaires de type 2 (TH2), telles que l’IL-4 et l’IL-13, interviennent dans la prolifération et la migration des éosinophiles au cours de la réaction inflammatoire, mais l’IL-5 participe à toutes les étapes du développement des éosinophiles, y compris leur différenciation dans la moelle osseuse, leur migration et leur survie au foyer d’inflammation. C’est pourquoi elle est considérée comme le moteur le plus important de l’activité des éosinophiles (Fig. 1) 5.
Les études de phase III sur les anti-IL-5
Trois anticorps monoclonaux dirigés contre l’IL-5 (AcM) ont été évalués dans le traitement de l’asthme grave au cours d’études cliniques de phase III. Deux d’entre eux, le mépolizumab et le reslizumab, ont été homologués par Santé Canada. Ces agents se lient tous les deux à l’IL-5 afin de l’empêcher d’agir. Le troisième agent, le benralizumab, a récemment été homologué par la FDA des É.-U. et semble en bonne voie de l’être ici aussi à la lumière des études qui sont terminées. Contrairement au mépolizumab et au reslizumab, le benralizumab se fixe au récepteur alpha de l’IL-5 (IL5Rα). En outre, le mépolizumab et le benralizumab s’administrent par voie sous-cutanée (s.-c.), alors que le reslizumab est injecté par voie intraveineuse (i.v.). Les monographies du mépolizumab et du reslizumab sont légèrement différentes, une conséquence des résultats des études de phase III. Les premières études négatives menées sur le mépolizumab et le reslizumab – qui ne comportaient pas l’hyperéosinophilie comme critère d’admissibilité – nous ont appris de façon répétée l’importance de bien choisir les patients. Or les études suivantes ont révélé qu’une éosinophilie inférieure à 150 cellules/μL est un facteur de prédiction d’une plus faible efficacité et que plus l’éosinophilie et le nombre d’exacerbations antérieures sont élevés meilleure est la réponse au traitement6.
Le mépolizumab
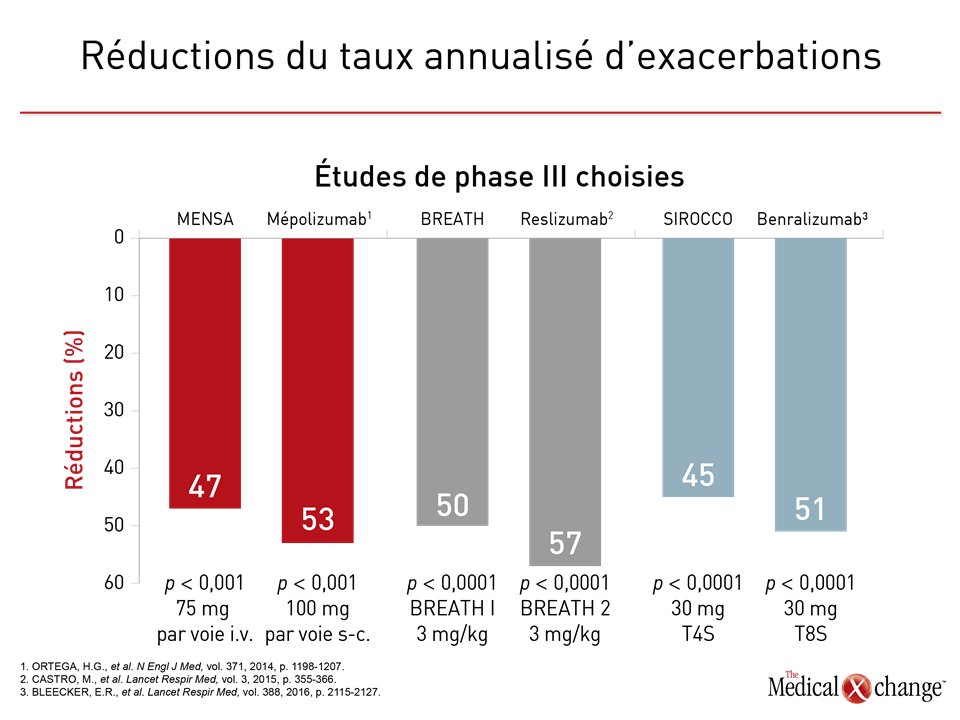
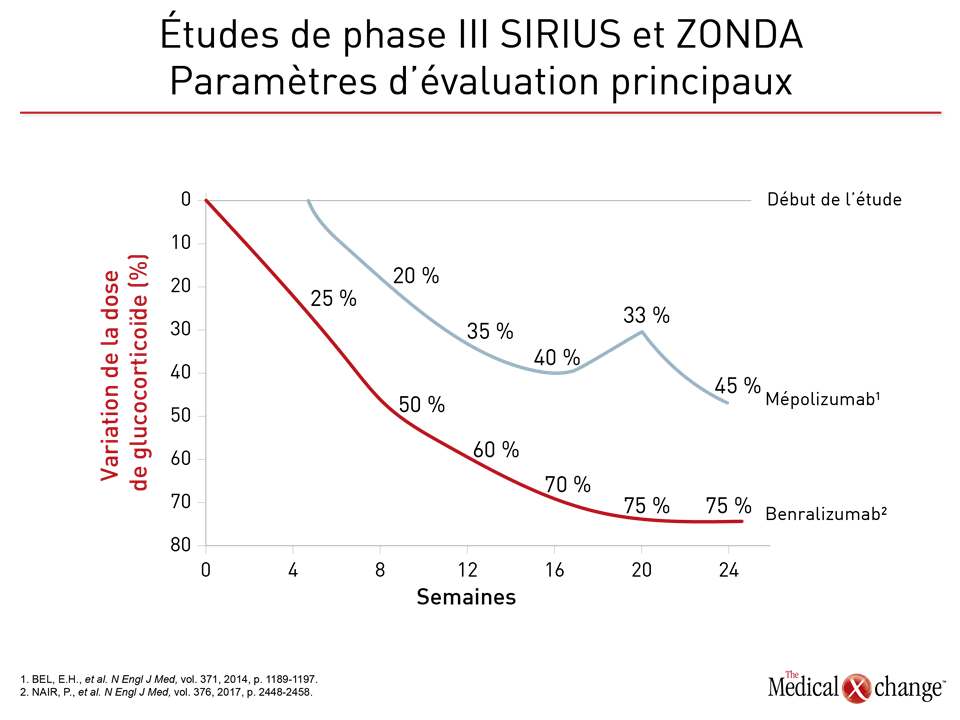
Au cours de la première d’une série d’études de phase III sur le mépolizumab, intitulée DREAM, 621 patients ont été affectés aléatoirement à l’une des trois doses de mépolizumab administré par voie i.v. ou à un placebo7. La présence d’un nombre élevé de granulocytes éosinophiles dans les expectorations (> 3 %) ou le sang (≥ 300 cellules/μL) comptait parmi les critères d’admissibilité de cette étude, mais d’autres signes d’asthme grave, comme une fraction d’oxyde nitrique exhalé (FeNO) égale ou supérieure à 50 ppb, étaient permis. Comparativement au placebo, la dose la plus forte et la plus efficace de mépolizumab a été reliée à une réduction de plus de 50 % du taux annualisé d’exacerbations (1,15 versus 2,4; p < 0,0001). La différence d’efficacité observée entre les doses plus faibles de mépolizumab et le placebo était elle aussi significative, mais il reste que la dose la plus forte était plus efficace. En outre, le bilan d’innocuité de toutes les doses se comparait à celui du placebo. Les résultats de deux études de phase III menées par la suite, soit les études MENSA et SIRIUS, ont été publiés en même temps. Le principal paramètre d’évaluation utilisé pendant ces études était respectivement la variation du taux d’exacerbations6 et l’importance de la réduction de la dose de glucocorticoïde8. La présence d’une éosinophilie égale ou supérieure à 300 cellules/µL pendant l’année précédente ou à 150 cellules/µL ou plus au moment du recrutement faisait partie des critères d’admissibilité aux deux études, un autre étant l’obtention de résultats positifs à une épreuve de provocation par la méthacholine ou le mannitol au cours de l’année précédente. L’étude SIRIUS était composée de deux groupes de sujets; l’un recevait 100 mg de mépolizumab administré par voie s.-c. toutes les 4 semaines et l’autre, un placebo apparié. L’étude MENSA quant à elle comportait un troisième groupe de sujets recevant 75 mg de mépolizumab par voie i.v. Pendant les 32 semaines de suivi de l’étude MENSA, le taux d’exacerbations a baissé de 47 % chez les sujets traités par la dose de 75 mg administrée par voie i.v. et de 53 % chez ceux qui recevaient des injections s.-c. de 100 mg (p < 0,001 dans les deux cas) comparativement aux témoins. Par ailleurs, les différences enregistrées pour plusieurs mesures de la fonction respiratoire, notamment l’augmentation moyenne du VEMS depuis le début de l’étude, étaient également significatives comparativement au placebo. Le traitement actif a aussi été relié à une amélioration des résultats obtenus par rapport au début de l’étude à des questionnaires validés portant sur les symptômes tels que le questionnaire en 5 points sur la maîtrise de l’asthme (Asthma Control Questionnaire [ACQ-5]). Les chercheurs de l’étude SIRIUS ont observé une diminution médiane de 50 % de la dose de glucocorticoïde utilisée par les sujets ayant reçu des injections s.-c. de mépolizumab, mais aucun changement à ce chapitre chez les témoins (p = 0,007). Ils ont également noté une baisse significative du taux annualisé d’exacerbations chez les sujets traités par le mépolizumab comparativement aux témoins (1,44 versus 2,12; p = 0,04). L’atténuation des symptômes objectivée par le questionnaire ACQ-5 était voisine de celle observée pendant l’étude MENSA. Le mépolizumab a également été relié à une amélioration significative des résultats enregistrés au questionnaire SGRQ (St. George’s Respiratory Questionnaire). Les données tirées de ces études ont joué un rôle prépondérant dans l’homologation par Santé Canada de la préparation de mépolizumab dosée à 100 mg pour administration par voie s.-c. toutes les 4 semaines. Elle est indiquée en appoint au traitement d’entretien chez les adultes atteints d’asthme grave accompagné d’une éosinophilie sanguine élevée, soit au moins 150 cellules/μL au moment d’entreprendre leur traitement ou 300 cellules/μL ou plus au cours de l’année précédente. En outre, les patients ne doivent pas avoir réussi à maîtriser convenablement leur asthme à l’aide de doses élevées de CSI alliées à un autre traitement de fond tel qu’un β-agoniste à longue durée d’action (BALA).
Le reslizumab
Le programme d’études cliniques du reslizumab a connu un parcours comparable à celui du mépolizumab. Une première étude pilote contrôlée par placebo qui ne comptait pas l’éosinophilie comme critère d’admissibilité a donné des résultats négatifs9. Or des bienfaits cliniques sont ressortis d’une étude subséquente pour laquelle une éosinophilie minimale avait été fixée, ce qui a justifié le recours à ce critère pour les études de phase III qui ont suivi10. Les résultats des deux études jumelles contrôlées par placebo du programme de phase III intitulé BREATH ont été publiés ensemble11. Seuls des patients atteints d’un asthme grave mal maîtrisé et présentant un nombre d’éosinophiles égal ou supérieur à 400 cellules/μL pouvaient y être recrutés. Le reslizumab leur a été administré par voie i.v. à une dose calculée en fonction de leur poids, soit 3,0 mg/kg toutes les 4 semaines. Le taux annualisé d’exacerbations a baissé de 50 % avec le reslizumab dans une des deux études et de 59 % dans l’autre (p < 0,001 dans les deux cas). Le bilan d’innocuité de cet agent, tout comme celui du mépolizumab, a été qualifié de semblable à celui d’un placebo. Les données tirées de ces études ont été pour beaucoup dans l’homologation par Santé Canada de la préparation de reslizumab dosée à 100 mg pour administration par voie i.v. toutes les 4 semaines. À l’instar du mépolizumab, le reslizumab est indiqué en appoint au traitement d’entretien chez les adultes atteints d’asthme grave à éosinophiles, qui ne réussissent pas à maîtriser convenablement leur asthme à l’aide de doses élevées de CSI alliées à un autre traitement de fond tel qu’un BALA. Se faisant l’écho des essais de phase III, la monographie précise que l’éosinophilie doit s’élever à 400 cellules/μL ou plus au moment d’amorcer le traitement, soit un seuil différent de celui prescrit pour le mépolizumab. La FDA a exigé que la monographie étatsunienne du reslizumab recommande une surveillance étroite des patients visant à déceler la moindre hypersensibilité ou réaction anaphylactique risquant d’engager le pronostic vital. Pour l’heure, rien n’indique que le reslizumab ait un effet d’épargne des stéroïdes.
Le benralizumab
Des chercheurs ont réalisé trois essais de phase III avec le benralizumab, qui se lie au récepteur alpha de l’IL-5 (IL5Rα), dans l’espoir de produire rapidement une déplétion des éosinophiles grâce à une action cytotoxique dépendante de la présence d’anticorps (ADCC)12. Au cours des études de phase I, l’administration par voie i.v. de doses uniques de benralizumab, dont la demi-vie moyenne excède 2 semaines, a entraîné une déplétion rapide et presque totale des éosinophiles13. L’efficacité et l’innocuité dont a fait preuve une préparation de benralizumab pour injection s.-c. dans le cadre des études de phase II ont pavé la voie aux études de phase III qui ont suivi14,15. Pendant deux d’entre elles, soit les études SIROCCO et CALIMA, des patients aux prises avec un asthme grave mal maîtrisé répondant à de nombreux critères cliniques, notamment des antécédents d’au moins 2 exacerbations au cours de l’année précédente malgré l’utilisation de doses élevées de CSI et normalement au moins un autre traitement de fond, ont été répartis aléatoirement de façon à recevoir soit 30 mg de benralizumab par voie s.-c. toutes les 4 semaines (T4S) ou toutes les 8 semaines (T8S), soit un placebo. Or le benralizumab administré T4S ou T8S a permis de raréfier les exacerbations de 45 % et de 51 % (rapports des taux), respectivement (p < 0,001 dans les deux cas) comparativement au placebo pendant les 48 semaines de suivi16. Dans le cadre de l’étude CALIMA, les rapports des taux témoignant de la raréfaction des exacerbations par rapport au placebo se sont respectivement chiffrés à 36 % (p = 0,0018) et à 28 % (p = 0,0188)17. Lors de l’étude ZONDA qui a pris fin récemment et qui comportait comme critère d’admissibilité une éosinophilie sanguine de 150 cellules/μL ou plus18, les patients ont là aussi été répartis aléatoirement de façon à recevoir soit 30 mg de benralizumab T4S ou T8S, soit un placebo. Pour ce qui est du paramètre d’évaluation principal, le benralizumab a entraîné une baisse de 75 % de la dose de glucocorticoïde entre le début et la 28e semaine de l’étude, soit une réduction significativement plus marquée que les 25 % observés avec le placebo (p < 0,001). Le taux annualisé d’exacerbations a été réduit de 55 % et de 70 % dans les groupes traités par le benralizumab T4S et T8S, respectivement (p = 0,003 et p < 0,001) comparativement aux témoins. L’incidence des effets indésirables signalés avec le benralizumab a également été similaire à celui du placebo. Aucune étude d’envergure menée avec répartition aléatoire au cours de laquelle le mépolizumab aurait été comparé au reslizumab n’a encore été réalisée. Ces deux agents sont les seuls qui sont présentement homologués aux fins d’inhibition de la voie de l’IL-5 dans les cas d’asthme. Or ces deux agents et l’autre médicament expérimental, le benralizumab, sont dotés de caractéristiques différentes qui pourraient présenter un intérêt clinique (Tableau 1). Certes les études de phase III étaient assorties de critères d’admissibilité et de schémas thérapeutiques variés, mais elles ont toutes mis au jour des baisses substantielles du taux annualisé d’exacerbations (Fig. 2). Les études de phase III SIRIUS et ZONDA ayant porté respectivement sur le mépolizumab et le benralizumab ont toutes les deux fait ressortir des gains significatifs pour ce qui est de leur paramètre d’évaluation principal, soit l’effet du traitement sur l’épargne des glucocorticostéroïdes (Fig. 3).
Les agents anti-IL-5 : une démarche concrète
Comme l’ont montré les études de phase III, les inhibiteurs de la voie de l’IL-5 exercent des effets cliniques positifs lorsqu’ils sont employés comme traitement d’appoint chez les adultes atteints d’un asthme grave à éosinophiles qu’un CSI allié à un autre traitement de fond ne parvient pas à maîtriser convenablement. Ces médicaments peuvent représenter des options intéressantes pour améliorer l’issue du traitement chez les types de patients qui étaient recrutés dans les études cliniques et en fonction desquels les indications actuelles ont été arrêtées. Cela dit, ces agents doivent absolument être utilisés de façon judicieuse compte tenu de leur coût et de leur administration itérative par voie i.v. ou s.-c. Les agents biologiques opposés à l’asthme grave comprennent maintenant des AcM anti-IL-5, ainsi que l’omalizumab, un AcM qui se lie aux IgE. Avant d’avoir recours à l’un ou l’autre de ces agents ciblés chez un patient, il est important de confirmer que les traitements types ne soulagent pas suffisamment ses symptômes. De nombreuses raisons peuvent expliquer l’obtention d’une réponse insuffisante, dont la non-exécution des ordonnances ou une mauvaise utilisation des médicaments prescrits. Par exemple, la technique d’inhalation, qui est une cause courante d’échec thérapeutique19, doit être vérifiée périodiquement. Il faut également évaluer la présence éventuelle de maladies concomitantes imitant ou exacerbant les symptômes de l’asthme, telles que le reflux gastro-œsophagien (RGO), la sinusite et le syndrome d’apnées obstructives du sommeil (SAOS) et traiter ces affections le cas échéant20. Moins de 10 % des patients atteints d’asthme sont affligés d’une forme grave de la maladie, celle-ci se définissant par une piètre maîtrise des symptômes malgré une utilisation bien adaptée des traitements types21. Le pourcentage de ces patients chez lesquels les granulocytes éosinophiles pourraient être une cible thérapeutique est, semble-t-il, encore plus faible. Selon la monographie en vigueur, un nombre élevé d’éosinophiles est une condition sine qua non pour amorcer un traitement par des agents biologiques dirigés contre l’IL-5. D’autres conditions destinées à restreindre l’utilisation des ressources en santé et à porter au maximum l’efficience de ces agents pourraient néanmoins être dictées dans diverses régions canadiennes. Pour le moment, l’idéal pour les patients atteints d’asthme dont la maladie est tellement mal maîtrisée en médecine de premier recours qu’elle pourrait justifier l’emploi d’agents biologiques serait d’être orientés vers un spécialiste qui sera alors à même d’analyser le bien-fondé de ces médicaments en regard des autres options offertes aux cas difficiles. Par ailleurs, les données probantes accumulées jusqu’à aujourd’hui restent muettes sur certaines caractéristiques des agents biologiques, y compris la durée optimale du traitement.
Conclusion
Les agents ciblant l’IL-5 sont efficaces chez certains patients atteints d’asthme grave à éosinophilies. La raréfaction des exacerbations observée avec ces agents pendant les études de phase III vient combler un besoin dans une population jusqu’à maintenant réfractaire aux traitements classiques. Il est probable que les travaux visant à concevoir des agents ciblés et à généraliser la personnalisation des traitements se traduisent par une amélioration des soins et par un enrichissement des connaissances sur l’intervention des granulocytes éosinophiles et des autres médiateurs de l’inflammation dans l’expression des phénotypes de l’asthme.
Références
- BOUSQUET, J., P. Chanez, J.Y. Lacoste, et al. « Eosinophilic inflammation in asthma », N Engl J Med, vol. 323, 1990, p. 1033-1039.
- CHLUMSKY, J., I. Striz, M. Terl et J. Vondracek. « Strategy aimed at reduction of sputum eosinophils decreases exacerbation rate in patients with asthma », J Int Med Res, vol. 34, 2006, p. 129-139.
- JAYARAM, L., M.M. Pizzichini, R.J. Cook, et al. « Determining asthma treatment by monitoring sputum cell counts: effect on exacerbations », Eur Respir J, vol. 27, 2006, p. 483-494.
- SHALIT, M., S. Sekhsaria et H.L. Malech. « Modulation of growth and differentiation of eosinophils from human peripheral blood CD34+ cells by IL5 and other growth factors », Cell Immunol, vol. 160, 1995, p. 50-57.
- NIXON, J., P. Newbold, T. Mustelin, G.P. Anderson et R. Kolbeck. « Monoclonal antibody therapy for the treatment of asthma and chronic obstructive pulmonary disease with eosinophilic inflammation », Pharmacol Ther, vol. 169, 2017, p. 57-77.
- ORTEGA, H.G., M.C. Liu, I.D. Pavord, et al. « Mepolizumab treatment in patients with severe eosinophilic asthma », N Engl J Med, vol. 371, 2014, p. 1198-1207.
- PAVORD, I.D., S. Korn, P. Howarth, et al. « Mepolizumab for severe eosinophilic asthma (DREAM): a multicentre, double-blind, placebo-controlled trial », Lancet, vol. 380, 2012, p. 651-659.
- BEL, E.H., S.E. Wenzel, P.J. Thompson, et al. « Oral glucocorticoid-sparing effect of mepolizumab in eosinophilic asthma », N Engl J Med, vol. 371, 2014, p. 1189-1197.
- KIPS, J.C., B.J. O’Connor, S.J. Langley, et al. « Effect of SCH55700, a humanized anti-human interleukin-5 antibody, in severe persistent asthma: a pilot study », Am J Respir Crit Care Med, vol. 167, 2003, p. 1655-1659.
- CASTRO, M., S. Mathur, F. Hargreave, et al. « Reslizumab for poorly controlled, eosinophilic asthma: a randomized, placebo-controlled study », Am J Respir Crit Care Med, vol. 184, 2011, p. 1125-1132.
- CASTRO, M., J. Zangrilli, M.E. Wechsler, et al. « Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: results from two multicentre, parallel, double-blind, randomised, placebo-controlled, phase 3 trials », Lancet Respir Med, vol. 3, 2015, p. 355-366.
- GHAZI, A., A. Trikha et W.J. Calhoun. « Benralizumab–a humanized mAb to IL-5Ralpha with enhanced antibody-dependent cell-mediated cytotoxicity–a novel approach for the treatment of asthma », Expert Opin Biol Ther, vol. 12, 2012, p. 113-118.
- BUSSE, W.W., R. Katial, D. Gossage, et al. « Safety profile, pharmacokinetics, and biologic activity of MEDI-563, an anti-IL-5 receptor alpha antibody, in a phase I study of subjects with mild asthma », J Allergy Clin Immunol, vol. 125, 2010, p. 1237-44 e2.
- CASTRO, M., S.E. Wenzel, E.R. Bleecker, et al. « Benralizumab, an anti-interleukin 5 receptor alpha monoclonal antibody, versus placebo for uncontrolled eosinophilic asthma: a phase 2b randomised dose-ranging study », Lancet Respir Med, vol. 2, 2014, p. 879-890.
- LAVIOLETTE, M., D.L. Gossage, G. Gauvreau, et al. « Effects of benralizumab on airway eosinophils in asthmatic patients with sputum eosinophilia », J Allergy Clin Immunol, vol. 132, 2013, p. 1086-96 e5.
- BLEECKER, E.R., J.M. FitzGerald, P. Chanez, et al. « Efficacy and safety of benralizumab for patients with severe asthma uncontrolled with high-dosage inhaled corticosteroids and long-acting beta2-agonists (SIROCCO): a randomised, multicentre, placebo-controlled phase 3 trial », Lancet, vol. 388, 2016, p. 2115-2127.
- FITZGERALD, J.M., E.R. Bleecker, P. Nair, et al. « Benralizumab, an anti-interleukin-5 receptor alpha monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised, double-blind, placebo-controlled phase 3 trial », Lancet, vol. 388, 2016, p. 2128-2141.
- NAIR, P., S. Wenzel, K.F. Rabe, et al. « Oral Glucocorticoid-Sparing Effect of Benralizumab in Severe Asthma », N Engl J Med, 2017.
- SANCHIS, J., I. Gich et S. Pedersen. « Aerosol Drug Management Improvement T. Systematic Review of Errors in Inhaler Use: Has Patient Technique Improved Over Time? », Chest, vol. 150, 2016, p. 394-406.
- BOULET, L.P. et M.E. Boulay. « Asthma-related comorbidities », Expert Rev Respir Med, vol. 5, 2011, p. 377-393.
- CUSTOVIC, A., S.L. Johnston, I. Pavord, et al. « EAACI position statement on asthma exacerbations and severe asthma », Allergy, vol. 68, 2013, p. 1520-1531.
Chapitre 4 : Les agents anti-IL-5 et les autres agents biologiques opposés à l’asthme grave
Les anticorps monoclonaux ciblant la voie de l’interleukine 5 (IL-5) exercent des effets positifs contre l’asthme hyperéosinophilique grave ne réagissant pas de manière optimale à un traitement par inhalation bien conduit, tel qu’une corticothérapie alliée à un β-agoniste à longue durée d’action. Cette inhibition de l’IL-5 a mené au constat que les granulocytes éosinophiles, qui parviennent à maturité et prolifèrent en réaction à cette cytokine, pouvaient être pris pour cibles en tant que médiateurs de l’inflammation des voies aériennes. Les indications actuelles des inhibiteurs de l’IL-5 reposent sur l’évaluation de la raison d’être, de la méthodologie et des résultats des essais cliniques ayant porté sur ces agents, mais l’utilisation de ces derniers pourrait évoluer à la lumière des études qui serviront à répondre aux questions restées sans réponse, notamment à propos de l’importance relative de la déplétion en éosinophiles. Les propriétés qui distinguent les agents anti-IL-5 les uns des autres, dont leur mode d’action, pourraient se révéler importantes sur le plan clinique et aider à mieux comprendre comment ils jugulent l’inflammation des voies aériennes. Ces agents biologiques sont relativement bien tolérés même s’ils sont administrés pendant longtemps, mais il demeure que leur utilisation efficiente passe obligatoirement par une sélection minutieuse des patients et la personnalisation des soins.
Afficher la revue