Revue d’experts
Maîtrise de la douleur causée par l’arthrose du genou : les infiltrations d’acide hyaluronique
Chapitre 3 : Les infiltrations d’acide hyaluronique dans le genou : prise en charge des symptômes en pratique clinique
Dr Michael Clarfield, CCMF
Directeur, Spécialistes en médecine du sport, Toronto, Ontario
La prise en charge de la gonarthrose vise à maîtriser la douleur et à limiter le plus possible l’incapacité fonctionnelle. Les cliniciens s’emploient à personnaliser le traitement en s’attaquant à l’objectif le plus pressant, soit la maîtrise de la douleur, tout en réduisant au minimum les risques inhérents aux traitements au long cours que la lutte contre cette maladie chronique exige parfois. Parmi les traitements pharmacologiques opposés à la gonarthrose, les infiltrations d’acide hyaluronique permettent de conjuguer efficacité et innocuité. Contrairement aux autres traitements conservateurs qui se montrent efficaces contre la douleur arthrosique, tels que les anti-inflammatoires non stéroïdiens (AINS), l’infiltration localisée d’acide hyaluronique risque peu de provoquer des effets indésirables locaux ou généraux. Comparativement aux préparations d’acide hyaluronique lancées en Europe et aux États-Unis dans les années 1990, les plus récentes comportent de nombreux avantages dont un effet durable au moyen d’une seule injection et dans certains cas, un soulagement plus rapide de la douleur. Les caractéristiques qui distinguent ces préparations les unes des autres pourraient se révéler encore plus utiles pour la personnalisation des soins chez certains patients.
Contexte
L’arthrose est souvent perçue, à tort, comme une maladie du vieil âge. Bien que la détérioration du cartilage aboutissant à l’arthrose puisse effectivement être liée au vieillissement, les phénomènes graduels qui caractérisent cette affection ont de nombreuses causes. Aujourd’hui, l’âge médian auquel l’arthrose est diagnostiquée est de 55 ans1, mais les blessures au genou qui endommagent le cartilage, les ligaments ou le ménisque, perturbent l’équilibre entre ces structures articulaires interdépendantes et déclenchent une arthrose évolutive, peuvent survenir à n’importe quel âge2. La perturbation du fonctionnement biomécanique d’un membre peut imposer des contraintes asymétriques à l’articulation et y provoquer une dégénérescence précoce. Les blessures au genou ne se soldent pas toutes par de l’arthrose, une affection multifactorielle qui peut avoir un lien avec une prédisposition génétique3, mais certaines contraintes imposées au genou, y compris les blessures, en augmentent considérablement le risque4. La gonarthrose clinique peut s’installer peu à peu pendant une dizaine d’années ou plus après la blessure de référence5. Les traumatismes ou les blessures au genou survenant tôt dans la vie font donc en sorte que l’incidence de la gonarthrose augmente dès la trentaine, certains cas étant rapportés chez des patients encore plus jeunes6.
Des données probantes ayant révélé que la gonarthrose peut s’installer après une blessure traumatique au genou, les chercheurs se sont penchés sur le risque que constituent pour l’arthrose d’apparition précoce les blessures infligées lors de la pratique d’un sport. L’étude du lien entre les déchirures du ligament croisé antérieur (LCA) réparées par des méthodes chirurgicales et la gonarthrose, par exemple, a permis de conclure que le risque de gonarthrose consécutivement à une seule blessure est faible, mais qu’il grimpe en flèche chez les patients ayant subi une autre blessure structurelle au genou en plus d’une déchirure du LCA7.
Cela dit, les blessures traumatiques ne sont pas les seules agressions qui déclenchent la détérioration du cartilage articulaire. L’obésité, dont l’incidence augmente dans de nombreux pays, y compris le Canada,8 est aussi associée à une hausse du risque d’arthrose d’apparition précoce9. Des rapports faisant état de lésions au cartilage articulaire chez des adolescents obèses sont venus corroborer les contraintes biomécaniques que l’obésité impose au genou10. En outre, l’obésité, un état inflammatoire, peut perturber encore plus l’équilibre articulaire en exerçant une régulation positive des facteurs qui favorisent le processus pathologique menant à l’arthrose11.
Le traitement de la gonarthrose chez des patients relativement jeunes met en lumière les difficultés qu’il y a à maintenir pendant longtemps un juste équilibre entre efficacité et innocuité, un problème qui est tout aussi important chez les personnes plus âgées. L’arthrose étant une maladie à la fois incurable et évolutive, sa prise en charge doit forcément reposer sur des stratégies de traitement au long cours. L’arthrose n’évolue pas à la même vitesse chez tous les patients, loin de là12, mais les lésions finissent par s’étendre aux autres tissus articulaires, dont la membrane synoviale, les muscles, les ligaments et l’os chez la majorité d’entre eux13. Les traitements non pharmacologiques, tels que la perte de poids chez les patients obèses ou les exercices de musculation chez les victimes de blessures traumatiques, sont des alliés importants pour ralentir ou stopper l’évolution de l’arthrose14,15. Les objectifs les plus pressants sont certes le soulagement de la douleur et le rétablissement ou l’amélioration de la fonction articulaire, mais au final, le jumelage d’agents pharmacologiques et d’interventions non pharmacologiques doit viser la stabilisation de la maladie et l’absence d’évolution (Fig. 1).
La gonarthrose : les objectifs cliniques
Un diagnostic de gonarthrose sera plus précis si les observations cliniques sont complétées par des clichés radiographiques16, mais si l’on en juge par le très populaire système de classification de Kellgren et de Lawrence17, il y aurait peu de corrélation entre l’intensité des symptômes et la gravité de l’atteinte articulaire visible sur ces clichés. En pratique essentiellement clinique, les méthodes reproductibles servant à évaluer le fardeau que représente la gonarthrose sur le plan clinique peuvent se révéler utiles pour les patients atteints de gonarthrose installée. Bien que l’indice WOMAC (Western Ontario and McMaster Universities Arthritis Index), qui rend compte de la douleur, de la raideur, de la fonction articulaire et de la symptomatologie dans son ensemble, soit précis18,19, beaucoup de cliniciens n’auront aucun mal à orienter ou à modifier leurs plans de traitement en se fiant uniquement sur les renseignements fournis par leurs patients.
La grande variabilité des manifestations de l’arthrose est la raison qui explique la diversité des objectifs cliniques d’un patient à l’autre. Même si la gonarthrose est reconnue comme la principale cause d’incapacité au Canada et aux États-Unis20,21, la définition de la douleur invalidante et de la raideur articulaire demeurent néanmoins subjectives. Le rétablissement de la fonction articulaire est probablement un objectif plus important pour un jeune athlète affligé d’arthrose et de raideurs que pour une personne âgée qui se plaint surtout de douleur. Il n’en demeure pas moins que le risque d’effets indésirables associé aux traitements chroniques est un problème dans tous les cas. Chez les patients relativement jeunes, il faudra apporter une attention particulière à la maîtrise de la maladie au fil des décennies. Quant aux personnes âgées, il faudra particulièrement tenir compte de leur plus grande vulnérabilité aux effets indésirables aigus des médicaments au moment de choisir un traitement.
Pour l’heure, l’arthrose est incurable. Toutefois, les méthodes de prise en charge qui permettent de ralentir ou de stopper les phénomènes biomécaniques et biochimiques déclenchés par la perte cartilagineuse (par ex., l’inflammation, le remodelage osseux ainsi que la déstabilisation et l’asymétrie articulaires22) soulèvent beaucoup d’intérêt. Or les seules stratégies éprouvées qui permettent réellement d’atteindre ces objectifs sont les interventions non pharmacologiques susceptibles d’atténuer les lésions au cartilage articulaire, comme la perte pondérale chez les obèses. Les nouvelles avenues de traitement à l’étude, notamment les stratégies cellulaires visant la régénération du cartilage23, sont motivées par la volonté d’améliorer l’intégrité articulaire afin de ralentir l’évolution de la maladie.
Les infiltrations d’acide hyaluronique et la maîtrise de l’arthrose
Les infiltrations d’acide hyaluronique, une technique aussi appelée viscosupplémentation, sont offertes depuis plus de 10 ans au Canada pour le traitement de la gonarthrose. Bien qu’elles figurent sur une longue liste de traitements pharmacologiques allant de l’acétaminophène aux opiacés, il convient de noter qu’elles ont été jugées utiles par l’American Academy of Orthopaedic Surgeons (AAOS) chez les patients atteints de gonarthrose réfractaire aux interventions non pharmacologiques conservatrices et autres traitements élémentaires comme l’administration d’acétaminophène24. Dans ses lignes directrices, l’AAOS, qui recommande l’utilisation d’acide hyaluronique dans les formes légères ou modérées de gonarthrose, souligne que les concentrations de cette substance lubrifiante produite naturellement par l’organisme sont généralement réduites chez les patients atteints d’arthrose. Toujours selon cette association, l’acide hyaluronique faciliterait les mouvements de l’articulation du genou et en améliorerait la fonction d’amortisseur, ce qui correspond aux résultats d’études publiées antérieurement25,26.
Des chercheurs ont analysé 76 études publiées sur l’emploi de l’acide hyaluronique dans le traitement de l’arthrose, 36 d’entre elles ayant servi à comparer cette substance à l’exercice ou à des agents actifs tels que des corticostéroïdes administrés par infiltrations intra-articulaires, des anti-inflammatoires non stéroïdiens (AINS). Or au terme d’évaluations ayant porté sur la douleur, la fonction articulaire et l’état des patients dans son ensemble, ils en sont venus à la conclusion que l’acide hyaluronique est efficace27. Leur analyse leur a également permis de constater que l’acide hyaluronique exerce des bienfaits cliniques plus durables que ceux des corticostéroïdes administrés par infiltrations intra-articulaires, qu’il est au moins aussi efficace que la plupart des autres traitements pharmacologiques et qu’il provoque habituellement peu d’effets indésirables généraux. Ils ont toutefois tenu à souligner qu’ils ont observé une certaine variation entre les différents produits étudiés pour ce qui est de l’efficacité et de la chronologie de la réponse clinique.
Cette variation est logique compte tenu des avancées qu’ont connues les préparations d’acide hyaluronique. Les premières préparations étaient toutes assez faiblement dosées en acide hyaluronique, d’où la nécessité d’administrer plusieurs injections, en plus d’être d’origine aviaire. Les préparations qui les ont suivies ont été améliorées de façon à en prolonger l’activité, à abaisser le risque d’effets indésirables et à reproduire le plus fidèlement possible l’activité biochimique de l’acide hyaluronique endogène, celui-ci intervenant davantage dans l’homéostasie articulaire que ce que les scientifiques croyaient au départ (Fig. 2)28. Si le rôle joué par cette substance dans la viscoélasticité de la synovie a été la principale raison ayant motivé la mise au point de produits d’acide hyaluronique exogène29, il faut savoir qu’une quantité importante et sans cesse croissante de données probantes issues d’études cliniques et expérimentales révèle que l’acide hyaluronique pourrait également atténuer la douleur causée par la gonarthrose et améliorer le fonctionnement de l’articulation du genou en agissant sur la perception de la douleur30, en exerçant une régulation positive sur les médiateurs de l’inflammation31 et en empêchant le remodelage de la matrice extracellulaire32.
La composition de la préparation d’acide hyaluronique optimale reste à définir. Certaines données probantes indiquent toutefois qu’un acide hyaluronique de haut poids moléculaire, qui s’approcherait ainsi davantage de l’acide hyaluronique endogène, offrirait une bioactivité plus intense aux patients atteints d’arthrose qu’un acide hyaluronique de bas poids moléculaire33. Un modèle expérimental a en effet permis de démontrer récemment que la lubrification de l’articulation est supérieure avec un acide hyaluronique de haut poids moléculaire34. C’est pourquoi l’acide hyaluronique contenu dans les préparations de nouvelle génération a un poids moléculaire plus élevé que celui des produits qui les ont précédées.
Par ailleurs, les préparations lancées ultérieurement étaient moins souvent d’origine aviaire, ce qui permettait d’éviter les problèmes d’allergie aux protéines aviaires et aux protéines des oeufs. Enfin, les produits les plus récents sont plus fortement dosés en acide hyaluronique, ce qui pourrait en amplifier l’activité biologique, accélérer la maîtrise des symptômes et prolonger la réponse au traitement. Par exemple, Monovisc et Synvisc-One, deux des produits les plus couramment utilisés, sont administrés à raison de 80 mg et de 48 mg par injection, respectivement (Fig. 3).
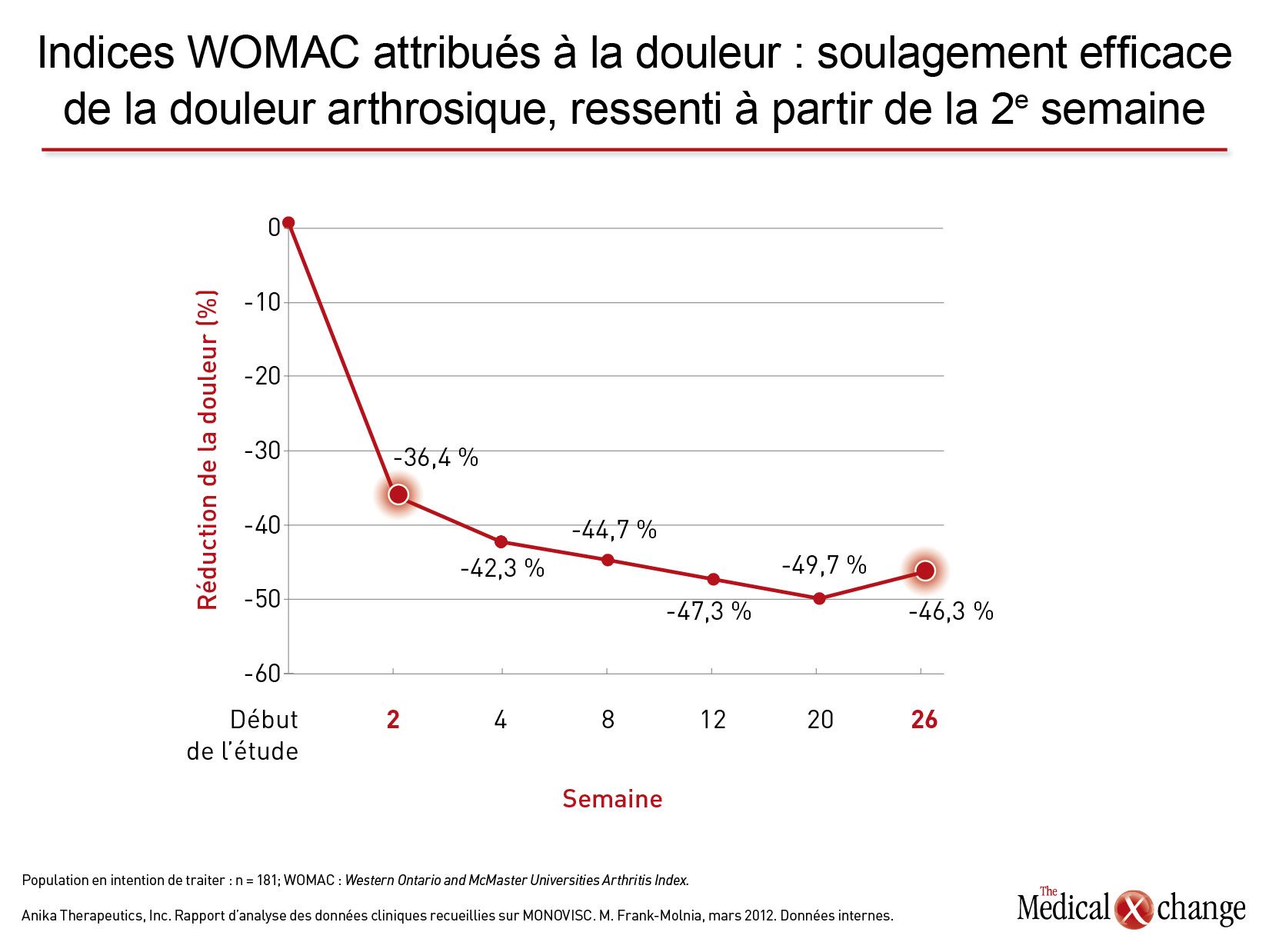
Il n’existe pas d’étude d’envergure menée à double insu et avec répartition aléatoire des sujets ayant servi à comparer les préparations d’acide hyaluronique actuellement sur le marché. Cela dit, les effets relatifs des divers agents pris individuellement, qui ont été objectivés dans le cadre d’essais contrôlés par placebo, correspondent aux avantages théoriques des agents de haut poids moléculaire et à forte concentration. Au cours des essais réalisés en vue de l’homologation de Monovisc, par exemple, les chercheurs ont noté une diminution de 36,4 % des scores attribués à la douleur à la visite de la 2e semaine35, ce qui n’a pas été le cas avec les autres agents. Les indices WOMAC attribués à douleur ont continué de baisser au cours des 18 semaines suivantes et à la fin des 26 semaines, ils se situaient toujours sous la valeur consignée à la 2e (Fig. 4). Le soulagement relativement rapide de la douleur pèse lourd dans l’opinion que se fait le patient de l’efficacité de l’acide hyaluronique et de ses répercussions sur sa qualité de vie.
Le recours à l’acide hyaluronique est un moyen intéressant de maîtriser les symptômes dans les formes légères ou modérées de la maladie lorsque la chronicité du traitement incite à l’utilisation d’agents bien tolérés, qui risquent peu de provoquer des effets indésirables généraux. Une seule infiltration des préparations à forte concentration d’acide hyaluronique de haut poids moléculaire actuellement offertes sur le marché peut être efficace pendant six mois et permet d’éviter les inconvénients et les malaises qui viennent avec les injections administrées à répétition. Il est toutefois recommandé d’utiliser des stratégies d’appoint, telles que des exercices de musculation et des orthèses de genou. Bien que les bienfaits à long terme de ces orthèses n’aient pas été démontrés dans le cadre d’essais cliniques contrôlés, leur utilisation a fait ses preuves en réduisant la charge imposée à l’articulation et en améliorant la symétrie de la démarche36. Il faudra également conseiller à certains patients, notamment ceux qui ne veulent pas ou ne peuvent pas aller en physiothérapie, des moyens de modifier leurs activités de façon à moins solliciter leur articulation malade.
Conclusion
La gonarthrose est une affection difficile à traiter et la poursuite des objectifs les plus pressants doit s’inscrire dans une perspective plus large, en regard du risque d’évolution et de la prise en charge à long terme de la maladie. L’acide hyaluronique est une option thérapeutique parmi beaucoup d’autres, mais il faut savoir qu’il offre une maîtrise des symptômes à tout le moins comparable à celui obtenu avec les AINS et les infiltrations intra-articulaires de corticostéroïdes. Comme il vient se substituer à un composé endogène jouant un rôle majeur dans la cinétique articulaire, l’acide hyaluronique exogène comporte peu de risques d’effets indésirables généraux. Les préparations plus récentes, qui renferment de fortes concentrations d’acide hyaluronique de haut poids moléculaire d’origine non aviaire, reproduisent probablement mieux les activités intra-articulaires de l’acide hyaluronique endogène que les produits des générations précédentes. Jumelé à des interventions non pharmacologiques, l’acide hyaluronique peut se révéler extrêmement utile pour soulager durablement la douleur, améliorer la fonction articulaire et réduire le risque d’évolution de la maladie.
1er CAS
Homme de 35 ans
Figure 5 (Fig. 5). Un comptable plutôt en forme, mais ayant des antécédents de douleur croissante au genou, consulte son médecin en raison d’une raideur articulaire qui l’empêche de faire du ski comme il le voudrait. Il prend de l’ibuprofène pour maîtriser ses symptômes, mais il se plaint d’accès fréquent de dyspepsie. Classiques, ses signes cliniques permettent de poser un diagnostic d’arthrose.
- Son médecin commence par lui prescrire des exercices de musculation, mais la persistance de la douleur incite le patient à revenir le consulter pour mieux maîtriser ce symptôme.
- Pour ce faire, le médecin procède à une infiltration fortement concentrée en acide hyaluronique de haut poids moléculaire et insiste pour que le patient évite tout exercice violent pendant 48 heures et pour qu’il surveille le moindre signe d’enflure.
- Deux semaines plus tard, le médecin apprend au cours d’une conversation téléphonique de contrôle que les symptômes du patient ont diminué, mais que celui-ci continue de prendre de l’ibuprofène comme traitement d’appoint.
- Quatre semaines après l’infiltration, le patient cesse de prendre des analgésiques et intensifie ses séances de musculation.
- Son médecin lui recommande de revenir le voir dans 6 mois ou plus tôt si les symptômes réapparaissent.
2e CAS
Femme de 60 ans
Figure 6 (Fig. 6). À la retraite depuis peu au terme d’une carrière d’une trentaine d’années dans l’immobilier, une femme ayant un mode de vie sédentaire a vu son indice de masse corporelle (IMC) passer de 32 à 37 en deux ans à peine. Elle est atteinte de diabète de type 2 et d’hypertension. Elle est allergique à beaucoup de choses, dont les noix, les oeufs et les tomates, et a déjà fait une hémorragie digestive. L’examen radiographique révèle une arthrose de stade 2, selon les critères de la classification de Kellgren et de Lawrence.
- Les inhibiteurs de la COX-2 étant relativement contre-indiqués dans son cas en raison de ses facteurs de risque de nature cardiovasculaire, la patiente s’est tournée vers les analgésiques opiacés qui lui avaient été prescrits à la suite d’une blessure au pied, mais elle se plaint d’avoir des problèmes de concentration durant la journée.
- Son médecin décide d’essayer les infiltrations fortement concentrées en acide hyaluronique de haut poids moléculaire ne provenant pas de sources aviaires.
- Il recommande à la patiente de prendre de l’acétaminophène pour calmer la douleur.
- À la visite de contrôle deux semaines plus tard, la patiente se plaint d’un effet analgésique insuffisant et demande à son médecin de lui prescrire des opiacés. À sa recommandation, elle accepte d’attendre deux semaines de plus, mais ne fait rien pour perdre du poids comme il le lui avait conseillé.
- Au bout de trois semaines, la douleur est bien maîtrisée, mais les clichés radiographiques pris à 6 mois montrent une détérioration appréciable des articulations, l’arthrose étant maintenant de stade 3, selon la classification de Kellgren et de Lawrence.
- Les diverses interventions chirurgicales possibles sont envisagées.
Références
1. NIINIMAKI, T. T., A. Eskelinen, P. Ohtonen, M. Junnila et J. Leppilahti. « Incidence of osteotomies around the knee for the treatment of knee osteoarthritis: a 22-year population-based study », International Orthopaedics, vol. 36, 2012, p. 1399-1402.
2. WILDER , F. V., B. J. Hall, J. P. Barrett, fils et N. B. Lemrow. « History of acute knee injury and osteoarthritis of the knee: a prospective epidemiological assessment. The Clearwater Osteoarthritis Study », Osteoarthritis and Cartilage, Osteoarthritis Research Society (OARS), vol. 10, 2002, p. 611-616.
3. SPECTOR, T. D. et A. J. MacGregor. « Risk factors for osteoarthritis: genetics », Osteoarthritis and Cartilage, Osteoarthritis Research Society (OARS), vol. 12 (suppl. A), 2004, p. S39-S44.
4. BROWN, T. D., R. C. Johnston, C. L. Saltzman, J. L. Marsh et J. A. Buckwalter. « Posttraumatic osteoarthritis: a first estimate of incidence, prevalence, and burden of disease », Journal of Orthopaedic Trauma, vol. 20, 2006, p. 739-744.
5. ROOS, H., T. Adalberth, L. Dahlberg et L. S. Lohmander. « Osteoarthritis of the knee after injury to the anterior cruciate ligament or meniscus: the influence of time and age », Osteoarthritis and cartilage, Osteoarthritis Research Society (OARS), vol. 3, 1995, p. 261-267.
6. GELBER , A. C., M. C. Hochberg, L. A. Mead, N. Y. Wang, F. M. Wigley et M. J. Klag. « Joint injury in young adults and risk for subsequent knee and hip osteoarthritis », Annals of Internal Medicine, vol. 133, 2000, p. 321-328.
7. OIESTAD, B. E., L. Engebretsen, K. Storheim, M. A. Risberg. « Knee osteoarthritis after anterior cruciate ligament injury: a systematic review », The American Journal of Sports Medicine, vol. 37, 2009, p. 1434-1443.
8. STATISTIQUE CANADA. Prévalence de l’obésité chez les adultes au Canada et aux États-Unis. http://www.statcan.gc.ca/pub/82-625-x/2011001/article/11411-fra.htm, Statistique Canada, 2013.
9. SUTTON, P. M. et E. S. Holloway. « The young osteoarthritic knee: dilemmas in management », BMC Medicine, vol. 11, 2013, p. 14.
10. WIDHALM, H. K., R. Seemann, M. Hamboeck, et al. « Osteoarthritis in morbidly obese children and adolescents, an age-matched controlled study », Knee Surgery, Sports Traumatology, Arthroscopy, revue officielle de l’ESSKA, 2014.
11. SOWER S, M. R. et C. A. Karvonen-Gutierrez. « The evolving role of obesity in knee osteoarthritis », Current Opinion in Rheumatology, vol. 22, 2010, p. 533-537.
12. WOLFE, F. et N. E. Lane. « The long-term outcome of osteoarthritis: rates and predictors of joint space narrowing in symptomatic patients with knee osteoarthritis », The Journal of Rheumatology, vol. 29, 2002, p. 139-146.
13. WIELAND, H. A., M. Michaelis, B. J. Kirschbaum et K. A. Rudolphi. « Osteoarthritis – an untreatable disease? », Nature Reviews Drug Discovery, vol. 4, 2005, p. 331-344.
14. CHRISTENSEN, R., A. Astrup et H. Bliddal. « Weight loss: the treatment of choice for knee osteoarthritis? A randomized trial », Osteoarthritis and Cartilage, Osteoarthritis Research Society (OARS), vol. 13, 2005, p. 20-27.
15. RODDY, E., W. Zhang et M. Doherty. « Aerobic walking or strengthening exercise for osteoarthritis of the knee? A systematic review », Annals of the Rheumatic Diseases, vol. 64, 2005, p. 544-548.
16. ROEMER , F. W., F. Eckstein, D. Hayashi et A. Guermazi. « The role of imaging in osteoarthritis », Best Practice & Research Clinical Rheumatology, vol. 28, 2014, p. 31-60.
17. NEOGI, T., D. Felson, J. Niu, et al. « Association between radiographic features of knee osteoarthritis and pain: results from two cohort studies », BMJ, vol. 339, 2009, p. b2844.
18. MCCONNELL, S., P. Kolopack et A. M. Davis. « The Western Ontario and McMaster Universities Osteoarthritis Index (WOMAC): a review of its utility and measurement properties », Arthritis and Rheumatism, vol. 45, 2001, p. 453-461.
19. TUBACH, F., P. Ravaud, G. Baron, et al. « Evaluation of clinically relevant changes in patient reported outcomes in knee and hip osteoarthritis: the minimal clinically important improvement », Annals of the Rheumatic Diseases, vol. 64, 2005, p. 29-33.
20. AGENCE DE LA SANTÉ PUBLIQUE DU CANADA. Vivre avec l’arthrite au Canada : un défi de santé personnel et de santé publique, http://www.phac-aspc.gc.ca/cd-mc/arthritis-arthrite/lwaicvaaac-10/index-fra.php, 2010.
21. CENTERS FOR DISEASE CONTROL AND PREVENTION. « Prevalence and most common causes of disability among adults–United States, 2005 », MMWR – Morbidity and Mortality Weekly Report, vol. 58, 2009, p. 421-426.
22. BRUYERE , O., J. H. Collette, O. Ethgen, et al. « Biochemical markers of bone and cartilage remodeling in prediction of longterm progression of knee osteoarthritis », The Journal of Rheumatology, vol. 30, 2003, p. 1043-1050.
23. MUSUMECI, G., P. Castrogiovanni et R. Leonardi, et al. « New perspectives for articular cartilage repair treatment through tissue engineering: A contemporary review », World Journal of Orthopedics, vol. 5, 2014, p. 80-88.
24. AAOS. Viscosupplementation treatment for arthritis. http://orthoinfoaaosorg/topiccfm?topic=a002172014.
25. BRZUSEK, D. et D. Petron. « Treating knee osteoarthritis with intra-articular hyaluronans », Current Medical Research and Opinion, vol. 24, 2008, p. 3307-3322.
26. MILLER , L. E. et J. E. Block. « US-Approved Intra-Articular Hyaluronic Acid Injections are Safe and Effective in Patients with Knee Osteoarthritis: Systematic Review and Meta-Analysis of Randomized, Saline-Controlled Trials », Clinical Medicine Insights Arthritis and Musculoskeletal Disorders, vol. 6, 2013, p. 57-63.
27. BELLAMY, N., J. Campbell, V. Robinson, T. Gee, R. Bourne et G. Wells. « Viscosupplementation for the treatment of osteoarthritis of the knee », The Cochrane Database of Systematic Reviews, 2006, CD005321.
28. MORE LAND, L. W. « Intra-articular hyaluronan (hyaluronic acid) and hylans for the treatment of osteoarthritis: mechanisms of action », Arthritis Research & Therapy, vol. 5, 2003, p. 54-67.
29. BELLAMY, N., J. Campbell, V. Robinson, T. Gee, R. Bourne et G. Wells. « Viscosupplementation for the treatment of osteoarthritis of the knee », The Cochrane Database of Systematic Reviews, 2006, CD005321.
30. POZO, M. A., E. A. Balazs et C. Belmonte. « Reduction of sensory responses to passive movements of inflamed knee joints by hylan, a hyaluronan derivative », Experimental Brain Research, vol. 116, 1997,p. 3-9.
31. YASUI , T., M. Akatsuka, K. Tobetto, M. Hayaishi et T. Ando. « The effect of hyaluronan on interleukin-1 alpha-induced prostaglandin E2 production in human osteoarthritic synovial cells », Agents and Actions, vol. 37, 1992, p. 155-156.
32. KAWASAKI, K., M. Ochi, Y. Uchio, N. Adachi et M. Matsusaki. « Hyaluronic acid enhances proliferation and chondroitin sulfate synthesis in cultured chondrocytes embedded in collagen gels », Journal of Cellular Physiology, vol. 179, 1999, p. 142-148.
33. WANG, C. T., Y. T. Lin, B. L. Chiang, Y. H. Lin et S. M. Hou. « High molecular weight hyaluronic acid down-regulates the gene expression of osteoarthritis-associated cytokines and enzymes in fibroblast-like synoviocytes from patients with early osteoarthritis »,Osteoarthritis and Cartilage, Osteoarthritis Research Society (OARS), vol. 14, 2006, p. 1237-1247.
34. ELMORSY, S., T. Funakoshi, F. Sasazawa, M. Todoh, S. Tadano et N. Iwasaki. « Chondroprotective effects of high-molecular-weight cross-linked hyaluronic acid in a rabbit knee osteoarthritis model », Osteoarthritis and Cartilage, Osteoarthritis Research Society (OARS), vol. 22, 2014, p. 121-127.
35. ANIKA THERAPEUTICS, INC. Rapport d’analyse des données cliniques recueillies sur MONOVISC. M. Frank-Molnia, mars 2012. Données internes. 36. BRIEM, K. et D. K. Ramsey. « The role of bracing », Sports Med Arthrosc, vol. 21, 2013, p. 11-17.
Chapitre 3 : Les infiltrations d’acide hyaluronique dans le genou : prise en charge des symptômes en pratique clinique
La prise en charge de la gonarthrose vise à maîtriser la douleur et à limiter le plus possible l’incapacité fonctionnelle. Les cliniciens s’emploient à personnaliser le traitement en s’attaquant à l’objectif le plus pressant, soit la maîtrise de la douleur, tout en réduisant au minimum les risques inhérents aux traitements au long cours que la lutte contre cette maladie chronique exige parfois. Parmi les traitements pharmacologiques opposés à la gonarthrose, les infiltrations d’acide hyaluronique permettent de conjuguer efficacité et innocuité. Contrairement aux autres traitements conservateurs qui se montrent efficaces contre la douleur arthrosique, tels que les anti-inflammatoires non stéroïdiens (AINS), l’infiltration localisée d’acide hyaluronique risque peu de provoquer des effets indésirables locaux ou généraux. Comparativement aux préparations d’acide hyaluronique lancées en Europe et aux États-Unis dans les années 1990, les plus récentes comportent de nombreux avantages dont un effet durable au moyen d’une seule injection et dans certains cas, un soulagement plus rapide de la douleur. Les caractéristiques qui distinguent ces préparations les unes des autres pourraient se révéler encore plus utiles pour la personnalisation des soins chez certains patients.
Afficher la revue