Revue d’experts
Vers la prochaine étape de la réduction du risque cardiovasculaire résiduel
CHAPITRE 2 : La mise au point des inhibiteurs de la PCSK9 et leurs promesses
Nabil G. Seidah, O.C., O.Q., Ph.D., FRSC
Directeur, Laboratoire de biochimie neuroendocrinienne, Institut de recherche clinique de Montréal
Chaire de recherche du Canada en protéolyse des précurseurs, Montréal (Québec)
Les concentrations sanguines de cholestérol des lipoprotéines de basse densité (C-LDL) sont en grande partie régulées par les récepteurs situés à la surface des cellules de C-LDL (LDLr). Lorsqu’il est lié à ces récepteurs qui le retirent de la circulation, le C-LDL ne peut plus jouer son rôle de substrat participant à l’athérosclérose. C’est pourquoi le principe à la base des inhibiteurs de la proprotéine convertase subtilisine/kexine de type 9 (PCSK9), des agents hypolipémiants, repose sur l’intensification de l’activité des LDLr. La PCSK9 est une protéine qui amplifie la dégradation des LDLr. Son inhibition permet donc de préserver l’activité des LDLr, d’où la plus grande quantité de C-LDL qui est retirée de la circulation. Au cours des essais cliniques, les anticorps monoclonaux dirigés contre la PCSK9 ont entraîné des baisses soutenues des concentrations de C-LDL, qui surpassaient celles enregistrées habituellement avec les inhibiteurs de la HMG-CoA réductase (statines). Par leur parcours, la découverte de la PCSK9 et la mise au point clinique d’inhibiteurs ciblés sont une illustration extrêmement éloquente de l’aptitude de la biologie moléculaire à concevoir rapidement de nouveaux traitements contre les maladies humaines.
Le contexte et un peu d’histoire
Les caractéristiques du neuvième membre de la famille des proprotéines convertases, la proprotéine convertase subtilisine/kexine de type 9 (PCSK9) ont été publiées pour la première fois en 20031. La PCSK9, qui a d’abord été appelée convertase neurale régulée par l’apoptose-1 (NARC-1), a été isolée avant même que sa fonction biologique ne soit connue, mais la découverte de mutants de cette proprotéine a vite permis de constater qu’elle joue un rôle important dans la biotransformation du cholestérol2,3. Les études qui ont suivi ont apporté d’autres précisions, à savoir que la PCSK9 se lie aux récepteurs du C-LDL pour ensuite le dégrader4,5. Moins d’une décennie après la caractérisation de la PCSK9, un essai clinique de Phase I a révélé qu’un anticorps monoclonal dirigé contre cette enzyme avait considérablement abaissé les concentrations de C-LDL chez des sujets humains6.
Moins d’une décennie après la caractérisation de la PCSK9, un essai clinique de Phase I a révélé qu’un anticorps monoclonal dirigé contre cette enzyme avait considérablement abaissé les concentrations de C‑LDL chez des sujets humains.
La PCSK9 est exprimée par un nombre restreint de cellules, dont des hépatocytes, des cellules du mésenchyme rénal et des cellules épithéliales du côlon1. La découverte de mutations du gène codant pour la PCSK9 chez des membres de deux familles atteints d’hypercholestérolémie a donné le coup d’envoi à la recherche sur son rôle dans la biotransformation du C-LDL2. Ces mutations avec gain de fonction (gain-of-function mutation; GOF) ont amené les chercheurs à croire qu’une activité plus intense de la PCSK9 se traduirait par une augmentation de la concentration de C-LDL circulant. Les mutations avec perte de fonction (loss-of-function mutation; LOF) de la PCSK9 ont par la suite été reliées à l’effet opposé, des observations qui sont venues enrichir le faisceau de preuves de plus en plus volumineux selon lequel cette enzyme est un important médiateur du C-LDL circulant3. L’utilité clinique éventuelle de ces observations est devenue plus apparente lorsqu’un parallèle a été établi entre la présence de mutations GOF ou de mutations LOF de la PCSK9 et une incidence plus élevée, ou inversement moins élevée, d’accidents cardiovasculaires comparativement à l’absence de pareilles mutations3,7. Par exemple, une étude a révélé que la présence d’une mutation LOF non-sens de la PCSK9 découverte chez près de 3 % des personnes de race blanche était associée à une réduction de 15 % de la concentration de C-LDL et à une baisse de 47 % des coronaropathies3. Bien qu’elle soit sensiblement moins répandue chez les Afro-Américains, cette même mutation a été reliée à une protection encore plus marquée contre ces maladies (Fig. 1). Le LDLr se fixe à la particule de C-LDL, puis la retire de la circulation par endocytose8. En règle générale, la PCSK9 se lie au LDLr et pénètre dans la cellule en même temps que la particule de C-LDL (Fig. 2)9,10. Une fois à l’intérieur, la PCSK9 provoque un changement dans la conformation du LDLr l’exposant ainsi à la dégradation lysosomale, ce qui neutralise sa fonction physiologique. En l’absence de la PCSK9, le LDLr retourne à la surface de la cellule où il peut de nouveau se fixer au C-LDL pour soutenir son activité. La corrélation directe inverse entre l’activité de cette protéine escorte et les taux de C-LDL circulant en fait une cible attrayante pour les stratégies de traitement hypocholestérolémiant. Essentiellement synthétisée dans le foie, la PCSK9 elle pourrait avoir d’autres fonctions biologiques hormis la régulation du C-LDL. Par exemple, au cours d’études expérimentales, les chercheurs ont constaté qu’elle participait à la biotransformation des triglycérides et à la régulation de l’équilibre du cholestérol dans les adipocytes et les entérocytes11,12. Pour l’heure, rien dans les études menées chez des humains n’indique clairement que la perte de fonction de la PCSK9 exerce des effets délétères sur la biotransformation du cholestérol ou sur d’autres activités biologiques. Même s’il est encore trop tôt pour écarter une telle possibilité, il n’empêche que deux rapports d’études ont recensé des personnes autrement en santé chez lesquelles la PCSK9 est indétectable en raison de multiples mutations LOF13,14. L’absence totale de PCSK9 y a été associée à des concentrations de C‑LDL de 0,4 mmol/L environ13.
Les programmes d’essais cliniques
De nombreux programmes d’essais cliniques ayant porté sur des anticorps monoclonaux dirigés contre la PCSK9 ont confirmé l’intérêt de cette proprotéine comme cible dans la réduction des taux de C-LDL. Bien que d’autres stratégies visant à inhiber l’activité de la PCSK9 soient à l’étude, ou l’ont été, dont celles reposant sur l’utilisation d’oligonucléotides antisens, d’ARN interférents courts (ARNic), de peptides inhibiteurs et d’adnectines10,15,16, ces travaux en sont encore à la première phase ou au stade préclinique. Les programmes d’essais d’envergure consacrés aux anticorps monoclonaux, dont les essais cliniques de Phase III, ont confirmé que l’inhibition de la PCSK9 réduit considérablement et durablement les concentrations de C-LDL.
Les programmes d’essais d’envergure consacrés aux anticorps monoclonaux, dont les essais cliniques de Phase III, ont confirmé que l’inhibition de la PCSK9 réduit considérablement et durablement les concentrations de C-LDL.
Selon l’une des premières séries d’expériences cliniques qui ont été publiées, les réductions des concentrations de C-LDL étaient fonction de la dose administrée et se situaient entre 28,1 % et 65,4 % après l’injection intraveineuse d’une seule dose d’alirocumab, un inhibiteur de la PCSK96. Les données de trois essais cliniques de Phase I de cette série ont été regroupées. Ces essais avaient été menés chez des volontaires sains et des patients atteints d’hypercholestérolémie familiale déjà traitée à l’aide d’atorvastatine. Dans le cadre d’une étude portant sur des doses multiples, des baisses soutenues des concentrations de C-LDL ont été observées tout au long de la période d’intérêt, l’alirocumab étant administré les 1er, 29e et 43e jours de l’étude. L’inhibiteur de la PCSK9 a nettement eu un effet additif chez les sujets atteints d’hypercholestérolémie familiale prenant de l’atorvastatine. À la lumière de ce qui précède et des résultats d’autres études cliniques, des chercheurs ont mis sur pied un programme de développement de Phase III intitulé ODYSSEY. Une des études ayant porté sur un des plus grands effectifs jamais réunis, l’étude à répartition aléatoire ODYSSEY LONG-TERM s’est déroulée dans 320 centres de recherche de 27 pays et auprès de 2341 patients17. Comparativement à celle d’un placebo, l’administration de 150 mg d’alirocumab toutes les 2 semaines a fait chuter les concentrations de C-LDL de 62,1 %. L’effet thérapeutique a été constant pendant les 78 semaines qu’a duré l’étude (Fig. 3). Les effets indésirables qui étaient à la fois les plus répandus et plus fréquents que chez les témoins étaient les réactions au point d’injection (5,9 % vs 4,2 %) et la myalgie (5,4 % vs 2,9 %). La fréquence des autres effets indésirables était faible, quoique les effets neurocognitifs (1,2 % vs 0,5 %) et ophtalmologiques (2,9 % vs 1,9 %) aient été plus nombreux avec l’alirocumab. Une analyse réalisée a posteriori a établi un parallèle entre l’alirocumab et une raréfaction des accidents cardiovasculaires majeurs (1,7 % vs 3,3 %; p = 0,02), ce qui cadre avec son activité hypolipémiante (Fig. 4a).
Les autres essais de Phase III du programme ODYSSEY qui sont terminés sont les suivants : ODYSSEY COMBO I18, ODYSSEY COMBO II18et ODYSSEY OPTIONS 119. Lors des essais COMBO, qui étaient tous contrôlés par placebo et menés chez des patients très exposés aux incidents cardiovasculaires, les chercheurs ont noté que l’alirocumab avait entraîné une chute importante des concentrations de C-LDL chez les patients prenant les doses de statine les plus fortes qui soient tolérées, tandis que l’étude OPTIONS a permis de constater que les baisses des concentrations de C‑LDL obtenues avec l’alirocumab étaient plus prononcées qu’avec les autres stratégies hypolipémiantes lorsque les deux options étaient jumelées à une statine à intensité élevée (atorvastatine ou rosuvastatine). Au cours de l’essai ODYSSEY ALTERNATIVE, au sujet duquel seul un résumé a été publié jusqu’à maintenant20, l’alirocumab a été associé à des baisses considérables et soutenues des concentrations de C-LDL chez des patients ne tolérant pas les statines(Fig. 5).
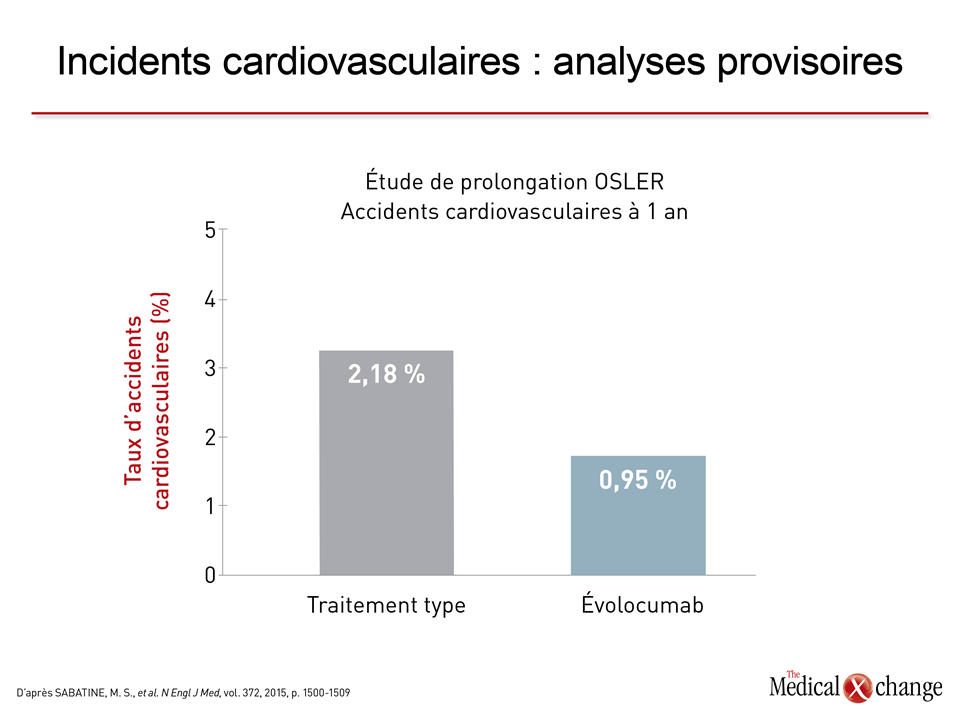
L’essai ODYSSEY OUTCOMES, qui a expressément été créé pour évaluer l’efficacité de l’alirocumab dans la prévention des incidents cardiovasculaires, est en cours de réalisation. Cet essai multinational auquel participent environ 18 000 patients très vulnérables qui, au moment de leur recrutement, ont été victimes d’un syndrome coronarien aigu au cours des 52 semaines précédentes, ont été répartis aléatoirement de façon à recevoir de l’alirocumab ou un placebo en plus des traitements types opposés aux dyslipidémies. Le critère d’évaluation principal est composé des événements suivants : décès imputable à une coronaropathie, infarctus du myocarde non mortel (IM), accident ischémique cérébral mortel ou non et hospitalisation motivée par un angor instable. Les résultats sont attendus au début de 2018. Des études avec répartition aléatoire ont aussi été menées sur l’évolocumab et le bococizumab, deux anticorps monoclonaux. L’évolocumab est celui des deux sur lequel nous disposons du plus grand faisceau de preuves, les données des études de prolongation menées en mode ouvert à la suite des études de Phase II (OSLER-1) et de Phase III (OSLER-2) ayant été regroupées, puis publiées21. Il ressort que l’administration d’évolocumab à 4465 patients à raison de 140 mg toutes les deux semaines ou de 420 mg une fois par mois a été reliée à des diminutions considérables et soutenues des concentrations de C-LDL et à une faible incidence d’effets indésirables. Bien que ces études de prolongation n’aient pas été effectuées avec répartition aléatoire des sujets, des taux plus élevés en chiffres absolus d’arthralgie (4,6 % vs 3,2 %), de céphalées (3,6 % vs 2,1 %) et de fatigue (2,8 % vs 1,0 %) ont été observés chez les patients traités par l’évolocumab comparativement à ceux qui avaient reçu le traitement type. Les taux d’effets indésirables graves ont été faibles de chaque côté, mais les effets neurocognitifs ont été plus nombreux chez les sujets traités par l’évolocumab (0,9 % vs 0,3 %). Comme ce fut le cas pendant l’étude ODYSSEY LONG-TERM, l’évaluation sans répartition aléatoire des incidents cardiovasculaires dans le cadre des études de prolongation OSLER donne à penser que l’inhibiteur de la PCSK9 comporte un avantage par rapport au traitement type (Fig. 4b).
Dans le cadre d’une étude posologique contrôlée par placebo ayant porté sur le bococizumab, les réductions des concentrations de C-LDL ont, semble-t-il, été du même ordre de grandeur que celles observées antérieurement avec l’alirocumab et l’évolocumab22. La fréquence des effets indésirables recensés au cours de cette étude de 24 semaines était faible et généralement comparable à celle observée avec le placebo. Dans la foulée de cette étude, des essais cliniques de Phase III sont prévus; le bococizumab y sera administré par voie sous-cutanée toutes les 2 semaines. Des observations similaires à celles recueillies pendant chacune de ces études sont issues d’une méta-analyse des données collectées sur 12 200 patients ayant participé à 25 essais contrôlés menés avec répartition aléatoire sur l’alirocumab ou l’évolocumab23. Les concentrations de C‑LDL y ont chuté de 50 à 60 % environ. Même s’il est essentiel de réserver notre jugement sur l’innocuité à long terme de ces médicaments jusqu’à ce qu’une quantité conséquente de données cliniques ait été recueillie pendant plusieurs années, aucune préoccupation concernant l’innocuité de ces produits n’a émergé de ces études. Dans l’ensemble, selon les données probantes accumulées jusqu’à aujourd’hui, il est fort probable que les inhibiteurs de la PCSK9 constitueront une avancée majeure dans la lutte contre les accidents cardiovasculaires grâce à leur effet hypolipémiant, notamment chez les patients qui y sont très exposés.
Les patients qui tireront le plus avantage des inhibiteurs de la PCSK9
Les statines, des médicaments efficaces et bien tolérés, sont à l’origine des essais cliniques phares qui ont révélé l’absolue nécessité de réduire les concentrations de C-LDL pour abaisser le risque cardiovasculaire. Il n’empêche que beaucoup de patients, notamment ceux qui sont les plus exposés aux incidents cardiovasculaires, ne réussissent pas à atteindre les valeurs cibles préconisées dans les lignes directrices, qui ont été établies grâce à ces essais cliniques. Un sondage réalisé au Canada a révélé que 40 % des patients très vulnérables, la majorité d’entre eux étant traités à l’aide de statines, n’étaient toujours par parvenus à ces valeurs24. Ces données montrent que ces patients ont énormément besoin d’autres stratégies hypolipémiantes efficaces et bien tolérées. Les données accumulées à ce jour portent à croire que les inhibiteurs de la PCSK9 pourraient jouer un rôle majeur dans la réduction du risque cardiovasculaire en augmentant simplement la proportion de patients capables d’atteindre les valeurs cibles actuelles. Plusieurs raisons expliquent que certains patients ne réalisent pas leur objectif thérapeutique avec les statines : intolérance absolue ou relative aux statines, notamment aux doses les plus fortes, et activité insuffisante de ces médicaments surtout lorsque les concentrations de C-LDL préthérapeutiques sont particulièrement élevées. Les inhibiteurs de la PCSK9 peuvent également offrir une meilleure maîtrise du C-LDL dans certaines formes d’hypercholestérolémie familiale. Or toutes ces applications cliniques sont déjà appuyées par des données. Par ailleurs, l’injection sous-cutanée d’un inhibiteur de la PCSK9 toutes les 2 à 4 semaines pourrait être une solution de rechange pratique pour les patients qui ne sont pas suffisamment fidèles à leur traitement uniquotidien par une statine à prise orale. Les inhibiteurs de la PCSK9 offrent également la possibilité d’évaluer l’intérêt d’abaisser les concentrations de C-LDL à des valeurs généralement atteignables chez les patients très exposés avec des statines utilisées en monothérapie. Au cours d’un essai mené récemment sur l’ajout d’ézétimibe à un traitement par une statine, les patients du groupe expérimental ont atteint une concentration médiane de C‑LDL de 1,4 mmol/L, qui a été associée à une raréfaction encore plus marquée des incidents cardiovasculaires, comparativement à 1,8 mmol/L dans le groupe recevant uniquement une statine à intensité élevée25. Comme les traitements hypolipémiants actuellement offerts sur le marché ont leurs limites, la concentration de C-LDL optimale reste à définir. Les inhibiteurs de la PCSK9 pourraient être appelés à intervenir dans la détermination des nouvelles réductions du risque cardiovasculaires qu’il sera possible d’obtenir en maîtrisant mieux le C-LDL.
Résumé
Les inhibiteurs de la PCSK9 ont ce qu’il faut pour combler un besoin important dans la prévention des incidents cardiovasculaires. Au cours d’essais menés avec répartition aléatoire des sujets, ils ont permis d’obtenir des diminutions plus prononcées des concentrations de C-LDL que les statines et ont été à tout le moins aussi bien tolérés. Qu’ils soient employés comme solution de rechange aux statines ou en association avec ces dernières, les inhibiteurs de la PCSK9 sont vraisemblablement capables d’augmenter notablement la proportion de patients exposés aux incidents cardiovasculaires qui obtiendront une protection maximale grâce à la maîtrise de leurs concentrations de C-LDL. La possibilité que ces agents mènent à une nouvelle définition des concentrations de C-LDL optimales chez les patients très vulnérables aux maladies cardiovasculaires sera probablement le point de mire des prochains essais cliniques.
Références
1. SEIDAH, N. G., S. Benjannet, L. Wickham, et al. « The secretory proprotein convertase neural apoptosis-regulated convertase 1 (NARC-1): liver regeneration and neuronal differentiation », Proc Natl Acad Sci U S A, vol. 100, 2003, p. 928-933. 2. ABIFADEL, M., M. Varret, J. P. Rabes, et al. « Mutations in PCSK9 cause autosomal dominant hypercholesterolemia », Nat Genet, vol. 34, 2003, p. 154-156. 3. COHEN, J. C., E. Boerwinkle, T. H. Mosley, fils et H. H. Hobbs. « Sequence variations in PCSK9, low LDL, and protection against coronary heart disease », N Engl J Med, vol. 354, 2006, p. 1264-1272. 4. TAVORI, H., D. Fan, J. L. Blakemore, et al. « Serum proprotein convertase subtilisin/kexin type 9 and cell surface low-density lipoprotein receptor: evidence for a reciprocal regulation », Circulation, vol. 127, 2013, p. 2403-2413. 5. MAXWELL, K. N. et J. L. Breslow. « Adenoviral-mediated expression of Pcsk9 in mice results in a low-density lipoprotein receptor knockout phenotype », Proc Natl Acad Sci U S A, vol. 101, 2004, p. 7100-7105. 6. STEIN, E. A., S. Mellis, G. D. Yancopoulos, et al. « Effect of a monoclonal antibody to PCSK9 on LDL cholesterol », N Engl J Med, vol. 366, 2012, p. 1108-1118. 7. TIBOLLA, G., G. D. Norata, R. Artali, F. Meneghetti et A. L. Catapano. « Proprotein convertase subtilisin/kexin type 9 (PCSK9): from structure-function relation to therapeutic inhibition », Nutr Metab Cardiovasc Dis, vol. 21, 2011, p. 835-843. 8. SEIDAH, N. G. « PCSK9 as a therapeutic target of dyslipidemia », Expert Opin Ther Targets, vol. 13, 2009, p. 19-28. 9. LAMBERT, G., B. Sjouke, B. Choque, J. J. Kastelein et G. K. Hovingh. « The PCSK9 decade », J Lipid Res, vol. 53, 2012, p. 2515-2524. 10. SEIDAH, N. G., Z. Awan, M. Chrétien et M. Mbikay. « PCSK9: a key modulator of cardiovascular health », Circ Res, vol. 114, 2014, p. 1022-1036. 11. ROUBTSOVA, A., M. N. Munkonda, Z. Awan, et al. « Circulating proprotein convertase subtilisin/kexin 9 (PCSK9) regulates VLDLR protein and triglyceride accumulation in visceral adipose tissue », Arteriosclerosis, thrombosis, and vascular biology, vol. 31, 2011, p. 785-791. 12. LEVY, E., A. Ben Djoudi Ouadda, S. Spahis, et al. « PCSK9 plays a significant role in cholesterol homeostasis and lipid transport in intestinal epithelial cells », Atherosclerosis, vol. 227, 2013, p. 297-306. 13. ZHAO, Z., Y. Tuakli-Wosornu, T. A. Lagacé, et al. « Molecular characterization of loss-of-function mutations in PCSK9 and identification of a compound heterozygote », American Journal of Human Genetics, vol. 79, 2006, p. 514-523. 14. HOOPER, A. J., A. D. Marais, D. M. Tanyanyiwa et J. R. Burnett. « The C679X mutation in PCSK9 is present and lowers blood cholesterol in a Southern African population », Atherosclerosis, vol. 193, 2007, p. 445-448. 15. HOOPER, A. J. et J. R. Burnett. « Anti-PCSK9 therapies for the treatment of hypercholesterolemia », Expert Opinion on Biological Therapy, vol. 13, 2013, p. 429-435. 16. FRANK-KAMENETSKY, M., A. Grefhorst, N. N. Anderson, et al. « Therapeutic RNAi targeting PCSK9 acutely lowers plasma cholesterol in rodents and LDL cholesterol in nonhuman primates », Proc Natl Acad Sci U S A, vol. 105, 2008, p. 11915-11920. 17. ROBINSON, J. G., M. Farnier, M. Krempf, et al. « Efficacy and safety of alirocumab in reducing lipids and cardiovascular events », N Engl J Med, vol. 372, 2015, p. 1489-1499. 18. KEREIAKES, D. J., J. G. Robinson, C. P. Cannon, et al. « Efficacy and safety of the proprotein convertase subtilisin/kexin type 9 inhibitor alirocumab among high cardiovascular risk patients on maximally tolerated statin therapy: The ODYSSEY COMBO I study », Am Heart J, vol. 169, 2015, p. 906-15 e13. 19. BAYS, H., D. Gaudet, R. Weiss, et al. « Alirocumab as Add-on To Atorvastatin Versus Other Lipid Treatment Strategies: ODYSSEY OPTIONS I Randomized Trial », The Journal of Clinical Endocrinology and Metabolism, 2015, p. jc20151520. 20. MORIARTY, P. M., T. A. Jacobson, E. Bruckert et P.D. Thompson. « Efficacy and safety of the proprotein convertase subtilisin/kexin type 9 monoclonal antibody alirocumab versus ezetemibe in patients with statin intolerance as defned by a placebo run-in and statin rechallenge arm », American Heart Association. Chicago: LBCT02; 2014. 21. SABATINE, M. S., R. P. Giugliano, S. D. Wiviott, et al. « Efficacy and safety of evolocumab in reducing lipids and cardiovascular events », N Engl J Med, vol. 372, 2015, p. 1500-1509. 22. BALLANTYNE C. M., J. Neutel, A. Cropp, et al. « Results of bococizumab, a monoclonal antibody against proprotein convertase subtilisin/kexin type 9, from a randomized, placebo-controlled, dose-ranging study in statin-treated subjects with hypercholesterolemia », Am J Cardiol, vol. 115, 2015, p. 1212-1221. 23. ZHANG, X. L., Q. Q. Zhu, L. Zhu, et al. « Safety and efficacy of anti-PCSK9 antibodies: a meta-analysis of 25 randomized, controlled trials », BMC Medicine, vol. 13, 2015, p. 123. 24. GOODMAN, S. G., A. Langer, N. R. Bastien, et al. « Prevalence of dyslipidemia in statin-treated patients in Canada: results of the DYSlipidemia International Study (DYSIS) », Can J Cardiol, vol. 26, 2010, p. e330-5. 25. CANNON, C. P., B. Cariou, D. Blom, et al. « Efficacy and safety of alirocumab in high cardiovascular risk patients with inadequately controlled hypercholesterolaemia on maximally tolerated doses of statins: the ODYSSEY COMBO II randomized controlled trial », European Heart Journal, vol. 36, 2015, p. 1186-1194.
CHAPITRE 2 : La mise au point des inhibiteurs de la PCSK9 et leurs promesses
Les concentrations sanguines de cholestérol des lipoprotéines de basse densité (C-LDL) sont en grande partie régulées par les récepteurs situés à la surface des cellules de C-LDL (LDLr). Lorsqu’il est lié à ces récepteurs qui le retirent de la circulation, le C-LDL ne peut plus jouer son rôle de substrat participant à l’athérosclérose. C’est pourquoi le principe à la base des inhibiteurs de la proprotéine convertase subtilisine/kexine de type 9 (PCSK9), des agents hypolipémiants, repose sur l’intensification de l’activité des LDLr. La PCSK9 est une protéine qui amplifie la dégradation des LDLr. Son inhibition permet donc de préserver l’activité des LDLr, d’où la plus grande quantité de C-LDL qui est retirée de la circulation. Au cours des essais cliniques, les anticorps monoclonaux dirigés contre la PCSK9 ont entraîné des baisses soutenues des concentrations de C-LDL, qui surpassaient celles enregistrées habituellement avec les inhibiteurs de la HMG-CoA réductase (statines). Par leur parcours, la découverte de la PCSK9 et la mise au point clinique d’inhibiteurs ciblés sont une illustration extrêmement éloquente de l’aptitude de la biologie moléculaire à concevoir rapidement de nouveaux traitements contre les maladies humaines.
Afficher la revue